2. 中国海洋大学海洋环境与生态教育部重点实验室, 山东 青岛 266100;
3. 中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100
海洋溶解有机物(Dissolved Organic Matter, DOM)是全球碳循环中最大的还原性碳库,在海洋和全球生态系统中扮演着举足轻重的角色[1]。其中有色溶解有机物(Chromophoric Dissolved Organic Matter, CDOM)是DOM中具有特征吸收紫外线和电磁波谱中可见区域[2]的部分,主要有类蛋白质和类腐殖质组成,分别与DOM产生和降解过程相关[3],被用来追踪DOM在深海环境中的动态分布[2, 4]。
马里亚纳海沟是西赤道太平洋中一个独特的深海环境,由太平洋板块自东向西俯冲于菲律宾板块之下消亡的地带[5],为地球上海水深度最大的区域[6],其地貌特征和水文地质性质相对独立。马里亚纳海沟上层初级生产力水平较低[7],但是由于海沟的漏斗效应,有机碳可能在马里亚纳海沟汇集。有研究表明,超过6 000 m深处有细菌旺盛活动[8-9]。细菌活动的物质基础是有机碳,但是马里亚纳海沟有机碳的通量、组成和迁移转化机制尚未清晰。
本文根据海水的吸收光谱和荧光光谱研究马里亚纳海沟海水DOM的组成和来源,认识从表层到深层DOM的变化特征,及其与有机碳循环和生物活动的关系。
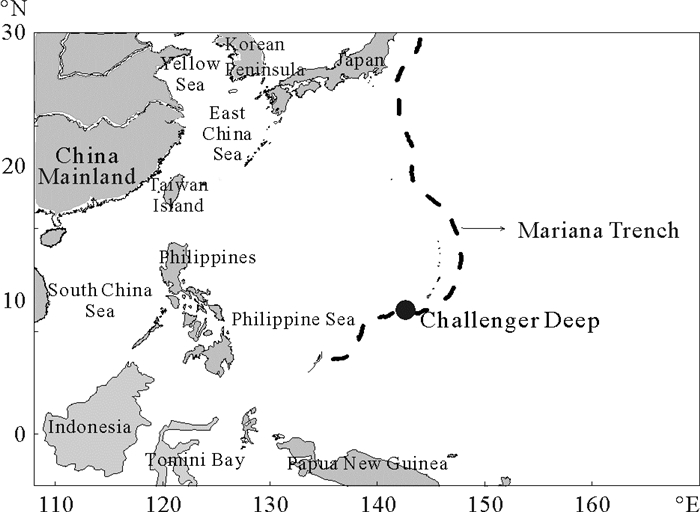
1 研究站位和方法 1.1 研究站位马里亚纳海沟位于菲律宾东北、马里亚纳群岛附近的太平洋底,是太平洋板块自东向西俯冲于菲律宾板块之下形成的一条向东弧形凸出、近南北向延伸的深沟。海沟全长2 550 km,为弧形,平均宽70 km,大部分水深在8 000 m以上,最大水深为11 034 m,称为挑战者深渊。采样站位接近于马里亚纳海沟的最深处,共采集6个层次,分别是0、991、1 759、3 699、5 367和8 727 m(见图 1)。
|
图 1 2015年12月马里亚纳海沟采样站位示意图 Fig. 1 Sampling sites in the Mariana Trench in December 2015 |
海水样品采集于2015年12月,水样经Whatman GF/F膜(450℃灼烧4 h)过滤后,滤膜用于颗粒有机碳(POC)含量分析,滤液储存于棕色玻璃瓶内(预烧4 h),用于溶解有机碳(DOC)含量和CDOM的吸收光谱和荧光光谱分析。
1.3 分析方法 1.3.1 POC分析POC样品室温解冻后,转移至玻璃皿中,以HCl (1 mol/L)去除无机碳,低温烘干后用锡纸包裹,采用PerkinElmer 2400 series-Ⅱ元素分析仪进行测定,测量偏差小于0.3%,精密度小于0.2%。
1.3.2 DOC分析DOC样品以岛津总有机碳分析仪配备自动进样器完成(Shimadzu TOC-L Analyzer),标准物质为邻苯二甲酸氢钾(KHP),样品经酸化后平行测定3次,分析误差小于5 μmol·L-1,分析精度小于4%。
1.3.3 CDOM吸收光谱分析样品在室温下避光解冻后,分别进行吸收光谱和和荧光光谱分析。吸收光谱分析使用紫外-可见分光光度计(UV-2550,岛津)在190~800 nm范围内对水样进行扫描,以Milli-Q水(电阻率=18.2 MΩ·cm)为参比,配10 cm石英比色皿,每隔1 nm读取1次数据。CDOM的吸收能力与发色团有关,常采用吸收系数表示CDOM的相对含量,吸收系数由吸光度按式(1)计算而来:
| $ \mathit{a}\left( \mathit{\lambda } \right){\rm{ = 2}}{\rm{.303/}}\mathit{L}{\rm{ \times [}}\mathit{A}\left( \mathit{\lambda } \right){\rm{ - }}\mathit{A}{\rm{(}}{\mathit{\lambda }_{\rm{0}}}{\rm{)]}}。$ | (1) |
式中:a(λ)为CDOM在波长λ处的光吸收系数(m-1);A(λ)为波长λ时的吸光度;A(λ0)为695~705 nm间10个纳米波段吸光度的平均值[10];L为比色皿长度(m)。
1.3.4 CDOM荧光光谱分析荧光光谱分析使用荧光分光光度计(F-4600,日立),样品于1 cm石英比色皿进行三维荧光光谱扫描;激发光源为450 W氙弧灯,PMT电压为700 V,激发波长200~450 nm,发射波长240~680 nm,步长和狭缝宽度均为5 nm,扫描速度为12 000 nm/min,响应时间为0.05 s。以Milli-Q水在激发波长350 nm处的拉曼峰面积,对荧光强度数据进行归一化处理,数据以拉曼单位(R.U., Raman Unit)表示[11]。
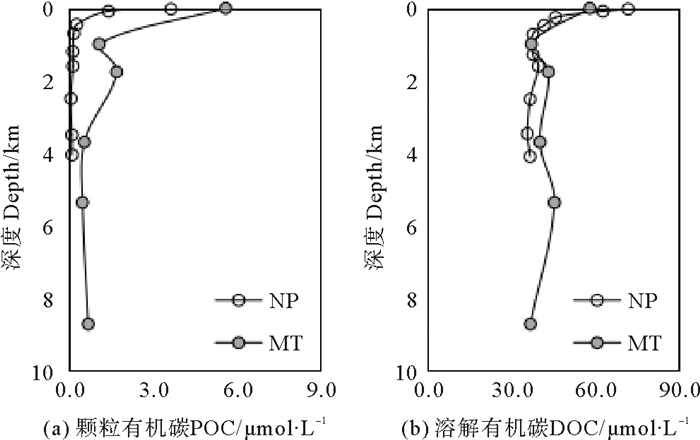
2 结果与讨论 2.1 颗粒有机碳、溶解有机碳的垂直分布特征马里亚纳海沟POC含量的垂直变化如图 2(a)所示,范围为0.51~5.63 μmol·L-1。表层水中POC含量最高,为5.63 μmol·L-1,之后迅速降至1 000 m的1.11 μmol·L-1。从1 000~2 000 m达到次高值1.74 μmol·L-1后,向深层水中逐渐降低,并维持在0.8 μmol·L-1以下。该含量从表层到底层,均高于东北太平POC含量[12]。
|
(MT-马里亚纳海沟;NP-北太平洋。数据来自文献[12, 14]。MT-Mariana Trench;NP-North Pacific. The data is from reference[12, 14].) 图 2 不同研究区域内DOC含量的垂直分布 Fig. 2 Vertical distribution of DOC concentrations in different study areas |
海洋中DOC是有机碳的主要存在形式,代表了海洋中97%的有机碳[13]。马里亚纳海沟DOC含量变化如图 2(b)所示,变化范围为37.12~58.30 μmol·L-1,平均浓度为43.76 μmol·L-1。DOC最高含量位于表层,为58.30 μmol·L-1。1 000 m后随深度增加维持在40 μmol·L-1左右,至最深层时达到最低含量。本研究区域DOC含量与东北太平洋相当[14]。研究站位表层水DOC占总有机碳的比例最低,约为91%;其他层次DOC占总有机碳的96%~99%。
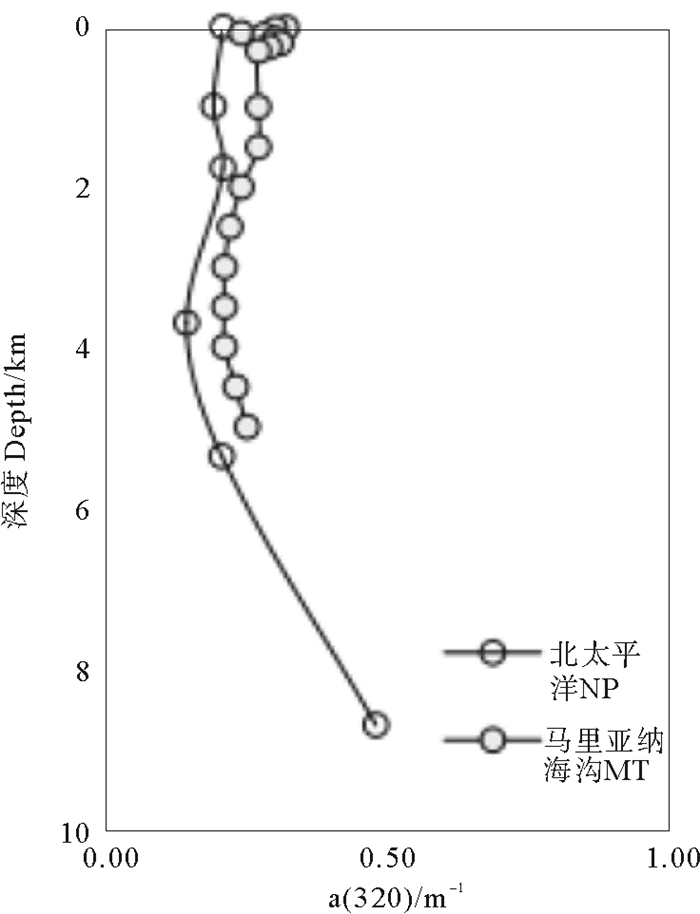
2.2 CDOM的吸收光谱特征CDOM的光谱吸收特性表现为由紫外区向可见光区的指数形式衰减[15]。以320 nm处的吸收系数a(320)表征CDOM的相对含量[16],其变化趋势如图 3所示。CDOM的a(320)垂直变化范围为0.14~0.48 m-1,平均值为0.24 m-1。从0~2 000 m水层CDOM的a(320)几乎不变,为0.20 m-1,之后随深度增加略减,4 000 m处CDOM的a(320)最小为0.14 m-1,4 000 m之后CDOM的相对含量迅速增加到最大值。本研究区域CDOM的a(320)与太平洋(160°W)区域(深度:0~5 000 m)水体CDOM的a(320) (0.05~0.45 m-1)相当[16],并变化趋势一致。
|
(MT-马里亚纳海沟;NP-北太平洋。数据来自文献[18]。MT-Mariana Trench;NP-North Pacific. The data is from reference[18].) 图 3 马里亚纳海沟不同水层CDOM光谱吸收系数a(320) Fig. 3 Absorption coefficient of CDOM (a(320)) in the different water layers at the Mariana Trench |
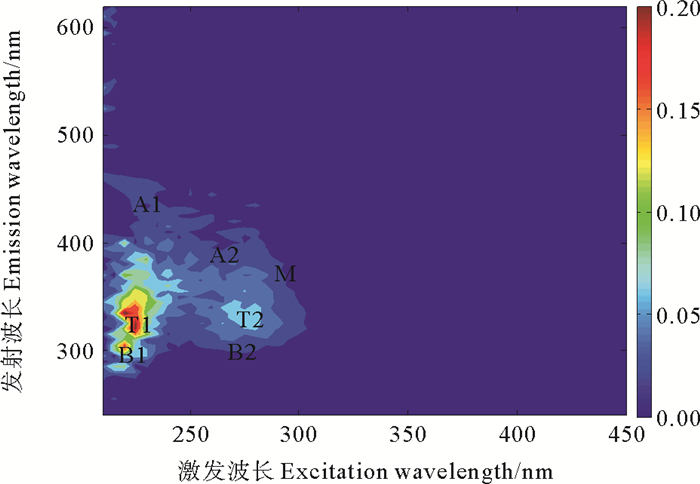
根据传统的寻峰法[17]得到7种荧光组分如图 4和表 1所示,包括3种类腐殖质荧光组分:A1、A2和M,及4种类氨基酸荧光组分:T1、T2、B1和B2。
|
图 4 马里亚纳海沟水体CDOM的典型三维荧光图谱 Fig. 4 Typical three-dimensional fluorescence spectrum of CDOM in the Mariana Trench |
|
|
表 1 马里亚纳海沟CDOM的主要荧光组分 Table 1 Principle fluorescence components of CDOM in the Mariana Trench |
7种荧光组分的荧光强度垂直分布如图 5所示。总体看来,类蛋白荧光强度垂直变化显著,类腐殖质荧光强度垂直变化较小。4种类蛋白荧光强度与类腐殖质中M的荧光强度呈现相似的变化特征,表层和2 000 m层最强,1 000 m层较弱,并与深层水相当。类腐殖质A1和A2荧光强度整体与类蛋白荧光强度和类腐殖质M的荧光强度的垂直变化特征相似,但是其从表层向深层变化幅度较小。类蛋白荧光强度占荧光组分总荧光强度的70%~85%,是CDOM荧光强度的主要贡献者。
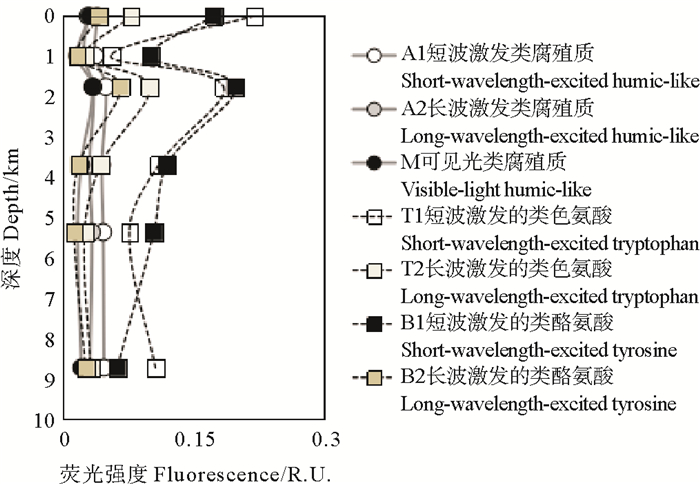
|
图 5 马里亚纳海沟水体CDOM各荧光组分相对荧光强度的垂直分布特征 Fig. 5 Vertical distribution of the fluorescence intensities of the fluorescent components of CDOM in the Mariana Trench |
CDOM是DOM中化学和生物学性质相对稳定的部分。CDOM相对含量与DOC含量的关系比对表明(见图 6),在2 000~6 000 m层二者的变化趋势相似,表层~1 000 m层CDOM相对含量差别很小,而DOC含量迅速降低。6 000 m以深区间CDOM与DOC呈现相反的变化趋势。可见随着深度变化,DOM的组成不断改变,CDOM相对含量与DOC含量之间呈现非一致变化。
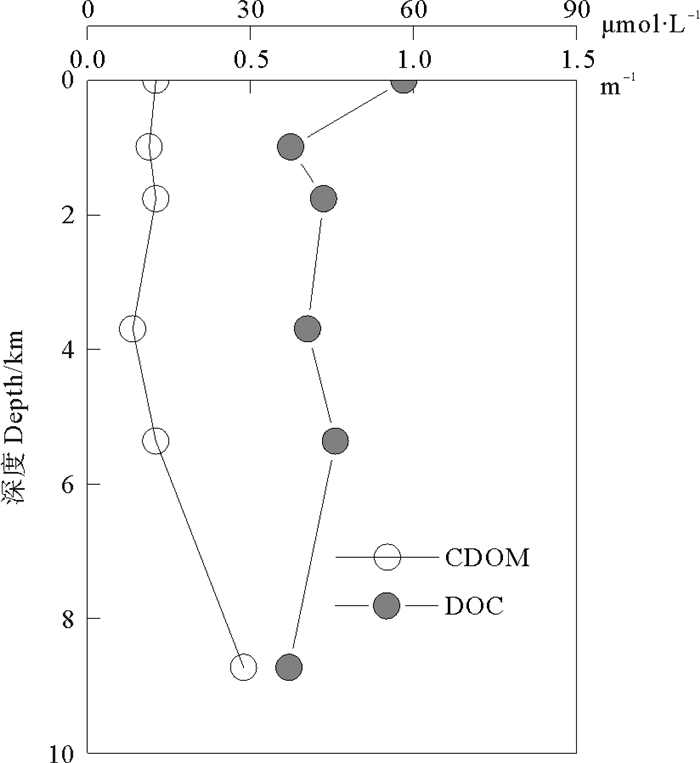
|
图 6 CDOM的相对含量与DOC含量的垂直分布 Fig. 6 Vertical distributions of CDOM relative content and DOC content |
吸光度比A250/A350可以用来反映其自身性质的变化,在一定程度上该比值与CDOM平均分子粒径成反比[20]。Sg值是吸收光谱曲线的光谱斜率,其值越大,CDOM的平均分子量越小;A250/A350比与Sg表征的信息相似[21]。马里亚纳海沟CDOM的A(250)/A(350)最小值位于8 727 m处,其次是2 000 m处,0~1 000 m以及3 000~6 000 m处A(250) /A(350)值相当,且最大。由此推知,马里亚纳海沟底层CDOM平均分子粒径较大,其平均分子量也较大,CDOM分子中芳香结构数量比较多;表层CDOM平均粒径比较小,可能与光辐照有关[21]。
生物源指数(BIX)是指激发波长为310 nm时,发射波长在380与430 nm处荧光强度的比值[22]。BIX可用于衡量现场水生生物生产和细菌活动的贡献[22]。本研究BIX范围为0.82~1.36,说明CDOM具有较强自生源特征;其中0~2 000 m以及大于6 000 m的区域内BIX值均大于1.0,说明上层和深层的细菌活动相对旺盛。上层水体旺盛的细菌活动与其较高的有机碳含量相关;深层水体POC和DOC含量都较低,而BIX显示的旺盛的细菌活动,与较高的CDOM a(320)相对应,推测深层水中CDOM可能是细菌活动的主要物质基础[23-24]。
2.5 马里亚纳海沟CDOM的转化特征CDOM时空变化由其来源和降解过程控制[18],开阔大洋,尤其在没有外源输入的情况下,CDOM主要来源于微生物对有机物的氧化和降解[2]。CDOM虽然直接或间接来源于浮游植物细胞物质[25-26],但是浮游动物、原生动物和细菌等都参预了CDOM的转化和降解[27]。其中类蛋白组分代表着新生的DOM,其产生主要与浮游生物和细菌活动有关[2],类腐殖质组分代表老化的DOM,其产生主要由生源有机物转化而来[28]。从CDOM的7种荧光组分变化来看,研究站位CDOM的类蛋白和类腐殖质荧光强度的垂直变化有所差别。类蛋白荧光强度在表层和2 000 m层的相对贡献较强,二者水平相当,说明该层次中DOM新生成能力较强,其中2 000 m层水体中类腐殖质荧光强度甚至高于表层水体,说明此处DOM降解和腐化作用更强。1 000 m和深层水体中类蛋白荧光强度的相对贡献降低,类腐殖质荧光强度相对贡献增强,说明在1 000 m和深层水中,DOM以有机物的老化和降解为主。同属类蛋白物质,类酪氨酸和类色氨酸在细胞外的行为也有差异,其中类酪氨酸降解速度明显快于类色氨酸*。底层水中短波激发类酪氨酸的荧光强度明显降低,短波激发类色氨酸荧光强度的明显升高,同时底层水体中DOC含量的降低,预示着海沟底层水体中可能存在着较大规模的微生物降解作用,但是该微生物降解作用的速度可能比较缓慢。底层水体中POC含量维持相对稳定的水平,可能是海沟POC汇集和缓慢降解的平衡结果;同理,鉴于底层水体中较强的CDOM荧光强度和较显著的细菌生物源指数,同时CDOM作为DOM中性质相对稳定的组分,说明海沟底层CDOM同样存在汇集和缓慢降解的平衡过程。将CDOM荧光组分的荧光强度与环境因子DO、pH和营养盐,及POC和DOC进行相关性分析,没有发现显著的相关关系,表明海沟CDOM的垂直变化不是由某种因子主要控制的,也可能由于本研究的样本数较少不适宜统计分析。
3 结论马里亚纳海沟是地球上最深的海沟,通过对马里亚纳海沟表层至深层水体DOC含量和CDOM光谱学特征的分析,研究马里亚纳海沟海水DOM的生物地球化学行为。主要结果如下:
(1) 研究站位DOC含量范围为37.12~58.30 μmol·L-1,以表层最高,2 000 m次之,深层较低并且含量相对稳定。
(2) CDOM的a(320)范围为0.14~0.48 m-1,从表层至4 000 m层之间与DOC变化规律较为一致,底层a(320)升高,可能与底层活跃持续的微生物活动或难降解化合物积累有关。
(3) 研究水体CDOM包括3种类腐殖质和4种类蛋白荧光组分,其中类腐殖质组分荧光信号从表层~底层相对稳定,类蛋白组分荧光信号变化较为显著。2种短波激发类蛋白荧光组分荧光信号的变化,与表层较高初级生产,2 000 m有机物再生产,以及底层物质的缓慢降解和汇集作用等生物和化学过程相一致。
| [1] |
Hedges J I, Keil R G. Sedimentary organic matter preservation: an assessment and speculative synthesis[J]. Marine Chemistry, 1995, 49(2): 81-115.
(  0) 0) |
| [2] |
Jørgensen L, Stedmon C A, Kragh T, et al. Global trends in the fluorescence characteristics and distribution of marine dissolved organic matter[J]. Marine Chemistry, 2011, 126(1): 139-148.
(  0) 0) |
| [3] |
Catalá T S, Reche I, Fuentes-Lema A, et al. Turnover time of fluorescent dissolved organic matter in the dark global ocean[J]. Nature Communications, 2015(6): 5986.
(  0) 0) |
| [4] |
Nelson N B, Siegel D A. The global distribution and dynamics of chromophoric dissolved organic matter[J]. Annual Review of Marine Science, 2013(5): 447-476.
(  0) 0) |
| [5] |
Fryer P, Hussong D M. Arc volcanism in the Mariana Trough[J]. Eos Trans. AGU, 1982(63): 1135.
(  0) 0) |
| [6] |
Gardner T W, Fisher D M, Morell K D, et al. Upper-plate deformation in response to flat slab subduction inboard of the aseismic Cocos Ridge, Osa Peninsula, Costa Rica[J]. Lithosphere, 2013, 5(3): 247-264. DOI:10.1130/L251.1
(  0) 0) |
| [7] |
Glud R N, Wenzhöfer F, Middelboe M, et al. High rates of microbial carbon turnover in sediments in the deepest oceanic trench on Earth[J]. Nature Geoscience, 2013, 6(4): 284-288. DOI:10.1038/ngeo1773
(  0) 0) |
| [8] |
Nunoura T, Takaki Y, Hirai M, et al. Hadal biosphere: insight into the microbial ecosystem in the deepest ocean on Earth[J]. Proceedings of the National Academy of Sciences, 2015, 112(11): E1230. DOI:10.1073/pnas.1421816112
(  0) 0) |
| [9] |
Turnewitsch R, Falahat S, Stehlikova J, et al. Recent sediment dynamics in hadal trenches: Evidence for the influence of higher-frequency (tidal, near-inertial) fluid dynamics[J]. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 2014, 90: 125-138. DOI:10.1016/j.dsr.2014.05.005
(  0) 0) |
| [10] |
雷惠, 潘德炉, 陶邦一, 等. 东海典型水体的黄色物质光谱吸收及分布特征[J]. Acta Oceanologica Sinica, 2009, 31(2): 57-62. Lei Hui, Pan Delu, Tao Bangyi, et al. The spectral absorption and distribution characteristics of CDOM in the typical waters of the East China Sea[J]. Acta Oceanologica Sinica, 2009, 31(2): 57-62. (  0) 0) |
| [11] |
Lawaetz A J, Stedmon C A. Fluorescence intensity calibration using the Raman scatter peak of water[J]. Applied Spectroscopy, 2009, 63(8): 936-940. DOI:10.1366/000370209788964548
(  0) 0) |
| [12] |
Druffel E R M, Bauer J E, Griffin S, et al. Dissolved inorganic radiocarbon in the North Pacific Ocean and Sargasso Sea[J]. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 2008, 55(4): 451-459. DOI:10.1016/j.dsr.2007.12.007
(  0) 0) |
| [13] |
Hansell D A, Carlson C A. Deep-ocean gradients in the concentration of dissolved organic carbon[J]. Nature, 1998, 395(6699): 263-266. DOI:10.1038/26200
(  0) 0) |
| [14] |
VBauer J E, Druffel E R M, Wolgast D M, et al. Distributions of dissolved organic and inorganic carbon and radiocarbon in the eastern North Pacific continental margin[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 1998, 45(4): 689-713.
(  0) 0) |
| [15] |
Stedmon C A, Markager S. Behaviour of the optical properties of coloured dissolved organic matter under conservative mixing[J]. Estuarine Coastal & Shelf Science, 2003, 57(5-6): 973-979.
(  0) 0) |
| [16] |
Youhei Y, Eiichiro T. Basin scale distribution of chromophoric dissolved organic matter in the Pacific Ocean[J]. Limnology & Oceanography, 2009, 54(2): 598-609.
(  0) 0) |
| [17] |
Coble P G. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy[J]. Marine Chemistry, 1996, 51(4): 325-346. DOI:10.1016/0304-4203(95)00062-3
(  0) 0) |
| [18] |
Stedmon C A, Markager S, Bro R. Tracing dissolved organic matter in aquatic environments using a new approach to fluorescence spectroscopy[J]. Marine Chemistry, 2003, 82(3): 239-254.
(  0) 0) |
| [19] |
Mayer L M, Schick L L, Iii T C L. Dissolved protein fluorescence in two Maine estuaries[J]. Marine Chemistry, 1999, 64(3): 171-179. DOI:10.1016/S0304-4203(98)00072-3
(  0) 0) |
| [20] |
Grzybowski W. Effect of short-term sunlight irradiation on absorbance spectra of chromophoric organic matter dissolved in coastal and riverine water[J]. Chemosphere, 2000, 40(12): 1313-1318. DOI:10.1016/S0045-6535(99)00266-0
(  0) 0) |
| [21] |
郭卫东, 程远月. 天然日光辐照下河口区CDOM的光化学降解[J]. 环境科学, 2008, 29(6): 1463-1468. Guo Weidong, Cheng Yuanyue. Photochemical degradation of CDOM in estuarine area under natural daylight irradiation[J]. Environmental Science, 2008, 29(6): 1463-1468. (  0) 0) |
| [22] |
Huguet A, Vacher L, Relexans S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 2009, 40(6): 706-719. DOI:10.1016/j.orggeochem.2009.03.002
(  0) 0) |
| [23] |
Nunoura T, Takaki Y, Hirai M, et al. Hadal biosphere: insight into the microbial ecosystem in the deepest ocean on Earth[J]. Proceedings of the National Academy of Sciences, 2015, 112(11): E1230. DOI:10.1073/pnas.1421816112
(  0) 0) |
| [24] |
Turnewitsch R, Falahat S, Stehlikova J, et al. Recent sediment dynamics in hadal trenches: Evidence for the influence of higher-frequency (tidal, near-inertial) fluid dynamics[J]. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 2014, 90: 125-138. DOI:10.1016/j.dsr.2014.05.005
(  0) 0) |
| [25] |
Cannizzaro J P, Carder K L. Estimating Chlorophyll a concentrations from remote-sensing reflectance in optically shallow waters[J]. Remote Sensing of Environment, 2006, 101(1): 13-24. DOI:10.1016/j.rse.2005.12.002
(  0) 0) |
| [26] |
Etheridge S M, Roesler C S. Temporal variations in phytoplankton, particulates, and colored dissolved organic material based on optical properties during a Long Island brown tide compared to an adjacent embayment[J]. Harmful Algae, 2004, 3(4): 331-342. DOI:10.1016/j.hal.2004.06.005
(  0) 0) |
| [27] |
Rochelle-Newall E J, Fisher T R. Production of chromophoric dissolved organic matter fluorescence in marine and estuarine environments: an investigation into the role of phytoplankton[J]. Marine Chemistry, 2002, 77(1): 7-21. DOI:10.1016/S0304-4203(01)00072-X
(  0) 0) |
| [28] |
Mopper K, Schultz C A. Fluorescence as a possible tool for studying the nature and water column distribution of DOC components[J]. Marine Chemistry, 1993, 41(1): 229-238.
(  0) 0) |
2. Key Laboratory of Marine Environmental Science and Ecology, Ocean University of China, Qingdao 266100, China;
3. Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, Ocean University of China, Qingdao 266100, China
 2018, Vol. 48
2018, Vol. 48


