2. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100;
3. 中国海洋大学化学化工学院,山东 青岛 266100
硝基酚类化合物(Nitro aromatic compounds, NACs)是一类常见的化工原料,也是制备炸药、农药、染料等产品的重要中间体[1]。但由于硝基的存在,NACs已被证实具有高毒性、致癌性、致突变性,且在水环境中具有较高稳定性,不易被一般化学或生物方法降解[2-3]。因此,NACs的无害化处理引起了广泛关注。氢转移催化法利用催化剂将供氢体提供的活性氢快速作用于NACs的硝基使其脱水还原为氨基,在常温常压下实现由硝基化合物向氨基化合物的转化[4]。该方法温和、高效、操作简便,且在去除NACs的同时还可获得高附加值的芳香胺,是一种十分有前景的NACs处理方法。
贵金属纳米粒子,如纳米金、纳米银、纳米铂等,被认为是氢转移催化反应有效的催化剂,但高昂的成本限制了其大规模应用。纳米铜粒子(Copper nanoparticles, CuNPs)价格低廉、自然界储量丰富,且具有界面效应和量子尺寸效应等特性,表现出与贵金属纳米粒子相似的催化活性,被认为是贵金属纳米粒子极有潜力的替代品[5-6]。然而,CuNPs具有较高的表面能,易团聚且形状难以控制,这限制了其氢转移催化NACs的活性[7]。选择适当的稳定剂控制CuNPs的尺寸形貌,并将其负载于合适的载体上以提高其稳定性是改善催化活性的重要手段。壳聚糖(Chitosan, CHS)是甲壳素的脱乙酰基衍生物,分子链中存在大量游离的—OH和—NH2,是一种常见的金属纳米粒子稳定剂[8]。壳聚糖的—NH2可与Cu(Ⅱ)形成金属配合物,通过还原金属配合物的方法可制得尺寸形貌可控的CuNPs,有效避免了CuNPs的团聚。脱乙酰度是壳聚糖重要的分子参数,以壳聚糖为稳定剂制备CuNPs时,脱乙酰度决定了CuNPs在壳聚糖分子链上的分布和溶液中壳聚糖的分子链构象[9],从而影响了CuNPs的尺寸和形貌,最终决定了其催化还原活性。氧化石墨烯(Graphene oxide, GO)具有较大的表面积,含有—COOH、—OH、—CH(O)CH—等亲水基团,在水中具有良好的分散性,是一种稳定性较好的载体[10]。在水溶液中带正电荷的壳聚糖与带负电荷的GO之间存在氢键和静电相互作用等,可使经壳聚糖稳定的CuNPs牢固负载在GO上,有效扩大了CuNPs与NACs的接触面积。此外,GO还被证明可以提高催化反应过程中的电子转移效率,具有提高催化剂催化性能的能力[11]。
本文以NaH2PO2·H2O和L-抗坏血酸为还原剂,以不同脱乙酰度壳聚糖为稳定剂,制备GO负载的CuNPs复合物(GO-CuNPs-CHS)。利用紫外-可见光谱(UV-visible spectra, UV-vis)研究了壳聚糖脱乙酰度对GO-CuNPs-CHS中CuNPs尺寸形貌的影响。利用傅里叶变换红外光谱(Fourier transform infrared spectra, FT-IR)、透射电子显微镜(Transmission electron microscopy, TEM)和X射线衍射(X-ray diffraction patterns, XRD)对GO-CuNPs-CHS进行了表征,研究了其对4-硝基苯酚的氢转移催化性能。
1 材料与仪器 1.1 实验材料壳聚糖(Chitosan,CS,分子量48×104 Da,脱乙酰度91.9%)购自山东奥康生物公司。氧化石墨烯(GO)购自山东利特纳米技术有限公司。氯化铜(CuCl2),L-抗坏血酸(C6H8O6),4-硝基苯酚(4-nitrophenol,4-NP),氢氧化钠(NaOH),醋酸(CH3COOH),硼氢化钠(NaBH4)均购自国药集团化学试剂有限公司。次亚磷酸钠一水合物(NaH2PO2·H2O)购自上海麦克林生化科技有限公司。所有试剂均为分析级,所有实验均使用去离子水。
1.2 实验仪器UV-2100 PC紫外可见分光光度计(上海菁华科技仪器有限公司),Tensor 27傅里叶变换红外光谱仪(德国布鲁克光谱仪器公司),H-7650透射电子显微镜(日立高新技术公司),D8 Advance X射线衍射仪(德国布鲁克光谱仪器公司)。
2 实验部分 2.1 不同脱乙酰度壳聚糖的制备根据Li等[12]的方法,以CS为原料通过N-乙酰化反应制备了脱乙酰度分别为77.0%、63.6%和52.3%的壳聚糖,分别标记为N1、N2和N3。
2.2 GO-CuNPs-CHS的制备所有玻璃器皿在新配制的王水溶液(HNO3∶HCl = 1∶3, v/v)中浸泡24 h以上,使用前用去离子水彻底漂洗。取3.3 mL浓度为1.0%(w/v)的壳聚糖醋酸溶液与1.7 mL 0.30 mg·mL-1 GO水溶液混合,使用1 mol·L-1 NaOH溶液调节pH值至5.0,加入2.0 mL 2 mmol·L-1 CuCl2溶液,在30℃下磁力搅拌1 h。将反应温度升至70 ℃,先后缓慢滴加0.8 mL 0.25 mol·L-1 L-抗坏血酸溶液和1.0 mL 0.1 mol·L-1 NaH2PO2·H2O溶液,继续反应1 h,所得溶液稀释两倍,记录UV-vis光谱。由壳聚糖CS、N1、N2和N3为稳定剂制备的复合物样品分别记为GO-CuNPs-CS、GO-CuNPs-N1、GO-CuNPs-N2和GO-CuNPs-N3。
2.3 GO-CuNPs-CHS的表征使用傅里叶变换红外光谱(FT-IR)在4 000~500 cm-1的扫描范围内,分析复合物官能团之间的相互作用。使用透射电镜(TEM),在100 kV加速电压下,观察复合物的形貌。使用Nano Measurer软件,随机测量CuNPs粒子的粒径,并计算标准偏差,得到CuNPs的平均粒径及粒径分布。使用X射线衍射(XRD),以CuKα为射线源,在40 kV管电压和500 mA管电流下,表征复合物的晶体结构。根据Debye-Scherrer公式(1)计算CuNPs平均晶粒尺寸:
| $ D=\frac{0.89 \lambda}{\beta \cos \theta} \text { 。} $ | (1) |
式中:D为CuNPs平均晶粒尺寸;λ为X射线波长(0.154 nm);β为衍射峰的半峰宽;θ为衍射角。
2.4 氢转移催化实验在过量NaBH4的条件下,以4-NP的氢转移催化反应为模型反应,考察了GO-CuNPs-CHS的催化性能。无特别说明时,是将20 mL 0.20 mmol·L-1 4-NP与等量新制备的0.15 mol·L-1 NaBH4水溶液混合,加入0.20 mL GO-CuNPs-CHS,将反应混合物置于30 ℃恒温振荡器中,在适当的时间间隔内,记录UV-vis光谱。
4-NP的转化率按下式计算:
| $ \text { Conversion }(\%)=\left(1-\frac{A_t}{A_0}\right) \times 100 \text { 。} $ | (2) |
式中:A0为4-硝基苯酚阴离子(4-NPi)的初始吸光度;At为反应时间t时4-NPi的吸光度。
4-NP的氢转移催化反应符合准一级反应动力学,拟合方程如下:
| $ \ln \left(\frac{A_0}{A_t}\right)=k t 。$ | (3) |
式中:k为氢转移催化反应的速率常数,min-1;t是反应时间,min。
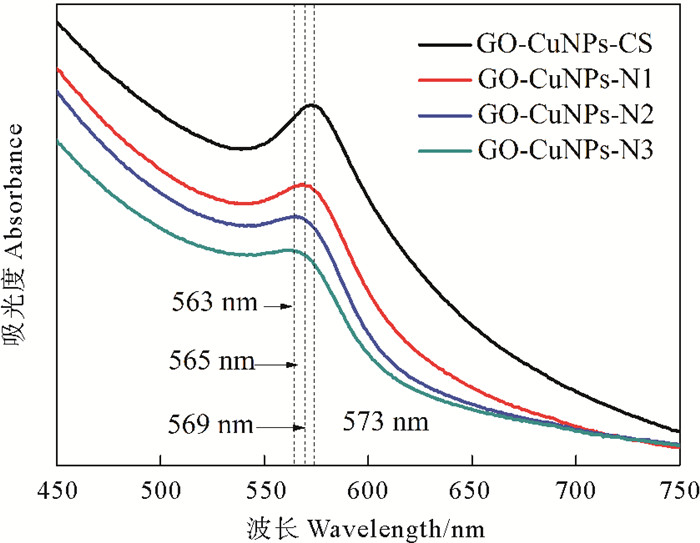
3 结果与讨论 3.1 GO-CuNPs-CHS的制备GO-CuNPs-CHS的制备中,Cu(Ⅱ)先与壳聚糖的—NH2形成金属配合物,然后通过还原金属配合物的方法制备CuNPs。因此,壳聚糖脱乙酰度对CuNPs的尺寸形貌有决定性作用。图 1为1.0%(w/v)的不同脱乙酰度壳聚糖溶液制备GO-CuNPs-CHS的UV-vis光谱图。在UV-vis光谱图中利用表面等离子体共振(Surface Plasmon Resonance,SPR)的位置来判断CuNPs的合成与粒径的变化[13]。一般来说,CuNPs的SPR强度越高表示合成的CuNPs越多,半峰宽越窄表示合成的CuNPs的尺寸越均匀,SPR的蓝移通常代表CuNPs尺寸减小。
|
图 1 由不同脱乙酰度壳聚糖制备的GO-CuNPs-CHS的UV-vis光谱图 Fig. 1 UV-vis spectra of GO-CuNPs-CHS composites synthesized by different degree of deacetylation chitosan |
如图 1所示,随着壳聚糖脱乙酰度的减小,CuNPs的特征吸收峰从573 nm蓝移到563 nm,表明CuNPs的粒径随着壳聚糖脱乙酰度减小而减小。经过壳聚糖的N-乙酰化反应,在壳聚糖的—NH2上引入较大的乙酰基团,使得低脱乙酰度壳聚糖分子链在溶液中具有较强的空间位阻效应,导致了壳聚糖分子链的刚性增强,抑制了CuNPs的进一步生长[9]。随着壳聚糖脱乙酰度的减小,可与壳聚糖螯合的Cu(Ⅱ)数量减少,合成的CuNPs减少,表现为CuNPs的SPR强度随着壳聚糖脱乙酰度的降低而降低。
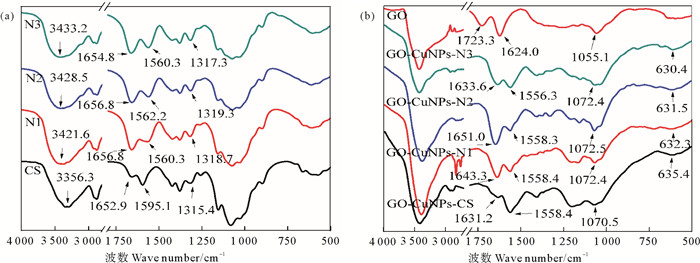
3.2 GO-CuNPs-CHS的表征 3.2.1 傅里叶变换红外光谱壳聚糖的FT-IR光谱如图 2(a)所示。壳聚糖在3 356.3~3 433.2 cm-1范围内的强吸收峰可以归因于—OH和—NH2的重叠伸缩振动[14]。CS在1 652.9和1 595.1 cm-1处的吸收峰分别对应—C=O的拉伸振动(酰胺I中的N-乙酰基)和—NH2的弯曲振动[15]。1 315.4 cm-1处的吸收峰是由N—H(酰胺ⅡI)的弯曲振动引起的[16]。与CS相比,低脱乙酰度的壳聚糖在1 560.3~1 562.2 cm-1处出现了对应于N—H的拉伸振动的吸收峰,1 654.8~1 656.8 cm-1处酰胺I带的特征峰明显增强,证明N-乙酰化壳聚糖成功制备。
|
图 2 不同脱乙酰度壳聚糖(a)及以其为稳定剂制备的GO-CuNPs-CHS和GO (b)的FT-IR光谱图 Fig. 2 FT-IR spectra of different degree of deacetylation chitosan (a) and GO-CuNPs-CHS composites and GO (b) |
GO中存在许多含氧基团,如图 2(b)所示,1 723.3、1 624.0和1 055.1 cm-1处的吸收峰分别归属于羰基和羧基的C=O伸缩振动[17]、GO的C=C骨架振动和伯醇的C—O伸缩振动[18]。GO-CuNPs-CHS在630 cm-1附近出现的特征峰代表CuNPs成功制备[19]。壳聚糖的—NH2弯曲振动的特征峰向低波数方向移动,GO的伯醇的C—O伸缩振动向高波数反向移动,表明GO的—OH、壳聚糖的—NH2与CuNPs之间发生了相互作用,GO与壳聚糖参与了CuNPs的负载和稳定。
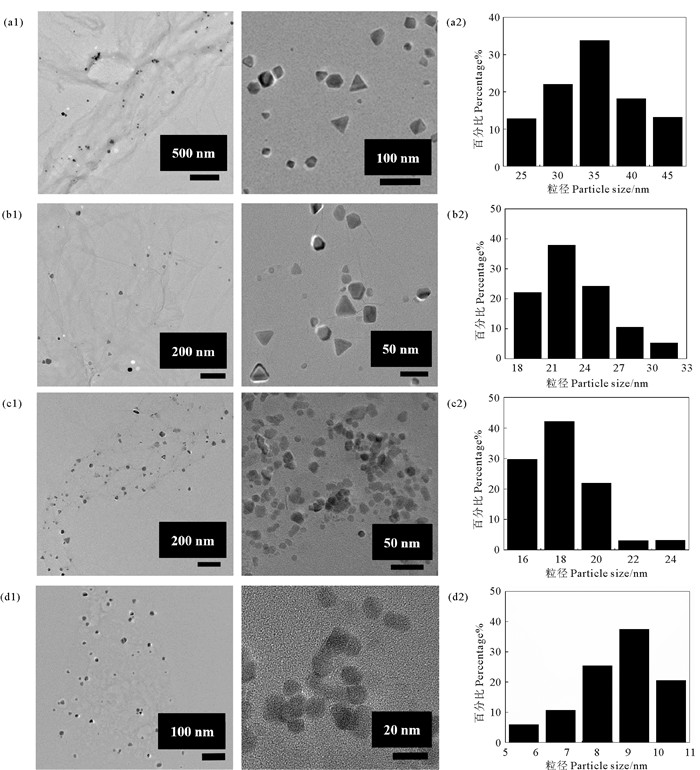
3.2.2 透射电子显微镜TEM图像显示了以不同脱乙酰度壳聚糖为稳定剂制备的GO-CuNPs-CHS尺寸形貌差异。其中球形与近球形的CuNPs以粒子直径表示粒径,三角形与近三角形的CuNPs以边长表示粒径[20]。
图 3(a1)—(d1)为GO-CuNPs-CHS的TEM图像,图 3(a2)—(d2)为对应的粒径分布直方图。由图 3(a)和(b)可知,GO-CuNPs-CS和GO-CuNPs-N1中的CuNPs均匀分散在GO上,CuNPs呈三角形和多边形等多种形状,平均粒径分别为(35.0±6.8) 和(22.0± 3.3) nm。GO-CuNPs-N2(见图 3(c))和GO-CuNPs-N3(见图 3(d))中,CuNPs主要为近球形,平均粒径分别为(18.0±1.8) 和(9.0±1.3) nm。结果表明,以低脱乙酰度壳聚糖为稳定剂可制备具有小粒径、近球形的CuNPs。
|
( (a) GO-CuNPs-CS, (b) GO-CuNPs-N1, (c) GO-CuNPs-N2, (d) GO-CuNPs-N3. ) 图 3 不同脱乙酰度壳聚糖为稳定剂制备的GO-CuNPs-CHS的TEM图像和粒径分布直方图 Fig. 3 TEM images and histogram of particle size distribution of GO-CuNPs-CHS composites synthesized by different degree of deacetylation chitosan |
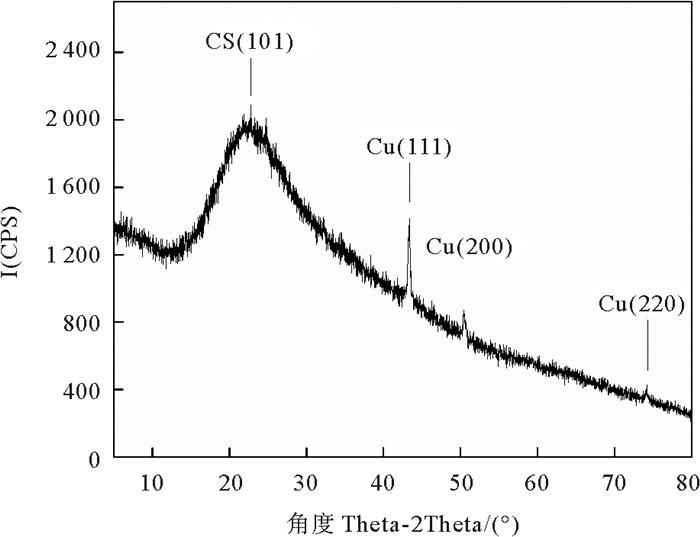
如图 4所示,使用XRD分析了GO-CuNPs-CS的晶体结构。GO-CuNPs-CS的XRD图谱中位于22.3°的衍射峰对应于CS的(101)晶面[21]。位于43.4°、50.4°和74.2°的衍射峰,分别对应于铜晶体的(111)、(200)和(220)晶面,与(JCPDS card no. 04-0836)相符,表明CuNPs的成功合成。根据Debye-Scherrer公式计算可知CuNPs的平均晶粒尺寸为32.3 nm。
|
图 4 GO-CuNPs-CS的XRD谱图 Fig. 4 XRD pattern of GO-CuNPs-CS |
以GO-CuNPs-CS为催化剂研究了不同反应温度下4-NP的氢转移催化反应。图 5(a)为4-NP转化率随着反应时间的变化图。在研究的温度范围内,反应30 min时,4-NP的转化率均可以达98.4%。反应温度越高,催化反应进行得越快。45 ℃时,反应10 min,转化率即可达98.3%。
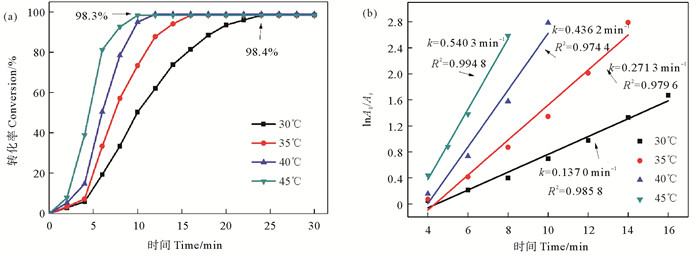
|
图 5 不同温度条件下GO-CuNPs-CS氢转移催化4-NP的(a)转化率和(b)lnA0/At随时间t变化 Fig. 5 Conversion of 4-NP (a) and plot of lnA0/At versus time for the hydrogen transform catalytic reduction of 4-NP (b) at different reaction temperature |
图 5(b)为不同反应温度下氢转移催化反应的动力学拟合曲线。由于该反应初期存在催化剂表面重构的“诱导期”,此时4-NP转化速率缓慢,对氢转移催化反应的动力学分析在反应进行4 min之后开始进行[22]。如图可知,氢转移催化反应符合伪一级动力学方程,当反应温度从30 ℃升高到45 ℃时,反应速率常数k从0.137 0增大至0.540 3 min-1。
3.3.2 壳聚糖脱乙酰度的影响图 6为壳聚糖脱乙酰度对以其为稳定剂制备的GO-CuNPs-CHS的4-NP氢转移催化性能的影响。如图 6(a)所示,反应进行24 min时,四种催化剂对4-NP转化率均可达到98.4%。以GO-CuNPs-CuNPs-N3为催化剂时,反应8 min时4-NP转化率已达98.4%。四种催化剂氢转移催化4-NP的过程均符合伪一级动力学方程(见图 6(b))。由壳聚糖CS、N1、N2和N3为稳定剂制备的GO-CuNPs-CHS对4-NP的氢转移催化反应速率常数分别为0.137 0、0.214 2、0.284 0和0.686 8 min-1。
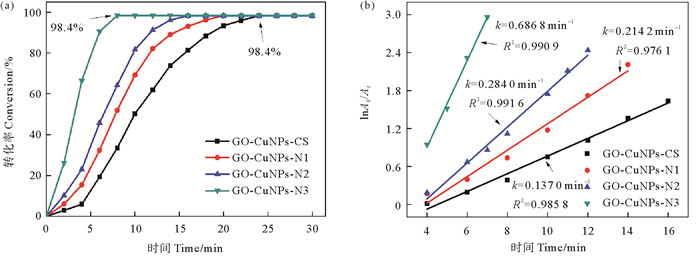
|
图 6 以不同脱乙酰度壳聚糖为稳定剂制备的GO-CuNPs-CHS氢转移催化4-NP反应的转化率(a)和lnA0/At随时间t变化(b) Fig. 6 Conversion of 4-NP by GO-CuNPs-CHS composites synthesized by different degree of deacetylation chitosan as stabilizer (a) and plot of lnA0/At versus time (b) |
分析四种GO-CuNPs-CHS对4-NP的氢转移催化反应的活化能和热力学行为。图 7(a)为GO-CuNPs-CHS氢转移催化4-NP的lnk对1/T的拟合曲线,依公式(4)可以计算出反应活化能Ea:
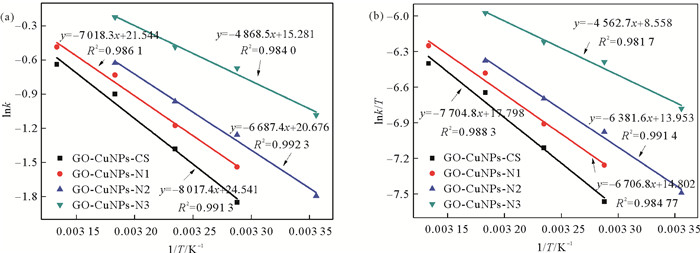
|
图 7 GO-CuNPs-CHS氢转移催化4-NP反应的(a) lnk和(b) lnk/T随1/T的变化图 Fig. 7 Plot of lnk versus 1/T (a) and plot of lnk/T versus 1/T of 4-NP hydrogen transfer catalytic reduction (b) by GO-CuNPs-CHS |
| $ \ln k=\ln A-{\frac{E_{\mathrm{a}}}{R T}}。$ | (4) |
式中:k为反应速率常数,min-1;Ea是反应的活化能,kJ·mol-1;R为理想气体常数,8.314 J·K-1·mol-1;T是绝对温度,K。
图 7(b)为GO-CuNPs-CHS氢转移催化4-NP的lnk/T对1/T的拟合曲线,依公式(5)和公式(6)可以计算得到焓变(ΔH)、熵变(ΔS)和不同反应温度下的吉布斯自由能(ΔG):
| $ \ln \frac{k}{T}=\left(-\frac{\Delta H}{R}\right) \frac{1}{T}+\frac{\Delta S}{R}+\ln \frac{K_B}{h} 。$ | (5) |
| $ \Delta G=\Delta H-T \Delta S 。$ | (6) |
式中:h为普朗克常数,1.104×10-35 J·min;KB为玻尔兹曼常数,1.381×10-23 J·K-1。
GO-CuNPs-CHS氢转移催化4-NP反应的活化能及热力学参数列于表 1。随着壳聚糖脱乙酰度的降低,以其为稳定剂制备的GO-CuNPs-CHS氢转移催化4-NP的Ea由66.7减小为40.5 kJ·mol-1,ΔH由64.1减小为37.9 kJ·mol-1,ΔS由-83.6减小为-160.4 J·K-1·mol-1,ΔG均大于零且随着反应温度的升高而增大。结果表明,GO-CuNPs-CHS氢转移催化4-NP的反应是非自发进行的吸热过程,且随着反应的进行,该过程的无序性逐渐减小。以GO-CuNPs-N3为催化剂时,4-NP的氢转移催化反应更容易进行。
|
|
表 1 GO-CuNPs-CHS氢转移催化4-NP反应的活化能及热力学参数 Table 1 Thermodynamic parameters of 4-NP hydrogen transfer catalytic reduction by GO-CuNPs-CHS |
将GO-CuNPs-CHS氢转移催化4-NP的Ea与其他文献进行比较(见表 2),结果表明本研究获得的Ea值低于一些已报道的CuNPs催化剂和一些贵金属催化剂氢转移催化4-NP的Ea值。
|
|
表 2 GO-CuNPs-CHS氢转移催化4-NP的活化能(Ea)与文献报道的催化剂体系的比较 Table 2 Comparison of the activation energy (Ea) for GO-CuNPs-CHS hydrogen transfer catalytic reduction of 4-NP with other reported catalyst systems |
GO-CuNPs-CHS氢转移催化4-NP的机理如图 8所示。反应开始时,4-NP和BH4-吸附在催化剂表面。BH4-充当供电子体释放电子,该电子迁移至催化剂的表面,形成表面活性氢作用于4-NP的硝基形成亚硝基,并进一步脱水还原使得4-NP转化为4-氨基苯酚(4-AP)[28]。
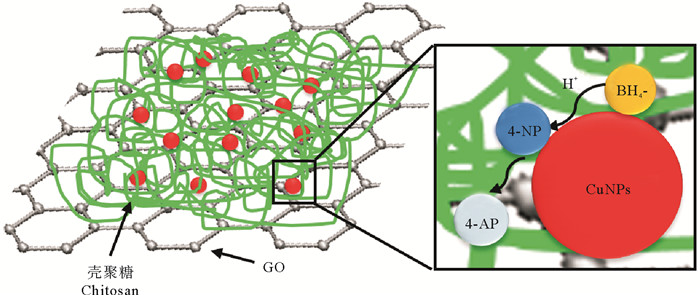
|
图 8 GO-CuNPs-CHS氢转移催化反应的机理 Fig. 8 Mechanism of hydrogen transfer catalytic reduction of GO-CuNPs-CHS composites |
GO-CuNPs-CHS具有较强氢转移催化活性的原因可能是:其一,CuNPs的氧化还原电位与尺寸有关,CuNPs的尺寸越小,氧化还原电位就越小。小尺寸的CuNPs与NACs之间可以形成更大的电位差,展示出更强的氢转移催化活性[29]。此外,CuNPs的尺寸越小与NACs接触的比表面积就越大。这也解释了以低脱乙酰度壳聚糖为稳定剂制备的GO-CuNPs-CHS具有更强氢转移催化性能的原因。其二,将CuNPs固定于GO载体上可有效提高氢转移催化性能。CuNPs均匀分布于GO载体表面,防止了CuNPs的团聚,增加了活性位点,有利于其与NACs充分接触。同时,GO具有优良的转移电子能力,以GO为载体可以加快氢转移催化反应中的电子转移速率,从而进一步提高GO-CuNPs-CHS的氢转移催化性能。
4 结论(1) 壳聚糖脱乙酰度决定了CuNPs的尺寸形貌。壳聚糖脱乙酰度越小越有利于制备小粒径、近球形的CuNPs。
(2) GO-CuNPs-CHS对4-NP的氢转移催化活性随着作为稳定剂的壳聚糖脱乙酰度的降低而增强,证明将小粒径、近球形的CuNPs负载于GO可制备高活性的氢转移催化剂。
(3) 以GO-CuNPs-CHS为催化剂的4-NP氢转移催化反应为非自发进行的吸热反应。升高反应温度有利于加快催化反应速率,且随着反应的进行,该过程的无序性逐渐减小。
| [1] |
Peres C M, Agathos S N. Biodegradation of nitroaromatic pollutants: From pathways to remediation[J]. Biotechnology Annual Review, 2000, 6: 197-220. (  0) 0) |
| [2] |
Rodgers J D, Bunce N J. Treatment methods for the remediation of nitroaromatic explosives[J]. Water Research, 2001, 35: 2101-2111. DOI:10.1016/S0043-1354(00)00505-4 (  0) 0) |
| [3] |
Tiwari J, Tarale P, Sivanesan S, et al. Environmental persistence, hazard, and mitigation challenges of nitroaromatic compounds[J]. Environmental Science and Pollution Research, 2019, 26: 28650-28667. DOI:10.1007/s11356-019-06043-8 (  0) 0) |
| [4] |
Orlandi M, Brenna D, Harms R, et al. Recent developments in the reduction of aromatic and aliphatic nitro compounds to amines[J]. Organic Process Research & Development, 2018, 22(4): 430-445. (  0) 0) |
| [5] |
Chen M, Gao Y, Fu B, et al. A tandem adsorption-catalysis strategy for the removal of copper ions and catalytic reduction of 4-nitrophenol[J]. ACS Omega, 2020, 5(36): 23372-23377. DOI:10.1021/acsomega.0c03329 (  0) 0) |
| [6] |
Li Q, Song H, Ye Y, et al. A green designed copper-resin composite for highly efficient catalytic reduction of 4-nitrophenol[J]. Colloid and Interface Science Communications, 2021, 42: 100407. DOI:10.1016/j.colcom.2021.100407 (  0) 0) |
| [7] |
BiÇçer M, Şişman I. Controlled synthesis of copper nano/microstructures using ascorbic acid in aqueous CTAB solution[J]. Powder Technology, 2010, 198: 279-284. DOI:10.1016/j.powtec.2009.11.022 (  0) 0) |
| [8] |
贾双珠, 李长安, 刘品祯, 等. 壳聚糖的应用研究进展[J]. 精细与专用化学品, 2022, 30(1): 25-30. Jia S Z, Li C A, Liu P Z, et al. Research progress in the application of chitosan[J]. Fine and Specialty Chemicals, 2022, 30(1): 25-30. (  0) 0) |
| [9] |
Lim C, Hwang D S, Lee D W. Intermolecular interactions of chitosan: Degree of acetylation and molecular weight[J]. Carbohydrate Polymers, 2021, 259: 117782. DOI:10.1016/j.carbpol.2021.117782 (  0) 0) |
| [10] |
Aunkor M T H, Mahbubul I M, Saidur R, et al. The green reduction of graphene oxide[J]. RSC Advances, 2016, 6: 27807-27828. DOI:10.1039/C6RA03189G (  0) 0) |
| [11] |
Tarcan R, Todor-Boer O, Petrovai I, et al. Reduced graphene oxide today[J]. Journal of Materials Chemistry C, 2020, 8: 1198-1224. DOI:10.1039/C9TC04916A (  0) 0) |
| [12] |
Li J, Du Y, Liang H. Influence of molecular parameters on the degradation of chitosan by a commercial enzyme[J]. Polymer Degradation and Stability, 2007, 92(3): 515-524. DOI:10.1016/j.polymdegradstab.2006.04.028 (  0) 0) |
| [13] |
Kottappara R, Pillai S C, Vijayan B K. Copper-based nanocatalysts for nitroarene reduction-A review of recent advances[J]. Inorganic Chemistry Communications, 2020, 121: 108181. DOI:10.1016/j.inoche.2020.108181 (  0) 0) |
| [14] |
喻弘, 李发彩, 彭春, 等. 戊二醛/纳米SiO2/壳聚糖复合膜的制备及其特性[J]. 食品工业, 2019, 40(6): 87-91. Yu H, Li F C, Peng C, et al. Preparation and properties of glutaraldehyde/nanosilica/ chitosan composite film[J]. The Food Industry, 2019, 40(6): 87-91. (  0) 0) |
| [15] |
Zhou H, Attalla E, Ahmed E A, et al. Synthesis of chitosan-stabilized copper nanoparticles (CS-CuNPs): Its catalytic activity for C-N and C-O cross-coupling reactions and treatment of bladder cancer[J]. Arabian Journal of Chemistry, 2021, 14(10): 103259. DOI:10.1016/j.arabjc.2021.103259 (  0) 0) |
| [16] |
贤凤, 程婉婷, 高静. 壳聚糖纳米粒子的制备方法及其作为药物递送载体的应用[J]. 化学试剂, 2021, 43(12): 1615-1622. Xian F, Cheng W T, Gao J. A review on the preparation methods of chitosan nanoparticles and their applications as drug delivery carriers[J]. Chemical Reagents, 2021, 43(12): 1615-1622. DOI:10.13822/j.cnki.hxsj.2021008404 (  0) 0) |
| [17] |
Yin D, Lu N, Li Z, et al. A computational infrared spectroscopic study of graphene oxide[J]. The Journal of Chemical Physics, 2013, 139: 084704. DOI:10.1063/1.4818539 (  0) 0) |
| [18] |
Yamada Y, Masaki S, Sato S. Brominated positions on graphene nanoribbon analyzed by infrared spectroscopy[J]. Journal of Materials Science, 2020, 55: 10522-10542. DOI:10.1007/s10853-020-04786-1 (  0) 0) |
| [19] |
Gong Y, Yu Y, Kang H, et al. Synthesis and characterization of graphene oxide/chitosan composite aerogels with high mechanical performance[J]. Polymers, 2019, 11(5): 777. DOI:10.3390/polym11050777 (  0) 0) |
| [20] |
Huergo M A, Maier C A, Castez M F, et al. Optical nanoparticle sorting elucidates synthesis of plasmonic nanotriangles[J]. ACS Nano, 2016, 10(3): 3614-3621. DOI:10.1021/acsnano.5b08095 (  0) 0) |
| [21] |
Antonino R S, Lia R P, Oliveira V A, et al. Preparation and characterization of chitosan obtained from shells of shrimp (Litopenaeus vannamei boone)[J]. Marine Drugs, 2017, 15(5): 141. DOI:10.3390/md15050141 (  0) 0) |
| [22] |
Bian T, Zhang J J, Wang Z, et al. MoS2-induced hollow Cu2O spheres: Synthesis and efficient catalytic performance in the reduction of 4-nitrophenol by NaBH4[J]. Applied Surface Science, 2021, 539: 148285. DOI:10.1016/j.apsusc.2020.148285 (  0) 0) |
| [23] |
Wu X Q, Wu X W, Shen J S, et al. In situ formed metal nanoparticle systems for catalytic reduction of nitroaromatic compounds[J]. RSC Advances, 2014, 90: 49287-49294. (  0) 0) |
| [24] |
El-Bahy Z M. Preparation and characterization of Pt-promoted NiY and CoY catalysts employed for 4-nitrophenol reduction[J]. Applied Catalysis A: General, 2013, 468: 175-183. DOI:10.1016/j.apcata.2013.08.047 (  0) 0) |
| [25] |
Lu Y, Mei Y, Walker R, et al. 'Nano-tree'-type spherical polymer brush particles as templates for metallic nanoparticles[J]. Polymer, 2003, 47: 4985-4995. (  0) 0) |
| [26] |
He T, Luo L, Yang J, et al. Self-healing and high reusability of Au nanoparticles catalyst based on supramolecular hydrogel[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2019, 583: 123954. (  0) 0) |
| [27] |
Thawarkar S R, Thombare B, Mundec B S, et al. Kinetic investigation for the catalytic reduction of nitrophenol using ionic liquid stabilized gold nanoparticles[J]. RSC Advance, 2018, 8: 38384-38390. (  0) 0) |
| [28] |
Din M I, Khalid R, Hussain Z, et al. Nanocatalytic assemblies for catalytic rduction of nitrophenols: A critical review[J]. Critical Reviews in Analytical Chemistry, 2020, 50(4): 322-338. (  0) 0) |
| [29] |
Jiang Z, Liu C, Sun L W. Catalytic properties of silver nanoparticles supported on silica spheres[J]. The Journal of Physical Chemistry B, 2005, 109(5): 1730-1735. (  0) 0) |
2. The Key Laboratory of Marine Environmental and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China;
3. College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China
 2023, Vol. 53
2023, Vol. 53


