自20世纪70年代末以来,环莱州湾地区经济不断发展,人类活动逐渐加强,陆源污染物不断排放入海[1-2],导致莱州湾海域营养盐结构发生显著变化,氮磷比逐渐失衡[3];同时溶解有机氮(DON)浓度不断升高,氮形态由氧化态向还原态转变。营养盐结构和组成的变化引起了浮游植物群落结构的变化[4],导致有害赤潮频发[5]、水母旺发等生态问题,并导致渔业资源衰退[6],对环湾地区经济社会的可持续发展造成严重影响[7]。
DON是海洋氮库中的主要组成者,近岸海域DON浓度不断增加,其在总溶解态氮(TDN)中占比不断增加,成为近岸海域最大的氮储库,其组成和结构对于浮游植物群落结构和丰度有显著影响[8]。调查显示,莱州湾入海河流及直排污口DON占TDN的比例在春季、夏季和秋季分别为77%、63%和54%,均在一半以上[9]。随着莱州湾DON浓度的增加,浮游植物群落结构出现了由硅藻向甲藻等非硅藻种群演替的趋势,这或与甲藻等非硅藻种群对DON吸收有关[10]。硅藻和甲藻对DON利用的差异很可能与其生态学行为有关,比如硅藻大多为光自养[11],甲藻为兼养,具有吞噬有机物的能力等[12]。因此,DON与沿海有害藻华爆发及浮游植物群落结构演替之间的关系受到广泛关注[13]。DON可以作为潜在氮源被细菌、真菌以及浮游植物吸收利用,参与生物氮循环过程[14]。DON生物可利用性由化学结构决定,化学结构又因分子量、组分、来源的差异而有所不同[15-16]。研究表明,尿素、氨基酸等小分子化合物具有更高的生物可利用性,可以支持海洋生态系统中绝大多数藻类的生长[17]。大分子DON的降解需要氨基酸氧化酶、亮氨酸氨肽酶、胰蛋白酶等多种酶协作,其中亮氨酸氨肽酶研究最多,可以用来指示DON的利用水平[18]。浮游植物可以通过产生亮氨酸氨肽酶水解大分子蛋白质为小分子多肽和氨基酸,间接利用大分子蛋白质作为氮源进行生长[19-20]。根据DON分子的亲疏水特性,可以将原组分经过XAD-8树脂分为疏水性较强的腐殖质类化合物和分子结构相对简单的亲水性较强的蛋白质类化合物[21]。浮游植物对亲水DON和疏水DON的利用存在显著的差异,其中60%~80%的亲水DON能被浮游植物吸收利用,表现出较高的生物可利用性,而仅有20%~27%的疏水DON能被浮游植物吸收利用,表现为较高的惰性[22],来自污水处理厂出水口DON的亲水组分能被藻类吸收利用,DON浓度降低了40%~85%[23],而疏水性组分生物可利用性较低[24],来自农场及农田附近的畜禽养殖源和农业源的DON疏水性组分有较高的生物利用性[25]。
目前国内外对硅甲藻演替的研究主要集中在无机态氮和小分子DON(尿素、氨基酸)[10, 26-27],而不同组分有机氮对于浮游植物群落中的硅甲藻演替的影响尚不清楚,且存在颇多争议[28-30]。因此本研究以农业源有机质作为DON氮源,设置不同氮磷比,加富DON原水和亲水、疏水不同组分,结合营养盐吸收动力学参数、亮氨酸氨肽酶酶活性、三维荧光光谱等,探讨浮游植物群落在不同氮磷比条件下对于DON亲水和疏水组分的响应。本研究结果有助于了解DON对硅藻和甲藻生长及其种群演替的影响,并可为赤潮的预测和防控提供科学依据。
1 材料和方法 1.1 研究区域莱州湾作为渤海三大海湾之一,是典型的半封闭性陆架海湾,其沿岸有黄河、小清河、白浪河等数十条河流汇入,带来了大量的营养盐,莱州湾西部海域富营养化较为严重,赤潮频发。培养实验藻种取自莱州湾西部赤潮高发区(37°25′N,119°21′E),岸基实验地点选在青岛市崂山区港东码头附近(36°17′N,120°41′E),该处夏季近海表层海水水温为19~28 ℃,与夏季莱州湾表层海水水温范围(20~28 ℃)基本重合[31-34](见图 1)。
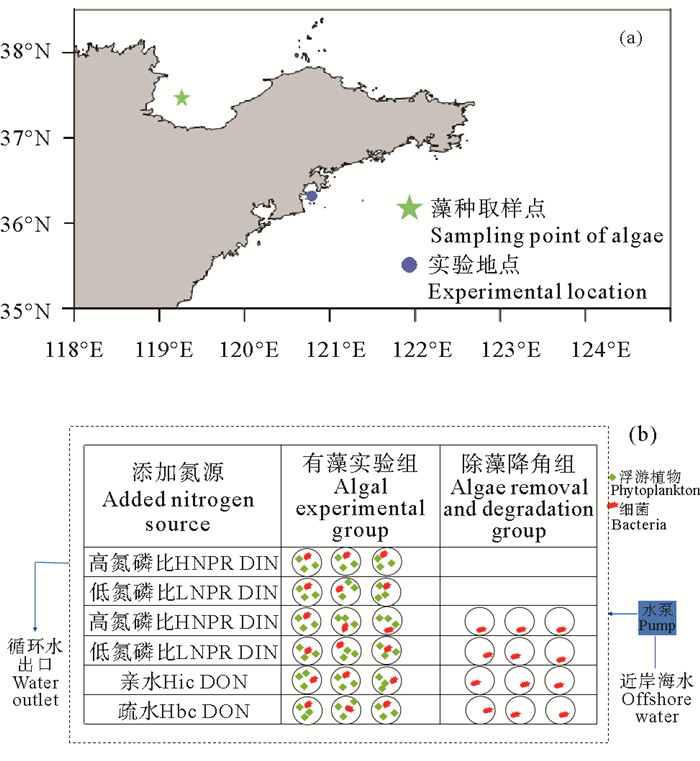
|
图 1 莱州湾岸基现场培养实验采水点(a)及实验设计(b) Fig. 1 Sampling point of seawater (a), experimental design (b) for shore based on-site cultivation experiment |
据第二次全国污染源普查公报,农业源作为近岸海域陆源污染源的重要组分部分,种植业占农业源水污染物总排放量的50%以上,选择农业应用较广的种植类植物生长调节剂作为加富源。将植物生长调节剂和超纯水按1∶10稀释溶解后,用0.22 μm的聚碳酸酯滤膜过滤得到滤液,在避光低温条件下进行切向流超滤浓缩(1 000道尔顿,Pallcompany)以提高DON在总氮中的占比。亲水、疏水组分通过XAD-8树脂[35]分离得到,树脂经预处理之后装入高硼硅色谱柱中,将超滤浓缩后的水样用盐酸酸化至pH为2,以1 mL·min-1的流速通过装有XAD-8树脂的色谱柱,收集得到亲水部分,紧接着用2倍柱体积的0.01 mol·L-1HCl溶液洗出色谱柱残余水样与前收集亲水部分合并,最后使用2倍柱体积的0.01 mol·L-1NaOH溶液以流速1 mL·min-1反冲洗色谱柱,收集得到疏水部分。不同加富源的溶解有机态氮、磷(DON、DOP),溶解无机态营养盐(NH4+-N、NO3--N、NO2--N、PO43--P)以及总溶解有机碳(TOC)浓度如表 1所示。
|
|
表 1 实验用溶解有机质中氮、磷营养盐(DON、NH4-N、NO3-N+NO2-N,PO4-P、DOP)以及总溶解有机碳(DOC)浓度 Table 1 Concentrations of nitrogen and phosphorus nutrients (DON, NH4-N, NO3-N+NO2-N, PO4-P, DOP) and total dissolved organic carbon (DOC) in dissolved organic matter for experiments |
现场实验采用岸基培养于2022年8月底开始,为保证培养体系中海水温度与近岸表层海水温度基本一致,采用泵吸海水循环装置(见图 1)。培养海水取自青岛市小麦岛黄海海域附近(36°03′N,120°25′E),经过0.45 μm醋酸纤维滤膜过滤两次静置用于培养实验,海水中DIN、DON、PO4-P和DOP浓度分别为8.55,13.5,0.103和0.208 μmol/L。将取自莱州湾(37°23′N,119°08′E)赤潮高发区的海水经120目筛绢过滤后,作为藻种接入培养海水,藻种与培养海水按3∶28比例充分混匀后,分别取18 L加入到12个20 L培养瓶中,共设置6组藻培养实验组,同时分别取18 L无藻实验海水加入到8个20 L培养瓶中,设置4组无藻空白对照实验,其中DIN加富组作为DON加富组对照,无藻空白对照组作为有藻培养组对照,每组实验设置2个平行,其中,DON设置原水、亲水(Hydrophilic DON,Hic DON)和疏水(Hydrophobic DON,Hbc DON)3组,氮磷比设置高氮磷比(TN∶TP=120∶1)(High N/P ratio,HNPR)和低氮磷比(TN∶TP=12∶1)(Low N/P ratio,LNPR)2个梯度(见表 2)。培养实验加富DON、DIN和PO4-P浓度按照表 2设置,加富Na2SiO3·9H2O浓度为30 μmol/L,无藻空白对照组用1.2 μm醋酸纤维滤膜过滤除藻[36-37]。
|
|
表 2 现场培养实验各加富组氮、磷营养盐初始浓度 Table 2 Initial concentrations of dissolved nitrogen and phosphorus nutrients in each enriched group in the field culture experiment |
试验周期设为26天,培养后期逐渐加大取样时间间隔,取样时间点为第0,1,2,3,4,5,7,9,12,15,18,22,26天上午9:00。实验期间每天记录水体温度和光照强度,将培养瓶充分混匀后取400 mL样品,用于浮游植物、营养盐、叶绿素a、三维荧光和酶活性的测量。水样经GF/F玻璃纤维滤膜过滤后,与膜样一起于-20 ℃条件下冷冻保存。
浮游植物种群鉴定是取未过滤水样50 mL,加入1 mL鲁哥试剂固定[38],常温保存后带回实验室,通过显微镜镜检确定浮游植物种群名称以及丰度。
溶解无机态营养盐(NH4-N、NO3-N、NO2-N、PO4-P、SiO3-Si)、总溶解态营养盐(TDN、TDP)和颗粒态营养盐(PN、PP)浓度根据国家海洋调查规范(GB12763.4—2007)标准方法测定,其中,总溶解态和颗粒态营养盐采用过硫酸钾氧化法[39]消化为溶解无机态营养盐,最后,溶解无机态营养盐采用营养盐自动分析仪(QuAAtro, Seal, Germany)测定,DON(TDN-DIN)和DOP(TDP-DIP)的浓度通过差减法得到,测定精度为±4.3%。
叶绿素a的含量采用90%的丙酮在4 ℃下萃取24 h,在转速4 000 r/min下离心10 min后取上清液,用紫外分光光度法测定吸光度,按Jeffrey改进的方程式进行计算[40]。
三维荧光光谱采用France-F4500-Fluorolog-3荧光光度计测定[41],可以用来测定水体中溶解有机质的组分和相对含量。发射负载(Ex)为220~500 nm,激发负载(Em)为250~580 nm,激发与发射波长带宽5 nm。通过MATLAB(R2022b, MathWorksR)软件平台,应用平行因子分析(PARAFAC)方法,根据三维荧光光谱中特征峰的位置和相对强度,解析得到不同溶解有机质的组分名称和浓度变化[36]。本实验分别选取5个峰作为研究对象,其激发波长(EX)/发射波长(EM)分别为,类蛋白质吸收峰T1峰(230,275 nm/340~350 nm)、B峰(220,270 nm/306,410 nm),类腐殖质峰A峰(紫外区)(230 nm/420 nm),类腐殖质峰C峰(富里酸)(330 nm/420 nm),类腐殖质M峰(290~310 nm/370~420 nm)[42-44]。DON加富组中,三维荧光光谱各特征峰的荧光强度(Ii)与浓度成正比,荧光强度的变化可以反映各特征组分浓度变化。生物指数(BIX)是激发波长为310 nm时,发射波长在380和430 nm的荧光强度比值,可以作为评判内源物质对DON的贡献。腐殖化指数(HIX)是在激发波长为254 nm时,发射波长在435~480 nm间积分面积与300~345 nm间积分面积的比值,其数值大小可以用来评判DON的腐殖化程度,HIX指数越大腐殖化程度越高。
亮氨酸氨肽酶活性的测定,采用荧光分光光度计(Ex=380 nm,Em=440 nm),以L-亮氨酸-7-氨基-甲基香豆素盐酸盐(L-leucine-7-amido-4-methylcoumarin hydrochloride)为反应底物,底物浓度为100 μmol/L,在水浴温度为30 ℃的黑暗环境中水浴1 h,通过测定亮氨酸氨肽酶对底物的水解速率获得酶活性参数[45]。采用聚碳酸酯膜(0.22、3 μm)过滤的方式,将胞外酶划分为溶解态(<0.22 μm)及细胞结合态(>0.22 μm);在细胞结合态的胞外酶部分,又进一步划分为0.22~3 μm粒径部分(细菌态)和>3 μm粒径部分(浮游植物态)。
1.3 数据分析方法 1.3.1 实验数据质量评估应用IBM SPSS软件系统(Windows19.0,IBM Corp., Armonk, NY, USA) 分析实验结果的可信度和显著性。其中,可信度采用平行样实验结果的重现性,具体采用双样实验结果的相对标准偏差(RSD)评价,以RSD<0.15为标准,置信水平α为0.05。显著性检验采用单因素分析法(ANOVA),显著性水平设置为α=0.05。
1.3.2 动力学参数拟合DON的降解过程可以采用一级降解动力学方程进行拟合[46]:
| $ \operatorname{DON}(\mathrm{t})=\mathrm{ADON} \cdot \exp (-\mathrm{k} \cdot \mathrm{t})+\mathrm{BDON}。$ | (1) |
式中:ADON、BDON分别为降解过程中易降解组分和难降解组分;k为降解速率常数(d-1)。
浮游植物生长动力学过程一般符合Logistic方程[47],营养盐吸收动力学过程一般符合Monod方程[37],分别采用Logistic方程和Monod方程描述浮游植物生长过程和对DIN、DON吸收动力学过程。分别以PN和Chl a表征浮游植物颗粒态氮和浮游植物生物量,在Monod方程中增加了最小浓度阈值(方程(2), (3), (4)),Logistic方程中增加了营养盐限制因子(方程(5)):
| $ \frac{\mathrm{dDIN}}{\mathrm{dt}}=-\mathrm{k}_{\mathrm{upDIN}} \cdot \mathrm{PN} \cdot \frac{\mathrm{DIN}-\mathrm{DIN}_{\min }}{\mathrm{k}_{\mathrm{sDIN}}+\mathrm{DIN}-\mathrm{DIN}_{\min }},$ | (2) |
| $ \frac{\mathrm{dDON}}{\mathrm{dt}}=-\mathrm{k}_{\mathrm{uPDON}} \cdot \mathrm{PN} \cdot \frac{\mathrm{DON}-\mathrm{DON}_{\min }}{\mathrm{k}_{\mathrm{sDON}}+\mathrm{DON}-\mathrm{DON}_{\min }}, $ | (3) |
| $ \begin{aligned} & \;\;\frac{\mathrm{dPN}}{\mathrm{dt}}=\mathrm{PN} \cdot\left(\mathrm{k}_{\mathrm{upDIN}} \cdot \frac{\mathrm{DIN}-\mathrm{DIN}_{\min }}{\mathrm{k}_{\mathrm{sDIN}}+\mathrm{DIN}-\mathrm{DIN}_{\min }}+\right. \\ & \left.\mathrm{k}_{\mathrm{upDON}} \cdot \frac{\mathrm{DON}-\mathrm{DON}_{\min }}{ {\text{\k}_{\mathrm{sDDN}}}+\mathrm{DON}-\mathrm{DON}_{\min }}\right)-k_{\mathrm{de}} \cdot \mathrm{PN}, \end{aligned} $ | (4) |
| $ \begin{aligned} & \;\;\frac{\mathrm{dChl} a}{\mathrm{dt}}=\mathrm{Chl} a \cdot k_{\mathrm{G}} \cdot\left(\frac{\mathrm{DIN}-\mathrm{DIN}_{\text {min }}}{\mathrm{k}_{\mathrm{sDIN}}+\mathrm{DIN}-\mathrm{DIN}_{\text {min }}}+\right. \\ & \left.\frac{\mathrm{DON}-\mathrm{DON}_{\min }}{\mathrm{k}_{\mathrm{sDON}}+\mathrm{DON}-\mathrm{DON}_{\min }}\right)-k_{\mathrm{D}} \cdot\left(\mathrm{Chl} a+\mathrm{Chl} a^2\right) 。\\ & \end{aligned} $ | (5) |
式中:kupDIN,kupDON分别代表着DIN、DON的吸收速率常数(μmol·L-1·h-1);ksDIN和ksDON分别代表着DIN,DON的半饱和常数(μmol·L-1),DONmin,DINmin为DON,DIN的最小浓度阈值(μmol·L-1);kG为浮游植物生长速率(h-1),kD为浮游植物死亡速率(h-1),kde为碎屑的降解速率(h-1)。本文将营养盐吸收速率常数与半饱和常数的比值作为营养盐的亲和力指数,其数值越大表明浮游植物对相应营养盐吸收利用能力越强[48-49]。
动力学方程采用非线性拟合,非线性拟合程序应用MATLAB (R2022b, MathWorksR)软件开发,算法采用ode45函数,根据最小二乘法拟合动力学参数[50]。
2 实验结果 2.1 浮游植物群落结构变化海水本底及各加富组浮游植物的藻密度以及丰度占比结果如图 2所示。实验海水培养体系的初始接入(第0天)的浮游植物群落主要包括硅藻门和甲藻门,优势种(丰度占比> 1%)共5属7种,硅藻为菱形藻(Nitzchia,丰度占比:38.62%)、扁面角毛藻(Chaetoceros compressus,30.58%)、拟旋链角毛藻(C. pseudoaurivillii,21.01%)、冰河拟星杆藻(Astrionellopsis glacialis,8.15%),甲藻包括米氏凯伦藻(K. mikimotois,1.58%)和塔玛亚历山大藻(A. tamarense)。
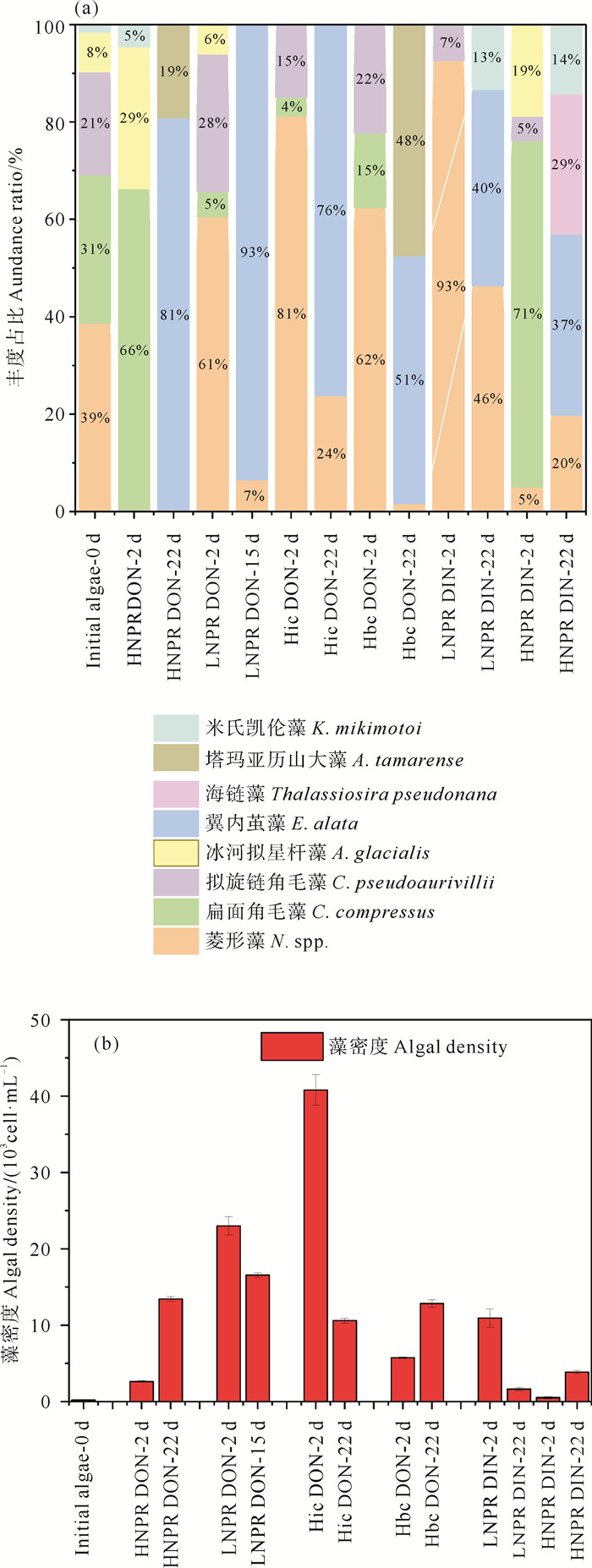
|
图 2 培养实验接入藻种第0天(0 d)和不同加富组前期叶绿素a峰值(2 d)、后期叶绿素a峰值(15或22 d) 浮游植物群落结构(a)和藻密度变化(b) Fig. 2 Changes in phytoplankton community structure (a) and algal density (b) on the 0 day (0 d), the early (2 d: peak value of chlorophyll a) and late (15 or 22 d) stage of different enrichment groups |
在同一加富组培养条件下双样重现性为83.9%,而在不同营养盐加富实验条件下,浮游植物优势种群均表现出差异性变化。具体来讲,在加富低氮磷比原水DON(Low N/P ratio DON,LNPR DON)条件下,培养前期(0~9 d)叶绿素a峰值时(第2天),浮游植物优势种群主要包括硅藻门的三个不同属包括菱形藻(Nitzchia spp.,60.6%)、拟旋链角毛藻(C. pseudoaurivillii,28.2%)、扁面角毛藻(C. compressus,5.2%)和冰河拟星杆藻(A. glacialis,6.1%),培养后期(10~26 d)叶绿素a峰值时(第15天)主要为硅藻门两个不同属包括翼内茧藻(Entomoneis alata,93.5%)和菱形藻(N. spp.,6.5%),发生了硅藻优势藻种演替;在加富高氮磷比原水DON(High N/P ratio DON,HNPR DON)条件下,浮游植物优势种群由前期叶绿素a峰值时(第2天)硅藻门的扁面角毛藻(C. compressus,66.4%)、冰河拟星杆藻(A. glacialis,29.1%)和甲藻门的米氏凯伦藻(K. mikimotoi,4.6%),演替为后期叶绿素a峰值时(第22天)硅藻门的翼内茧藻(E. alata,80.8%)和甲藻门的塔玛亚历山大藻(A. tamarense,19.2%)。在加富亲水DON(Hydrophilic DON,Hic DON)的条件下,浮游植物群落由前期叶绿素a峰值时(第2天)的菱形藻(Nitzchia spp.,81.2%),拟旋链角毛藻(C. pseudoaurivillii,14.9%),扁面角毛藻(C. compressus,3.88%)硅藻门两个不同属,演替为后期叶绿素a峰值时(第22天)翼内茧藻(E. alata,76.2%),菱形藻(N. spp.,23.7%)的硅藻门两个属,未检测出甲藻;在加富疏水DON(Hydrophobic DON, Hbc DON)的条件下,浮游植物优势种群由前期叶绿素a峰值时(第2天)的菱形藻(N. spp.,62.4%),扁面角毛藻(C.compressus,15.3%),冰河拟星杆藻(A.glacialis,22.3%)硅藻门三个属,演替为后期叶绿素a峰值时(第22天)的硅藻门的翼内茧藻(E. alata,50.8%)和甲藻门的塔玛亚历山大藻(A. tamarense,47.5%)。藻密度结果显示,Hic DON加富组前期叶绿素a峰值时(第2天)藻密度为4.08×104 cell/mL高于Hbc DON加富组(0.57×104 cell/mL)。LNPR DON,HNPR DON加富组藻密度均高于LNPR DIN,HNPR DIN加富组(P<0.05)。LNPR DON加富组后期叶绿素a峰值时(第15天)藻密度为0.16×104 cell/mL显著低于前期(第2天)藻密度1.09×104 cell/mL(P<0.05)。Hbc DON加富组后期叶绿素a峰值时(第22天)藻密度为1.28×104 cell/mL高于前期(第2天)藻密度0.57×104 cell/mL(P<0.05)。
2.2 叶绿素a和营养盐浓度变化叶绿素a和营养盐浓度变化如图 3所示,培养体系中的TN、TP基本守恒(RSD≤10%)。除Hbc DON加富组无机态硅氮比值为2.24外,其它加富组无机态硅氮比为0.81±0.13,在培养过程中不存在硅限制(见图 4)。以叶绿素a和PN表征的浮游植物生物量和颗粒态氮浓度结果显示,浮游植物表现为双峰变化形式,而溶解态营养盐(DIN、DON、TDP)浓度则表现为双谷变化形式,生物学特征显著。浮游植物第一个生长死亡周期(前期,0~9 d),除HNPR DIN加富组Chl a浓度在第3天进入指数生长期外,均在第1天进入指数生长期,到第2~3天达到平台期,然后迅速进入死亡期,基本符合S型变化规律(见图 3)。在浮游植物第二个生长死亡周期(后期,10~26 d),除LNPR DON加富组Chl a浓度在15 d到达峰值外,均在22 d到达第二个峰值。对比DON和DIN加富对照实验结果显示,LNPR DON和Hic DON加富组Chl a浓度峰值均高于LNPR DIN加富组(P<0.05),通过扣除DIN加富组对照实验结果,Hic DON加富组Chl a浓度显著高于Hbc DON加富组(P<0.05)。对比不同氮磷比实验条件结果显示,LNPR DIN加富组组Chl a浓度显著大于HNPR DIN加富组(P<0.05),LNPR DON加富组在培养实验后期Chl a浓度显著大于HNPR DON加富组(P<0.05)。浮游植物前后两个生长期不同形态营养盐浓度变化显示,PN、PP的变化均表现为与Chl a同向、与TDN、TDP反向变化规律,而在浮游植物死亡期,PN、PP的降低滞后于Chl a降低(见图 3)。
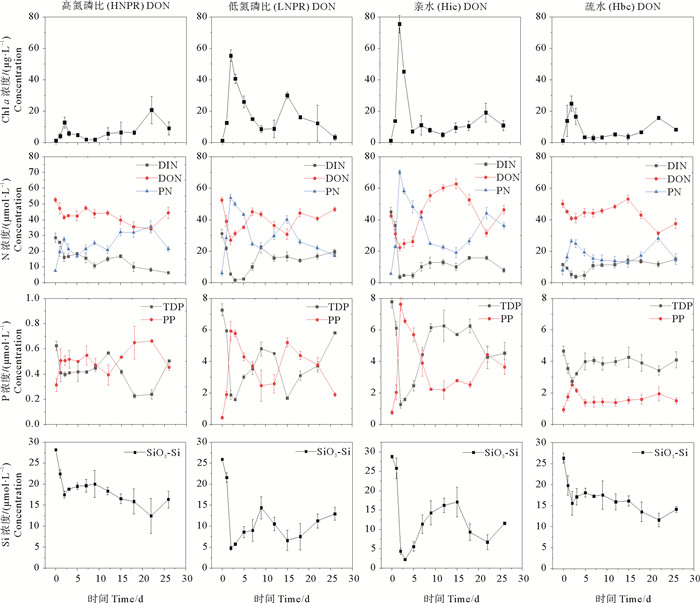
|
图 3 不同DON加富组叶绿素a(Chl a)和营养盐(N、P、Si)浓度变化 Fig. 3 Changes in chlorophyll a (Chl a) and nutrients (N, P, Si) concentrations in different DON enrichment groups |
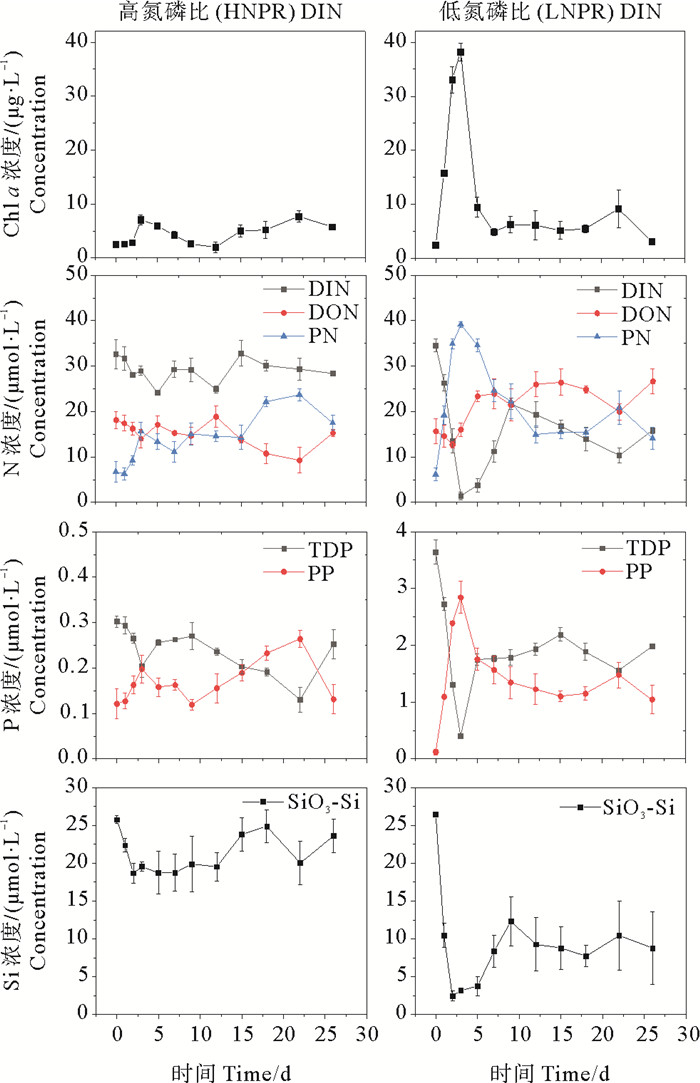
|
图 4 DIN对照组叶绿素a(Chl a)和营养盐(N、P、Si)浓度变化 Fig. 4 Changes in chlorophyll a (Chl a) and nutrient salt (N, P, Si) concentrations in the DIN control group |
对于无藻空白对照组,DON主要通过光照、微生物等降解转换成DIN。DON浓度变化趋势为先快速下降,后降低速度减慢,最后趋于稳定,符合一级降解动力学方程(见图 5(a))。DIN浓度变化则与之相反,呈现出先快速升高后趋于稳定的变化趋势(见图 5(b))。
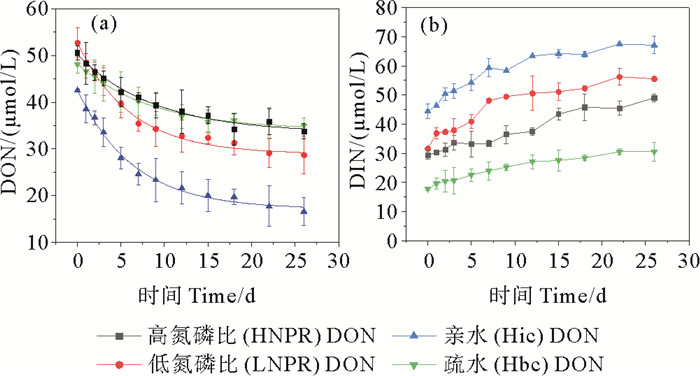
|
图 5 无藻对照组DON降解过程DON拟合结果(a)和DIN浓度变化(b) Fig. 5 The degradation of DON in the algae-free control group, (a) DON fitting results and (b) variation in DIN concentration |
无藻空白对照组DON降解过程动力学拟合结果显示(见表 3),在DON降解速率常数上,LNPR DON和Hic DON加富组分别为(0.17±0.06) μmol/L和(0.16±0.02) d-1,大于HNPR DON和Hbc DON加富组的(0.11±0.01) μmol/L和(0.12±0.021) d-1(P>0.05)。在易降解组分占比上,LNPR DON和Hic DON加富组分别为45%±2%和60%±2%,显著高于HNPR DON加富组的36%±3%和Hbc DON加富组的29%±1%(P<0.05)。
|
|
表 3 无藻对照组DON降解过程动力学参数 Table 3 Kinetic parameters of DON degradation in the algae-free control group |
对比分析有藻和无藻培养实验DON浓度变化结果显示(见图 6)。在实验2天内浮游植物直接吸收利用的DON(ABDON-BDON)占比,LNPR DON和Hic DON加富组分别为33.0%±2.5%和33.6%±1.9%,显著大于HNPR DON和Hbc DON加富组的13.3%±1.6%和13.2%±1.2%(P<0.05)。
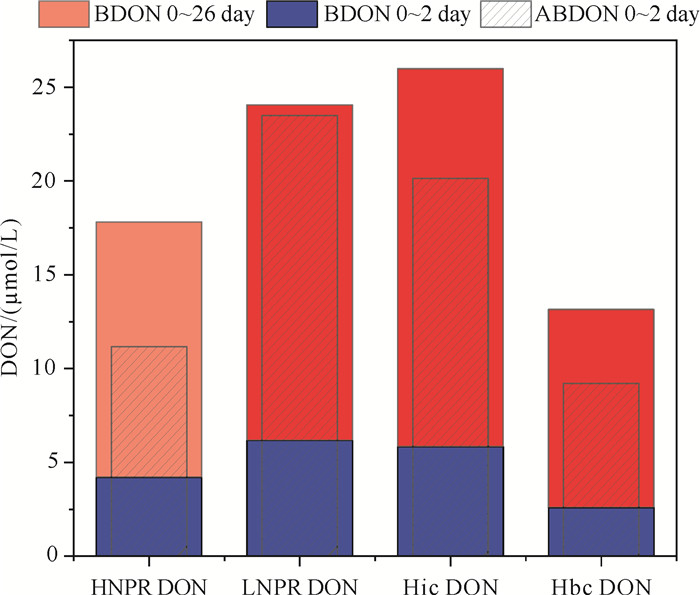
|
( BDON是无藻培养组中DON浓度变化值,ABDON是有藻培养组中DON的浓度变化值。BDON represents the change in DON concentration in the group without algae culture and ABDON represents the change in DON concentration in the group with algae culture. ) 图 6 不同DON加富组ABDON和BDON浓度变化 Fig. 6 Changes in ABDON and BDON concentrations in different DON enrichment groups |
针对不同加富组中浮游植物前期和后期最优浮游植物种群,根据优势度按比例获取PN、DIN、DON(ABDON-BDON)和Chl a数据,采用最小二乘法非线性拟合技术,应用Matlab软件,分别进行生态动力学过程拟合(见图 7)。其中,营养盐吸收动力学的拟合时间由浮游植物生长周期确定,根据PN的变化,前期浮游植物生长期约为2~3 d,后期浮游植物生长期大约为5~7 d。这样,可得到菱形藻(N. spp.)、扁面角毛藻(C. compressus)、塔玛亚历山大藻(A. tamarense)的生长和营养盐吸收动力学参数(见表 4)。其中,菱形藻(N. spp.)、扁面角毛藻(C. compressus)、塔玛亚历山大藻(A. tamarense)的生长速率常数分别为0.05、0.04和0.03 h -1。不同优势藻种对DIN和DON的亲和力指数存在差异,菱形藻(N. spp.)、扁面角毛藻(C. compressus)和塔玛亚历山大藻(A. tamarense)对DIN的亲和力指数分别为0.08±0.01、0.06和0.002,DON的亲和力指数分别为0.006±0.000 2、0.005和0.05。
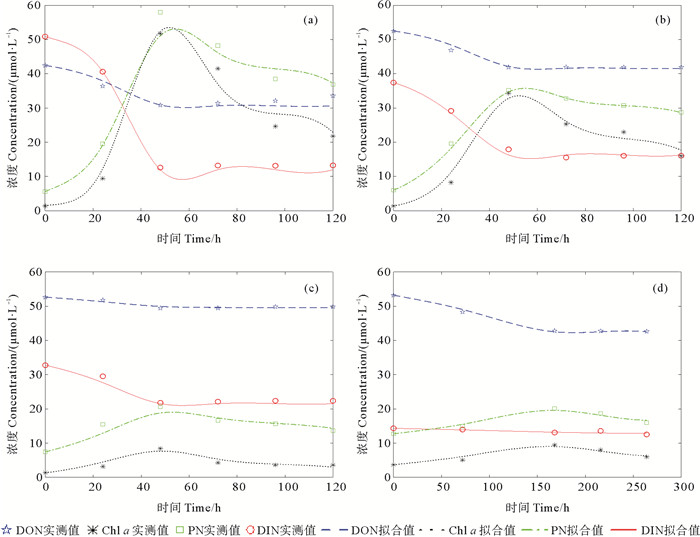
|
( a、b、c、d分别代表菱形藻(Hic DON加富组前期)、菱形藻(LNPR DON加富组前期)、扁面角毛藻(HNPR DON加富组前期)、塔玛亚历山大藻(Hbc DON加富组后期)。a, b, c, and d respectively represent N. spp. (Early stage of Hic DON enrichment group), N. spp. (Early stage of LNPR DON enrichment group), C. compressus (Early stage of HNPR DON enrichment group), and A. tamarense (Late stage of Hbc DON enrichment group). ) 图 7 不同加富组优势藻种营养盐吸收动力学拟合 Fig. 7 Nutrient absorption kinetics fitting of dominant algae species in different enrichment groups |
|
|
表 4 不同藻种营养盐吸收动力学参数 Table 4 Nutrient absorption kinetics parameters of different algae species |
应用平行因子分析法解析不同加富组三维荧光吸收峰相对荧光强度(见图 8)及参数变化(见表 5),对比不同加富组,Hbc DON加富组有较高占比的类腐殖质C组分(27.0%)和类腐殖质M(16.1%),Hic DON加富组有较高占比的类蛋白质T组分(42.5%)和类蛋白质B组(33.6%),分析LNPR DON和Hic DON加富组各峰值变化,在0~3 d,类蛋白质T1组分和类蛋白质B组分降低较多,在3~5 d随着硅藻的大量消亡,类蛋白质B组分迅速升高,在5~22 d培养实验后期,LNPR DON和Hic DON加富组类蛋白质B组分分别降低了41.9%,38.3%。Hbc DON加富组在培养实验后期,类腐殖质C组分和A组分分别在5~22 d下降了39.6%和16.4%。整个培养过程中腐殖化指数(HIX)除了Hbc DON加富组以外,呈现整体下降趋势,BIX指数呈现上升趋势,体系中类蛋白质组分占比逐渐升高,内源物质增加。在LNPR DON和Hic DON加富组中第5天类蛋白质B组分增加,BIX指数增加。
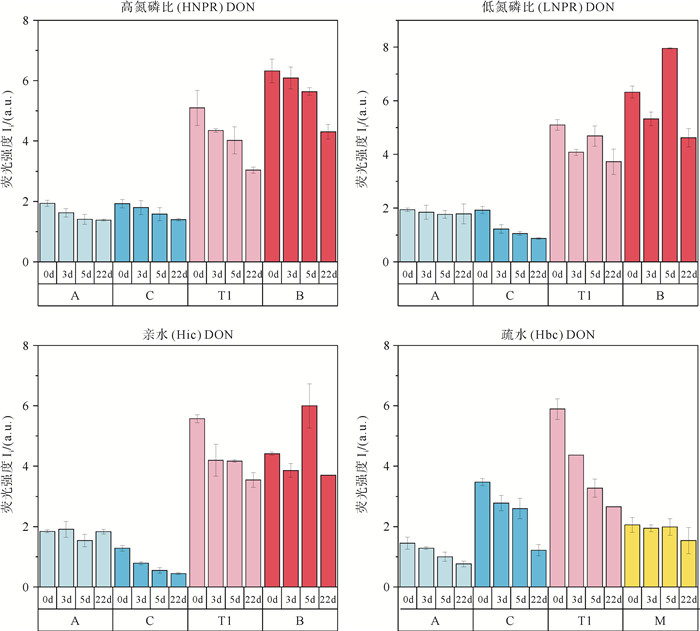
|
图 8 DON加富组的三维荧光特征峰(A、T1、C、B/M)荧光强度变化 Fig. 8 Changes in the fluorescence intensity of 3D fluorescence characteristic peaks (A, T1, C, B/M) in DON enrichment groups |
|
|
表 5 不同DON加富组BIX、HIX指数变化 Table 5 Changes of BIX and HIX index in different DON enrichment groups |
图 9为不同加富组培养过程中LAP酶活性的实验结果。培养过程中亮氨酸氨肽酶主要是以浮游植物态形式存在,显著大于细菌态和溶解态(P<0.05),细菌态酶活性除Hic DON加富组在第5天浓度升高,其它加富组在培养周期都处在较低水平,溶解态酶活性在整个培养过程中处于比较低的水平且没有明显浓度变化。培养实验前期(0~9 d),HNPR DON、LNPR DON、Hic DON、Hbc DON浮游植物态酶活性平均值分别为2.25、3.24、2.94和1.40 μmol·L-1·h-1;培养实验后期(10~26 d),HNPR DON、LNPR DON、Hic DON、Hbc DON浮游植物态酶活性平均值分别为2.10、2.04、0.97和1.52 μmol·L-1·h-1。对比不同加富组,HNPR DON加富组在第5天达到最大值,晚于其它加富组(第3天达到最大值)。浮游植物态酶活性结果表明,Hic DON加富组酶活性最大值为(8.37±0.56) μmol·L-1·h-1显著大于Hbc DON加富组的最大值(2.86±0.63) μmol·L-1·h-1(P<0.05),LNPR DON加富组酶活性最大值为(7.76±0.69) μmol·L-1·h-1显著大于HNPR DON加富组的最大值(3.73±0.36) μmol·L-1·h-1(P<0.05)。在浮游植物态亮氨酸氨肽酶达到最低值后,不同加富组均缓慢升高,Hbc DON加富组在第22天达到第二个峰值为(2.05±0.65) μmol·L-1·h-1,Hic DON在第26天达到第二个峰值为(1.43±0.48) μmol·L-1·h-1。
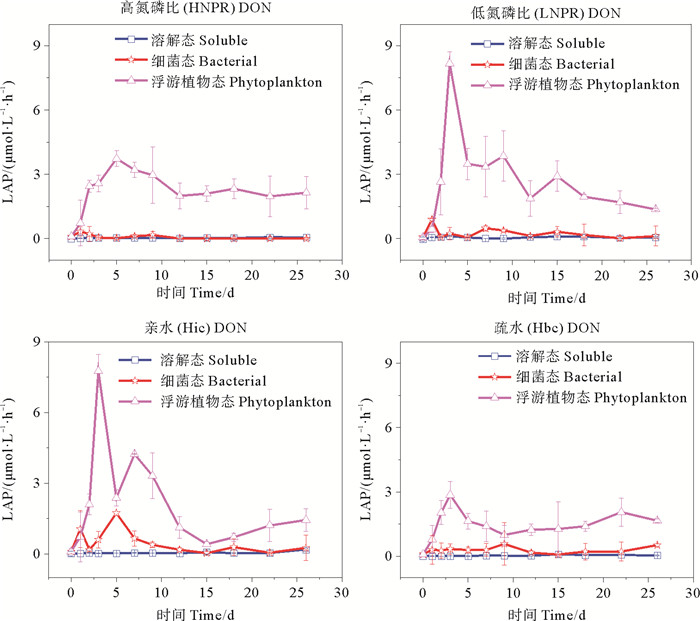
|
图 9 DON加富组中不同形态亮氨酸氨肽酶活性变化 Fig. 9 Changes of leucine aminopeptidase activity of different DON enrichment groups |
现场培养实验结果表明,浮游植物优势种群演替受DON不同组分影响。甲藻可以吸收利用Hbc DON,在培养实验后期演变为优势藻种;而Hic DON则主要被硅藻吸收利用,培养过程中始终以硅藻为优势藻。这与胶州湾现场培养实验中,Hic DON生物可利用性高,可以被中肋骨条藻(Skeletonema costatum)、菱形藻属(N. spp.)等硅藻吸收利用的结论一致[37],而Hbc DON对浮游植物生长影响的认识上,与Liu等人实验结果中疏水组分不能刺激藻类生长[29]不一致。有研究表明,DON可以作为氮源经微生物降解或浮游植物直接吸收来促进浮游植物生长,在浮游植物群落演替中发挥重要作用[51],本研究相关Hbc DON对硅藻和甲藻演替的影响尚属首次,结果表明,塔玛亚历山大藻(A. tamarense)较硅藻对DON具有更强的亲和力,这可能是其在培养后期无机态营养盐耗尽后,因更强的DON亲和力而演变为优势藻。
三维荧光光谱和酶活性分析表明,Hbc DON加富组含有较高占比的类腐殖质C峰(27.0%)和M峰(16.1%),其腐质化指数(HIX=1.17)也显著高于Hic DON加富组(HIX=0.86),这可能是DON类腐殖质组分促进甲藻生长而演变为优势藻的内在原因。研究表明,腐殖质可以刺激藻类细胞代谢促进甲藻的生长[52],塔玛亚历山大藻(A. tamarense)等甲藻具有更强的大分子蛋白质转运能力[53]和直接吞噬类腐殖质组分等大分子化合物的能力[54],使得其对于大分子蛋白质和类腐殖质具有较强的竞争能力,同时塔玛亚历山大藻(A. tamarense)等甲藻可以释放藻毒素来抑制其它藻种的生长[55],促使其成为优势藻种。而硅藻在LNPR DON和Hic DON加富组早期是优势藻的原因,与高生物指数(BIX=1.29)的Hic DON组分含有高占比的类蛋白质吸收峰T1峰(42.5%)和B峰(33.6%)以及Hic DON较快的降解速率有关,这也反映在硅藻高活性表达的亮氨酸氨肽酶上。Coble[56]等用类蛋白质组分代表易降解组分,用类腐殖质代表难降解组分。在菌降解DON过程中,降解速率存在差异一般与两个方面有关:一方面是异养细菌种类、数量[57],另一方面是DON的组成、结构[58],Hic DON组分高类蛋白质组分占比可能是其降解速率较快和生物可利用性较高的重要原因。研究表明,亲水性小分子类蛋白质化合物有较高的生物可利用性[59],污水处理厂[29],湖泊沉积物[60]中亲水性DON均可以被浮游植物吸收利用促进藻类生长。在硅甲藻演替过程中,菱形藻(N. spp.)对以谷氨酸为代表的DON亲和力较高,中肋骨条藻(S. costatum)等硅藻可以直接吸收利用类蛋白质T2组分,类蛋白质T1组分可以被快速降解促进中肋骨条藻(S. costatum)生长[36]。
浮游植物的硅藻和甲藻演替还受到氮磷比的影响,现场培养实验结果显示,HNPR DON加富组中DON降解速率较慢,在26 d培养实验中易降解DON占比较低,可能是因为磷限制导致了异养细菌的密度和生物活性降低[61]。有研究表明,细菌代谢依赖于磷的可用性,而不是总溶解有机碳(DOC)的可用性,极端的寡营养环境下细菌的呼吸需求升高,导致其生长缓慢[62-63]。高氮磷比条件下,磷作为限制性因子,可能会导致浮游细菌的生长受到抑制,但由于本实验并未进行浮游细菌的种群丰度相关检测,该结论有待进一步研究。HNPR DON加富培养实验条件下,塔玛亚历山大藻(A. tamarense)在培养后期也演变为优势藻。这与石岩峻的实验结果一致,在氮限制条件下,塔玛亚历山大藻(A. tamarense)生长受到明显抑制,在磷限制条件下,塔玛亚历山大藻(A. tamarense)生长受到影响较小[64]。硅甲藻种群之间的差异很大,硅藻对于还原态氮和氮磷比较低的情况下较为适宜生长,硅藻更多的是通过光合自养的方式生长,而与之相反,甲藻可以在高氮磷比环境中持续存在,倾向于混合营养[65]。在硅藻赤潮爆发后期水体中的磷被迅速消耗,氮磷比增加,甲藻门对于磷限制竞争力较强,可能是甲藻赤潮爆发的诱因[66],在高氮磷比下,链状亚历山大藻(Alexandrium catenella)通过诱导高亲和力磷酸盐吸收系统来适应磷胁迫[67]。本研究表明,氮磷比会对DON微生物降解速率产生较大影响,低氮磷比条件下DON微生物降解速率显著高于高氮磷比条件。原水高氮磷比DON加富组可能因高氮磷比引起的DON(DOP)降解速率慢,无机态营养盐缺乏造成硅藻生长慢,甲藻因更强的DON亲和力而演变为优势藻。
4 结论本文采用一次性营养盐加富现场培养实验,探究DON亲水和疏水组分对莱州湾浮游植物硅藻和甲藻演替的影响,主要结论如下:
(1) DON作为氮源能促进浮游植物的生长,硅藻和甲藻优势种演替与DON亲水和疏水组分密切关联,DON亲水组分易降解组分占比较高和类蛋白质组分含量较高,可被硅藻吸收利用而促进硅藻生长,DON疏水组分则主要是类腐殖质等难降解组分,能被甲藻吸收利用而促进甲藻生长。
(2) 菱形藻(N. spp.)、扁面角毛藻(C. compressus)等硅藻对DIN的亲和力高于塔玛亚历山大藻(A. tamarense)等甲藻,是培养实验在无机营养盐充足条件下前期成为优势藻的原因,塔玛亚历山大藻(A. tamarense)等甲藻DON的亲和力高于硅藻,是培养实验后期在无机态营养盐耗尽条件下成为优势藻的原因。
(3)硅藻和甲藻演替还受到氮磷比的影响,主要与不同氮磷比条件下DON降解速率差异有关,高氮磷比条件下DON降解速率慢,硅藻生长受抑制而甲藻丰度占比增加。
| [1] |
Holtgrieve G W, Schindler D E, Hobbs W O, et al. A coherent signature of anthropogenic nitrogen deposition to remote watersheds of the northern hemisphere[J]. Science, 2011, 334(6062): 1545-1548. DOI:10.1126/science.1212267 (  0) 0) |
| [2] |
Glibert P M, Mayorga E, Seitzinger S. Prorocentrum minimum tracks anthropogenic nitrogen and phosphorus inputs on a global basis: Application of spatially explicit nutrient export models[J]. Harmful Algae, 2008, 8(1): 33-38. DOI:10.1016/j.hal.2008.08.023 (  0) 0) |
| [3] |
Li H G, Li X R, Xu Z H, et al. Nutrient budgets for the Bohai Sea: Implication for ratio imbalance of nitrogen to phosphorus input under intense human activities[J]. Marine Pollution Bulletin, 2022, 179: 113665. DOI:10.1016/j.marpolbul.2022.113665 (  0) 0) |
| [4] |
张锦峰, 高学鲁, 李培苗, 等. 莱州湾西南部海域及其毗邻河流水体营养盐的分布特征及长期变化趋势[J]. 海洋通报, 2015, 34(2): 222-232. Zhang J F, Gao X L, Li P M, et al. Distribution characteristics and long-term change trend of nutrients in the waters of southwestern Laizhou Bay and adjacent river[J]. Marine Science Bulletin, 2015, 34(2): 222-232. (  0) 0) |
| [5] |
王峰. 基于海陆统筹的渤海入海污染物总量控制研究[D]. 青岛: 中国海洋大学, 2015. Wang F. Research on Total Amount Control of Pollutant Leaking into the Bohai Sea Based on Sea-Land Integrated Planning[D]. Qingdao: Ocean University of China, 2015. (  0) 0) |
| [6] |
Jin X, Shan X, Li X, et al. Long-term changes in the fishery ecosystem structure of Laizhou Bay, China[J]. Science China: Earth Sciences, 2013, 56(3): 366-374. DOI:10.1007/s11430-012-4528-7 (  0) 0) |
| [7] |
祝雅轩, 裴绍峰, 张海波, 等. 莱州湾营养盐和富营养化特征与研究进展[J]. 海洋地质前沿, 2019, 35(4): 1-9. Zhu Y X, Pei S F, Zhang H B, et al. Characteristics and research progress of nutrients and eutrophication in Laizhou Bay, China[J]. Marine Geology Frontiers, 2019, 35(4): 1-9. (  0) 0) |
| [8] |
张桂成. 长江口及其邻近海域溶解有机氮的生物可利用性及其在赤潮爆发过程中的作用研究[D]. 青岛: 中国海洋大学, 2015. Zhang G C. Bioavailability of Dissolved Organic Nitrogen and Its Role During the Outbreak of Harmful Algal Blooms in Changjiang River Estuary and Its Adjacent Sea[D]. Qingdao: Ocean University of China, 2015. (  0) 0) |
| [9] |
梁生康, 李姗姗, 马浩阳, 等. 基于陆海同步调查的莱州湾营养盐时空分布及限制因子分析[J]. 中国海洋大学学报(自然科学版), 2022, 52(8): 97-110. Liang S K, Li S S, Ma H Y, et al. Spatial-temporal distributions and limiting factors of nutrients in Laizhou Bay based on land-sea synchronous survey[J]. Periodical of Ocean University of China, 2022, 52(8): 97-110. (  0) 0) |
| [10] |
Crandall J B, Teece M A. Urea is a dynamic pool of bioavailable nitrogen in coral reefs[J]. Coral Reefs, 2012, 31(1): 207-214. DOI:10.1007/s00338-011-0836-1 (  0) 0) |
| [11] |
Flynn K, Stoecker D, Mitra A, et al. Misuse of the phytoplankton-zooplankton dichotomy: The need to assign organisms as mixotrophs within plankton functional types[J]. Theoretical & Experimental Chemistry, 2013, 3(1): 71-73. DOI:10.3969/j.issn.1007-192X(s).2013.01.014 (  0) 0) |
| [12] |
Burkholder J, Glibert P M, Skelton H M. Mixotrophy, a major mode of nutrition for harmful algal species in eutrophic waters[J]. Harmful Algae, 2009, 8(1): 77-93. (  0) 0) |
| [13] |
Gilbert P M. Eutrophication, harmful algae and biodiversity—Challenging paradigms in a world of complex nutrient changes[J]. Marine Pollution Bulletin, 2017, 124(2): 591-606. DOI:10.1016/j.marpolbul.2017.04.027 (  0) 0) |
| [14] |
Nebbioso A, Piccolo A. Molecular characterization of dissolved organic matter (DOM): A critical review[J]. Analytical and Bioanalytical Chemistry, 2013, 405(1): 109-124. DOI:10.1007/s00216-012-6363-2 (  0) 0) |
| [15] |
Li K Q, Ma Y P, Dai A Q, et al. Degradation dynamics and bioavailability of land-based dissolved organic nitrogen in the Bohai Sea: Linking experiment with modeling[J]. Marine Pollution Bulletin, 2017, 124(2): 856-870. DOI:10.1016/j.marpolbul.2017.02.033 (  0) 0) |
| [16] |
Kudela R M, Lane J Q, Cochlan W P. The potential role of anthropogenically derived nitrogen in the growth of harmful algae in California, USA[J]. Harmful Algae, 2008, 8(1): 103-110. DOI:10.1016/j.hal.2008.08.019 (  0) 0) |
| [17] |
Bradley P B, Sanderson M P, Frischer M E, et al. Inorganic and organic nitrogen uptake by phytoplankton and heterotrophic bacteria in the stratified Mid-Atlantic Bight[J]. Estuarine Coastal & Shelf Science, 2010, 88(4): 429-441. (  0) 0) |
| [18] |
Caruso G. Leucine aminopeptidase, β-glucosidase and alkaline phosphatase activity rates and their significance in nutrient cycles in some coastal Mediterranean sites[J]. Marine Drugs, 2010, 8(4): 916-940. DOI:10.3390/md8040916 (  0) 0) |
| [19] |
Petrone K C, Richards J S, Grierson P F. Bioavailability and composition of dissolved organic carbon and nitrogen in a near coastal catchment of south-western Australia[J]. Biogeochemistry, 2009, 92(1-2): 27-40. DOI:10.1007/s10533-008-9238-z (  0) 0) |
| [20] |
Bronk D A, See J H, Bradley P, et al. DON as a source of bioavailable nitrogen for phytoplankton[J]. Biogeosciences, 2007, 4(3): 283-296. DOI:10.5194/bg-4-283-2007 (  0) 0) |
| [21] |
Thurman E M. Organic Geochemistry of Natural Waters[M]. Berlin: Springer Science and Business Media, 2012.
(  0) 0) |
| [22] |
Feng W, Li C, Zhang C, et al. Characterization of phosphorus in algae from a eutrophic lake by solution 31 P nuclear magnetic resonance spectroscopy[J]. Limnology, 2019, 20: 163-171. DOI:10.1007/s10201-018-0562-2 (  0) 0) |
| [23] |
Liu H Z, Jeong J, Gray H, et al. Algal uptake of hydrophobic and hydrophilic dissolved organic nitrogen in effluent from biological nutrient removal municipal wastewater treatment systems[J]. Environmental Science & Technology, 2012, 46(2): 713-721. (  0) 0) |
| [24] |
Fan L, Brett M T, Jiang W, et al. Dissolved organic nitrogen recalcitrance and bioavailable nitrogen quantification for effluents from advanced nitrogen removal wastewater treatment facilities[J]. Environmental Pollution, 2017, 229: 255-263. DOI:10.1016/j.envpol.2017.05.093 (  0) 0) |
| [25] |
Li B, Brett M T. The influence of dissolved phosphorus molecular form on recalcitrance and bioavailability[J]. Environmental Pollution, 2013, 182: 37-44. DOI:10.1016/j.envpol.2013.06.024 (  0) 0) |
| [26] |
李志林, 石晓勇, 张传松. 春季黄渤海海水中尿素分布特征及溶解态氮的组成[J]. 环境科学, 2015, 36(11): 3999-4004. Li Z L, Shi X Y, Zhang C S. Distribution characteristics of urea and constitution of dissolved nitrogen in the Bohai Sea and the Huanghai Sea in spring[J]. Environmental Science, 2015, 36(11): 3999-4004. (  0) 0) |
| [27] |
Wen Z, Chen F. Optimization of nitrogen sources for heterotrophic production of eicosapentaenoic acid by the diatom Nitzschia laevis[J]. Enzyme and Microbial Technology, 2001, 29(6-7): 341-347. DOI:10.1016/S0141-0229(01)00385-4 (  0) 0) |
| [28] |
Berman T, Bronk D. Dissolved organic nitrogen: A dynamic participant in aquatic ecosystems[J]. Aquatic Microbial Ecology, 2003, 31(3): 279-305. (  0) 0) |
| [29] |
Liu H, Jeong J, Gray H, et al. Algal uptake of hydrophobic and hydrophilic dissolved organic nitrogen in effluent from biological nutrient removal municipal wastewater treatment systems[J]. Environmental Science & Technology, 2012, 46(2): 713-721. (  0) 0) |
| [30] |
Feng W, Liu S, Li C, et al. Algal uptake of hydrophilic and hydrophobic dissolved organic nitrogen in the eutrophic lakes[J]. Chemosphere, 2019, 214: 295-302. DOI:10.1016/j.chemosphere.2018.09.070 (  0) 0) |
| [31] |
吴雪, 李希磊, 杨俊丽, 等. 莱州湾扇贝养殖区浮游藻类的生态特征[J]. 水产科学, 2017, 36(3): 347-352. Wu X, Li X L, Yang J L, et al. Ecological characteristics of phytoplankton in scallop culture area in Laizhou Bay[J]. Fisheries Science, 2017, 36(3): 347-352. (  0) 0) |
| [32] |
李子琳, 张海彦, 赵亮, 等. 渤海浮游植物群落结构时空分布及其影响因素[J]. 海洋科学, 2021, 45(8): 10-20. Li Z L, Zhang H Y, Zhao L, et al. Spatial and temporal distribution and factors influencing the phytoplankton community structure in the Bohai Sea[J]. Marine Science, 2021, 45(8): 10-20. (  0) 0) |
| [33] |
鞠霞, 熊学军. 渤、黄、东海水温季节变化特征分析[J]. 海洋科学进展, 2013, 31(1): 55-68. Ju X, Xiong X J. Distributions and seasonal changes of water temperature in the Bohai Sea, Yellow Sea and East China Sea[J]. Advances in Marine Science, 2013, 31(1): 55-68. DOI:10.3969/j.issn.1671-6647.2013.01.007 (  0) 0) |
| [34] |
孙慧慧, 刘西汉, 孙西艳, 等. 莱州湾浮游植物群落结构与环境因子的时空变化特征研究[J]. 海洋环境科学, 2017, 36(5): 662-669. Sun H H, Liu X H, Sun X Y, et al. Temporal and spatial variations of phytoplankton community and environmental factors in Laizhou bay[J]. Marine Environmental Science, 2017, 36(5): 662-669. (  0) 0) |
| [35] |
Leenheer J A, Huffman Jr E W. Classification of organic solutes in water by using macroreticular resins[J]. Journal of Research of the US Geological Survey, 1976, 4(6): 737-751. (  0) 0) |
| [36] |
Yang R, Chen S, Zhang X, et al. Influences of the hydrophilic components of two anthropogenic dissolved organic nitrogen groups on phytoplankton growth in Jiaozhou Bay, China[J]. Marine Pollution Bulletin, 2021, 169: 112551. DOI:10.1016/j.marpolbul.2021.112551 (  0) 0) |
| [37] |
陈善乔. 陆源DON对胶州湾浮游植物生长影响的现场培养实验研究[D]. 青岛: 中国海洋大学, 2019. Chen S Q. Field Culture Experimental Study on the Effects of Land-Based DON on Phytoplankton Growth of Jiaozhou Bay[D]. Qingdao: Ocean University of China, 2019. (  0) 0) |
| [38] |
Hans U. Zur Vervollkommnung der quantitativen Phytoplankton-Methodik: Mit 1 Tabelle und 15 abbildungen im Text und auf 1 Tafel[J]. Sil Communications, 1958, 9(1): 1-38. (  0) 0) |
| [39] |
Valderrama J C. The simultaneous analysis of total nitrogen and total phosphorus in natural waters[J]. Marine Chemistry, 1981, 10(2): 109-122. DOI:10.1016/0304-4203(81)90027-X (  0) 0) |
| [40] |
Jeffrey S W, Humphrey G F. New Spectrophotometric equations for determining chlorophylls a, b, c1, and c2 in higher plants, algae and natural phytoplankton[J]. Plant Physiology and Biochemistry, 1975, 8: 53-59. (  0) 0) |
| [41] |
Spencer R, Ahad J, Baker A, et al. The estuarine mixing behaviour of peatland derived dissolved organic carbon and its relationship to chromophoric dissolved organic matter in two North Sea estuaries (UK)[J]. Estuarine Coastal and Shelf Science, 2007, 74(1-2): 131-144. DOI:10.1016/j.ecss.2007.03.032 (  0) 0) |
| [42] |
Kim Y B, Ahn J H. Changes of absorption spectra, SUVA(254), and color in treating landfill leachate using microwave-assisted persulfate oxidation[J]. Korean Journal of Chemical Engineering, 2017, 34(7): 1980-1984. DOI:10.1007/s11814-017-0104-3 (  0) 0) |
| [43] |
Song F H, Wu F C, Xing B S, et al. Protonation-dependent heterogeneity in fluorescent binding sites in sub-fractions of fulvic acid using principle component analysis and two-dimensional correlation spectroscopy[J]. Science of the Total Environment, 2018, 616: 1279-1287. (  0) 0) |
| [44] |
Coble P G, Del Castillo C E, Avril B. Distribution and optical properties of CDOM in the Arabian Sea during the 1995 Southwest Monsoon[J]. Deep-Sea Research Part Ⅱ: Topical Studies in Oceanography, 1998, 45(10-11): 2195-2223. DOI:10.1016/S0967-0645(98)00068-X (  0) 0) |
| [45] |
Hoppe H G. Significance of exoenzymatic activities in the ecology of brackish water: Measurements by means of methylumbelliferyl-substrates[J]. Marine Ecology Progress Series, 1983, 11(3): 299-308. (  0) 0) |
| [46] |
Lonborg C, Sondergaard M. Microbial availability and degradation of dissolved organic carbon and nitrogen in two coastal areas[J]. Estuarine Coastal and Shelf Science, 2009, 81(4): 513-520. (  0) 0) |
| [47] |
Killberg-Thoreson L, Sipler R E, Bronk D A. Anthropogenic nutrient sources supplied to a chesapeake bay tributary support algal growth: A bioassay and high-resolution mass spectrometry approach[J]. Estuaries & Coasts, 2013, 36(5): 966-980. (  0) 0) |
| [48] |
Smayda T J. Harmful algal blooms: their ecophysiology and general relevance to phytoplankton blooms in the sea[J]. Limnology and Oceanography, 1997, 42(2): 1137-1153. (  0) 0) |
| [49] |
Healey F P. Slope of the Monod equation as an indicator of advantage in nutrient competition[J]. Microbial Ecology, 1980, 5(4): 281-286. (  0) 0) |
| [50] |
郜培怡, 李克强, 陈衎, 等. 氮形态组成对海洋浮游植物群落结构的影响与动力学研究[J]. 中国海洋大学学报(自然科学版), 2021, 51(5): 57-71. Gao P Y, Li K Q, Chen K, et al. The study of effects of nitrogen forms on marine phytoplankton community structure and related dynamics[J]. Periodical of Ocean University of China, 2021, 51(5): 57-71. (  0) 0) |
| [51] |
Varela M M, Bode A, Fernandez E, et al. Nitrogen uptake and dissolved organic nitrogen release in planktonic communities characterised by phytoplankton size-structure in the Central Atlantic Ocean[J]. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 2005, 52(9): 1637-1661. (  0) 0) |
| [52] |
Prakash A A, Rashid M A. Influence of humic substances on the growth of marine phytoplankton: Dinoflagellates 1[J]. Limnology and Oceanography, 1968, 13(4): 598-606. (  0) 0) |
| [53] |
夏威. 东海原甲藻和米氏凯伦藻对氮、磷限制的分子响应机制研究[D]. 广州: 暨南大学, 2016. Xia W. Study on Molecular Response Mechanism of Prorocentrum donghaiense Lu and Karenia mikimotoi Hansen Grown into Nitrogen Limitation or Phosphorus Limitation[D]. Guangzhou: Jinan University, 2016. (  0) 0) |
| [54] |
张清春. 东海大规模甲藻赤潮种吞噬特性及其在赤潮形成中的作用初探[D]. 青岛: 中国科学院研究生院(海洋研究所), 2011. Zhang Q C. Phagotrophic Characteristics of Causative Species in Large-scale HABs in East China Sea and Its Role in HABs Formation[D]. Qingdao: The Institute of Oceanology, Chinese Academy of Sciences, 2016. (  0) 0) |
| [55] |
刘洁生, 谢瑾, 杨维东, 等. 营养盐限制条件下塔玛亚历山大藻对东海原甲藻的化感作用研究[J]. 热带亚热带植物学报, 2006(3): 207-212. Liu J S, Xie J, Yang W D, et al. Allelopathic Effect of Alexandrium tamarense on Prorocentrum donghaiense under Limited Nutrient Conditions[J]. Journal of Tropical and Subtropical Botany, 2006(3): 207-212. (  0) 0) |
| [56] |
Coble P G, Schultz C A, Mopper K. Fluorescence contouring analysis of DOC intercalibration experiment samples: A comparison of techniques[J]. Marine Chemistry, 1993, 41(1-3): 173-178. (  0) 0) |
| [57] |
Payandi-Rolland D E D, Shirokova L S, Nakhle P, et al. Aerobic release and biodegradation of dissolved organic matter from frozen peat: Effects of temperature and heterotrophic bacteria[J]. Chemical Geology, 2020, 536: 119448. (  0) 0) |
| [58] |
Benner R, Opsahl S. Molecular indicators of the sources and transformations of dissolved organic matter in the Mississippi river plume[J]. Organic Geochemistry, 2001, 32(4): 597-611. (  0) 0) |
| [59] |
Petrone K C, Richards J S, Grierson P F. Bioavailability and composition of dissolved organic carbon and nitrogen in a near coastal catchment of south-western Australia[J]. Biogeochemistry, 2009, 92: 27-40. (  0) 0) |
| [60] |
Feng W Y, Liu S S, Li C C, et al. Algal uptake of hydrophilic and hydrophobic dissolved organic nitrogen in the eutrophic lakes[J]. Chemosphere, 2019, 214: 295-302. (  0) 0) |
| [61] |
白洁, 张昊飞, 李岿然, 等. 胶州湾冬季异养细菌与营养盐分布特征及关系研究[J]. 海洋科学, 2004, 28(12): 31-34. Bai J, Zhang H F, Li K R, et al. Distribution and relationship between bacterioplankton and inorganic nutrients in Jiaozhou Bay in winter[J]. Marine Sciences, 2004, 28(12): 31-34. (  0) 0) |
| [62] |
Smith E M, Prairie Y T. Bacterial metabolism and growth efficiency in lakes: the importance of phosphorus availability[J]. Limnology and Oceanography, 2004, 49(1): 137-147. (  0) 0) |
| [63] |
Mills M M, Moore C M, Langlois R, et al. Nitrogen and phosphorus co-limitation of bacterial productivity and growth in the oligotrophic subtropical North Atlantic[J]. Limnology and Oceanography, 2008, 53(2): 824-834. (  0) 0) |
| [64] |
石岩峻. 赤潮藻对营养盐的吸收及生长和相关特性研究[D]. 北京: 北京化工大学, 2004. Shi J Y. The Nutrient Availability, Growth and Related Characteristics of Red Tide Algae[D]. Beijing: Beijing University of Chemical Technology, 2004. (  0) 0) |
| [65] |
Glibert P M, Burkholder J, Kana T M. Recent insights about relationships between nutrient availability, forms, and stoichiometry, and the distribution, ecophysiology, and food web effects of pelagic and benthic Prorocentrum species[J]. Harmful Algae, 2012, 14: 231-259. (  0) 0) |
| [66] |
于仁成, 吕颂辉, 齐雨藻, 等. 中国近海有害藻华研究现状与展望[J]. 海洋与湖沼, 2020, 51(4): 768-788. Yu R C, Lv S H, Qi Y Z, et al. Progress and prospectives of harmful algal blooms studies in China[J]. Oceanologia et Limnologia Sinica, 2020, 51(4): 768-788. (  0) 0) |
| [67] |
章伟婕. 链状亚历山大藻对营养盐限制和补充的蛋白质组响应[D]. 厦门: 厦门大学, 2014. Zhang W J. Proteomic Response of a Dinoflagellate Alexandrium catenella to Nutrient Limitation and Addition[D]. Xiamen: Xiamen University, 2014. (  0) 0) |
 2024, Vol. 54
2024, Vol. 54


