2. 中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003
鱼类与其他脊索动物相比有着更为丰富的色素细胞,是研究体色和色素代谢机制的优良模型[1]。它们的体色可受饵料、环境和遗传等因素影响,但其本质上是通过基因调控不同类别色素细胞的发生,最终实现对鱼类体色变化的调节作用[2-4]。对大西洋鲑鱼(Salmo salar)的研究发现类胡萝卜素经吸收后在肠细胞或者肝脏细胞中代谢,未被代谢的类胡萝卜素同脂蛋白相结合,通过血液运输最终在肌肉沉积[5]。Maoka等的研究表明东星斑(Plectropomas leopardus)体色与体内类胡萝卜素含量直接相关,暗黑色个体中的类胡萝卜素含量比体色鲜亮个体低10~20倍[6]。另外,关献涛等[7]通过研究发现,在饲料中增加类胡萝卜素添加剂和虾青素,可以使东星斑的体色变红。类胡萝卜素是由植物、藻类、细菌和真菌产生的萜类脂溶性色素[8],硬骨鱼类不具有合成类胡萝卜素功能,它们只能从食物中获取这种必须的营养物质[9]。
动物体内β类胡萝卜素裂解加氧酶家族(Beta-carotene oxygenase family, BCO)是调节类胡萝卜素代谢的主要基因,属于类胡萝卜素裂解加氧酶(Carotenoid cleavage oxygenases,CCOs)超家族成员[8, 10-12],广泛存在于动物、植物和微生物中。在哺乳动物中,已鉴定出三种类胡萝卜素裂解加氧酶同源基因,分别是15’, 15’-β-胡萝卜素加氧酶基因(Bco1)、9’, 10’-β-胡萝卜素加氧酶基因(Bco2)和视网膜色素上皮细胞特异性蛋白65基因(Rpe65)。其中Bco1和Bco2通过裂解碳-碳双键并在裂解部位的底物中结合2个氧原子来对类胡萝卜素进行裂解,进而参与调控类胡萝卜素的代谢[12]。而Rpe65是一种异构水解酶,可以将反式视黄酯水解为11-顺式视黄醇进而参与维生素A循环,其仅在视网膜色素上皮细胞(RPE)特异表达[8, 13]。BCO基因家族在硬骨鱼中存在基因扩张现象,目前已鉴定出2个Bco1同源基因和4个Bco2同源基因,分别为Bco1、Bco1l、Bco2、Bco2l、Bco2a和Bco2b[14]。有研究发现大西洋鲑鱼Bco2l是在硬骨鱼谱系分支出现前复制产生的,并且推测Bco2a和Bco2b由硬骨鱼第三次全基因组复制加倍产生[15]。另外,在青鳉鱼(Oryzias latipes)、大西洋鳕鱼(Gadus morhua)和大西洋鲱鱼(Clupea harengus)中均已鉴定出Bco1、Bco1l、Bco2l、Bco2a和Bco2b[16],而在斑马鱼中已鉴定出包括Bco2在内的全部6个BCO基因[17]。
以往研究发现大西洋鲑鱼Bco1l[5]和Bco2l[18]基因与肉色显著相关,并且Bco2l中最显著的单核苷酸多态性位点(SNP)直接影响其66%的肉色变化[18]。另外,Li等[19]在扇贝肌肉中发现Bco1l是类胡萝卜素代谢必要基因,且大肠杆菌实验结果表明Bco1l具有比Bco2更广泛的底物。在脊尾白虾中,敲降EcBco基因后肝胰脏颜色发生了明显变化,且类胡萝卜素含量显著高于未敲降的对照组[20]。在东星斑(Plectropomas leopardus)中,通过对体色差异个体进行转录组分析得出Bco2表达水平可以影响东星斑的体色[21]。另外,在哺乳动物中,Vёge和Boman等发现Bco2基因无义突变导致绵羊出现了黄色脂肪表型[22],在牛和家兔上的研究也得出相似的结果[23]。Raghuvanshi等发现Bco1和Bco2基因定位于肝细胞和肠道黏膜上皮细胞,且Bco1在肝星状细胞和静脉内皮细胞高表达[24]。近年来Bco2被认为具有防止线粒体中类胡萝卜素过度积累的功能,参与维持类胡萝卜素稳态[25-27]。因此,BCO基因家族是类胡萝卜素代谢通路中最为重要且存在最为广泛的一类基因家族。
东星斑又名豹纹鳃棘鲈,属于鲈形目鳃棘鲈属[28],主要分布在印度洋—太平洋的热带或者亚热带水域的珊瑚礁边缘[29]。野生条件下东星斑体色艳丽,但是在养殖条件下,东星斑呈现出鲜红色、褐色、棕色甚至黑色等体色表型[29]。而消费者对体色鲜红的东星斑尤其喜欢,导致红色的东星斑售价是黑色的至少两倍,因此针对其体色经济性状方面的育种研究具有重要的经济价值[30]。东星斑的红、黑体色差异研究目前仅定位到与类胡萝卜素代谢相关的基因,如BCO基因家族,但尚未开展其在类胡萝卜素代谢方面的研究,尤其是它们在红、黑个体中的表达差异和作用的研究。因此,有必要探究东星斑BCO基因家族对类胡萝卜素代谢的调控作用,解析BCO基因家族影响东星斑红黑个体体色差异的遗传机制,以辅助东星斑良种培育工作。
1 材料与方法 1.1 东星斑BCO基因家族成员鉴定和其蛋白理化特征预测在NCBI数据库(https://www.ncbi.nlm.nih.gov/)下载东星斑的基因组序列(GenBank登录号:NC_056468.1)、蛋白质序列和cDNA序列到本地服务器后,基于本地Blast工具软件和之前已经建好的混合靶序列文件库进行基因注释工作,构建本地数据库。从UniProt数据库(https://www.uniprot.org/)下载龙胆石斑(Epinephelus lanceolatus)、青鳉(O. latipes)、红旗东方鲀(Takifugu rubripes)和人(Homo specise)的6个BCO家族的氨基酸序列作为种子序列,用子工具Tblastn处理东星斑的编码(CDS)序列,筛选e值为-5。选取评分最高的候选基因在Blast在线平台(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行验证比对,最终确定东星斑中BCO家族基因种类和个数, 筛选出的4个东星斑BCO基因ID分别是Bco1: XM_042510018.1; Bco1l: XM_042513345.1; Bco2l: XM_042488251.1; Bco2b: XM_042486586.1。并以对应的已标记基因ID号在CDS翻译成的氨基酸序列(PEP)文件中找到东星斑BCO的氨基酸序列,在基因注释(GFF)文件中找到注释好的序列特征信息。了解蛋白质的亚细胞定位有助于分析蛋白质的功能和相互作用。利用PSORT网站(http://psort.hgc.jp/)进行东星斑BCO家族蛋白质等电点和亚细胞结构预测,并绘制统计表格。
1.2 东星斑BCO家族基因结构分析利用GSDS 2.0网站(http://gsds.gao-lab.org/),根据其要求准备好BED格式文件绘制基因结构[31]。
1.3 东星斑BCO蛋白保守序列和结构域的预测分析利用MEME网站(https://meme-suite.org/meme/tools/meme)对东星斑BCO家族蛋白的保守序列进行分析[32],并用SMART网站(http://smart.embl.de/smart/set_mode.cgi?NORMAL=1)进行蛋白质结构域的预测,通过对结构域和模体的预测分析,来判断BCO家族蛋白质的结构和功能的保守性[32]。
1.4 BCO家族系统发育分析从Ensembl数据库(https://asia.ensembl.org/index.html)和NCBI数据库中获取已发表的19个物种的48条BCO氨基酸序列。19个物种中:硬骨鱼类有三棘刺鱼(Gasterosteus aculeatus)、许氏平鲉(Sebastes schlegelii)、美国黄金鲈(Perca flavescens)、半滑舌鳎(Cynoglossus semilaevis)、电鳗(Electrophorus electricus)、牙鲆(Paralichthys olivaceus)、尼罗罗非鱼(Oreochromis niloticus)、大黄鱼(Larimichthys crocea)、红鳍东方鲀(T. rubripes)、绿河鲀(Tetraodon nigroviridis)、南美花鳉(Poecilia formosa)、青鳉(O. latipes)、斑点雀鳝(Lepisosteus oculatus)和龙胆石斑(E. Lanceolatus);四足类有人(H. sapiens)、小鼠(Mus musculus)、非洲爪蟾(Xenopus laevis)、鸡(Gallus gallus)和中华鳖(Pelodiscus sinensis)。将这48条氨基酸序列与东星斑的4条BCO基因氨基酸序列进行多序列比对,并用MEGA7选取邻近法(Neighbor-Joining)构建系统进化树(Test of Phylogeny=Bootstrap,method= 2 000, Model=p-distance, Gaps=Pairwise deletion),并使用同样方法分别构建Bco1和Bco2进化树。
1.5 BCO家族在染色体上前后基因共线性分析利用Genomicus数据库(https://www.genomicus.bio.ens.psl.eu/genomicus-82.01/cgi-bin/search.pl)和NCBI数据库分别对东星斑存在的4个BCO基因家族的基因进行共线性分析。对于Bco1基因,用人、鼠、鸡、非洲爪蟾、红鳍东方鲀、尼罗罗非鱼和青鳉进行基因共线性分析,对于Bco2基因用人、鼠、鸡和红鳍东方鲀、尼罗罗非鱼、斑点雀鳝、三棘刺鱼、半滑舌鳎、绿河鲀、南美花鳉和龙胆石斑(Ela)进行基因共线性分析。分别找到对应的BCO基因家族上、下游基因的线性排布并用Visio绘制可视化图进行分析。东星斑则通过本地服务器定位的BCO基因找到其上、下游基因并通过在线Blast验证结果准确性,最后用Visio绘制染色体基因线性分布图进行分析。
1.6 东星斑BCO蛋白结构预测及分析借助PSIPRED网站(http://bioinf.cs.ucl.ac.uk/psipred/)进行BCO家族蛋白的二级结构预测,并结合基因结构信息将其结构特点绘制成表[34]。应用SWISS-Model在线平台(https://swissmodel.expasy.org/) 构建三维模型中找到序列一致度大于30%的已知序列作为模板构建模型,并选取预测的全球模型质量评估(GMQE)最高的模型,并通过SWISS-Model自带的评价系统对构建的模型进行评估。用POCASA在线平台(http://g6altair.sci.hokudai.ac.jp/g6/service/pocasa/)检测已经预测的三维结构空腔并选择该平台自带的Roll算法来预测配体结合位点[33]。用RESB PDB网站(https://www.rcsb.org/3d-view)对下载文件进行可视化分析和相似对比分析。
1.7 东星斑BCO基因家族表达定量分析随机选取120日龄的红、黑体色的东星斑各3尾,分别取与其体色相关的脑、肠、肝脏和皮肤4个组织,使用Trizol试剂(供应商:Invitrogen, CA, USA)提取各组织样品总RNA,使用RNase-free DNaseI(供应商:TaKaRa, Dalian, China)处理样品以除去基因组DNA。采用微量分光光度计(供应商:Implen, Munich, Germany)和1.5%琼脂糖凝胶电泳检测RNA的浓度和完整性。使用反转录M-MLV试剂盒(供应商:TaKaRa, Dalian, China)合成cDNA第一链,反转录在PCR仪中进行,具体程序如下:30 ℃,10 min;72 ℃,15 min;冰上冷却,合成的cDNA置于-20 ℃保存备用。
根据鉴定出的东星斑BCO基因序列利用IDT网站(https://sg.idtdna.com/)设计荧光定量PCR引物(见表 1),并选择Rpl13为内参基因[35]。建立实时荧光定量PCR反应体系:2 μL的cDNA溶液(浓度10 ng/μL);10 μL SYBY Green I Real-time PCR Master Mix;上向和反向引物(2 μmol /L)各4 μL,共构建20 μL的体系。黑红体色差异样品分别设3个生物学重复,且每个样品设置3个技术重复。使用Light Cycler480实时荧光定量PCR仪(Roche)进行扩增。设置反应条件:94 ℃,10 min;94 ℃,15 s;60 ℃,1 min,40个循环;94 ℃,15 s,1个循环。通过分析产物的溶解曲线检验引物的特异性,采用2-ΔΔCt方法计算目的基因的相对表达量,将数据结果用SPSS20.0软件进行单因素方差分析。
|
|
表 1 荧光定量PCR引物列表 Table 1 Primers used for qRT-PCR |
东星斑全基因组范围内的筛查共鉴定出4种BCO基因,根据系统的聚类分析和NCBI上对硬骨鱼BCO基因家族的命名方法,分别命名为Bco1、Bco1l、Bco2l、Bco2b,并且这4种基因分别分布在不同的染色体上。由表 2可见,东星斑BCO基因家族CDS长度为1 563~1 566 bp,相应蛋白的氨基酸序列长度在520~521之间,相对分子量在58.89~59.81 kD之间,相对分子质量和长度差异很小,统一性高。该家族基因在染色体上的分布显示,Bco1在21号染色体,Bco1l在24号染色体,Bco2l在11号染色体,Bco2b在5号染色体上。该家族蛋白等电点集中在6.01~6.79之间,较为稳定,为偏中性蛋白质,其亚细胞定位预测结果显示除Bco2l可能是线粒体蛋白,其余都是细胞质蛋白,在细胞质内行使其功能。其中,Bco2l的亚细胞定位预测与哺乳动物中Bco2表达位置一致。
|
|
表 2 东星斑4个BCO基因家族成员及相应蛋白理化信息 Table 2 Information of 4 BCO gene family members in Plectropomus leopardus |
为了研究东星斑BCO基因的结构多样性,比较了它们的外显子和内含子结构(见图 1),4种东星斑BCO基因外显子数目为10~23个,内含子数目是11~24个。

|
图 1 东星斑BCO基因结构示意图 Fig. 1 Gene structure of BCO in Plectropomus leopardus |
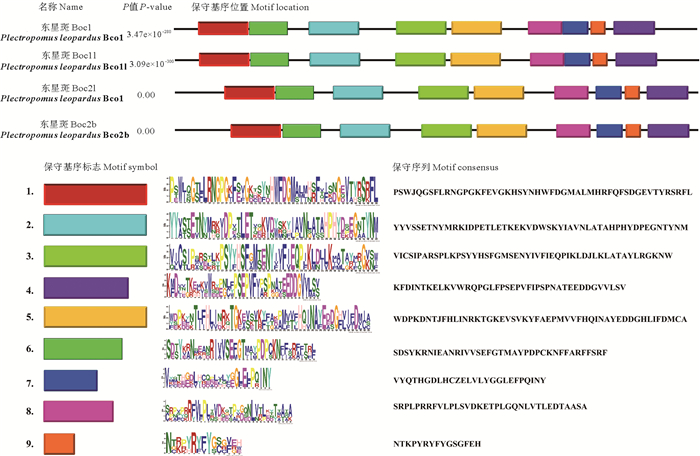
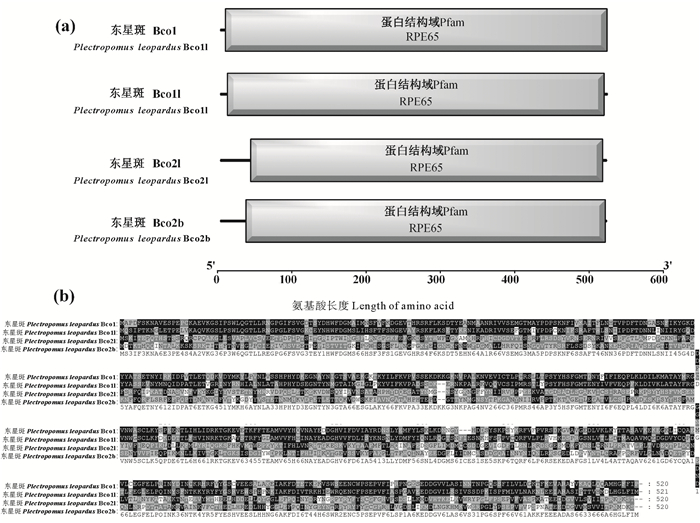
东星斑BCO蛋白保守基序预测结果如图 2所示,Bco1、Bco1l、Bco2l和Bco2b都具有9个相同的motif,其排列方式也都是一致。这一结果表明东星斑BCO的蛋白结构在进化过程中未发生明显的分化,功能仍具有一定的保守性。应用SMART在线软件对BCO蛋白结构域的预测结果显示东星斑4种BCO蛋白的结构域具有高度相似性,即都仅有一个RPE65结构功能域,也进一步验证东星斑BCO蛋白仍然保持相似的主要功能特征(见图 3)。
|
图 2 东星斑BCO蛋白保守基序分析 Fig. 2 Protein motifs of BCO transcription factors of Plectropomus leopardus |
|
((a) SMART网站对东星斑4种BCO蛋白结构域预测图; (b)东星斑BCO蛋白结构域聚类图。(a) Functional domain of BCO family in Plectropomus leopardus by SMART website; (b) Alignment of domains of Plectropomus leopardus BCO family proteins.) 图 3 东星斑BCO家族蛋白结构域预测图和蛋白结构域聚类图 Fig. 3 Functional domain and Alignment of domains of BCO family proteins in Plectropomus leopardus |
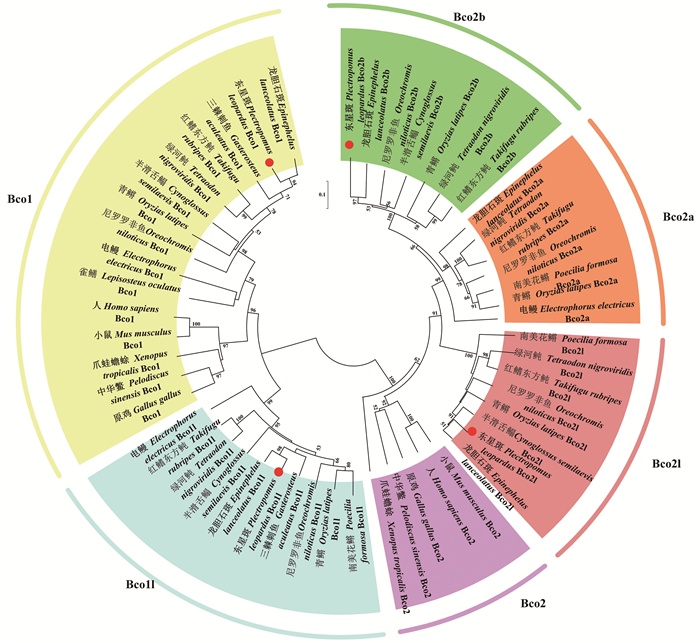
四足类和硬骨鱼类BCO基因家族的系统进化树的拓扑结构显示,整个BCO基因家族聚成Bco1和Bco2两大类,细分为6支,分别为Bco1、Bco1l、Bco2、Bco2l、Bco2a和Bco2b。在东星斑中找到的4种BCO基因分别在进化树中聚类到Bco1、Bco1l、Bco2l和Bco2b的位置(见图 4)。
|
(采用邻接法(Neighbor-Join, NJ)对MEGA7.0软件构建的BCO氨基酸序列进行系统发育树分析,自举值为2 000次,不同的颜色代表不同的分支,红点代表东星斑BCO所在位置。Phylogenetic tree based on BCO amino acid sequences made with MEGA7.0 software using Neighbor-Joining (NJ) method. Aligned sequences were bootstrapped 2 000 times. Different colors represent different branches. The red dot represents the location of the BCO in Plectropomus leopardus.) 图 4 脊椎动物BCO家族氨基酸序列系统发生分析 Fig. 4 Phylogenetic analysis based on BCO family amino acid sequences of vertebrates |
如图 4所示,系统发生树表明四足类动物的BCO家族蛋白种类要少于硬骨鱼类。进化分析表明,硬骨鱼Bco1和Bco1l首先分别聚成2个分枝,再与四足类动物Bco1聚在一枝。同样,Bco2更为明显,硬骨鱼在其特有的进化过程中衍生出Bco2l、Bco2a和Bco2b 3种同源蛋白。Bco2同源蛋白的进化树结果显示哺乳类动物的Bco2蛋白同硬骨鱼类的Bco2l蛋白距离较近,同源关系更为紧密。东星斑Bco1和Bco1l基因同Bco2l和Bco2b基因的系统发育聚类结果同基因结构上的同源性结果基本一致。
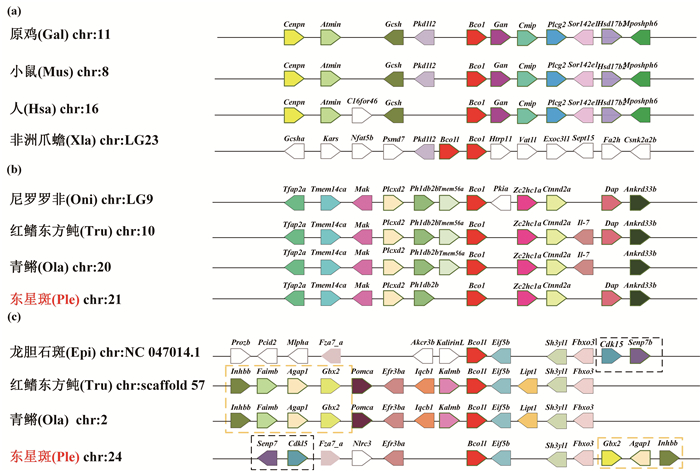
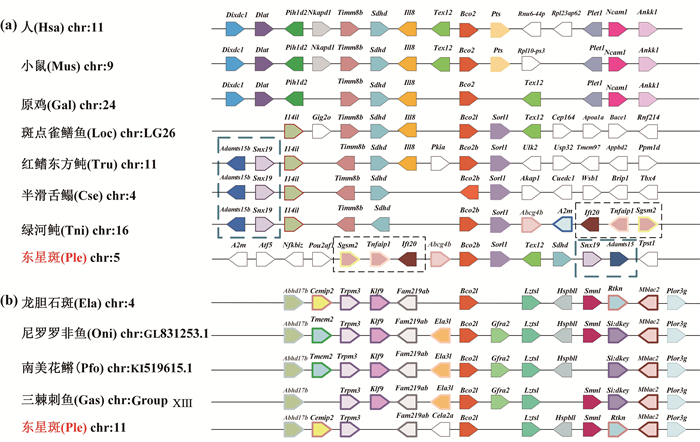
2.5 BCO基因家族共线性分析应用基因共线性分析进一步验证BCO基因家族在硬骨鱼中的起源和进化过程。由图 5可以看出,四足类动物Bco1(见图 5(a))的上、下游基因同硬骨鱼类Bco1(见图 5(b))的上、下游基因存在较大差异,但四足类和硬骨鱼类中,同类的Bco1基因上、下游基因在染色体上的排列顺序相对保守。虽然在Bco1l(见图 5c)的共线性图中有明显的前、后基因异位现象,但也可以很直观的在上、下游找到相对应的基因,可以看出硬骨鱼在进化过程中较保守。图 6中Bco2基因的共线性分析也得出相似的结果,四足类Bco2基因同硬骨鱼类Bco2b的共线性关系更为明确,这个结果同上述系统发生树的绘制结果相一致。Bco2b基因在硬骨鱼中的保守性较差,存在大量倒位、异位基因和无共线性表现的基因(见图 6(a)),这可能因在其进化中出现过较为复杂的进化现象所导致,而硬骨鱼Bco2l基因上、下游基因在染色体上的排列具有较好的共线性(见图 6(b))。
|
((a)四足类Bco1基因共线性分析; (b)硬骨鱼Bco1基因共线性分析; (c)硬骨鱼Bco1l基因共线性分析。(a) Synteny analysis of Bco1 genes among Tetrapoda; (b) Synteny analysis of Bco1 genes among Osteichthyes; (c) Synteny analysis of Bco1l genes among Osteichthyes.) 图 5 脊椎动物Bco1基因家族共线性分析 Fig. 5 Synteny analysis of Bco1 genes among vertebrates |
|
((a)四足类和硬骨鱼类Bco2基因共线性分析;(b)硬骨鱼Bco2l基因共线性分析。(a) Synteny analysis of Bco2 genes among Tetrapoda and Osteichthyes; (b) Synteny analysis of Bco2l genes among Osteichthyes.) 图 6 脊椎动物Bco2基因家族共线性分析 Fig. 6 Synteny analysis of Bco2 genes among vertebrates |
通过分析BCO家族的氨基酸序列,对其蛋白二级结构的组成进行了预测并结合基因结构预测结果统计分析(见表 3),可以看出东星斑BCO家族成员主要由α-螺旋、β-折叠和无规则卷曲组成,其中β-折叠和无规则卷曲的含量较高,所有蛋白的β-折叠百分比、不规则卷曲百分比都大于38%,Bco1的β-折叠百分比为41.86%,Bco1l和Bco2b的不规则卷曲百分比均为51.68%,表明β-折叠和无规则卷曲对BCO家族蛋白结构域的形成具有重要作用。
|
|
表 3 东星斑BCO基因家族基因序列及相应蛋白结构特征 Table 3 Gene sequence and corresponding protein structure characteristics of BCO gene family from Plectropomus leopardus |
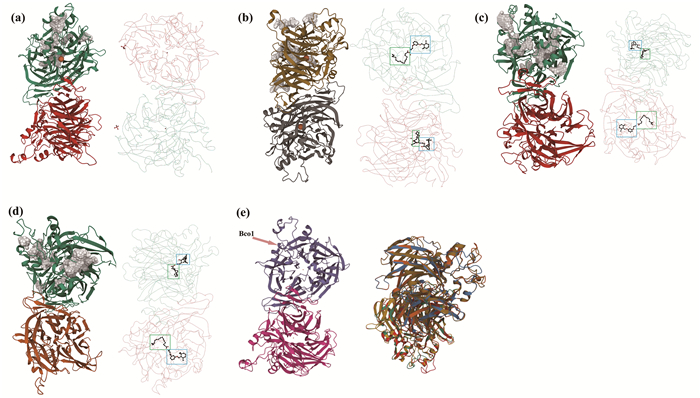
SWISS-Model同源建模结果表明东星斑BCO家族4种蛋白都是由A、B两条链构成(见图 7(a)—(d)),这两条链依据能量原则盘曲折叠分别形成一个自己的疏水内核。同源模型比对结果显示,其同源性最高的都是RPE65(同源性都大于30%),这与应用SMATRT预测出的家族基因共有结构域都有RPE65是一致的(见图 3)。与Bco1蛋白单一RPE65功能域同源模型模板不同的是,其另外3个BCO蛋白家族成员同源模板模型是结合了2个PLM (C16H32O2)配体和2个A6V (C19H29NO2)配体的RPE65功能域(见图 7)。并且Bco1和Bco1l蛋白预测模型是以金属Fe2+为配体的寡聚体,属于非血红素含铁加氧酶家族。其中活性包含2个部位:Fe2+同4个高度保守的组氨酸组成的八面体motif结构; 由7个α-螺旋组成的β-螺旋桨motif结构。Bco2l和Bco2b的预测模型整体上均同Bco1和Bco1l三者都存在高度一致性,也存在巨大的疏水通道,但并没有Fe2+配体,仅含一个共同的由9个α-螺旋组成的β-螺旋桨motif结构(见图 7(a)—(d))。根据空间结构相似性分析结果,Bco1蛋白独立于其他3种BCO蛋白,在部分空间结构同其他三个有一定的差异(见图 7(e))。
|
((a)东星斑Bco1三维结构预测及其配体展图; (b)东星斑Bco1l三维结构预测及其配体展图; (c)东星斑Bco2l三维结构预测及其配体展图; (d)东星斑Bco2b三维结构预测及其配体展图; (e)东星斑4个BCO三维预测模型相似性比较图,红球为Fe2+配体,绿色方框标注PLM (C16H32O2)配体,蓝色方框标注A6V (C19H29NO2)配体。(a) Three-dimensional conformation of Bco1 protein and its ligand display diagram in Plectropomus leopardus; (b) Three-dimensional conformation of Bco1l protein and its ligand display diagram in Plectropomus leopardus; (c) Three-dimensional conformation of Bco2l protein and its ligand display diagram in Plectropomus leopardus; (d) Three-dimensional conformation of Bco2b protein and its ligand display diagram in Plectropomus leopardus; (e) Similar row comparison of three-dimensional conformation of BCO in Plectropomus leopardus. Red ball is Fe2+ ligand, green box marked with PLM(C16H32O2) ligand, blue box marked with A6V (C19H29NO2) ligand.) 图 7 东星斑BCO家族蛋白质三维结构预测 Fig. 7 The three-dimensional conformation of BCO protein in Plectropomus leopardus |
根据拉马线德兰图、预测模型序列一致性(Sequence identity)和GMQE可信度(见表 4),东星斑4种BCO蛋白的三维结构的拉氏图允许区(Ramachandran favoured)均高于89.9%,拉氏图不允许区(Ramachandran outliers)都低于2.06%,表明BCO三维模型的二面角分布和立体构象较为合理,符合立体化学φ和ψ二面角分布的要求,分析显示序列一致性均高于35.83%,GMQE均高于0.70,表明模型预测结果准确性较好。
|
|
表 4 东星斑4个BCO家族蛋白三维结构预测信息 Table 4 Prediction Information of three-dimensional structure of 4 BCO family members in Plectropomus leopardus |
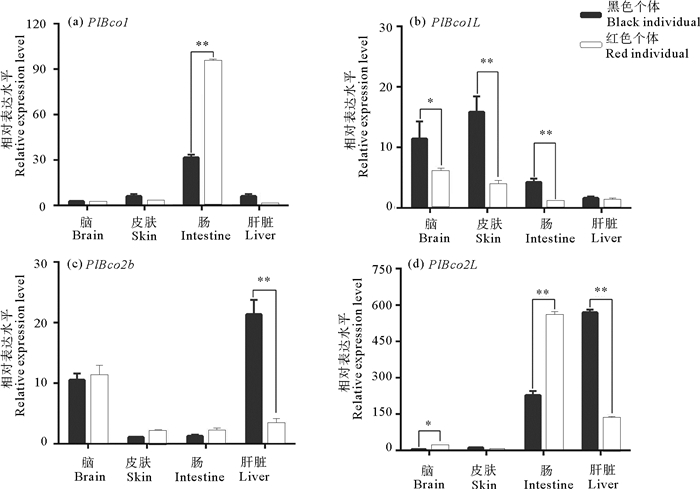
东星斑的5个组织RNA表达水平的结果显示(见图 8)。在脑组织中主要是Bco1l和Bco2b表达,且黑色个体的Bco1l表达量显著高于红色个体。在皮肤组织中Bco1l低水平表达,黑色个体的表达量显著高于红色个体。在肠道组织中Bco1和Bco2l表达水平较高,在红色个体中的表达量显著高于黑色个体;Bco1l低水平表达,且在黑色个体的表达量显著高于在红色个体的表达量。Bco2l和Bco2b在肝组织中表达量相对较高,且在黑色个体肝组织中的表达量显著高于在红色个体肝组织中的表达量。
|
((a)东星斑Bco1基因在红黑个体的不同组织表达情况,(b)东星斑Bco1l基因在红黑个体的不同组织表达情况,(c)东星斑Bco2b基因在红黑个体的不同组织表达情况,(d)东星斑Bco2l基因在红黑个体的不同组织表达情况。*表示显著性P < 0.05,**表示显著性P<0.01。(a) Expression of Bco1 gene in different tissues of red and black individuals. (b) Expression of Bco1l gene in different tissues of red and black individuals. (c) Expression of Bco2b gene in different tissues of red and black individuals. (d) Expression of Bco2l gene in different tissues of red and black individuals. * Indicates significance P < 0.05 and **Indicates significance P < 0.01.) 图 8 东星斑不同组织BCO基因表达情况与体色关系图 Fig. 8 Relationship between BCO genes expression and skin color in different tissues of Plectropomus leopardus |
硬骨鱼中拥有比哺乳动物更多的BCO家族基因,参与类胡萝卜素代谢的途径也更具有多样性,但是,有关硬骨鱼中类胡萝卜素代谢的调控机理尚不清楚[36]。已有研究结果表明东星斑呈现鲜红和黑褐色的体色可能是由于它们对类胡萝卜素的选择性吸收及代谢的不同造成的[37],本研究初步鉴定和分析了东星斑类胡萝卜素裂解加氧酶家族,并探究了其对东星斑体色的影响,为深入解析东星斑体色形成机制提供了基础理论依据。
本研究在东星斑基因组中鉴定出4种BCO家族基因,基因结构分析显示东星斑中Bco2b和Bco2l基因同Bco1和Bco1l在基因长度上差异显著,且Bco1l的外显子数目是Bco2l的外显子数目的两倍。进化分析结果显示,四足类动物和硬骨鱼类已有很明显的分化,分别聚在不同的进化枝,这表明进化过程中硬骨鱼类的BCO基因家族已经进化出不同于四足类的特异性差异。另外,Bco2同源基因的聚类结果与Hessel等推断的Bco2a和Bco2b是由于硬骨鱼的第三次全基因组复制(FSGD或3R)而产生的,而Bco2l基因的起源可能与硬骨鱼谱系中先前的复制事件相契合[14]。基因共线性分析表明,Bco1和Bco1l其二者的及上、下游基因在四足类和硬骨鱼类之间不存在共线性。在进化过程中,四足类和硬骨鱼类Bco1基因已经出现了明显的分歧(见图 5)。这与Helgeland等[15]发现2个Bco1同源分枝Bco1和Bco1l可能是在放射鳍(Actinopterygii)和瓣鳍鱼类(Sarcopterygii)分化之前发生的一次古老的复制事件的结果相印证[15]。由于没有在瓣鳍鱼类和四足类动物中找到Bco1l基因,推测硬骨鱼在进化过程中发生过非功能化和丢失现象[14]。
BCO蛋白结构分析显示,它们的二级结构中包含较多的β-折叠和无规则卷曲结构,表明β-折叠和无规则卷曲对东星斑BCO家族蛋白的功能具有较大的影响。motif预测结果(见图 2)显示东星斑BCO蛋白的4个家族成员都有9个相同的motif且排列顺序一致,推测它们在进化过程中没发生明显的功能分化。蛋白功能域分析结果显示4种东星斑BCO蛋白中都仅包含一个RPE65功能域,与它们可以结合反式视黄酯并异构水解为11-顺式视黄醇的功能相一致[15]。另外,东星斑BCO蛋白三级结构均预测出一个贯穿始终的疏水通道,研究显示该通道与BCO蛋白底物特异性相关[38],也进一步为该家族进化保守提供了有力证据。除此之外,预测结果显示:同Bco1和Bco1l蛋白模型相比,Bco2b和Bco2l预测模型没有Fe2+结合位点,且β-螺旋桨指纹结构多了2个α-螺旋,这种差异可能与双键切割区域的选择性有关[26]。空间结构比对结果显示Bco1蛋白独立于BCO蛋白家族另外3个成员,这可能与Bco1对底物的高度保守有关。
McGraw等[39]指出类胡萝卜素在雀形目中存在3种着色机制,一种是直接沉积未经修饰的类胡萝卜素,再者是沉积转化后的黄色类胡萝卜素,第三种是沉积酮化后的红色类胡萝卜素。类胡萝卜素的着色涉及到类胡萝卜素在肠道的吸收和运输,并在肝脏为主的其他靶组织代谢,最后以不同形态在皮肤等体表组织沉积[40-44]。Toews等[39]研究发现类胡萝卜素经肠道吸收后,通过脂蛋白在血清中运输到靶组织然后代谢成衍生产物,进而参与机体生长发育等重要生理过程[41]。肠道对类胡萝卜素的吸收和肝脏对类胡萝卜素的代谢是影响类胡萝卜素沉积着色的重要因素。东星斑不同组织定量结果显示,在肝脏中黑色个体的Bco2b和Bco2l基因的表达量显著高于红色个体(见图 8)。由于肝脏是类胡萝卜素代谢的主要器官,因此,Bco2l和Bco2b在肝脏中的高表达与体色为黑色的表型是一致的[41]。另外,肌肉是富集类胡萝卜素的主要组织,其次是皮肤、肝脏和生殖腺,在性成熟过程中,鱼类可以将肌肉中的类胡萝卜素转移到皮肤和生殖腺中[44]。已有研究表明,BCO基因家族主要参与类胡萝卜素转化成其他衍生物,其在肠道组织中表达将有助于肠道吸收的类胡萝卜素代谢并积累相关衍生物[43]。在东星斑肠道中,Bco1和Bco2l的表达较高且红色个体显著高于黑色个体,因此,在体色红色的东星斑肠道组织中Bco1和Bco2l可参与食物中摄取类胡萝卜素代谢的过程,并协助类胡萝卜素衍生物的合成以及在皮肤等组织沉积等。已有研究表明,哺乳动物中Bco1仅参与类胡萝卜素代谢,而主要参与着色的叶黄素是由Bco2进行代谢的[41, 45-46]。Andrade等[47]发现Bco2的表达下调,可导致玉米黄质、叶黄素的沉积,同样哺乳动物Bco2的缺失和突变也会导致体内类胡萝卜素的积累[22-23]。Bandara等[48]研究发现小鼠的Bco2基因在C9和C10位氧化裂解β-类胡萝卜素,而缺乏Bco2的小鼠在肝脏中积累类胡萝卜素。以上研究表明Bco2是类胡萝卜素代谢中至关重要的基因。在鱼类中,Lehnert等[18]通过全基因组关联分析发现大鳞大马哈鱼肌肉颜色与Bco2l显著相关,并且Bco2l基因在其白色肌肉个体的表达水平显著高于红色个体。同大鳞大马哈鱼肌肉颜色形成相似,本文作者在东星斑的研究也表明Bco2l基因在黑色个体肝脏中的表达显著低于在红色个体肝脏中的表达。另外,系统进化分析显示硬骨鱼的Bco2l基因聚在同一枝,与哺乳类动物的Bco2基因同源,结合东星斑Bco2l在不同组织中的表达水平进一步证明Bco2l基因与Bco2基因功能具有相似性,对东星斑体色的形成起主要作用。另外邓成等[37]研究发现,皮肤对色素吸收和代谢的差异,是导致东星斑体色差异的重要原因。在东星斑黑色个体的皮肤组织中Bco1l表达水平显著高于红色个体皮肤组织中Bco1l的表达水平,表明Bco1l也是调控东星斑类胡萝卜素代谢进而影响东星斑体色的重要基因。
综上,本文系统的鉴定和分析了东星斑BCO基因家族,深入分析了BCO表达水平与东星斑体色形成的关系,证明Bco2l在肝脏中的低表达是导致红色东星斑体内类胡萝卜素沉积的关键因素。上述结果为后续深入解析东星斑体色形成机制及硬骨鱼中类胡萝卜素代谢的调控机制提供理论基础。
| [1] |
Luo M, Lu G, Yin H, et al. Fish pigmentation and coloration: Molecular mechanisms and aquaculture perspectives[J]. Reviews in Aquaculture, 2021, 13: 2395-2440. DOI:10.1111/raq.12583 (  0) 0) |
| [2] |
Nüsslein-Volhard C, Singh A P. How fish color their skin: A paradigm for development and evolution of adult patterns[J]. Mechanisms of Ageing and Development, 2017, 39(3): 1600231. (  0) 0) |
| [3] |
黄鸿兵, 尹思慧, 李潇轩, 等. 鱼虾体色及呈现机制研究进展[J]. 天津农业科学, 2021, 27(7): 5. Huang H B, Yin S H, Li X X, et al. Research progress on body color and presentation mechanism of fish and shrimp[J]. Tianjin Agricultural Sciences, 2021, 27(7): 5. (  0) 0) |
| [4] |
范云鹏, 赵韩, 罗世民, 等. 花鲫早期体色发育和几个体色相关基因在不同鲫的表达分析[J]. 激光生物学报, 2019, 28(4): 11. Fan Y P, Zhao H, Luo S M, et al. Early body color development of flower crucian carp and expression analysis of several body color related genes in different crucian carp[J]. Journal of Laser Biology, 2019, 28(4): 11. (  0) 0) |
| [5] |
Helgeland H, Sodeland M, Zoric N, et al. Genomic and functional gene studies suggest a key role of beta-carotene oxygenase 1 like (Bco1l) gene in salmon flesh color[J]. Surface Science Reports, 2019, 9(1): 20061. (  0) 0) |
| [6] |
Maoka T, Sato W, Nagai H, Takahashi T. Carotenoids of red, brown, and black specimens of Plectropomus leopardus, the coral trout (Suziara in Japanese)[J]. Journal of Oleo Science, 2017, 66(6): 579-584. DOI:10.5650/jos.ess16179 (  0) 0) |
| [7] |
关献涛. 饲料中添加虾青素、叶黄素等4种物质对东星斑的生长、体色和抗氧化性的影响[D]. 上海: 上海海洋大学, 2017. Guan X T. Effect of Four Feed Additives(Astaxanthin and Xanthophyll etc.) on Growth, Body Color and Antioxidant Capability of Leopard Coral Grouper, Plectropomus leopardus[D]. Shanghai: Shanghai Ocean University, 2017. (  0) 0) |
| [8] |
Ep A, Su A, Ibr B, et al. Evolutionary aspects and enzymology of metazoan carotenoid cleavage oxygenases[J]. Biochimica et Biophysica Acta (BBA)—Molecular and Cell Biology of Lipids, 2020, 1865(11): 158665. (  0) 0) |
| [9] |
Rashidian G, Rainis S, Proki M D, et al. Effects of different levels of carotenoids and light sources on swordtail fish (Xiphophorus helleri) growth, survival rate and reproductive parameters[J]. Natural Product Research, 2020, 35(21): 3675-3686. (  0) 0) |
| [10] |
Jin Y, Yu Y, Zhang C, et al. Characterization and function analysis of the beta-carotene oxygenase-like genes in carotenoids metabolism of the ridgetail white prawn Exopalaemon carinicauda[J]. Frontiers in Physiology, 2021, 105(48): 19000-19005. (  0) 0) |
| [11] |
Oberhauser V, Voolstra O, Bangert A, et al. NinaB combines carotenoid oxygenase and retinoid isomerase activity in a single polypeptide[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(48). (  0) 0) |
| [12] |
Poliakov E, Soucy J, Gentleman S, et al. Phylogenetic analysis of the metazoan carotenoid oxygenase superfamily: A new ancestral gene assemblage of BCO-like (BCOL) proteins[J]. Scientific Reports, 2017, 7(1): 13192. DOI:10.1038/s41598-017-13521-x (  0) 0) |
| [13] |
Amengual J, Coronel J, Marques C, et al. β-carotene oxygenase 1 activity modulates circulating cholesterol concentrations in mice and humans[J]. Journal of Nutrition, 2020, 150(8): 2023-2030. DOI:10.1093/jn/nxaa143 (  0) 0) |
| [14] |
Hessel S, Eichinger A, Isken A, et al. CMO1 deficiency abolishes vitamin a production from β-carotene and alters lipid metabolism in mice[J]. Journal of Biological Chemistry, 2007, 282(46): 33553. DOI:10.1074/jbc.M706763200 (  0) 0) |
| [15] |
Helgeland H, Sandve S R, Torgersen J S, et al. The evolution and functional divergence of the beta-carotene oxygenase gene family in teleost fish—exemplified by Atlantic salmon[J]. Gene, 2014, 543(2): 268-274. DOI:10.1016/j.gene.2014.02.042 (  0) 0) |
| [16] |
Kasahara M, Naruse K, Sasaki S, et al. The medaka draft genome and insights into vertebrate genome evolution[J]. Nature, 2007, 447(7145): 714-719. DOI:10.1038/nature05846 (  0) 0) |
| [17] |
Auer R L, Riaz S, Cotter F E. The 13q and 11q B-cell chronic lymphocytic leukaemia-associated regions derive from a common ancestral region in the zebrafish[J]. British Journal of Haematology, 2010, 137(5): 443-453. (  0) 0) |
| [18] |
Lehnert S J, Christensen K A, Vandersteen W E, et al. Carotenoid pigmentation in salmon: Variation in expression at BCO2-l locus controls a key fitness trait affecting red coloration[J]. Proceedings of the Royal Society B: Biological Sciences, 2019, 286(1913): 20191588. DOI:10.1098/rspb.2019.1588 (  0) 0) |
| [19] |
Li X, Wang S, Xun X, et al. A carotenoid oxygenase is responsible for muscle coloration in scallop[J]. Biochimicaet Biophysica Acta Molecular & Cell Biology of Lipids, 2019, 1864(7): 966-975. (  0) 0) |
| [20] |
Jin Y, Yu Y, Zhang C, et al. Characterization and function analysis of the beta-carotene oxygenase-like genes in carotenoids metabolism of the ridgetail white prawn Exopalaemon carinicauda[J]. Frontiers in Physiology, 2020, 11: 745. DOI:10.3389/fphys.2020.00745 (  0) 0) |
| [21] |
Yang Y, Wu L N, Chen J F, et al. Whole-genome sequencing of leopard coral grouper (Plectropomus leopardus) and exploration of regulation mechanism of skin color and adaptive evolution[J]. Zoological Research, 2020, 41(3): 328-340. DOI:10.24272/j.issn.2095-8137.2020.038 (  0) 0) |
| [22] |
Våge D I, Boman I A. A nonsense mutation in the beta-carotene oxygenase 2 (BCO2) gene is tightly associated with accumulation of carotenoids in adipose tissue in sheep (Ovis aries)[J]. BMC Genetics, 2010, 11: 10. (  0) 0) |
| [23] |
Strychalski J, Gugoek A, Brym P, et al. Polymorphism of the Bco2 gene and the content of carotenoids, retinol, and α-tocopherol in the liver and fat of rabbits[J]. Revista Brasileira de Zootecnia, 2019, 48: e20180243. DOI:10.1590/rbz4820180243 (  0) 0) |
| [24] |
Raghuvanshi S, Reed V, Blaner W S, et al. Cellular localization ofβ-carotene 15', 15' oxygenase-1 (Bco1) and β-carotene 9', 10'oxygenase-2 (BCO2) in rat liver and intestine[J]. Archives of Biochemistry & Biophysics, 2015, 572: 19-27. (  0) 0) |
| [25] |
Lobo G P, Isken A, Hoff S, et al. BCDO2 acts as a carotenoid scavenger and gatekeeper for the mitochondrial apoptotic pathway[J]. Development, 2012, 139(16): 2966. DOI:10.1242/dev.079632 (  0) 0) |
| [26] |
Amengual J, Lobo G P, Golczak M, et al. A mitochondrial enzyme degrade scarotenoids and protects against oxidative stress[J]. FASEB Journal, 2010, 25(3): 948-959. (  0) 0) |
| [27] |
Wu L, Lu P, Guo X, et al. β-carotene oxygenase 2 deficiency-triggered mitochondrial oxidative stress promotes low-grade inflammation and metabolic dysfunction[J]. Free Radical Biology and Medicine, 2021, 164(4): 271-284. (  0) 0) |
| [28] |
王锐, 齐遵利, 张秀文, 等. 东星斑的生物学特性和人工养殖技术[J]. 中国水产, 2011, 164(4): 33-34. Wang R, Qi Z L, Zhang X W, et al. Biological characteristics and artificial culture techniques of east star spot[J]. Chinese Fisheries, 2011, 164(4): 33-34. (  0) 0) |
| [29] |
MaokaT, Sato W, Nagai H, et al. Carotenoids of red, brown, and black specimens of Plectropomus leopardus, the coral trout (Suziara in Japanese)[J]. Journal of Oleo Science, 2017, 10(6): 579-584. (  0) 0) |
| [30] |
Khasanah M, Kadir N N, Jompa J. Reproductive biology of three important threatened/near-threatened groupers (Plectropomus leopardus, Epinephelus polyphekadion and Plectropomus areolatus) in eastern Indonesia and implications for management[J]. Animals: An Open Access Journal from MDPI, 2019, 9(9): 643. (  0) 0) |
| [31] |
Hu B, Jin J, Guo A Y, et al. GSDS 2.0: An upgraded gene feature visualization server[J]. Bioinformatics, 2015, 31(8): 1296-1297. DOI:10.1093/bioinformatics/btu817 (  0) 0) |
| [32] |
Bailey T L, Johnson J, Grant C E, et al. The MEME suite[J]. Nucleic Acids Research, 2015, 43(W1): 39-49. DOI:10.1093/nar/gkv416 (  0) 0) |
| [33] |
Yao M. Roll: A new algorithm for the detection of protein pockets and cavities with a rolling probe sphere[J]. Bioinformatics, 2010, 26(1): 46-52. DOI:10.1093/bioinformatics/btp599 (  0) 0) |
| [34] |
Jones D T. Protein secondary structure prediction based on position-specific scoring matrices[J]. Journal of Molecular Biology, 1999, 292(2): 195-202. DOI:10.1006/jmbi.1999.3091 (  0) 0) |
| [35] |
Chen X J, Sun Y, Zhang P P, et al. Screening of stable internal reference genes by quantitative real-time PCR in humpback grouper Cromileptes altivelis[J]. Journal of Oceanology and Limnology, 2021, 39(5): 1985-1999. DOI:10.1007/s00343-020-0238-8 (  0) 0) |
| [36] |
刘合露, 郑怀平, 张涛, 等. 海产动物体内虾青素的代谢及转运沉积[J]. 海洋科学, 2010, 34(4): 104-108. Liu H H, Zheng H, Zhang T, et al. Metabolism and transport deposition of astaxanthin in marine animals[J]. Marine Science, 2010, 34(4): 104-108. (  0) 0) |
| [37] |
邓成, 陈帅龙, 叶恒振, 等. 体色差异豹纹鳃棘鲈的色素及酶含量分析[J]. 生命科学研究, 2020, 24(1): 15-20. Deng C, Chen S L, Ye H Z, et al. Analysis of pigment and enzyme levels of Plectropomus leopardus with body color difference[J]. Life Science Research, 2020, 24(1): 15-20. (  0) 0) |
| [38] |
Shmarakov I O, Yuen J J, Blaner W S. Carotenoid metabolism and enzymology[J]. Paseik, New Jersey: Humana Press, 2013. (  0) 0) |
| [39] |
Mcgraw K J, Crino P M N L. Colourful house finch: Analysis of plasma and liver pigments in wild moulting birds[J]. Functional Ecology, 2006, 20(4): 678-688. DOI:10.1111/j.1365-2435.2006.01121.x (  0) 0) |
| [40] |
Toews D P L, Hofmeister N R, Taylor S A. The evolution and genetics of carotenoid processing in animals[J]. Trends in Genetics, 2017, 33(3): 171-182. DOI:10.1016/j.tig.2017.01.002 (  0) 0) |
| [41] |
周利梅, 周光宏. 类胡萝卜素在动物营养中的研究进展[J]. 粮食与饲料工业, 2001(2): 39-41. Zhou L, Zhou G H. Research progress of carotenoids in animal nutrition[J]. Grain and Feed Industry, 2001(2): 39-41. (  0) 0) |
| [42] |
薛泊宁, 张雁云, 董路. 基于类胡萝卜素着色的鸟类羽色多样性形成机制[J]. 生物多样性, 2021, 29(6): 843-854. Xue B, Zhang Y Y, Dong L. Formation mechanism of bird feather color diversity based on carotenoid coloring[J]. Biodiversity, 2021, 29(6): 843-854. (  0) 0) |
| [43] |
任晓莹, 王树林. 日粮中β-胡萝卜素水平对牦牛肠道BCMO1和BCDO2基因及相关代谢调控因子表达的影响及相关性分析[J]. 农业生物技术学报, 2021, 29(6): 1132-1141. Ren X Y, Wang S L. Effects of dietary β-carotene levels on the expression of BCMO1 and BCDO2 genes and related metabolic regulatory factors in intestinal tract of yaks and their correlation analysis[J]. Journal of Agricultural Biotechnology, 2021, 29(6): 1132-1141. (  0) 0) |
| [44] |
贺国龙, 刘立鹤. 鱼类体色成因及其调控技术研究进展(下)[J]. 水产科技情报, 2010(2): 88-91. He G L, Liu L H. Research progress on the causes and regulation techniques of fish body color (part two)[J]. Fishery Science and Technology Information, 2010(2): 88-91. (  0) 0) |
| [45] |
任建敏. 类胡萝卜素结构及在动植物中的功能与生理活性[J]. 重庆工商大学学报(自然科学版), 2021, 38(2): 102-107. Ren J. Structure, function and physiological activity of carotenoids in animals and plants[J]. Journal of Chongqing University of Science and Technology (Natural Science Edition), 2021, 38(2): 102-107. (  0) 0) |
| [46] |
Kloer D P, Schulz G E. Structural and biological aspects of carotenoid cleavage[J]. Cellular & Molecular Life Sciences, 2006, 63(19-20): 2291-2303. (  0) 0) |
| [47] |
Andrade P, Pinbo C, Lanuza G P, et al. Regulatory changes in pterin and carotenoid genes underlie balanced color ploymorphisms in the wall lizard[J]. PNAS, 2019, 116: 5633-5642. (  0) 0) |
| [48] |
Bandara S, Thomas L D, Ramkumar S, et al. The structural and biochemical basis of apocarotenoid processing by beta-carotene oxygenase-2[J]. ACS Chemical Biology, 2021, 16(3): 480-490. (  0) 0) |
2. Key Laboratory of Marine Genetics and Breeding (Ocean University of China), Ministry of Education, Qingdao 266003, China
 2023, Vol. 53
2023, Vol. 53


