2. 山东省水生生物资源养护管理中心, 山东 烟台 264003;
3. 海州湾渔业生态系统教育部野外科学观测研究站,山东 青岛 266003;
4. 青岛海洋科学与技术试点国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237
山东近海海域具有优越的渔业资源栖息环境,成为生物资源的重要产卵场和索饵场,也是我国海洋渔业生产的传统渔场集中分布的海域[1]。近年来由于受到捕捞压力增大、气候变化以及环境污染等影响,山东近海海域生态系统发生变化,重要的渔业经济物种资源衰退,矛尾虾虎鱼(Chaeturichthys stigmatias)已经成为优势度较大的物种[2-6]。
矛尾虾虎鱼隶属于硬骨鱼纲(Osteichthves)鲈形目(Perciformes)虾虎鱼科(Gobiidae)矛尾虾虎鱼属(Chaeturichthys),为近海底层暖温种,栖息于近岸海域及河口海域,在中国沿海均有分布[7]。矛尾虾虎鱼作为一年生鱼类,3月达到性成熟,4月中下旬开始产卵直到5月,产卵后相继死亡[8]。矛尾虾虎鱼主要摄食钩虾类、糠虾类和瓣鳃类等,是蓝点马鲛(Scomberomorus niphonius)、黄鮟鱇(Lophius litulon)和细纹狮子鱼(Liparis tanakae)等大中型鱼类的饵料生物[3],在近海底栖食物网中占据重要地位,对维持近海生态系统的稳定性和多样性起到了重要作用。2010年邓维德[8]对矛尾虾虎鱼的生长和繁殖做过初步研究,2013年孟宽宽等[9]对黄河口及邻近海域的矛尾虾虎鱼其群体组成、体长-体重关系和性成熟等渔业生物学特性进行了初步分析。然而对于山东近海矛尾虾虎渔业生物学特征的研究较少,且缺乏季节变化的详细研究。目前对矛尾虾虎鱼的研究主要以资源调查为主[2-6],对其体长-体重关系、性腺发育的季节变化及摄食等渔业生物学特征的研究亟待补充。
本研究根据山东近海渔业资源全面调查中矛尾虾虎鱼的底拖网数据及渔业生物学数据,分析了矛尾虾虎鱼各季节的群体组成、体长-体重关系,摄食及性腺成熟度的季节变化。旨在全面了解在山东近海海域的矛尾虾虎鱼渔业生物学特征及其季节变化,补充其相关数据,以便为山东近海海域渔业资源的保护和合理开发提供科学依据,并为今后进一步研究矛尾虾虎鱼提供生物学依据。同时提供山东近海矛尾虾虎鱼详细的摄食习性数据,为进一步研究山东近海食物网络提供参考。
1 材料与方法 1.1 样品采集矛尾虾虎鱼样品采集为2016年10月和2017年1、5和8月在山东近海海域的渔业资源调查。调查海域范围为118°20′E—123°50′E,37°30′N—38°30′N,共设立177个站位(见图 1)。本次调查按《海洋渔业资源调查规范》(SC/T 9403—2012)等[10]进行。调查船为220 kW的单拖渔船,底拖网为1 380目×4.67 cm。拖网时网口高度约7.53 m,宽度约15 m。拖网调查均安排在白天(6:00—18:00)进行,拖速为2~3 kn,每站拖网时间约为1 h。

|
图 1 山东近海海域底拖网调查站位 Fig. 1 Sampling stations of bottom trawl survey in the coastal waters of Shandong province |
本次调查的样品分析按照《海洋渔业资源调查规范》(SC/T 9403—2012)等[10]进行,每个站位随机取30尾样品测量矛尾虾虎鱼的体长和体重,不足30尾则全取,共取样2 994尾; 每个站位随机取20尾样品进行解剖,观察其摄食等级和性腺成熟度,全年共有134个站位中取到样品,共取样1 009尾,并随机对其部分胃含物进行分析,共取样252尾(见表 1)。
|
|
表 1 山东近海矛尾虾虎鱼样品量 Table 1 Sample quantity of C. stigmatias in the coastal waters of Shandong |
利用频率分布法,分别以10 mm和10.00 g为组距,对矛尾虾虎鱼体长和体重进行分析,利用独立样本t检验分析分析各季节矛尾虾虎鱼平均体长及平均体重是否有显著性差异[11]。
1.3.2 体长-体重关系矛尾虾虎鱼体长与体重关系用以下幂函数公式拟合[12]:
| $ W=a L^{b}。$ |
式中:W表示鱼体重(g); L表示鱼体长(mm); a和b是两个待确定的参数。a表示生长的条件因子,反映种群所处环境的优劣,在一定程度上表示生物的肥满度。b为异速生长因子,反映生长发育的不均匀性,若b>3,为正异速生长,体重的增长较体长的增长快; 若b < 3,为负异速增长,体重的增长较体长的增长慢; 若b=3,为等速生长,体重与体长增长同速[13]。
使用使用协方差分析(ANCOVA)检验分析全年及不同季节间个体体长-体重关系参数的差异,使用t检验分析参数b与3的差异[14]。
1.3.3 胃含物分析及摄食等级分析对矛尾虾虎鱼的胃含物进行分析,摄食等级根据《海洋渔业资源调查规范》(SC/T 9403—2012)[10]要求,肉眼观察后将摄食等级划分5个等级,统计摄食食物组成,用饵料生物的重量百分比(W/%)、尾数百分比(N/%)、出现频率(F/%)和相对重要性指标(IRI)来评价鱼类各种饵料的重要性,计算公式如下[15]:
| $ \begin{array}{l} \text { 质量百分比 } W=\frac{\text { 某饵料生物质量 }}{\text { 全部饵料生物总质量 }} \times 100 \% ; \\ \text { 个数百分比 } N=\frac{\text { 某饵料生物质量 }}{\text { 全部饵料生物总质量 }} \times 100 \% \text { ; } \\ \text { 出现频率 } F=\frac{\text { 某饵料生物出现次数 }}{\text { 非空胃个数 }} \times 100 \% ; \\ I R I=F \times(W+N)。\end{array} $ |
利用列联表卡方检验分析矛尾虾虎鱼不同季节、体长组间摄食等级是否存在显著性差异[11]。
1.3.4 性腺成熟度性腺成熟度根据《海洋渔业资源调查规范》(SC/T 9403—2012)[10]要求,肉眼观察划分,统计矛尾虾虎鱼各季节性腺成熟度进行统计分析,绘制各季节性腺成熟度比例分布图。
2 结果 2.1 体长、体重组成山东近海海域矛尾虾虎鱼的体长分布范围为30~225 mm,平均体长为(90.27±28.15)mm,优势体长为40~130 mm。独立样本t检验分析结果表明,各季节矛尾虾虎鱼的平均体长存在显著差异(P < 0.05)。其中,冬季个体平均体长最大,为(107.37±27.13)mm,优势体长为70~140 mm; 其次为春季和秋季,平均体长分别为(100.88±17.68)和(82.56±24.40)mm,优势体长为80~120 mm和50~120 mm; 夏季平均体长最小,为(74.68±21.16)mm,优势体长为50~110 mm(见图 2)。

|
图 2 山东近海海域矛尾虾虎鱼体长季节分布频率直方图 Fig. 2 Frequency histogram of standard length of C. stigmatias in the coastal waters of Shandong in different seasons |
4个调查季节当中,矛尾虾虎鱼的体重范围为0.24~80.84 g,平均体重为(8.90±8.53)g,优势体重为1~15 g。通过独立样本t检验分析,各季节矛尾虾虎鱼的平均体重存在显著差异(P < 0.05)。其中,冬季个体平均体重最大,为(13.44±10.43)g,优势体重为0.48~20 g; 其次为春季,平均体重为(9.48±5.49)g,优势体重为2.7~20 g; 夏季和秋季个体平均体重较小,分别为(5.23±4.78)和(6.86±6.80)g,优势体重分别为(0.24~10)和(0.69~10)g(见图 3)。矛尾虾虎鱼在冬季体重分布范围较大,其余月份体重分布范围相对较小。

|
图 3 山东近海海域矛尾虾虎鱼季节体重分布频率直方图 Fig. 3 Frequency histogram of body weight of C. stigmatias in the coastal waters of Shandong in different seasons |
各季节及全年的矛尾虾虎鱼体长与体重呈显著的幂函数关系(P < 0.05)(见表 2),协方差分析(ANCOVA)检验分析表明,各季节及全年的矛尾虾虎鱼体长-体重关系具有显著性差异(P < 0.05)。如表 2所示条件因子a在秋季最大,冬季和春季的条件因子a逐渐减小,到夏季时最小; 生长指数b的季节变化趋势与a的相反。拟合其全年体长(L)-体重(W)关系:W=2.02×10-5L2.83(R2=0.945 5,n=2 992)(见图 4),经t检验b值与3存在显著性差异(t=-3.40, P < 0.05),表明其生长符合异速生长类型,且b < 3,为负异速生长。
|
|
表 2 山东近海海域矛尾虾虎鱼不同季节体长-体重关系 Table 2 Length-weight relationships of C. stigmatias in the coastal waters of Shandong in different seasons |
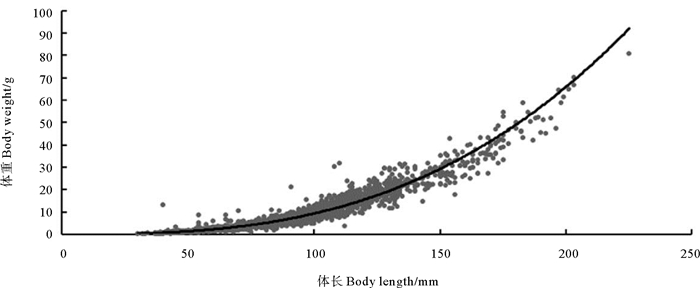
|
图 4 山东近海海域矛尾虾虎鱼体长-体重关系 Fig. 4 Body length-body weight relationship of C. stigmatias in the coastal waters of Shandong |
根据矛尾虾虎鱼的春夏季胃含物分析,表明其春夏季摄食食物组成包括7个类群(见表 3),根据相对重要性指数百分比(IRI),瓣鳃类在矛尾虾虎鱼的食物组成中占比最大,为78.83%,其次为虾类(14.94%)、多毛类(2.34%)、腹足类(2.23%)、鱼类(1.53%),蟹类和蛇尾类均不足1%。从矛尾虾虎鱼食物组成生物种类分析来看,共有23种。帘蛤科(Veneridae)的IRI%最高(62.54%),其次为樱蛤科(Tellinidae)、不可辨识虾类、蛇尾纲(Ophiuroidea)、玉螺科(Naticidae)。
|
|
表 3 山东近海矛尾虾虎鱼食物组成 Table 3 Diet composition of C. stigmatias in the coastal waters of Shandong |
全年所有体长组矛尾虾虎鱼的摄食等级0~4级所占比例分别为1.49%、55.18%、25.75%、13.05%和4.58%,摄食等级以1、2级为主(见图 5)。利用列联表卡方检验分析结果表明,不同季节摄食等级存在显著差异(P < 0.01)。春季和冬季摄食等级随着体长增大而呈现递增趋势; 秋季的摄食等级以1、2级为主,且摄食等级随体长变化不明显; 夏季中小体长组的摄食等级随体长增大呈现递增趋势,但较大体长组的摄食等级较低(见图 5)。

|
图 5 山东近海海域矛尾虾虎鱼不同体长组摄食等级百分比组成 Fig. 5 Percentage composition of feeding grade of different body length groups of C. stigmatias in the coastal waters of Shandong |
对不同季节矛尾虾虎鱼的性腺成熟度进行分析,发现其性腺成熟度所占比例存在明显的季节变化(见图 6)。夏季矛尾虾虎鱼均为性腺未发育的Ⅰ期个体; 秋季主要为Ⅰ期和Ⅱ期的个体,分别占76.47%和23.53%;冬季个体中Ⅰ期占39.40%,Ⅱ期占35.41%,Ⅲ期的个体占22.94%,Ⅳ期和Ⅴ期所占比例较少,分别为1.75%和0.50%;春季有少量的Ⅱ期、Ⅲ期和Ⅳ期的个体,所占比例分别为0.62%、4.94%和2.74%,其他的均为性腺未发育的Ⅰ期的个体,占91.98%。

|
图 6 山东近海海域矛尾虾虎鱼性腺成熟度各季节变化 Fig. 6 Seasonal variation of gonadal maturity of C. stigmatias in the coastal waters of Shandong |
研究结果表明,夏季和秋季作为矛尾虾虎鱼生长的前期,其平均体长、体重差异均较小; 而在性腺开始发育的冬季,矛尾虾虎鱼的平均体长、体重较秋季有较大增长。
调查期间,矛尾虾虎鱼体长-体重关系中幂指数b为2.830 4,经检验与3存在显著性差异(P < 0.05),表明矛尾虾虎鱼为负异速生长。这与孟宽宽等[9]研究的黄河口及邻近海域矛尾虾虎鱼b值(3.183)差异较大。许多研究表明,导致b值差异的原因有很多,包括性别或种群的不同[16]、环境、发育阶段、捕捞强度[17-18]、胃饱满度、个体食性的转化[17]等。Stergiou等[19]曾指出,在相对较高的捕捞压力下,鱼类个体的体重生长速度减慢,表现为异速生长因子降低。尽管矛尾虾虎鱼个体较小,经济价值有限,在渔业生产中,常常被当作小杂鱼作为其他鱼类的饲料,但由于山东近海渔业资源进一步匮乏,渔民为扩大收入增加对小型鱼类的捕捞,造成矛尾虾虎鱼生长压力变大。这可能是造成山东近海海域矛尾虾虎鱼群体呈现负异速增长的重要原因。
生长条件因子a值的大小可以在一定程度上反应鱼类的肥满度,与饵料基础、水文环境等因素有关。当饵料丰富、水温等环境条件适宜的情况下,a值较大[17]。秋季矛尾虾虎鱼体长-体重关系中参数a值最大,说明秋季的矛尾虾虎鱼生长所需的饵料资源、水温等条件较其他季节更加适宜。同时对于矛尾虾虎鱼这种一年生鱼类来说,鱼类体型大小对于a值大小也有一定影响。夏季作为矛尾虾虎鱼生长前期,体型较小,摄食强度不高,导致a值最小。尽管冬季环境较为恶劣,但矛尾虾虎鱼此时体型较大,可捕食的饵料种类增多,摄食强度较高,因而a值较大。
3.2 摄食习性及摄食强度本研究中山东近海海域春夏季矛尾虾虎鱼胃含物分析表明,矛尾虾虎鱼主要以底栖动物为食,主要摄食瓣鳃类,其次为虾类,主要饵料有镜蛤(Dosinia)、樱蛤(Tellinidae)和独眼钩虾(Monoculodes limnophilus)等。这与张波等根据全年数据研究的渤海海域矛尾虾虎鱼食物种类组成并没有较大差异,表明春夏的矛尾虾虎鱼的胃含物分析结果也具有一定代表性。但是,想全面准确的了解该物种的摄食习性,还应当对其他季度的胃含物数据进行分析。矛尾虾虎鱼作为山东近海海域优势度较大的底栖鱼类,摄食的食物范围广泛,对生态系统中低营养级的底栖生物具有下行效应,而且对其他摄食相近物种的鱼类如小黄鱼、其他虾虎鱼类产生竞争。同时作为一些大中型鱼类的饵料生物[2],在“底栖动物→虾虎鱼、小黄鱼→大型经济鱼类”食物链中占有重要地位,对维护近海生态系统稳定性和多样性起到重要作用。同时本研究还表明矛尾虾虎鱼摄食水平不仅与季节变化有关,也与其生长发育有关,表现在其摄食强度随体长增加而呈现增加的趋势。有研究表明,性成熟个体由于性腺发育占据一定的体腔空间,会导致摄食强度减弱[20]。本研究中,春季为矛尾虾虎鱼的繁殖期,因此矛尾虾虎鱼在春季摄食水平较低。由于夏季较大体型的矛尾虾虎鱼数量较少,采集上来的较大个体矛尾虾虎鱼摄食强度分析结果有一定偶然性,导致夏季出现最大体长组摄食等级降低的现象,这说明在分析不同体型鱼类摄食强度时,要尽可能地增加样本数量。
3.3 繁殖特性本研究表明,山东近海矛尾虾虎鱼的性腺成熟时间较孟宽宽等[9]研究的黄河口及其邻近海域矛尾虾虎鱼性腺成熟时间有所提前,这可能是受水温等因素的影响。水温是鱼类的生殖周期中重要条件[21-22],水温的升高能够提前鱼类性腺的成熟时间[23],近年来温室效应等原因导致海洋水温增加以及不同海域水温升高时间的不同这些原因都可能是导致鱼类性腺成熟时间变化的原因。春季矛尾虾虎鱼性腺Ⅰ期比例较大,这与调查时间有关,矛尾虾虎鱼4月中旬开始产卵并持续到5月中旬,大量性腺成熟个体产卵后死亡[8],而本研究当中春季航次调查时间在5月下旬,所以捕捞到较多性腺未成熟的个体。
本研究首次探究了山东近海海域矛尾虾虎鱼生长特征的季节变化、摄食组成、不同体长组摄食水平及其季节变化、性比及性腺成熟度。由于调查范围广,获得了丰富的数据,进一步完善了矛尾虾虎鱼渔业生物学特征的研究,为进一步研究矛尾虾虎鱼生态学特性提供一定的依据。但由于调查取样的时间及样品分析的限制,在探究矛尾虾虎鱼渔业生物学特征中,缺乏水温、水深、盐度等环境因子对其影响的研究。在日后的研究中可对此改进,例如通过运用线性混合效应模型来分析单鱼种体长-体重关系,增加时间、水深、盐度等环境因子进行建模分析,既可以提高生长方程的准确性,同时可以探究影响鱼种体长-体重关系的因素。
| [1] |
陈大刚. 黄渤海渔业生态学[M]. 北京: 海洋出版社, 1991: 4-21. Chen D G. Fisheryecology of Bohai and Yellow Seas[M]. Beijing: China Ocean Press, 1991: 4-21. (  0) 0) |
| [2] |
张波. 渤海鱼类的食物关系[J]. 渔业科学进展, 2018, 39(3): 11-22. Zhang B. Feeding ecology of fishes in the bohai sea[J]. Progress In Fishery Sciences, 2018, 39(3): 11-22. (  0) 0) |
| [3] |
吕振波, 李凡, 曲业兵, 等. 2010年夏季黄河口及邻近海域鱼类群落多样性[J]. 渔业科学进展, 2013, 34(2): 10-18. Lü Z B, Li F, Qu Y B, et al. Fish community diversity in the Huanghe estuary and its adjacent area in summer, 2010[J]. Progress in Fishery Sciences, 2013, 34(2): 10-18. (  0) 0) |
| [4] |
李凡, 张焕君, 吕振波, 等. 莱州湾游泳动物群落种类组成及多样性[J]. 生物多样性, 2013, 21(5): 537-546. Li F, Zhang H J, Lü Z B, et al. Species composition and community diversity of nekton in Laizhou Bay, China[J]. Biodiversity Science, 2013, 21(5): 537-546. (  0) 0) |
| [5] |
杨涛, 单秀娟, 金显仕, 等. 莱州湾鱼类群落的关键种[J]. 水产学报, 2016, 40(10): 1613-1623. Yang T, Shan X J, Jin X S, et al. Keystone species of fish community in the Laizhou Bay[J]. Journal of Fisheries of China, 2016, 40(10): 1613-1623. (  0) 0) |
| [6] |
孙鹏飞, 单秀娟, 吴强, 等. 莱州湾及黄河口水域鱼类群落结构的季节变化[J]. 生态学报, 2014, 34(2): 367-376. Sun P F, Shan X J, Wu Q, et al. Seasonal variations in fish community structure in the Laizhou Bay and the Yellow River Estuary[J]. Acta Ecologica Sinica, 2014, 34(2): 367-376. (  0) 0) |
| [7] |
伍汉霖, 钟俊生. 中国动物志, 硬骨鱼纲, 鲈形目[M]. 北京: 科学出版社, 2008: 311-312. Wu H L, Zhong J S. Fauna of China Osteichthyes: Perciformes (V) Gobioidei[M]. Beijing: Science Press, 2008: 311-312. (  0) 0) |
| [8] |
邓维德. 矛尾虾虎鱼生长与繁殖的初步研究[D]. 昆明: 云南大学, 2010. Deng W D. A Preliminary Study of Growth and Reproduction of Chaeturichthys stigmatias[D]. Kunming: Yunnan University, 2010. (  0) 0) |
| [9] |
孟宽宽, 王晶, 张崇良, 等. 黄河口及其邻近水域矛尾虾虎鱼渔业生物学特征[J]. 中国水产科学, 2017, 24(5): 939-945. Meng K K, Wang J, Zhang C L, et al. The fishery biological characteristics of Chaeturichthys stigmatias in the Yellow River estuary and its adjacent waters[J]. Journal of Fishery Sciences of China, 2017, 24(5): 939-945. (  0) 0) |
| [10] |
国家质量监督检验检疫总局. GB/T12763.6—2007, 海洋调查规范第6部分: 海洋生物调查[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine. GB/T12763.6—2007, Specifications for Oceanographic Survey-part 6: Marine Biological Survey[S]. Beijing: China Bodys Press, 2007. (  0) 0) |
| [11] |
王淼, 徐开达, 梁君. 杭州湾北部棘头梅童鱼繁殖群体生物学特征初步分析[J]. 上海海洋大学学报, 2018, 27(5): 781-788. Wang M, Xu K D, Liang J. Preliminary analysis of biological characteristics of reproductive stocks of Collichthys lucidus in Northern Hangzhou Bay[J]. Journal of Shanghai Ocean University, 2018, 27(5): 781-788. (  0) 0) |
| [12] |
Ricker W E. Linear regressions in fishery research[J]. J Fish Res Board Can, 1973, 30(3): 409-434. DOI:10.1139/f73-072
(  0) 0) |
| [13] |
Froese R. Cube law, condition factor and weight-length relationships: History, meta-analysis and recommendations[J]. J Appl Ichthyol, 2006, 22(4): 241-253. DOI:10.1111/j.1439-0426.2006.00805.x
(  0) 0) |
| [14] |
Morey G, Moranta J, Massutí E, et al. Weight-length relationships of littoral to lower slope fishes from the western Mediterranean[J]. Fish Res, 2003, 62(1): 89-96. DOI:10.1016/S0165-7836(02)00250-3
(  0) 0) |
| [15] |
牟秀霞, 张弛, 张崇良, 等. 黄渤海蓝点马鲛繁殖群体渔业生物学特征研究[J]. 中国水产科学, 2018, 25(6): 161-169. Mu X X, Zhang C, Zhang C L, et al. The fisheries biology of the spawning stock of Scomberomorus niphonius in the Bohai and Yellow Seas[J]. Journal of Fishery Sciences of China, 2018, 25(6): 161-169. (  0) 0) |
| [16] |
张国政, 李显森, 朱建成, 等. 黄海中南部小黄鱼当年幼鱼生长特征的研究[J]. 渔业科学进展, 2010, 31(3): 15-22. Zhang G Z, Li X S, Zhu J C, et al. The growth characteristics of small yellow croaker Larimichthys polyactis (Bleeker, 1987) under yearling in the central and southern Yellow Sea[J]. Marine Fisheries Research, 2010, 31(3): 15-22. (  0) 0) |
| [17] |
董婧, 王冲, 唐明芝, 等. 黄海区玉筋鱼体长和体重的关系[J]. 水产科学, 2004, 23(10): 9-11. Dong J, Wang C, Tang M Z, et al. Relationship between body length and body weight of Pacific sand lance in the Yellow Sea[J]. Fisheries Science, 2004, 23(10): 9-11. (  0) 0) |
| [18] |
朱立新, 侯刚, 梁振林. 基于贝叶斯方法的黄海北部鳀鱼体长与体重关系式参数估计[J]. 中国水产科学, 2015, 22(4): 757-769. Zhu L X, Hou G, Liang Z L. Parameter estimation of the weight-length relationship of Japanese anchovy in the north Yellow Sea using Bayesian methods[J]. Journal of Fishery Sciences of China, 2015, 22(4): 757-769. (  0) 0) |
| [19] |
Stergiou K I, Moutopoulos D K. A review of length-weight relationships of fishes from Greek marine waters[J]. Naga, 2001, 24(1/2): 23-39.
(  0) 0) |
| [20] |
林楠, 姜亚洲, 袁兴伟, 等. 象山港黄姑鱼的食物组成与摄食习性[J]. 中国水产科学, 2013, 20(6): 1284-1292. Lin N, Jiang Y Z, Yuan X W, et al. Diet compositionand feeding ecology of Nibea albiflora in Xiangshan Bay, east China Sea[J]. Journal of Fishery Sciences of China, 2013, 20(6): 1284-1292. (  0) 0) |
| [21] |
Munro A D, Scott A P, Lam T J. Reproductive seasonality in teleosts: Environmental influences[J]. Copeia, 1990(4): 1192.
(  0) 0) |
| [22] |
Lam T J. Environmental influences on gonadal activity in fish[J]. Fish Physiology, 1983, 9: 65-116.
(  0) 0) |
| [23] |
Hoar W S, Randall D J, Donaldson E M. Fish Physiology: Volume IX Reproduction (Part B: Behavior and Fertility Control)[M]. London: Academic Press, 1983.
(  0) 0) |
2. Shandong Hydrobios Resources Conservation and Management Center, Yantai 264003, China;
3. Field Observation and Research Station of Haizhou Bay Fishery Ecosystem, Ministry of Education, Qingdao 266003, China;
4. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China
 2021, Vol. 51
2021, Vol. 51


