浮游动物是海洋食物链中的重要环节,在生物泵过程中起关键作用,其丰度、分布、物种组成和群落结构的变化直接影响整个海洋生态系统的物质循环和能量流动[1-3]。浮游动物对环境变化较为敏感,其生物特性有助于揭示海流、水团及海洋气候变化规律,因而常被选作生物指示种用以海洋研究[4]。同时,浮游动物也是许多鱼类的重要饵食资源,对海区渔业资源的补充起重要作用[5]。因此,分析浮游动物丰度、群落结构、分布及其影响因素是了解相应海区生态系统功能的重要组成部分。
黄海是中国重要的陆架边缘海,其沿岸河流众多。鸭绿江、淮河等通过沿岸流把丰富的营养物质带入黄海,为海洋浮游生物提供良好的营养条件[6]。夏季,黄海的典型海洋现象就是黄海冷水团(YSCWM)的存在,它是位于黄海中部洼地的深层和底部的季节性水团(见图 1a),其底层温度通常低于10 ℃,具有低温高盐的特征[7-8],对黄海浮游动物的分布有重要的影响。目前学者们将黄海冷水团分为北黄海冷水团(N-YSCWM)和南黄海冷水团(S-YSCWM)[7-8]。冬季,黄海的典型海洋现象是黄海暖流(YSWC)的存在,它由济州岛西侧海域进入黄海,其主轴流经黄海海槽西侧(见图 1b)[7-8],带来大量高温高盐的外海水,伴随着海水而来的浮游动物丰富了黄海的浮游生物资源[4, 9]。关于黄海浮游动物的群落变化一直以来受到国内外海洋学者关注和研究[10-13],但大多数的报道都仅仅是围绕南黄海展开的,而对于整个黄海海域的报道较少,对黄海冷水团内浮游动物的报道也相对较少,本文将结合黄海冷水团以及黄海暖流进一步对整个黄海海域的浮游动物群落结构及环境影响因素展开分析。
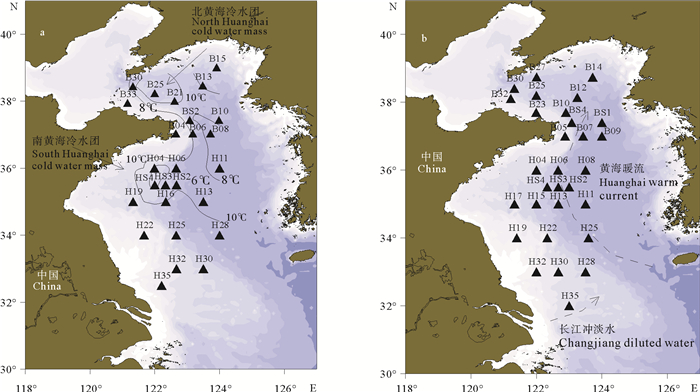
|
( a.夏季; b.冬季。图中黄海冷水团区域的绘制来源于本次夏季调查的CTD底层温度数据。a. Summer; b. Winter. The schematic diagram of YSCWM by the data of bottom temperature from CTD. ) 图 1 夏、冬季调查站位 Fig. 1 Investigated area and the sampling stations in summer and winter |
分别于2016年7月和2017年1月搭乘“东方红2号”海洋综合考察船在黄海(118.97 °E~123.99 °E,32.50 °N~39.31 °N)展开调查,两季共得到57个站位的样品,其中夏季27个站位(见图 1a),冬季30个站位(见图 1b),两季采样站位因实际情况有微小差别。样品的采集及处理方法等均按《海洋调查规范—海洋生物调查》(GB/T 12763:6—2007)进行。使用大型浮游生物网(网孔近似值505 μm,网口面积0.5 m2)由底到表垂直拖曳采集浮游动物,样品用5%福尔马林海水溶液固定,带回实验室后用体式显微镜镜检,使用电子天平称量其湿重生物量。采样过程中配备流量计(Hydro-bios)以测定滤水量。温度、盐度、深度、溶解氧、浊度等环境数据均由船载CTD(SeaBird911plus)测定。
1.2 数据处理浮游动物优势种用优势度(Y)来计算,当Y≥0.02时,定义该种为优势种[13]。
采用香农-威纳指数(Shannon-Wiener)(H′)表示物种多样性,采用均匀度指数(Pielou index)反映群落中各种类丰度的差异程度,采用丰富度指数(Margalef index)表示物种数目的多寡[14-15]。
使用Surfer v6.0软件绘制采样站点图及浮游动物丰度、生物量和香农-威纳指数的平面分布图。使用SPSS v17.0软件分析环境因子(温度、盐度、溶解氧、水深、叶绿素和深度)与浮游动物丰度、湿重生物量和香农-威纳指数的相关性。
将每站的丰度值以log10(x+1)标准化处理减少高丰度物种的权重,使用Primer v5.0软件建立Bray-Curtis相似性距离矩阵,进行Cluster聚类和多维标度排序分析(MDS)。
2 结果 2.1 水文环境 2.1.1 黄海夏季水文环境分布夏季的表层海水温度普遍较高,黄海中部的表层海水温度高于北黄海和黄海南部(见图 2a);黄海海域中的一些底层海水温度低于10 ℃,这个区域与黄海冷水团的分布范围基本一致,位于北黄海的是北黄海冷水团,位于南黄海的是南黄海冷水团。南黄海有两个低于10 ℃的中心,靠近山东沿岸的是青岛外海冷水团,另一个是仁川外海冷水团(见图 2b);黄海夏季表层和底层盐度的平面分布较为相近,均为黄海中部盐度高,近岸海域盐度低的特点;图 2e~h依次为拖网水深、溶解氧、水体浊度和叶绿素的平面分布。
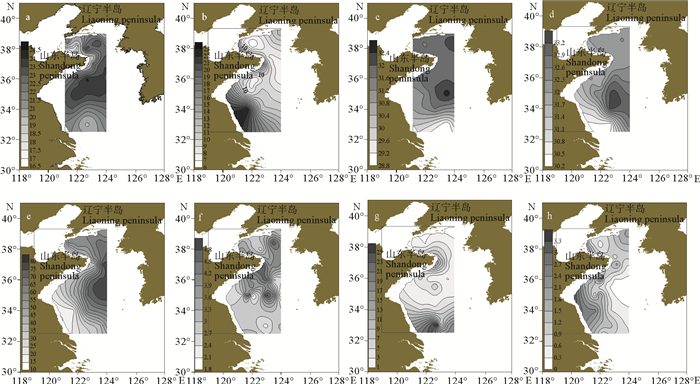
|
( a.表层温度; b.底层温度; c.表层盐度; d.底层盐度; e.水深; f.溶解氧; g.浊度; h.叶绿素。a. Surface temperature; b. Bottom temperature; c. Surface salinity; d. Bottom salinity; e. Depth; f. Dissolved oxygen g. Turbidity h. Chlorophyll. ) 图 2 夏季水文环境平面分布图 Fig. 2 Environmental factors horizontal distribution in Yellow sea in summer |
冬季黄海的海水温度整体上呈自南向北逐渐降低的趋势,黄海暖流流经海域的水温明显高(见图 3a、6b);北黄海和黄海中部的表底层盐度分布趋势相近,但在长江口近岸海域有明显的不同,其表层盐度的分布较为复杂,而底层盐度有明显的自近岸向远海盐度逐渐增加的趋势(见图 3c、d);溶解氧的平面分布与底层盐度有相反,有近岸高,远海低的趋势(见图 3e);图 3f为拖网深度的平面分布。表 2是按照群落划分的各组环境因子结果。
|
( a.表层温度; b.底层温度; c.表层盐度; d.底层盐度; e.溶解氧; f.水深。a. Surface temperature; b. Bottom temperature; c. Surface salinity; d. Bottom salinity; e. Dissolved oxygen; f. Depth. ) 图 3 冬季水文环境平面分布图 Fig. 3 Environmental factors horizontal distribution in Yellow sea in winter |
夏冬两季共鉴定出浮游动物97种。夏季有67种,其中原生动物1种,腔肠动物14种,栉水母1种,节肢动物32种,毛颚动物4种,浮游被囊类2种,浮游幼虫13种。浮游节肢动物占总种数的48%,包括介形类3种,糠虾类1种,端足类2种,磷虾类3种,十足类1种,涟虫类1种,桡足类21种。冬季有76种,其中原生动物1种,腔肠动物17种,节肢动物38种,毛颚动物5种,浮游被囊类2种,浮游幼虫13种。浮游节肢动物占总种数的50%,包括介形类2种,糠虾类2种,磷虾类5种,端足类2种,十足类2种,桡足类25种。桡足类是两个季节分类鉴定中最占优势的一大类群,后面依次是腔肠动物和浮游幼虫。
2.3 丰度和生物量 2.3.1 丰度夏季黄海浮游动物的丰度范围是10.2~523.9 ind/m3,其丰度高值区主要分布在北黄海冷水团区域,南黄海冷水团区域和黄海南部的长江口附近(见图 4a)。冬季浮游动物的丰度范围是4.4~687.8 ind/m3。北黄海近岸沿海,黄海中部以及34 °N以南近海的浮游动物丰度明显高于周边海域(见图 4b)。冬季的平均丰度略低于夏季。
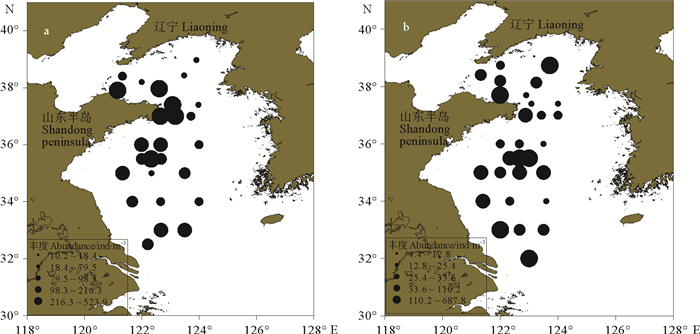
|
( a.夏季;b.冬季。a. Summer; b. Winter. ) 图 4 调查海域浮游动物丰度的平面分布 Fig. 4 The horizontal distribution of zooplankton abundance of investigated sea area |
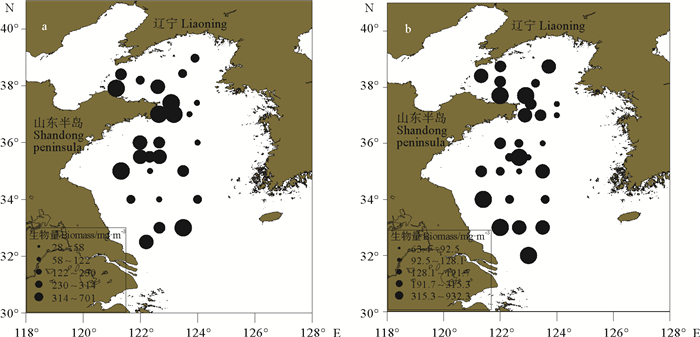
夏季黄海浮游动物的湿重生物量范围是28.6~700.5 mg/m3,其分布趋势与夏季浮游动物的丰度平面分布基本一致(见图 5a)。冬季的湿重生物量范围是63.4~932.3 mg/m3,其分布趋势为近海的生物量普遍高于外海,黄海中部(123 °E~124 °E,35 °N~36 °N)形成了生物量的高值区(见图 5b)。
|
( a.夏季;b.冬季。a. Summer; b. Winter. ) 图 5 调查海域浮游动物生物量的平面分布 Fig. 5 The horizontal distribution of zooplankton biomass of investigated sea area |
夏季黄海浮游动物的Cluster聚类与MDS分析结果如图 6a所示。其中,二维MDS分压力系数(Stress)分别为0.18,说明MDS图形具有一定的可信度。根据聚类分析的结果,结合地理分布,在45%的群落相似度下,将夏季的27个站位分为4个群落(见图 4a),Group1中站点均分布于北黄海的东部及北部,占据了北黄海的大部分区域,该区域有浊度低,溶解氧和叶绿素含量最高的环境特点(见图 2);Group2中站点多位于北黄海近岸及黄海中部海域,该区域底层平均温度为10 ℃(见图 5b),大部分站位都在南黄海冷水团影响区域;Group4中站点都分布在黄海南部,其底层海水温度和浊度为全海区最高,盐度和叶绿素含量最低;Group3处于Group4和Group2之间。

|
图 6 Cluster聚类和MDS多维定标结果及地理信息图 Fig. 6 Results of cluster and MDS analysis and geographic information map |
冬季黄海浮游动物的Cluster聚类与MDS分析结果如图 6b所示。其中,二维MDS分压力系数(Stress)为0.19,说明MDS图形具有一定的可信度。但考虑到实际地理因素的影响,仅仅按照聚类的结果划分显然不合理。因此,结合已有以往的冬季调查,在一定的群落相似度下,将冬季的30个站位分为以下3个群落。Group1群落位于北黄海,该群落的大多数站位群落相似度在40%以上。Group2群落位于南黄海,除了黄海中部35.5°N上的站位外,其它站位的群落相似度也在40%以上。位于长江口附近的H35站位单独构成一个群落(Group3)。
2.5 优势种调查海区夏冬两季共有8个优势种类,两季的优势种相差较大,各群落之间的优势种差异也较大。夏季共有7个优势种类(见表 1),均为黄海的常见优势种,分别为夜光虫(Noctiluca scintillans)、中华哲水蚤(C. sinicus)、小拟哲水蚤(Paracalanus parvus)、拟长腹剑水蚤(Oithona similis)、桡足幼体(Copepoda larva)、强壮箭虫(Sagitta crassa)和细足法虫戎(Parathemisto gracilipes)。Group1中有5个优势种类,其中最占优势的是拟长腹剑水蚤,其他几个优势种的优势度比较接近;Group2中优势度最高的是中华哲水蚤,为0.462;细足法虫戎是该群落中特有的优势种;Group3和Group4中占绝对优势的是中华哲水蚤,优势度分别为0.758和0.689。
|
|
表 1 夏季优势种及其丰度和优势度 Table 1 Dominant species and their dominance and abundance in summer |
冬季调查海域共有5个优势种类(见表 2),分别为夜光虫,中华哲水蚤,异体住囊虫(Oikopleura dioica)和强壮箭虫。Group1群落中最占优势的是中华哲水蚤,其优势度达0.472,其次是强壮箭虫;Group2群落中优势度最高的也是中华哲水蚤,其优势度高达0.599;Group3仅包含H35站位,该站位夜光虫的丰度最高,为645.7 ind/m3。
|
|
表 2 冬季优势种及其丰度和优势度 Table 2 Dominant species and their dominance and abundance in winter |
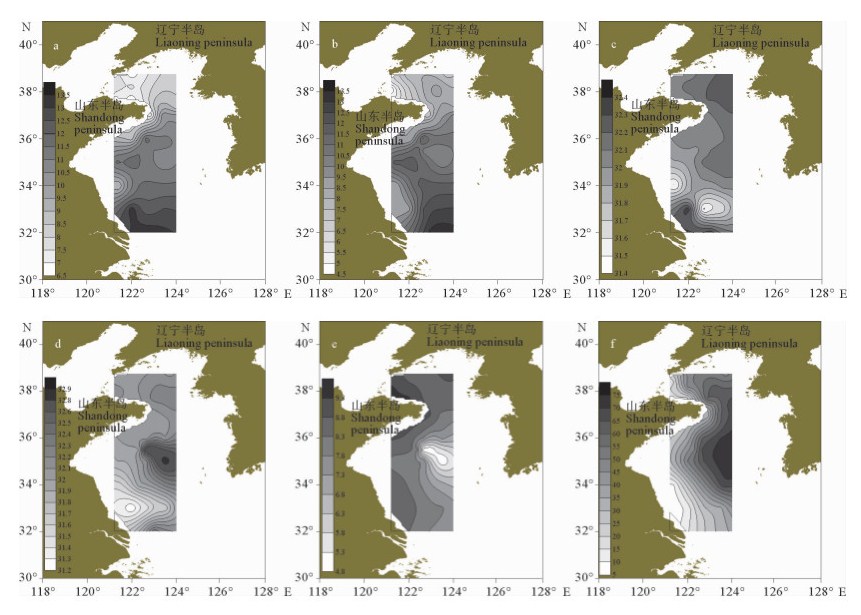
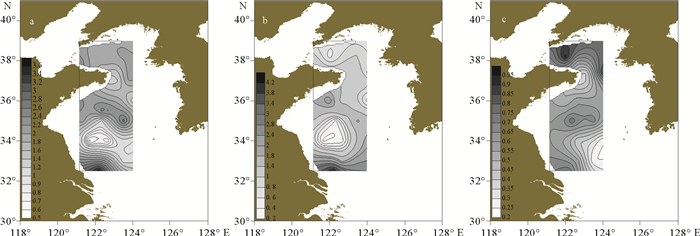
夏季黄海浮游动物的香农-威纳指数的高值区主要位于黄海南部长江口附近和黄海中部35 °N~36 °N之间(见图 7a),最高值为2.68,低值区与Group3的地理位置重合。调查海区丰富度指数的高值区主要位于黄海南部,最高值为4.19,高值区与Group4的地理位置基本一致(见图 7b)。均匀度指数的分布呈北黄海高于南黄海的趋势,北黄海的北部数值较高,与Group1的地理位置大致相同(见图 7c、表 3)。
|
( a.香农-威纳指数; b.丰富度指数; c.均匀度指数。a. Shannon-Wiener; b. Pielou index; c. Margalef index. ) 图 7 调查海域夏季生物多样性指数的水平分布 Fig. 7 The horizontal distribution of zooplankton biodiversity of investigated sea area in summer |
|
|
表 3 夏季各群落的生物多样性 Table 3 Biodiversity indexes in each group in summer |
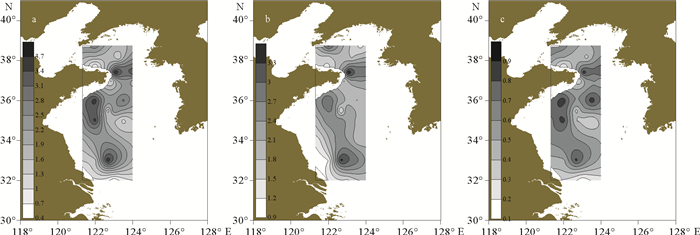
冬季黄海浮游动物的香农-威纳指数的高值区主要位于荣成市近海和黄海中部(见图 8a),其最高值是黄海暖流主轴区的BS4,高达3.77。调查海域的丰富度指数与香农-威纳指数的平面分布较为相近(见图 8b)。Group1与Group2的生物多样性整体上较为接近,H35的三项多样性指数最低(见图 8c、表 4)。
|
( a.香农-威纳指数; b.丰富度指数; c.均匀度指数。a. Shannon-Wiener; b. Pielou index; c. Margalef index. ) 图 8 调查海域冬季的生物多样性指数水平分布 Fig. 8 The horizontal distribution of zooplankton biodiversity of investigated sea area in winter |
|
|
表 4 冬季各群落的生物多样性 Table 4 Biodiversity indexes in each group in winter |
夏季,环境因子对浮游动物群落结构的影响较为复杂(见表 5),在Group1中,浮游动物的香农-威纳指数与浊度显著正相关,与表层温度显著负相关。在Group2中,浮游动物的湿重生物量与叶绿素含量呈极显著正相关,与底层温度呈显著正相关,与表层温度、底层盐度和水深呈极显著负相关;浮游动物的丰度与表层温度呈极显著负相关,与深度呈显著负相关。在Group3中,浮游动物的均匀度指数与表层温度呈极显著正相关,与海水的浊度显著负相关;生物量与底层温度呈显著正相关。
|
|
表 5 夏季各群落环境因子对浮游动物的影响 Table 5 Correlation between zooplankton and environmental factors in each group in summer |
冬季,对浮游动物的群落结构的影响主要环境因素是采样水深,溶解氧和底层海水的温度三个方面(见表 6)。在Group1群落,浮游动物的生物量与底层海水的温度与采样深度呈显著负相关,与海水中的溶解氧呈显著正相关;浮游动物的丰度与溶解氧呈显著正相关。在Group2群落中,浮游动物的丰度与采样深度呈显著负相关,与海水中的溶解氧呈极显著负相关。
|
|
表 6 冬季各群落环境因子对浮游动物的影响 Table 6 Correlation between zooplankton and environmental factors in each group in winter |
夏冬两季共鉴定出浮游动物97种,与近些年对黄海夏季的大型网浮游动物的报道相近[16-17],略低于使用中型网(网孔近似值167 μm)和WP2型网(网孔近似值200 μm)的调查报道[6, 18],原因是大型网的网孔较大,一些小型浮游动物极有可能在拖曳的过程中漏掉。夏季与冬季浮游动物种类差别较大,且夏季浮游动物的种类数明显低于冬季,原因可能是夏季黄海冷水团处于强盛期,其他海流相对较弱,很难入侵黄海,因而无法带入更多种类[16],而随着冬季黄海暖流的输入,丰富了黄海浮游动物种类资源。
本次调查中夏季的浮游动物平均丰度为118.0 ind/m3,平均生物量为203.8 mg/m3;冬季的平均丰度为77.7 ind/m3,平均生物量为211.8 mg/m3。本次调查的生物量结果与近些年的浮游动物生物量相近[16]。夏季,分布在黄海冷水团海域的浮游动物丰度和生物量普遍较高,这可能是黄海冷水团的温盐比较稳定,为大部分浮游动物提供了稳定的生境,并且冷水团的低温环境使其能躲避高温伤害。冬季浮游动物的丰度和生物量受黄海暖流的影响较大,黄海暖流自济州岛沿着黄海海槽西侧北上,带来大量高温、高盐的外海水,其流经的主轴与35°N的交汇处是冬季黄海丰度和生物量的高值区,这与时永强报道一致[19]。长江口附近可能是受到长江冲淡水的影响,水体混合较好,温度较为适中,并有沿岸流带来的较为丰富的营养物质,因而该海域的丰度和生物量都比较高[20]。
夏季,调查海域的主要优势种为中华哲水蚤和强壮箭虫。研究表明10~20 ℃是中华哲水蚤的最适生长发育区间[21],夏季黄海表层海水的温度普遍高于20 ℃,不利于其发育和繁殖,因此中华哲水蚤多分布在能够提供低温保护的黄海冷水团和减轻高温伤害的长江口附近[22]。冬季中华哲水蚤的高值区分布在黄海暖流的主轴区,黄海暖流高温高盐的特征更加适合其生长代谢。强壮箭虫是大型网调查中常见的优势种,其出现率为100%,研究表明10~15 ℃是强壮箭虫的最适温度区间,其丰度高值区基本位于夏季黄海冷水团海域和冬季黄海暖流流经地主轴区,原因可能是冷水团和黄海暖流为其提供了适宜的温度环境[23-24]。
夏季与冬季的优势种差异较大,夏季的优势种多为桡足类,除中华哲水蚤外,还有小拟哲水蚤和拟长腹剑水蚤,以往关于这两种优势种多见于中型网的调查报道中[25-26]。由于这两种水蚤的体型较小,有可能在拖曳的过程中漏掉,其实际丰度可能比本次调查高。因此,更适合使用中型网开展此类浮游动物的调查。冬季的优势种除中华哲水蚤占绝对优势外,还有中华假磷虾、长尾类幼虫和异体住囊虫等,在大型网调查中都比较常见[27]。
3.2 群落划分与环境因子对浮游动物的影响调查海域夏季的群落划分结果与很多学者的划分较为相近。郑执中[1]将黄海的浮游动物划分为山东沿岸群落,苏北沿岸群落,黄海中部群落和长江口外围群落。左涛等[28]将南黄海及其与东海交汇水域划分为南黄海沿岸群落,黄海中部群落,黄东海交汇水群落和东海近岸混合水群落。本次将夏季黄海浮游动物聚类组群Group1~4分别命名为:北黄海群落,山东近岸群落,黄海中部群落和长江口外围群落。
北黄海群落(Group1)均分布于北黄海,并且处于北黄海地北部和东部。相关性分析结果表明表层海水温度与浮游动物的香农-威纳指数呈显著负相关,而夏季表层海水的温度普遍较高,高温不利于多数浮游动物的生理代谢,因而北黄海群落的香农-威纳指数较低。这与卜亚谦等[29]调查结果一致。山东沿岸群落(Group2)的基本上是夏季北黄海冷水团和青岛外海冷水团位置的组合(见图 1a)。表层温度、底层温度、底层盐度等都对该群落有一定的影响。黄海冷水团低温高盐的特点给多数浮游动物提供低温保护,避免了表层高温伤害,因而该群落的丰度和生物量整体较高[16]。7月下旬的冷水团已经较为强盛,其他海流很难入侵冷水团海域,许多邻近海域的浮游动物无法入内,其生物多样性明显低于该海域冬季浮游动物的生物多样性,这表明黄海冷水团海域中的浮游动物有一定保守性,这与王晓等[16]报道相近。黄海中部群落(Group3)多分布在34 °N和124 °E附近,中华哲水蚤、强壮箭虫等多种优势种在该海域的分布较少。该海域只有少部分在黄海冷水团的势力范围,其生物量、丰度和多样性皆为全海区最低。这与李雨苑等[18]调查结果一致。长江口外围群落(Group4)均位于长江口附近。长江口冲淡水流带来丰富的营养物质,有利于浮游动植物的生长发育;并且该海域水体混合度高,可以减轻夏季表层海水温度过高带给部分浮游动物的伤害[30];该群落距离东海的交汇处较近,常有水体交换带来的浮游动物种类。因此,该海域浮游动物的丰度、生物量以及生物多样性较高。
冬季黄海浮游动物的MDS分压力系数(Stress)分为0.19,表明本次聚类结果具有一定的可信度。许多站位虽然被划分到一个群落里,但其实际位置相距过远,所以仅仅使用统计分析的结果缺少实际意义。因此,在结合了实际地理位置和群落相似度的基础上,对黄海浮游动物群落进行了重新划分。将Group1命名为北黄海群落;Group2命名为南黄海群落;Group3虽然仅有H35站位,但该海域受长江口的影响较大,命名为长江口群落,其香农-威纳指数、丰富度指数和均匀度指数均为全海域最低。南黄海群落与长江口群落的划分与Shi Y Q等[11]冬季黄海浮游动物群落划分的结果相吻合。黄海暖流主轴流经的海域的浮游动物多样性、均匀度和丰富度都显著高于周边海域,并且在许多站位中都有暖水种的记录,如肥胖箭虫、平滑针刺水蚤等。这些暖水种与王荣等[4]的调查结果相近,极有可能是黄海暖流强迫输运的结果[3]。
4 结语黄海海域的浮游动物群落结构存在季节差异,夏季的优势种主要为中华哲水蚤和强壮箭虫,浮游动物的分布受黄海冷水团的影响较大,受冷水团影响范围内的浮游动物多样性较高,生物量和丰度也较高,且群落相似度与其它海域的浮游动物有明显的区分。冬季,黄海暖流丰富了黄海的浮游生物资源,黄海暖流流经海域的生物多样性更高。除黄海冷水团和黄海暖流外,黄海南部浮游动物受长江口冲淡水的影响也较大,该区域内的浮游动物丰度和生物量也较高。在本次分析中,温度和盐度是浮游动物相关性最大的环境因素,无论黄海冷水团、黄海暖流,还是长江口冲淡水,都会对黄海水文环境,尤其是温度、盐度造成一定的影响,进而对黄海的浮游动物群落结构造成改变。
| [1] |
郑执中. 黄海和东海西部浮游动物羣落的结构及其季节变化[J]. 海洋与湖沼, 1965(3): 199-204. Zheng Z Z. The structure of zooplankton communities and its seasonal variation in the Yellow sea and the western east China sea[J]. Oceanologia et Limnologia Sinica, 1965(3): 199-204. (  0) 0) |
| [2] |
Sun S, Huo Y Z, Yang B, 20 10. Zooplankton functional groups on the continental shelf of the yellow sea[J]. Deep Sea Res, Part Ⅱ, 57(11-12): 1006-1016.
(  0) 0) |
| [3] |
王亮, 李超伦, 于非. 冬季南黄海浮游动物群落结构及其对黄海暖流的指示[J]. 海洋与湖沼, 2013, 44(4): 853-859. Wang L, Li C L, Yu F. Zooplankton community structure in the South Yellow sea in winter and indication of the Yellow Sea Warm Current[J]. Oceanologia et Limnologia Sinica, 2013, 44(4): 853-859. (  0) 0) |
| [4] |
王荣, 高尚武, 王克, 等. 冬季黄海暖流的浮游动物指示[J]. 水产学报, 2003(S1): 39-48. Wang R, Gao S W, Wang K, et al. Zooplankton indication of the Yellow Sea warm current in winter[J]. Journal of Fisheries of China, 2003(S1): 39-48. (  0) 0) |
| [5] |
左涛, 王荣, 高尚武, 等. 南黄海鳀鱼(Engraulis japonicus)产卵场小型桡足类的数量分布[J]. 海洋与湖沼, 2006(4): 330-336. Zuo T, Wang R, Gao S W, et al. Abundance of small-sized copepods in anchovy Engraulis japonicus spawning ground in southern Yellow sea[J]. Oceanologia et Limnologia Sinica, 2006(4): 330-336. DOI:10.3321/j.issn:0029-814X.2006.04.007 (  0) 0) |
| [6] |
陈学超, 朱丽岩, 黄瑛, 等. 南黄海浮游动物群落结构研究[J]. 海洋科学, 2017, 41(10): 41-49. Chen X C, Zhu L Y, Huang Y, et al. Community structure of the zooplankton in the Southern Yellow Sea[J]. Marine Sciences, 2017, 41(10): 41-49. DOI:10.11759/hykx20160428005 (  0) 0) |
| [7] |
李昂.黄海冷水团年际变化研究[D].青岛: 中国科学院研究生院(海洋研究所), 2016. Li A. The Study on Interannual Variability of Yellow Sea Cold Water Mass[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2016. (  0) 0) |
| [8] |
魏传杰.南黄海水文环境季节变化与湍流混合研究[D].青岛: 中国科学院大学(中国科学院海洋研究所), 2018. Wei C J. Seasonal Variability of Hydrological Properties and Turbulent Mixing in Southern Yellow Sea[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2018. (  0) 0) |
| [9] |
刁新源.黄海暖流、黄海冷水团及其春季演变过程研究[D].青岛: 中国科学院研究生院(海洋研究所), 2015. Diao X Y. The study of Yellow Sea Warm Current, Yellow Sea Cold Water Mass and Their Evolution Process in Spring[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2015. (  0) 0) |
| [10] |
邹艺伟, 杨青, 李全宝, 等. 北黄海浮游动物群落结构及年间比较[J]. 海洋环境科学, 2013, 32(5): 683-687. Zou Y W, Yang Q, LI Q B, et al. Community structure and variation of zooplankton in the Northern Yellow Sea[J]. Marine Environmental Science, 2013, 32(5): 683-687. (  0) 0) |
| [11] |
Shi Y Q, Zuo T, Yuan W, et al. Spatial variation in zooplankton communities in relation to key environmental factors in the Yellow Sea and East China Sea during winter[J]. Continental Shelf Research, 2018, 170: 33-41. DOI:10.1016/j.csr.2018.10.004
(  0) 0) |
| [12] |
Tsi-Chung C. The structure of zooplankton communities and its seasonal variation in the Yellow Sea and in the western east China Sea[J]. Oceanologia et Limnologia Sinica, 1965, 7(3): 199-204.
(  0) 0) |
| [13] |
Clarke K, Warwick R. Change in marine communities: An approach to statistical analysis and interpretation[M]. Plymouth: PRIMER-E Ltd, 2001.
(  0) 0) |
| [14] |
Shannon C E, Weaner W. The Mathematical Theory of Communication[M]. Urbana IL: The University of Illinois Press, 1949: 125.
(  0) 0) |
| [15] |
Field J G, Clarke K R, Warwick R M. A practical strategy for analysing multispecies distribution patterns[J]. Marine Ecology Progress Series, 1982, 8(2): 37-52.
(  0) 0) |
| [16] |
王晓, 王宗灵, 蒲新明, 等. 夏季南黄海浮游动物分布及其影响因素分析[J]. 海洋学报(中文版), 2013, 35(5): 147-155. Wang X, Wang Z L, Pu X M, et al. Analysis of the distribution of zooplankton in the Southern Yellow Sea in summer and its influencing factors[J]. ACTA Oceanologica Sinica, 2013, 35(5): 147-155. DOI:10.3969/j.issn.0253-4193.2013.05.016 (  0) 0) |
| [17] |
贺雨涛, 刘光兴, 房静, 等. 2008年夏季南黄海浮游动物群落特征[J]. 海洋环境科学, 2019, 38(4): 494-502. He Y T, Liu G X, Fang J, et al. Community characteristics of zooplankton in the South Yellow Sea in summer, 2008[J]. Marine Environmental Science, 2019, 38(4): 494-502. (  0) 0) |
| [18] |
李雨苑, 刘光兴, 陈洪举. 秋季黄海WP2型网采浮游动物的群落特征[J]. 中国海洋大学学报(自然科学版), 2015, 45(7): 46-52. Li Y Y, Liu G X, Chen H J. Community characteristics of zooplankton sampled with WP2 net in Yellow Sea in autumn[J]. Periodical of Ocean University of China, 2015, 45(7): 46-52. (  0) 0) |
| [19] |
时永强.黄海浮游动物功能群年际变化研究[D].青岛: 中国科学院大学(中国科学院海洋研究所), 2015. Shi Y Q. Interannual Changes of Zooplankton Functional Groups in the Yellow Sea[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2015. (  0) 0) |
| [20] |
王晓东, 李超伦. 基于1998-2011年调查数据的长江口海域浮游动物群落划分[J]. 海洋科学, 2018, 42(8): 38-47. Wang X D, Li C L. Classification of zooplankton communities in the adjacent waters of the Chang jiang River estuary based on data from 1998 to 2011[J]. Haiyang Kexue, 2018, 42(8): 38-47. (  0) 0) |
| [21] |
曹文清, 林元烧, 杨青, 等. 我国中华哲水蚤生物学研究进展[J]. 厦门大学学报(自然科学版), 2006, 45(2): 54-61. Cao W Q, Lin Y S, Yang Q, et al. Advanced in biology of Calanus sinicus in China[J]. Journal of Xiamen University (Natural Science), 2006, 45(2): 54-61. (  0) 0) |
| [22] |
陈峻峰, 左涛, 王秀霞. 南黄海浮游动物主要种类数量分布年间比较[J]. 海洋学报(中文版), 2013, 35(6): 195-203. Chen J F, Zuo T, Wang X X. Interannual abundance variations of the dominant zooplankton species in the south Yellow sea[J]. ACTA Oceanologica Sinica, 2013, 35(6): 195-203. DOI:10.3969/j.issn.0253-4193.2013.06.021 (  0) 0) |
| [23] |
刘青, 朱海燕, 刘芳, 等. 温度、盐度对强壮箭虫耗氧率和窒息点的影响[J]. 应用生态学报, 2011, 22(11): 3081-3086. Liu Q, Zhu H Y, Liu F, et al. Effects of temperature and salinity on oxygen consumption rate and asphyxiation point of Sagitta crassa[J]. Chinese Journal of Applied Ecology, 2011, 22(11): 3081-3086. (  0) 0) |
| [24] |
刘晓慧, 薛莹, 张崇良, 等. 黄河口及其邻近水域强壮箭虫密度的时空分布及其与环境因子的关系[J]. 海洋学报, 2017, 39(6): 74-83. Liu X H, Xue Y, Zhang C L, et al. Spatio-temporal distribution of density of Sagitta crassa and its relationship with environment factors in the Yellow River Estuary and its adjacent water[J]. Haiyang Xuebao, 2017, 39(6): 74-83. DOI:10.3969/j.issn.0253-4193.2017.06.008 (  0) 0) |
| [25] |
王荣, 张鸿雁, 王克, 等. 小型桡足类在海洋生态系统中的功能作用[J]. 海洋与湖沼, 2002(5): 453-460. Wang R, Zhang H Y, Wang K, et al. Function performed by small copepods in marine ecosystem[J]. Oceanologia et Limnologia Sinica, 2002(5): 453-460. DOI:10.3321/j.issn:0029-814X.2002.05.001 (  0) 0) |
| [26] |
Turner J T. The importance of small planktonic copepods and their roles in pelagic marine food webs[J]. Zool Stud, 2004, 43(2): 255-266.
(  0) 0) |
| [27] |
王晓, 姜美洁, 刘萍, 等. 秋季南黄海浮游动物分布及其影响因素[J]. 海洋学报, 2016, 38(10): 125-134. Wang X, Jiang M J, Liu P, et al. Analysis of the distribution of zooplankton in the Southern Yellow Sea in autumn and its influencing factors[J]. Acta Oceanologica Sinica, 2016, 38(10): 125-134. DOI:10.3969/j.issn.0253-4193.2016.10.013 (  0) 0) |
| [28] |
左涛, 王荣, 陈亚瞿, 等. 春季和秋季东、黄海陆架区大型网采浮游动物群落划分[J]. 生态学报, 2005(7): 1531-1540. Zuo T, Wang R, Chen Y Q, et al. Net macro-zooplankton community classification on the shelf area of the East China Sea and the Yellow Sea in spring and autumn[J]. Acta Ecologica Sinica, 2005(7): 1531-1540. DOI:10.3321/j.issn:1000-0933.2005.07.001 (  0) 0) |
| [29] |
卜亚谦, 朱丽岩, 陈香, 等. 夏冬季渤海、北黄海浮游动物群落结构及其与环境因子的关系[J]. 中国海洋大学学报(自然科学版), 2019, 49(2): 59-66. Bu Y Q, Zhu L Y, Chen X, et al. Community structure of zooplankton and its relationship with environmental factors in the Bohai and the north Huanghai sea in summer and winter[J]. Periodical of Ocean University of China, 2019, 49(2): 59-66. (  0) 0) |
| [30] |
汤新武, 蔡德所, 陈求稳, 等. 三峡工程三期蓄水初期长江口水域春季浮游动物群落特征及其与环境的关系[J]. 环境科学学报, 2015, 35(4): 1082-1088. Tang X W, Cai D S, Chen Q W, et al. Spring character of zooplankton community and its relation to environmental factors in Yangtze estuary right after the third-stage impoundment of Three Gorges Reservoir[J]. Acta Scientiae Circumstantiae, 2015, 35(4): 1082-1088. (  0) 0) |
 2020, Vol. 50
2020, Vol. 50


