含铬废水是全球公认的严重危害人类生存环境的有害物质之一,其来源广泛,常见于电镀、制革、冶金、化工和印染的工业生产过程中[1-4],与铬化合物有关的产品在我国工农业生产所占比例约为15%,现阶段每年约排放几十吨的铬废料[5],未经处理的含铬废物进入土壤和水体会造成严重的污染。其中,以CrO42-、Cr2O72-、HCrO4-等阴离子形式存在的六价铬(Cr(Ⅵ))在铬污染中危害最大,易被人体吸收并积蓄[6],是一种严重毒害人体健康的化学物质。所以,研究六价铬废水的处理对解决水环境的污染问题具有重要的意义。
目前处理六价铬废水的主要方法有还原沉淀法[7-9]、膜法[10-13]、吸附法[14-19]、电化学法[20-21]、生物法[22-27]等。磁性纳米Fe3O4颗粒(Magnetic nanoparticles, MNPs)作为吸附剂具有比表面积大、表面活性位点多、高吸附容量等优点,而且通过简单的外加磁铁吸引就可以实现从水中的快速分离,在去除染料和重金属方面具有很好的效果[28-32]。当前将纳米Fe3O4用于六价铬的去除主要有三种应用形式:一是借助其磁性分离的功能作为其他吸附剂的载体,二是单独作为吸附剂去除六价铬,三是通过引入功能基团提高吸附性能,将修饰之后的纳米Fe3O4颗粒用于六价铬的去除研究[33-38]。巯基基团作为修饰剂对纳米Fe3O4颗粒进行改性,可以改善材料的吸附性能。由于形成Cr(Ⅵ)硫酯的平衡常数比Cr(Ⅵ)含氧酯的高几个数量级[39],当Fe3O4表面涂有含巯基的化合物时,材料对Cr(Ⅵ)的去除效果将增强。3-巯基丙酸中的羧基对Fe具有高亲和力,可以对纳米Fe3O4颗粒进行修饰;同时,巯基保持游离,在去除反应中可以与Cr(Ⅵ)络合[40]。为了实现纳米Fe3O4颗粒制备过程的简单环保,利用植物提取物中的活性成分如酚类、黄酮类作还原剂及分散剂成为一种新兴的制备方法[41]。但是,现阶段将植物提取物绿色合成的磁性纳米颗粒用于Cr(Ⅵ)污染去除的研究鲜少报道[41-42]。
白蜡树(Fraxinus chinensis Roxb)是一种落叶乔木,多为栽培,对土壤的适应性很强,植株萌发力强生长迅速,广泛种植于亚欧大陆及美洲地区,其树皮可做药用。本课题组在前期研究中,已测得白蜡树叶片提取物具有较高的抗氧化能力(0.047 Fe2+mmol/L),总酚含量(TPC)为(83.3±5.1)GAE CV/g DW[35],证明其有较高的还原化合物的能力,有利于还原金属离子制备磁性纳米颗粒。
本研究采用白蜡树叶片提取物合成磁性纳米颗粒(Phytogenic magnetic nanoparticles, PMNPs),并使用3-巯基丙酸(3-MPA)对制备的纳米颗粒进行官能化修饰,对其进行表征,将改性后的植物磁性纳米颗粒(3-MPA@PMNPs)应用于去除水中六价铬,对利用植物提取物绿色合成的磁性纳米颗粒去除水中六价铬效果进行研究。
1 材料与方法 1.1 试剂与仪器七水合硫酸亚铁,FeSO4·7H2O,国药集团化学试剂有限公司;六水合三氯化铁,FeCl3·6H2O,天津恒兴化学试剂制造有限公司;3-巯基丙酸,HSCH2CH2CO2H,上海麦克林生化试剂有限公司;没食子酸,C7H6O5,国药集团化学试剂有限公司;重铬酸钾,K2CrO7,国药集团化学试剂有限公司;二苯碳酰二肼,C13H14N4O,山东绿英化工科技有限公司;试验所用试剂为分析纯;白蜡树树叶采摘自中国海洋大学崂山校区;试验过程全程使用去离子水。
Tensor27型傅里叶红外光谱仪,德国布鲁克有限公司;XRD-6100型X射线衍射仪,日本电子株式会社;JSM-6610LV型扫描电子显微镜,日本电子株式会社;ASAP2020型比表面积和孔径分布仪,美国麦克默瑞提克仪器有限公司;ESCALAB250型X射线光电子能谱分析,德国赛默飞世尔公司;VSM600型振动样品磁强计,美国Lake Shore公司;UV-2800AH型紫外可见分光光度计,尤尼柯(上海)仪器有限公司。
1.2 白蜡树叶片提取液的制备白蜡树树叶采摘自中国海洋大学崂山校区内,制备植物提取物的方法参照Imran、Manquián-Cerda、Smuleac等[43-45]在文献中介绍的方法。将采摘的新鲜叶片用去离子水彻底清洗,除去灰尘等杂质,然后在阳光下自然风干。干净的白蜡树叶片在85 ℃干燥箱中烘干6 h进一步降低水分含量,将完全干燥的叶片经过切碎研磨过筛(2 mm),收集粉末并储存备用。
称取10 g白蜡树叶粉末于100 mL三角瓶中,再加入80 mL去离子水,搅拌均匀后在80 ℃下加热至少90 min,然后将提取液进行真空抽滤,得到白蜡树叶片提取液,并在4 ℃环境下储存备用。
1.3 PMNPs的制备分别称取7.321 g FeSO4·7H2O和7.321 g FeCl3·6H2O于100 mL三角瓶中,加入50 mL去离子水,得到金属离子溶液(Fe2+:Fe3+=1.028:1)。将白蜡树叶片提取液和配置的金属离子溶液按照1:1的体积比例进行混合,在80 ℃下磁力搅拌60 min。在搅拌过程中,反应体系中逐滴滴加0.1 mol/L的NaOH溶液,调节pH至12。混合物颜色从淡绿色完全变为黑色,即反应完成。将反应制得的磁性纳米颗粒悬浊液进行离心、真空抽滤,用乙醇溶液将获得的黑色沉淀洗涤两次,得到的产物再次进行真空抽滤,在80 ℃下真空干燥20 min,将制得的PMNPs保存备用。
1.4 3-MPA@PMNPs的制备称取5 g PMNP粉末和2.35 g 3-MPA于100 mL锥形瓶中,加入50 mL去离子水,使用NaOH调节pH到8,在室温下超声处理12 h。通过真空抽滤收集超声处理的悬浊液,用乙醇溶液洗涤两次,然后再次真空抽滤,收集的黑色颗粒在80 ℃下干燥20 min,保存得到的3-MPA@PMNPs,用于水中六价铬去除试验。
1.5 六价铬的去除试验以重铬酸钾为去除对象,以一定量的3-MPA@PMNPs去除一定初始浓度的重铬酸钾溶液。将反应容器放置于摇床中振荡,根据反应时间,使用磁铁吸引悬浮的3-MPA@PMNPs,再进行取样,用二苯碳酰二肼分光光度计法测定六价铬浓度。
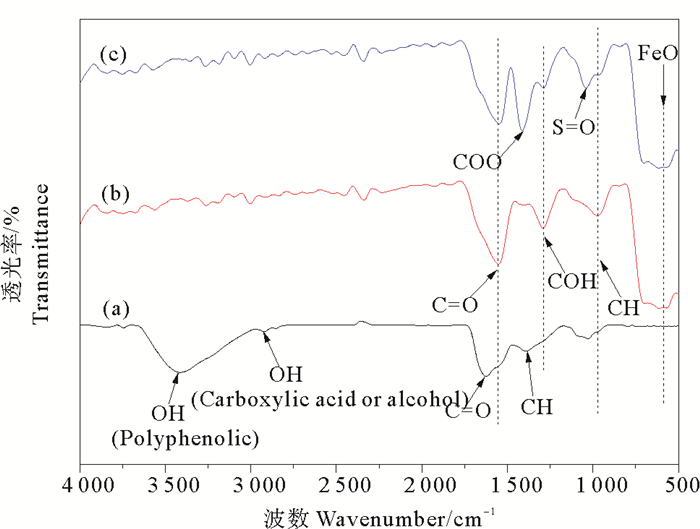
2 结果与讨论 2.1 材料的表征 2.1.1 FTIR分析白蜡树叶片提取物、未改性的植物磁性纳米颗粒PMNPs和经3-巯基丙酸改性后的植物磁性纳米颗粒3-MPA@PMNPs的FTIR谱图如图 1所示。图 1(a)显示了在波长4 000~500 cm-1范围内白蜡树叶片提取物的FTIR谱图,3 411 cm-1处的吸收峰,是来自多酚类物质中的OH伸缩振动[43],波长2 922 cm-1处的吸收峰是羧酸或乙醇中的OH的伸缩振动,在1 626 cm-1处的吸收是CO的伸缩振动。羟基、羰基等基团的吸收峰进一步证明了白蜡树叶片提取物中多酚类、糖类等物质的存在。图 1(b)PMNPs红外光谱图中,在1 550 cm-1处的谱带归属于白蜡树提取物中醛酮类生物成分的CO键,在1 292 cm-1附近的吸收峰,归因于C—O—H的伸展谱带[44],在974 cm-1处的吸收峰来源于CH的收缩振动。613、582、568 cm-1附近吸收峰都可归因于Fe-O的特征吸收谱带,说明成功制备了磁性氧化铁Fe3O4[45]。与PMNPs相比,3-MPA@PMNPs的在2 668和2 570 cm-1附近并未出现文献所说的3-巯基丙酸的S-H特征光谱[46],而在1 413和1 039 cm-1附近出现两处新的吸收峰,分别是属于羧基COO-的对称伸缩振动[47]和亚硫酰基SO的振动吸收峰。表明在表面修饰的过程中,3-巯基丙酸与PMNPs是通过羧基COOH结合,且原本的SH。在改性反应中被氧化为磺酸基被结合在3-MPA@PMNPs表面[40]。材料的FTIR光谱图证明了白蜡树叶片提取物中的生物成分在纳米Fe3O4颗粒的形成过程中发挥了作用,使用3-巯基丙酸成功对其进行了表面官能化修饰。
|
((a)白蜡树叶片提取物, (b)PMNPs, (c)3-MPA@PMNPs。(a) Fraxinus chinensis Roxb extract, (b) PMNPs, (c) 3-MPA@PMNPs.) 图 1 材料的傅里叶红外谱图 Fig. 1 The FTIR spectrun of materials |
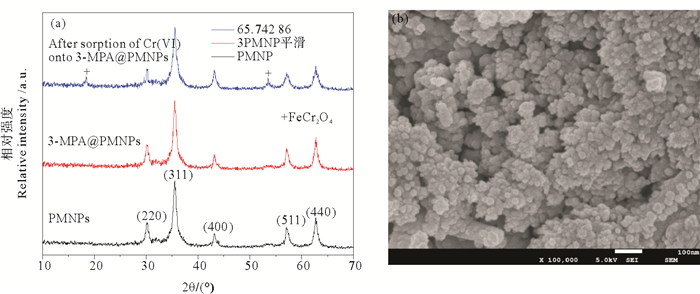
利用X射线粉末衍射仪(XRD)对磁性纳米颗粒进行分析,如图 2(a)所示。结果表明,制备的纳米Fe3O4颗粒是高度结晶的,大部分衍射峰来自磁铁矿Fe3O4晶体,在30.2°、35.5°、43.1°、57.2°和62.7°处衍射峰分别对应于(220)(311)(400)(511)(440)的晶面Fe3O4衍射峰[40]。3-MPA@PMNPs与PMNPs相比,并未出现新的衍射峰,表面改性并不会对磁性纳米颗粒的晶体结构造成明显影响。而将3-MPA@PMNPs用于去除水中六价铬反应之后材料的XRD图谱与反应前相比,在2θ=18.3°和2θ=53.5°处出现了两个新的衍射峰,来自于铬铁矿FeCr2O4,说明3-MPA@PMNPs去除水中六价铬的反应将Cr6+还原为Cr3+,并以铁铬氧化物的形式沉积在3-MPA@PMNPs材料表面。3-MPA@PMNPs的平均直径由谢勒公式[48]计算,平均粒径为37.2 nm。从3-MPA@PMNPs的扫描电镜图 2(b)可知,制备的3-MPA@PMNPs为近似圆球形,粒径大致范围为20~50 nm。
|
((a)材料的XRD图;(b)3-MPA@PMNPs的扫描电镜图。(a) XRD spectrun of materials; (b) SEM of 3-MPA@PMNPs.) 图 2 材料的XRD和SEM图 Fig. 2 The XRD and SEM images of materials |
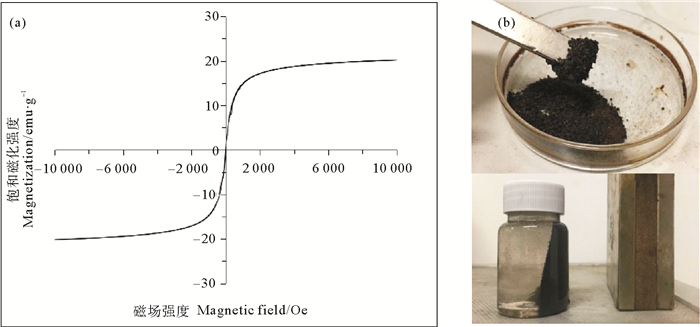
磁性纳米颗粒磁性的大小主要取决于所制备颗粒的尺寸、形态和形状,制备方法和过程是影响材料磁性大小的关键因素。使用振动样品磁强计(VSM)测定3-MPA@PMNPs的磁性大小,磁滞回线如图 3(a)所示。从图 3(a)可以看出,3-MPA@PMNPs的磁滞回线根据原点呈中心对称,剩余磁化强度Mr和矫顽力Hc都为零,表明没有磁滞现象,说明3-MPA@PMNPs为超顺磁性。当磁场强度从0增加到111.9Oe时,3-MPA@PMNPs迅速磁化,磁化强度为7.9 emu/g,饱和磁化强度值为20.2 emu/g,表明3-MPA@PMNPs材料具有较强的磁性。在磁铁吸引下,可以快速将3-MPA@PMNPs材料与溶液分离,如图 3(b)所示。
|
((a)3-MPA@PMNPs的磁滞回线;(b)3-MPA@PMNPs被磁铁吸引。(a) VSM of 3-MPA@PMNPs; (b) Magnetic separation of 3-MPA@PMNPs using a handheld magnet.) 图 3 3-MPA@PMNPs的磁滞回线 Fig. 3 VSM measurements of 3-MPA@PMNPs |
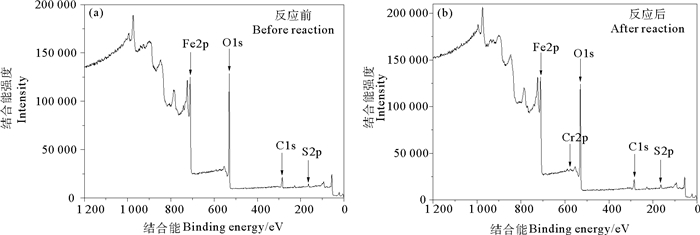
对去除Cr(Ⅵ)反应前后3-MPA@PMNPs表面进行XPS全谱扫描图谱分析,扫描结果见图 4所示。从图 4(a)可以看到,3-MPA@PMNPs表面Fe、O、C、S四种元素的组成情况。在711 eV附近的是Fe元素的特征峰,在530 eV附近的是O元素的特征峰,在285 eV附近的是C元素的特征峰,在167 eV附近的是S元素的特征峰。图 4(b)显示,3-MPA@PMNPs去除Cr(Ⅵ)反应后,在结合能580eV附近是Cr元素的特征峰,表明反应体系中的Cr(Ⅵ)被成功吸附到3-MPA@PMNPs材料表面。3-MPA@PMNPs表面的C、O元素主要来自白蜡树叶片提取物中多糖、酚类等生物分子。
|
图 4 3-MPA@PMNPs与Cr(Ⅵ)反应前后的XPS全谱图 Fig. 4 XPS spectra of 3-MPA@PMNPs before and after reaction with Cr(Ⅵ) |
3-MPA@PMNPs去除Cr(Ⅵ)反应后,材料表面各元素的化学价态分析结果如图 5所示。从图 5(a)中可以看出,Cr元素谱图中较强峰出现在576.5和586.0 eV处,分别对应Cr(Ⅲ)和Cr(Ⅵ),说明3-MPA@PMNPs去除Cr(Ⅵ)反应产物中存在Cr(Ⅲ)和Cr(Ⅵ)两种价态。反应体系中的一部分Cr(Ⅵ)被3-MPA@PMNPs还原为Cr(Ⅲ),并被吸附在3-MPA@PMNPs的表面,3-MPA@PMNPs对Cr(Ⅵ)的去除是一个物理吸附与化学吸附共存的过程。
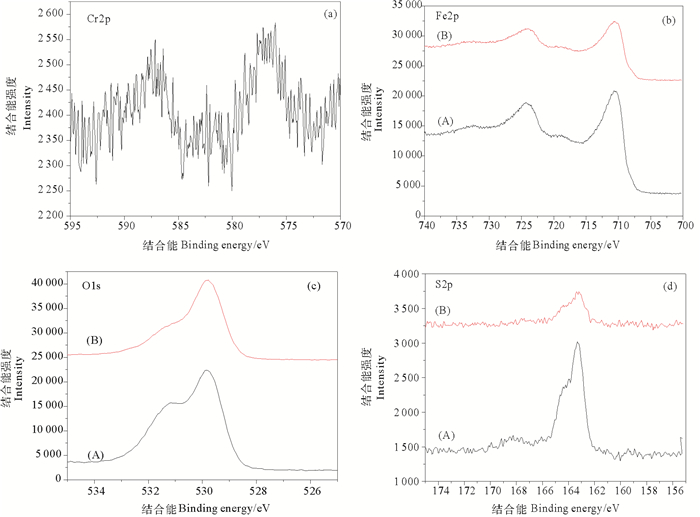
|
((a)反应后Cr2p,(b)Fe2p,(c)O1s,(d)S2p;反应前(A)反应后(B)。(a) Chromium, (b) Iron, (c) Oxygen and (d) Sulfur. (A) before interaction, (B) after interaction.) 图 5 3-MPA@PMNPs材料表面主要元素的XPS谱图 Fig. 5 XPS spectra of 3-MPA@PMNPs |
反应前后Fe元素高分辨率Fe2p谱图如图 5(b)所示。检测到723.6~724.3和710.0~710.9 eV两处峰位,分别对应Fe2p3/2轨道和Fe2p1/2轨道,Fe(Ⅱ)和Fe(Ⅲ)两种形式Fe元素的存在进一步证明制备的3-MPA@PMNPs主要成分为磁铁矿Fe3O4。由图 5(c)中(A)可知,3-MPA@PMNPs表面O1s的XPS谱图可分为两个峰,两个峰的中心分别位于529.8和531.2 eV,分别对应OH-和O2-的结合能。在3-MPA@PMNPs去除Cr(Ⅵ)后,位于531.2 eV处的特征峰变缓,说明在反应过程中,材料表面的O2-受到了反应的影响,可能是与被还原后的Cr(Ⅲ)相结合,进而被吸附在3-MPA@PMNPs表面。由图 5(d)可知,反应前3-MPA@PMNPs材料材料表面S2p的XPS图谱位于163.3 eV,对应于磺酸基团(-SO3H)[40],而相对于反应前高窄谱峰,反应后S2p轨道谱峰谱带变宽,且结合能强度明显减小,这可能是因为磺酸基团-SO3H在与Cr(Ⅵ)相互作用时受到了影响。3-MPA@PMNPs对Cr(Ⅵ)去除过程有:一方面,Cr(Ⅵ)被还原为Cr(Ⅲ),以铁铬氧化物的形式结合在3-MPA@PMNPs材料表面;另一方面,由于静电作用,Cr(Ⅵ)以HCrO4-♂的形式转移到-SO3H上,形成螯合物,从而加强去除六价铬的效果。
2.2 六价铬去除试验 2.2.1 PMNPs和3-MPA@PMNPs对六价铬的去除能力对比图 6是在温度为20℃条件下,投加量为1.5 g/L的改性前后磁性纳米Fe3O4颗粒对Cr(Ⅵ)溶液去除能力的对比。从图中可以看出,与未改性的PMNPs相比,改性后的3-MPA@PMNPs在去除溶液浓度为30 mg/L Cr(Ⅵ)去除率约为PMNPs的1.8倍,对于浓度为10~50 mg/L Cr(Ⅵ)溶液去除量皆显著升高。当溶液中Cr(Ⅵ)浓度为50 mg/L时,改性后的3-MPA@PMNPs在反应平衡时的去除量为21.85 mg/g,比改性前提高了77%。
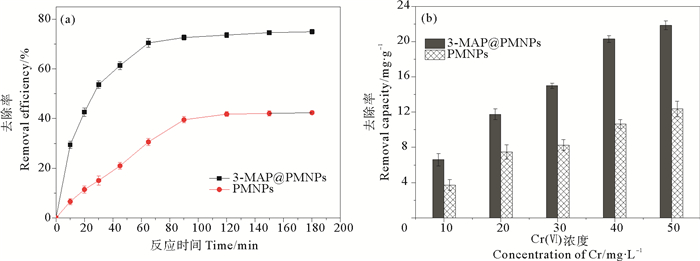
|
((a)材料对30 mg/L Cr(Ⅵ)的去除率,(b)材料对不同溶液浓度Cr(Ⅵ)的去除量。(a) Removal efficiency of Cr(Ⅵ) (30 mg/L), (b)Removal capacity at different Cr(Ⅵ) inintial concentration.) 图 6 PMNPs和3-MPA@PMNPs对六价铬的去除能力对比 Fig. 6 Removal capacity of Cr(Ⅵ) by 3-MPA@PMNPs and PMNPs |
对比发现,3-MPA@PMNPs去除水中六价铬的去除效果更好,这是因为与未改性的PMNPs相比,经过3-巯基丙酸对磁性纳米Fe3O4颗粒的官能化修饰后,磺酸基团-SO3H与Cr(Ⅵ)之间存在强相互作用,从而增强了3-MPA@PMNPs对水中六价铬的去除能力。
2.2.2 3-MPA@PMNPs投加量的影响图 7(a)是在温度为20 ℃条件下,初始浓度为50 mg/L的Cr(Ⅵ)溶液中,不同3-MPA@PMNPs投加量0.50、1.00、1.25、1.50、2.00、4.00 g/L对Cr(Ⅵ)的去除结果。
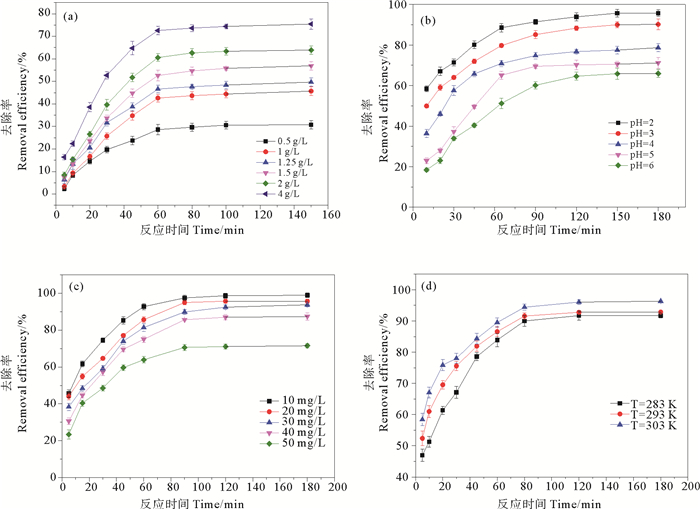
|
((a)投加量,(b)pH,(c)Cr(Ⅵ)初始浓度,(d)反应温度。(a) Dosage, (b) pH, (c) Initial concentration, (d)Temperature.) 图 7 各因素对3-MPA@PMNPs去除Cr(Ⅵ)的去除的影响 Fig. 7 The removal efficiency of Cr(Ⅵ) by 3-MPA@PMNPs under different condition |
在反应前40 min去Cr(Ⅵ)除率快速升高,在反应时间为60 min时,反应逐渐趋于平衡,Cr(Ⅵ)去除率达到最大。且随着投加量的增加,Cr(Ⅵ)去除率也逐渐升高。当3-MPA@PMNPs投加量从0.5 g/L增加到4 g/L后,Cr(Ⅵ)去除率增加了1.45倍。这是因为在污染物浓度一定时,随着3-MPA@PMNPs含量的升高,与Cr(Ⅵ)反应的活性位点增多、接触几率增加,从而提高了Cr(Ⅵ)的去除率。但是随着投加量的增加,Cr(Ⅵ)去除量下降。这是因为随着投加量的增加,反应体系中未被Cr(Ⅵ)占据的活性位点也相对增加,导致材料对Cr(Ⅵ)的去除量逐渐降低。
2.2.3 pH的影响用1.5 g/L的3-MPA@PMNPs分别处理不同pH值(2、3、4、5、6)的Cr(Ⅵ)溶液,去除效果如图 7(b)所示。随着pH的增大,3-MPA@PMNPs对Cr(Ⅵ)的去除率逐渐降低。在pH=2时,去除率最高,为95%;在pH < 5的情况下,3-MPA@PMNPs对Cr(Ⅵ)的去除能力表现较好,在反应平衡时,去除率都在70%以上。pH值越低越有利于Cr(Ⅵ)的去除,这是因为在pH=2~5条件下,Cr(Ⅵ)以HCrO4-形式存在,随着pH的增大,则逐渐转化为CrO42-[49],经过改性的3-MPA@PMNPs在酸性条件下对HCrO4-的亲和力要好于CrO42-[40]。同时由于H+吸附在材料表面使得材料表面质子化,HCrO4-通过静电作用被吸附在3-MPA@PMNPs表面,所以酸性条件下的HCrO4-更容易被3-MPA@PMNPs吸附。
2.2.4 Cr(Ⅵ)初始浓度的影响图 7(c)显示了在温度为20 ℃、pH=2条件下,1.5 g/L的3-MPA@PMNPs对不同溶液初始浓度(10、20、30、40、50 mg/L)的Cr(Ⅵ)的去除率。从图中可以得出,在反应80 min后,3-MPA@PMNPs对5个初始浓度的Cr(Ⅵ)去除率逐渐趋于稳定,说明反应在80 min内即可达到平衡;在浓度小于40 mg/L时,Cr(Ⅵ)去除率较高,都在80%以上,当初始Cr(Ⅵ)浓度为10 mg/L时,平衡时的去除率接近100%,几乎可以将浓度为10 mg/L的Cr(Ⅵ)污染物全部去除;当初始Cr(Ⅵ)浓度为50 mg/L时,去除率降低为71.55%。随着Cr(Ⅵ)初始浓度的增大,3-MPA@PMNPs对Cr(Ⅵ)的去除率呈逐渐下降的趋势。这是因为当3-MPA@PMNPs的投加量一定时,3-MPA@PMNPs吸附位点有限,无法全部去除大量的Cr(Ⅵ),所以Cr(Ⅵ)的去除率随初始浓度增加而下降。
2.2.5 反应温度的影响图 7(d)为在pH=2,3-MPA@PMNPs的投加量为1.5 g/L,Cr(Ⅵ)初始浓度为30 mg/L条件下,对不同反应在20、30、40 ℃下的Cr(Ⅵ)的去除率。由图可见,随着反应温度的升高,3-MPA@PMNPs对Cr(Ⅵ)的去除率也逐渐升高,但是升高幅度不大。当反应温度为20 ℃,反应达到平衡时Cr(Ⅵ)的去除率为91.7%,当温度升高到40 ℃时,去除率为96.31%。
2.3 吸附等温线的研究吸附等温线能够揭示反应达到平衡时Cr(Ⅵ)在固相与液相之间的分布情况,常用等温线模型包括Langmuir模型、Freundlich模型和Tempkin模型。
Langmuir吸附方程表示为公式1:
| $ \frac{{{C_{\rm{e}}}}}{{{q_{\rm{e}}}}} = \frac{1}{{b{q_{\rm{m}}}}} + \frac{{{C_{\rm{e}}}}}{{{q_{\rm{m}}}}}。$ | (1) |
Freundlich等温方程可由公式2表示:
| $ {\rm{ln}}{q_{\rm{e}}} = {\rm{ln}}{{\rm{K}}_{\rm{f}}} + \frac{1}{n}{\rm{ln}}{C_{\rm{e}}}。$ | (2) |
Tempkin模型可表示为式3:
| $ {q_{\rm{e}}} = {{\rm{B}}_{\rm{t}}}{\rm{ln}}{{\rm{A}}_{\rm{t}}} + {{\rm{B}}_{\rm{t}}}\ln {C_{\rm{e}}}。$ | (3) |
其中:Ce为反应达到平衡时的Cr(Ⅵ)浓度,mg/L;qe为反应达到平衡时的吸附量,mg/g;qm为饱和吸附量,mg/g;b为Langmuir吸附常数,与结合位点和被吸附物之间亲和力有关,L/mg;Kf是吸附常数,(mg/g);
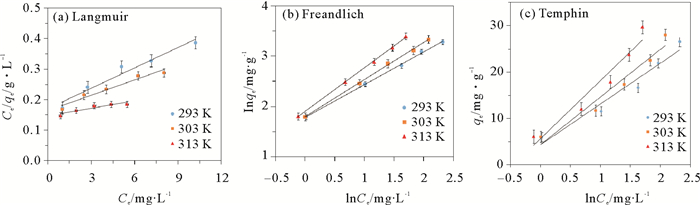
|
图 8 3-MPA@PMNPs去除六价铬的等温式线性回归 Fig. 8 The linear form for Cr(Ⅵ) adsorption |
|
|
表 1 3-MPA@PMNPs去除六价铬的吸附等温参数 Table 1 Isothermal parameters for removal of Cr(Ⅵ) by 3-MPA@PMNPs |
由图 8和表 1可知,3-MPA@PMNPs对不同反应温度下的六价铬的去除数据与Freundlich吸附等温方程拟合后,其相关系数R2值最大,在0.998 7~0.999 2范围内,均大于Langmuir和Tempkin模型的R2,说明3-MPA@PMNPs对水中六价铬的吸附更接符合Freundlich吸附等温方程。3-MPA@PMNPs对六价铬的吸附过程不是单分子层吸附,而是遵循多层吸附和非均相吸附的过程。根据等温方程计算出来的等温数值如表 1所示,Freundlich吸附等温方程的1/n值在0.383 9~0.392 8之间,均小于1,说明3-MPA@PMNPs材料吸附六价铬吸附性能较好,吸附过程容易进行。而Tempkin吸附等温线相关系数较差,不能很好的描述3-MPA@PMNPs材料对水中六价铬的吸附行为。
2.4 吸附动力学的研究分别采用拟一级动力学方程、拟二级动力学方程和颗粒内扩散模型对3-MPA@PMNPs去除不同浓度的六价铬溶液的数据进行拟合。
拟一级动力学模型可表示为式4:
| $ {\rm{log}}({q_{\rm{e}}} - {q_{\rm{t}}}) = \log {q_{\rm{e}}} - \frac{{{{\rm{k}}_1}}}{{2.303}}t。$ | (4) |
拟二级动力学模型可表示为5:
| $ \frac{t}{{{q_t}}} = \frac{1}{{{{\rm{k}}_2}{q_{\rm{e}}}^2}} + \frac{1}{{{q_{\rm{e}}}}}t。$ | (5) |
颗粒内扩散动力学方程见式6:
| $ {q_t} = {{\rm{k}}_{\rm{p}}}{t^{0.5}} + C。$ | (6) |
其中:qe为饱和吸附量,mg/g;t为吸附时间,min;qt为t时刻的吸附量,mg/g;k1为拟一级速率常数,min-1;k2为拟二级速率常数,g/(mg·min);kp为颗粒内扩散速率常数,mg/(g·min)。
以qt对t作图,可以得到3-MPA@PMNPs对Cr(Ⅵ)的吸附动力学曲线,使用1.5 g/L的3-MPA@PMNPs分别处理不同初始浓度的Cr(Ⅵ)溶液,如图 9(a)所示。使用拟一级动力学方程、拟二级动力学方程和颗粒内扩散模型对吸附数据进行拟合,拟合结果见图 9(b)(c)(d)和表 2。
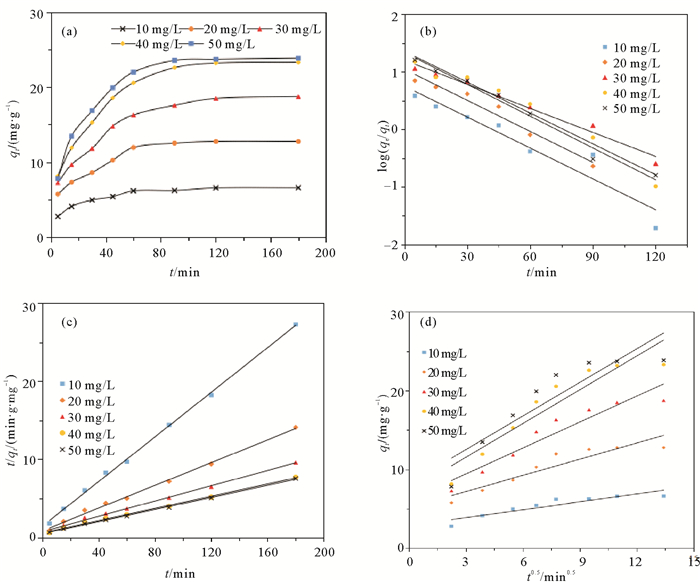
|
((a)3-MPA@PMNPs对不同浓度Cr(Ⅵ)吸附量随时间变化曲线;(b)拟一级动力学,(c)拟二级动力学,(d)内扩散动力学。(a) Adsorption capacity of at different Cr(Ⅵ) concentration, (b) Pseudo-first order model, (c) Pseudo-second order model and (d) Intraparticle diffusion model.) 图 9 3-MPA@PMNPs去除不同浓度六价铬的线性回归方程 Fig. 9 Kinetic models for the adsorption of Cr(Ⅵ) onto 3-MPA@PMNPs |
|
|
表 2 3-MPA@PMNPs对不同浓度六价铬的吸附动力学参数 Table 2 Kinetic parameters for the adsorption of Cr(Ⅵ) onto 3-MPA@PMNPs |
由图 9和表 2可知,3-MPA@PMNPs去除六价铬的吸附行为更加符合拟二级动力学方程,其相关性好于拟一级动力学方程,不同浓度下其R2在0.995 9~0.998 7范围内。说明二级动力学模型能够更好的反应3-MPA@PMNPs对六价铬的吸附机理,化学吸附为反应的限速步骤。颗粒内扩散拟合结果,其线性相关性不好,在各浓度下的R2值在0.826 0~0.904 3之间,表明颗粒内扩散不是反应的速率主要控制步骤。
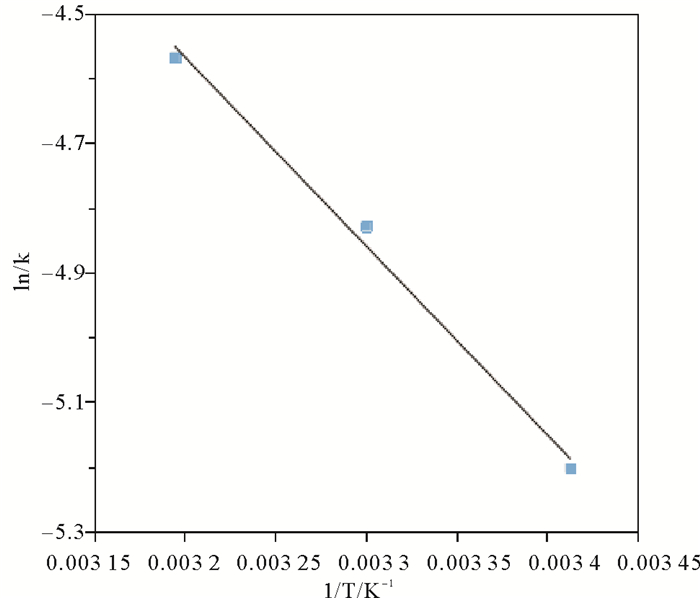
不同类型反应的反应活化能不同,活化能越低,说明反应活化分子的数目越多,反应就越迅速。Arrhenius经验方程能够反应温度与反应速率之间的关系,可表示为式7:
| $ \ln k = - \frac{{Ea}}{{RT}} + C。$ | (7) |
其中:k为反应速率,取拟二级速率常数;Ea为反应的活化能,J/mol;R=8.313J/(mol·K)为理想气体常数;T为反应温度,K;C为反应常数。化学反应的过程决定了C与Ea值的大小。
以lnk对T-1作图,如图 10所示,由方程的斜率和截距求得反应的活化能Ea=24.26 > 20 kJ/mol,反应常数C=4.77。因此,3-MPA@PMNPs对水中Cr(Ⅵ)的去除主要以化学吸附为主。
|
图 10 Arrhenius方程曲线 Fig. 10 Plots of Arrhenius model |
(1) 利用白蜡树叶片提取物为还原剂制备了具有超顺磁性的纳米颗粒PMNPs,并在此基础上使用3-巯基丙酸对其进行表面官能化修饰,得到的3-MPA@PMNPs呈球状,平均粒径为37.2 nm,材料表面具有丰富的官能团,良好的磁化性能使其易于从水中收集进行再利用。
(2) 随着反应体系中3-MPA@PMNPs吸附剂使用量的增加,六价铬的去除率随之升高、去除量逐渐降低;随着Cr(Ⅵ)初始浓度的增大,3-MPA@PMNPs对Cr(Ⅵ)的去除率呈逐渐下降的趋势;随着反应温度的升高,3-MPA@PMNPs对Cr(Ⅵ)的去除率逐渐升高;溶液pH的越小,3-MPA@PMNPs对Cr(Ⅵ)的去除率越高,在pH < 5的情况下,3-MPA@PMNPs对Cr(Ⅵ)的去除能力表现较好,在反应平衡时的去除率都在70%以上。
(3) 3-MPA@PMNPs去除Cr(Ⅵ)包括氧化还原反应和吸附反应两个过程:六价铬被还原为三价铬以铁铬氧化物的形式被吸附在3-MPA@PMNPs表面;六价铬以HCrO4-形式转移到磺酸基团上形成螯合物,进一步加强去除六价铬的效果。
(4) 3-MPA@PMNPs对Cr(Ⅵ)吸附行为符合Freundlich模型,去除过程倾向于多层吸附和非均相吸附的过程。吸附动力学符合二级动力学模型,主要以化学吸附为主。
| [1] |
聂宁, 丁远昭, 李喜青. 制备斜发沸石和零价铁复合材料处理水中的六价铬污染[J]. 中国环境科学, 2013, 33(3): 443-447. Nie N, Ding Y Z, Li X Q. Preparation of zeolite and zero valent iron composite for cleanup of hexavalent contamination in water[J]. China Environmental Science, 2013, 33(3): 443-447. DOI:10.3969/j.issn.1000-6923.2013.03.009 (  0) 0) |
| [2] |
Yin X, Liu W, Ni J. Removal of coexisting Cr(Ⅵ) and 4-chlorophenol through reduction and Fenton reaction in a single system[J]. Chemical Engineering Journal, 2014, 248(188): 89-97.
(  0) 0) |
| [3] |
Mystrioti C, Xenidis A, Papassiopi N. Application of iron nanoparticles synthesized by green tea for the removal of hexavalent chromium in column tests[J]. Journal of Geoscience & Environment Protection, 2014, 2(2): 28-36.
(  0) 0) |
| [4] |
Liu W, Zhang J, Zhang C, et al. Adsorptive removal of Cr (Ⅵ) by Fe-modified activated carbon prepared from Trapa natans, husk[J]. Chemical Engineering Journal, 2010, 162(2): 677-684. DOI:10.1016/j.cej.2010.06.020
(  0) 0) |
| [5] |
国家发展和改革委员会, 国家环境保护总局.铬渣污染综合整治方案[C].2005. National Development and Reform Commission, State Environmental Protection Administration[C].[S.l.]: Comprehensive Treatment of Chromium Slag Pollution, 2005. (  0) 0) |
| [6] |
Krishnani K K, Ayyappan S. Heavy metals remediation of water using plants and lignocellulosic agrowastes[J]. Rev Environ Contam Toxicol, 2006, 188: 59-84.
(  0) 0) |
| [7] |
郭峰. 含铬(Ⅵ)废水无害化处理技术研究进展[J]. 中国资源综合利用, 2017(8): 62-65. Guo F. Research progress in harmless treatment of wastewater containing chromium (Ⅵ)[J]. China Resources Comprehensive Utilization, 2017(8): 62-65. DOI:10.3969/j.issn.1008-9500.2017.08.023 (  0) 0) |
| [8] |
邹敏敏, 陈足意, 曾冬铭, 等. 硫酸亚铁处理电镀废水中重金属离子的研究[J]. 电镀与环保, 2012, 32(3): 49-51. Zou M M, Chen Z Y, Zeng D M., et al. Study on treatment of heavy metal ions in electroplating wastewater with ferrous sulfate[J]. Electroplating & Pollution Control, 2012, 32(3): 49-51. DOI:10.3969/j.issn.1000-4742.2012.03.017 (  0) 0) |
| [9] |
吴克明, 范志功, 黄娜, 等. 冷轧含铬废水的化学还原法处理研究[J]. 工业安全与环保, 2008, 34(11): 5-6. Wu K M, Fan Z M, Huang N, et al. Research on rolling wastewater containing chromium by chemical reducing method[J]. Industrial Safety and Environmental Protection, 2008, 34(11): 5-6. DOI:10.3969/j.issn.1001-425X.2008.11.002 (  0) 0) |
| [10] |
王剑南, 黄俊旗, 李晶. 对废水中Cr6+治理的研究进展[J]. 安徽化工, 2016, 42(5): 8-11. Wang J N, Huang J Q, Li J. Research progress of Cr6+ treatment in wastewater[J]. Anhui Chemical Industry, 2016, 42(5): 8-11. DOI:10.3969/j.issn.1008-553X.2016.05.003 (  0) 0) |
| [11] |
王静. 铬离子(六价)去除技术研究进展[J]. 化工管理, 2016(10): 105-105. Wang J. Research progress of chromium ion (Ⅵ) removal technology[J]. Chemical Enterprise Management, 2016(10): 105-105. DOI:10.3969/j.issn.1008-4800.2016.10.054 (  0) 0) |
| [12] |
刘存海, 喻莹. 隔膜电解及SiO2吸附处理含铬废水的研究[J]. 电镀与精饰, 2011, 33(4): 43-46. Liu C H, Yu Y. Treatment of chromium-containing wastewater with SiO2 adsorption under diaphragm electrolysis[J]. Plating & Finshing, 2011, 33(4): 43-46. DOI:10.3969/j.issn.1001-3849.2011.04.012 (  0) 0) |
| [13] |
廖小深, 魏俊富, 赵孔银, 等. 聚砜中空纤维纳滤膜在Cr(Ⅵ)去除中的应用[J]. 天津工业大学学报, 2014(3): 1-6. Liao X S, Wei J F, Zhao K Y, et al. Application of polysulfone nanofiltration hollow fiber membrane in removal of chromium(Ⅵ)[J]. Journal of Tianjin Polytechnic University, 2014(3): 1-6. DOI:10.3969/j.issn.1671-024X.2014.03.001 (  0) 0) |
| [14] |
吕建波, 刘东方, 李杰, 等. 水中铬的吸附法处理技术研究现状与进展[J]. 水处理技术, 2013, 39(12): 5-10. Lv J B, Liu D F, Li J, et al. Research situation and progress of adsorptive removal of chromium from aqueous solutions[J]. Technology of Water Treatment, 2013, 39(12): 5-10. DOI:10.3969/j.issn.1000-3770.2013.12.002 (  0) 0) |
| [15] |
Sarkar B, Xi Y F, Megharaj M, et al. Remediation of hexavalent chromium through adsorption by bentonite based Arquad® 2HT-75 organoclays[J]. Journal of Hazardous Materials, 2010, 183(1-3): 87-97. DOI:10.1016/j.jhazmat.2010.06.110
(  0) 0) |
| [16] |
Figueiredo H, Silva B, Quintelas C, et al. Biosorption of hexavalent chromium based on modified Y zeolites obtained by alkali-treatment[J]. Environmental Engineering & Management Journal, 2010, 9(3): 305.
(  0) 0) |
| [17] |
Sarbak Z. Activity of mineral adsorbents in removal of colour, odors and heavy metals[J]. Przemysl Chemiczny, 2010, 89(2): 146-149.
(  0) 0) |
| [18] |
王雪瑾, 朱霞萍, 蓝路梅. 镁铝层状超分子化合物去除废水中的六价铬[J]. 应用化学, 2017, 34(1): 98-104. Wang X J, Zhu X P, Lan L M. Efficient removal of Cr(Ⅵ) in wastewater by Mg/Al layered superamolecular compounds[J]. Chinese Journal of Applied Chemistry, 2017, 34(1): 98-104. (  0) 0) |
| [19] |
Wang H L, Yang Y, Wang H, et al. Effects of Cr promoter on structure and fischer-tropsch synthesis performance over Fe-based catalysts[J]. Chinese Journal of Catalysis, 2010, 31(7): 809-816.
(  0) 0) |
| [20] |
刘玉星, 朱明娟, 龙燕. 电化学法在工业含铬废水处理中的应用研究[J]. 当代化工研究, 2016(8): 68-69. Liu Y X, Zhu M J, Long Y. Application research of electrochemistry method in industial chrome-contained wastewater treatment[J]. Modern Chemical Research, 2016(8): 68-69. (  0) 0) |
| [21] |
周杰, 陈禾逸, 魏俊, 等. 铁碳微电解处理含铬废水的试验研究[J]. 电镀与涂饰, 2013, 32(6): 43-45. Zhou J, Chen H Y, Wei J, et al. Experimental study on chromium-containing wastewater by iron-carbon microelectrolysis[J]. Electroplating & Finishing, 2013, 32(6): 43-45. DOI:10.3969/j.issn.1004-227X.2013.06.012 (  0) 0) |
| [22] |
李媛媛, 张杰. 微生物去除Cr(Ⅵ)机理以及技术应用现状[J]. 黑龙江农业科学, 2017(9): 124-128. Li Y Y, Zhang J. Microbial removal of Cr(Ⅵ) mechanism and application[J]. Heilongjiang Agricultural Sciences, 2017(9): 124-128. (  0) 0) |
| [23] |
Ishak A F, Karim N A, Wan A A, et al. Chromate detoxification using combination of ChromeBacTM system and immobilized chromate reductase beads[J]. International Biodeterioration & Biodegradation, 2016, 113: 238-243.
(  0) 0) |
| [24] |
Robins K J, Hooks D O, Rehm B H A, et al. Escherichia coliNemA is an efficient chromate reductase that can be biologically immobilized to provide a cell free system for remediation of Hexavalent Chromium[J]. Plos One, 2013, 8(3): e59200. DOI:10.1371/journal.pone.0059200
(  0) 0) |
| [25] |
郑施雯, 魏远, 顾红波, 等. 铬污染地区植物重金属含量特征与耐性植物筛选研究[J]. 林业科学研究, 2011, 24(2): 205-211. Zheng S D, Wei Y, Gu H B, et al. Characteristics of heavy metals in plants growing on Cr contaminated area and Cr-tolerant plants screening[J]. Forest Research, 2011, 24(2): 205-211. (  0) 0) |
| [26] |
潘方珍, 徐传云, 王杰. 水培条件下绿萝对水体中铅、铬的净化作用[J]. 科技通报, 2014(3): 215-217. Pan F Z, Xu C Y, Wang J. The purification effect of scindapsus aureus for Pb, Cr pollution water under hydroponic conditions[J]. Bulletin of Science and Technology, 2014(3): 215-217. DOI:10.3969/j.issn.1001-7119.2014.03.051 (  0) 0) |
| [27] |
马亚梦, 王洋洋, 谭秀民, 等. Cr(Ⅵ)污染生物修复研究进展[J]. 安徽农业科学, 2015(22): 176-178. Ma Y M, Wang Y Y, Tan X M, et al. Research progress of Cr (Ⅵ) pollution bioremediation[J]. Journal of Anhui Agricultural Sciences, 2015(22): 176-178. DOI:10.3969/j.issn.0517-6611.2015.22.068 (  0) 0) |
| [28] |
Ali I. New generation adsorbents for water treatment[J]. Chemical Reviews, 2012, 112(10): 5073-5091. DOI:10.1021/cr300133d
(  0) 0) |
| [29] |
Hua M, Zhang S, Pan B, et al. Heavy metal removal from water/wastewater by nanosized metal oxides: A review[J]. Journal of Hazardous Materials, 2012, 211-212: 317. DOI:10.1016/j.jhazmat.2011.10.016
(  0) 0) |
| [30] |
Tang S C N, Lo I M C. Magnetic nanoparticles: Essential factors for sustainable environmental applications[J]. Water Research, 2013, 47(8): 2613. DOI:10.1016/j.watres.2013.02.039
(  0) 0) |
| [31] |
Pang Y, Zeng G, Tang L, et al. PEI-grafted magnetic porous powder for highly effective adsorption of heavy metal ions[J]. Desalination, 2011, 281(1): 278-284.
(  0) 0) |
| [32] |
Sharma Y C, Srivastava V. CoMPArative studies of removal of Cr(Ⅵ) and Ni(Ⅱ) from aqueous solutions by magnetic nanoparticles[J]. J Chem Eng Data, 2010, 56(4): 819-825.
(  0) 0) |
| [33] |
Shamaila S, Sajjad A K L, Ryma N U A, et al. Advancements in nanoparticle fabrication by hazard free eco-friendly green routes[J]. Applied Materials Today, 2016, 5: 150-199. DOI:10.1016/j.apmt.2016.09.009
(  0) 0) |
| [34] |
方晓波. 纳米四氧化三铁技术去除水中六价铬的研究进展[J]. 广东化工, 2016, 43(15): 127-128. Fang X B. Research progress of removal of Cr(Ⅵ) from aqueous solution by Nano ferroferric oxide technology[J]. Guangdong Chemical Industry, 2016, 43(15): 127-128. DOI:10.3969/j.issn.1007-1865.2016.15.060 (  0) 0) |
| [35] |
Larraza I, Lópezgónzalez M, Corrales T, et al. Hybrid materials: Magnetite-Polyethylenimine-Montmorillonite, as magnetic adsorbents for Cr(Ⅵ) water treatment[J]. Journal of Colloid & Interface Science, 2012, 385(1): 24-33.
(  0) 0) |
| [36] |
Thinh N N, Hanh P T, Ha le T T, et al. Magnetic chitosan nanoparticles for removal of Cr(Ⅵ) from aqueous solution[J]. Materials Science & Engineering C Materials for Biological Applications, 2013, 33(3): 1214-1218.
(  0) 0) |
| [37] |
Zhang H, Liu D L, Zeng L L, et al. β-Cyclodextrin assisted one-pot synthesis of mesoporous magnetic Fe3O4@C and their excellent performance for the removal of Cr (Ⅵ) from aqueous solutions[J]. Chinese Chemical Letters, 2013, 24(4): 341-343. DOI:10.1016/j.cclet.2013.02.007
(  0) 0) |
| [38] |
Sun X, Yang L, Li Q, et al. Amino-functionalized magnetic cellulose nanocomposite as adsorbent for removal of Cr(Ⅵ): Synthesis and adsorption studies[J]. Chemical Engineering Journal, 2014, 241(1): 175-183.
(  0) 0) |
| [39] |
Xu P, Zeng G M, Huang D L, et al. Use of iron oxide nanomaterials in wastewater treatment: A review[J]. Science of the Total Environment, 2012, 424(4): 1-10.
(  0) 0) |
| [40] |
Mcauley A, Olatunji M A. Metal-ion oxidations in solution. Part XIX. Redox pathways in the oxid[J]. Revue Canadienne De Chimie, 1977, 55(18): 3335-3340. DOI:10.1139/v77-465
(  0) 0) |
| [41] |
Burks T, Avila M, Akhtar F, et al. Studies on the adsorption of chromium(Ⅵ) onto 3-Mercaptopropionic acid coated superparamagnetic iron oxide nanoparticles[J]. Journal of Colloid & Interface Science, 2014, 425(7): 36-43.
(  0) 0) |
| [42] |
Ali I, Peng C, Naz I, et al. Phytogenic magnetic nanoparticles for wastewater treatment: A review[J]. Rsc Advances, 2017, 7(64): 40158-40178. DOI:10.1039/C7RA04738J
(  0) 0) |
| [43] |
Ali I, Peng C, Tong Y, et al. Sorption of cationic malachite green dye on phytogenic magnetic nanoparticles functionalized by 3-marcaptopropanic acid[J]. Rsc Advances, 2018, 8: 8878-8897. DOI:10.1039/C8RA00245B
(  0) 0) |
| [44] |
Manquiáncerda K, Cruces E, Angélica R M, et al. Preparation of nanoscale iron (oxide, oxyhydroxides and zero-valent) particles derived from blueberries: Reactivity, characterization and removal mechanism of arsenate[J]. Ecotoxicology & Environmental Safety, 2017, 145: 69-77.
(  0) 0) |
| [45] |
Smuleac V, Varma R, Sikdar S, et al. Green synthesis of Fe and Fe/Pd bimetallic nanoparticles in membranes for reductive degradation of Chlorinated organics[J]. J Memb Sci, 2011, 379(1): 131-137.
(  0) 0) |
| [46] |
Prasad C, Karlapudi S, Venkateswarlu P, et al. Green arbitrated synthesis of Fe3O4, magnetic nanoparticles with nanorod structure from pomegranate leaves and Congo red dye degradation studies for water treatment[J]. Journal of Molecular Liquids, 2017, 240.
(  0) 0) |
| [47] |
Olena T, Elena G, Wang D, et al. Binding studies of molecular linkers to ZnO and MgZnO nanotip films[J]. Journal of Physical Chemistry B, 2006, 110(13): 6506-6515. DOI:10.1021/jp0570317
(  0) 0) |
| [48] |
Hatakeyama M, Kishi H, Kita Y, et al. A two-step ligand exchange reaction generates highly water-dispersed magnetic nanoparticles for biomedical applications[J]. Journal of Materials Chemistry, 2011, 21(16): 5959-5966. DOI:10.1039/c0jm04381h
(  0) 0) |
| [49] |
Gupta V K, Nayak A. Cadmium removal and recovery from aqueous solutions by novel adsorbents prepared from orange peel and Fe2O3, nanoparticles[J]. Chemical Engineering Journal, 2012, 180(3): 81-90.
(  0) 0) |
| [50] |
Venkateswarlu S, Kumar S H, Jyothi N V V. Rapid removal of Ni(Ⅱ) from aqueous solution using 3-Mercaptopropionic acid functionalized bio magnetite nanoparticles[J]. Water Resources & Industry, 2015, 12: 1-7.
(  0) 0) |
 2018, Vol. 48
2018, Vol. 48


