犬肾上皮连续细胞系(Madin-Darby canine kidney cell lines, MDCK)是目前被广泛使用的体外药物吸收模型之一,能够短时间内在Transwell通透性支持物上形成极化单层上皮细胞,可以模拟肠上皮用于物质的吸收转运机制研究[1-2],也常用于多聚免疫球蛋白受体(Polymeric immunoglobulin receptor,pIgR)跨黏膜上皮细胞转运抗体等相关研究[3-4]。鱼类pIgR是黏膜免疫防御系统的重要组成成分,能够转运多聚免疫球蛋白到外分泌液中形成分泌型抗体,在黏膜表面发挥免疫保护功能[5]。由于MDCK细胞不表达内源性多聚免疫球蛋白受体[6],在哺乳动物的研究中,利用转染技术建立稳定表达外源性pIgR的MDCK细胞作为体外模型,在细胞水平上进行pIgR对多聚免疫球蛋白的极性转运过程的研究已较为成熟[7-8],但是鱼类pIgR介导多聚免疫球蛋白跨上皮细胞的转运过程尚不明确,已建立的稳定表达外源性鱼类pIgR的体外研究模型也较少。我们前期克隆表达分析了牙鲆(Paralichthys olivaceus)pIgR[9],正在通过构建稳定表达牙鲆pIgR的MDCK细胞模型研究pIgR介导黏膜抗体分泌的过程,但是发现脂质体瞬时转染MDCK细胞的转染效率极低[10],严重影响稳定转染细胞的筛选。因此,急需改进脂质体瞬时转染MDCK细胞的方法,弄清转染条件对转染效率和细胞活力的影响,以获得最佳转染方法和条件,用于后续稳定转染细胞模型的构建。
转染是指将外源基因(如DNA、RNA等)导入真核细胞使该基因在细胞中表达的过程,在生物学研究中,将功能核酸引入细胞是研究蛋白功能的重要手段[11]。目前常用的转染方法有脂质体法、电穿孔法、病毒载体法等[12]。在选择基因传递方法时,主要考虑三个重要因素:1)成本的有效性和易用性;2)缺乏毒性和免疫原性;3)转染和基因表达的效率。但是,目前为止没有一个转染方法能够同时满足这三个标准[13]。近年来,阳离子脂质体转染技术发展较快,由于具有操作方法简单、细胞毒性相对较小、安全性好、试剂商品化等优点,被许多实验采用,但不足之处是转染效率普遍较低,对细胞类型有选择性[14-15]。因此,本文通过改进脂质体转染MDCK细胞的方法,研究不同DNA用量、脂质体/DNA比例和悬浮孵育时间等转染参数下的转染效率和细胞活力,以得到转染效率高、细胞活力好的转染条件,为筛选建立稳定表达鱼类pIgR的MDCK细胞系提供基础资料。
1 材料与方法 1.1 实验材料MDCK strain Ⅱ细胞(ATCC CRL-2936)购自美国模式培养物集存库(ATCC);真核表达载体pCI-neo-EGFP保存于本实验室-80 ℃超低温冰箱。
无内毒素质粒抽提试剂盒购于TIANGEN公司。MEM、Opti-MEM细胞培养液,胎牛血清(FBS)购自Gibco公司。Lipofectamine 3000 Reagent购自Thermo Fisher Scientific。Cell Counting Kit-8(CCK-8)购自Abbkine公司。
1.2 转染质粒制备与细胞培养将实验室-80 ℃保存的真核表达载体pCI-neo-EGFP表达菌在含有50 μg/mL氨苄青霉素的普通液体培养基中扩大培养,使用无内毒素质粒抽提试剂盒提取真核质粒,NanoDrop 8000测定质粒浓度及纯度,1%琼脂糖凝胶电泳检测质粒质量。用超纯水调整质粒浓度至400 ng/μL以上,在生物安全柜内经0.22 μm一次性滤器过滤后分装冻存于-20℃冰箱备用。
复苏后的MDCK细胞用含有10% FBS和1%青-链霉素混合双抗的MEM完全培养液培养在37 ℃、5% CO2培养箱,每2天传代一次,当培养至10~15代时显微镜观察细胞生长状态,开始转染实验。
1.3 脂质体常规转染常规转染按照Lipofectamine 3000 Reagent说明书操作。转染前一天,以3×105~4×105 cells/mL的细胞密度接种到6孔培养板上,使转染当天细胞密度达到85%~90%融合。配制DNA-脂质体转染复合物,每孔250 μL(溶液1:125 μL Opti-MEM细胞培养液+7.5 μL lipofectamine 3000;溶液2:125 μL Opti-MEM细胞培养液+2.5 μg质粒+5 μL P 3000;将溶液1与溶液2混合),室温下静置15 min。将6孔板中的细胞用0.01 mol/L无菌磷酸盐缓冲液(PBS,pH=7.4)冲洗2遍后,加入2 mL Opti-MEM细胞培养液;将配制的转染复合物逐滴加入孔中,摇动培养板,轻轻混匀;37 ℃、5% CO2培养36 h,在倒置荧光显微镜488 nm激发波长下观察转染水平,并使用流式细胞术测定细胞转染效率。
1.4 脂质体悬浮法转染转染前一天传代,转染当天将细胞消化下来,调整细胞浓度为6孔细胞培养板每孔2×106 cells,1 000 r/min离心5 min去上清,保留细胞沉淀。用配制的DNA-脂质体转染复合物重悬细胞,37 ℃细胞培养箱内孵育20 min后加2 mL Opti-MEM接种到6孔培养板上。37 ℃条件下5% CO2培养36 h,倒置荧光显微镜观察,并使用流式细胞术测定转染效率。
1.5 悬浮法转染条件优化转染前一天传代,转染当天将MDCK细胞消化下来,调整细胞浓度为24孔细胞培养板每孔5×105 cells,1 000 r/min离心5 min去上清,保留细胞沉淀。配制DNA-脂质体转染复合物时,溶液1和溶液2中Opti-MEM用量为50 μL,转染条件设置32个优化条件分组:DNA用量分为0.25、0.5、0.75和1 μg共4组,脂质体/DNA比例分为2:1、3:1、4:1和5:1共4组,每组3个平行。将溶液1与溶液2混合,室温下静置15 min。用配制的转染复合物将上述各组细胞重悬,37 ℃条件下细胞培养箱内分别孵育20和40 min,加1 mL Opti-MEM,取900 μL细胞接种到24孔培养板上,37 ℃下5% CO2培养36 h,流式细胞术测定转染效率,使用CCK-8试剂盒检测细胞活力。
1.6 流式细胞术将转染36 h后的MDCK细胞用PBS冲洗一遍,胰酶消化后,完全培养基重悬细胞,室温下1 000 r/min离心3 min,用PBS重悬过筛。将在流式细胞仪前散射(FSC)/侧散射(SSC)的散点图中呈现的明显细胞群进行设门(Gate),圈入90%以上细胞,分析其荧光参数。Gate中细胞的荧光参数情况显示于荧光强度直方图中,横轴为FL1通道荧光强度对数,纵轴为相对细胞数量。以未转染组细胞为阴性对照,分别叠加转染组检测的荧光强度曲线,设置Marker(M),使阴性对照99%以上的细胞位于阴性范围内,M内细胞即为有绿色荧光蛋白表达的转染阳性细胞。
1.7 细胞活力检测使用CCK-8试剂盒检测细胞活力。取每个分组转染孵育后的细胞悬液用Opti-MEM调整细胞浓度,接种到96孔板,使每孔细胞数量为5×105个细胞,每组3个平行。96孔板最边缘一圈不接种细胞,分别设置3个只有培养液的空白孔和3个未转染细胞的对照孔,将培养板在37 ℃下5% CO2培养箱孵育24 h后,更换培养液为MEM细胞培养液,向每孔加入10 μL CCK溶液。将培养板在37 ℃下5% CO2培养箱内孵育1 h,用酶标仪测定在450 nm处的OD值。细胞活力计算公式如下:
| $ \ \ \ \ \ {\rm{细胞活力}}\left( {\rm{\% }} \right) = [{\rm{ }}({A_{\rm{s}}} - {A_{\rm{b}}})/({A_{\rm{c}}} - {A_{\rm{b}}})] \times \\ 100{\rm{\% }}。$ |
式中:As:实验孔OD值(含有转染细胞的培养基、CCK-8);Ac:对照孔OD值(含有未转染细胞的培养基、CCK-8);Ab:空白孔OD值(不含有细胞的培养基、CCK-8)。
1.8 统计分析利用Origin 8.0软件分别绘制转染效率和细胞活性的柱状图,所得数据表示为均值±标准误的形式(x±SE)。用SPSS 20.0软件的单因素方差分析(One-way ANOVA)和Duncan多重比较分析转染效率之间的差异水平,P<0.05为显著性差异。
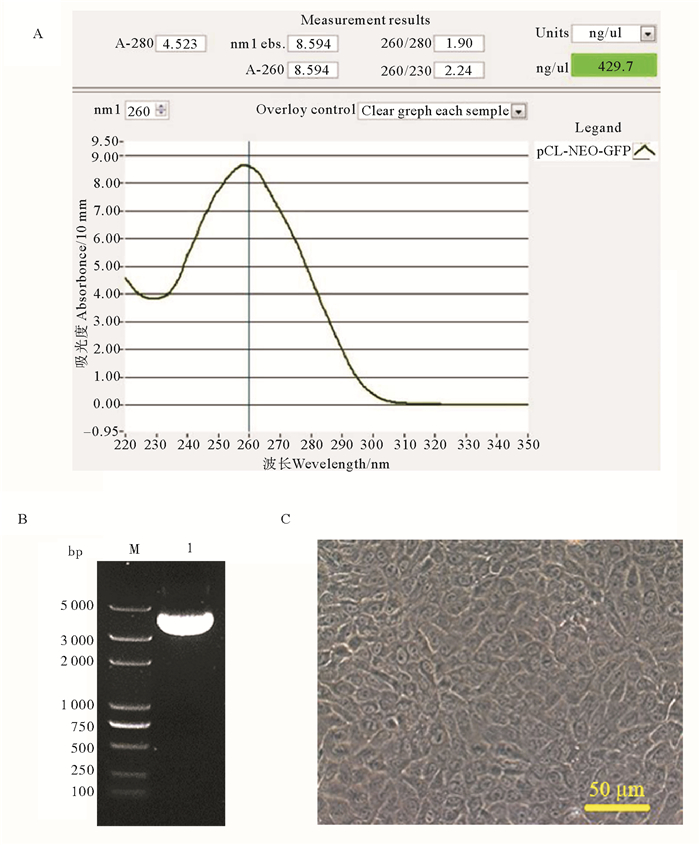
2 结果 2.1 转染质粒提取和MDCK细胞培养结果提取的真核质粒pCI-neo-EGFP经Nanodrop 8000检测(见图 1A)显示质粒在260 nm处有最高峰,A 260/280约为1.90,表明没有RNA、蛋白质、酚等污染;A 260/230约为2.24,表明无胍盐及有机溶剂残留,且质粒浓度较高为429.7 ng/μL;琼脂糖凝胶电泳结果显示(见图 1B),质粒条带清晰,无降解,在小于5 000 bp处有一条最明亮的主条带,结合pCI-neo-EGFP理论值大小为6220 bp可推断所提取的质粒至少90%以上为超螺旋构象。综上表明所提质粒质量好,符合转染要求。
|
(A. Nanodrop 8000测质粒浓度及纯度;B. pCI-neo-EGFP质粒琼脂糖凝胶电泳图,M:DL5000 DNA Marker,1:真核质粒;C. 10~15代的MDCK细胞。A. The concentration and purity of plasmid by Nanodrop 8000 assay; B. The agarose gel electrophoresis result of plasmid pCI-neo-EGFP,M: DL5000 DNA Marker, 1: Eukaryotic plasmid; C. MDCK cells from 10th to 15th generation.) 图 1 pCI-neo-EGFP质粒提取和犬肾上皮连续细胞系培养结果(MDCK strain Ⅱ ATCC CRL-2936) Fig. 1 pCI-neo-EGFP plasmid and Madin-Darby canine kidney cell lines (MDCK strain Ⅱ ATCC CRL-2936) |
在显微镜下观察复苏后10~15代的MDCK细胞(见图 1C),形态规则,呈铺路石状紧密排列,中央有扁圆形细胞核,细胞贴壁较紧,增殖较快,生长旺盛,可用于转染。
2.2 常规法与悬浮法转染效果的比较转染后36 h,在倒置荧光显微镜下观察细胞转染效果,常规法转染的MDCK细胞受lipofectamine 3000毒性影响,细胞状态较差,上清中漂浮的死细胞较多,呈圆形,并且表达绿色荧光的细胞多为漂浮的死细胞(见图 2A)。悬浮法转染后,细胞状态好,漂浮的死细胞较少,荧光显微镜下可见绿色荧光蛋白在贴壁细胞的细胞质和细胞核内均有表达(见图 2B)。

|
(A.常规法转染的细胞488通道(EGFP)、明视野(BF)及叠加图(Merge);B.悬浮法转染的细胞488通道(EGFP)、明视野(BF)及叠加图(Merge);标尺=50 μm。A. Cells transfected by conventional method at the GFP channels (EGFP), bright field (BF) and their merged picture (Merge); B. Cells transfected by suspension method at the GFP channel (EGFP), bright field (BF) and their merged picture (Merge). Bar=50 μm.) 图 2 脂质体瞬时转染36 h后荧光显微镜观察结果 Fig. 2 Fluorescence microscope observation after liposome transient transfection for 36 h |
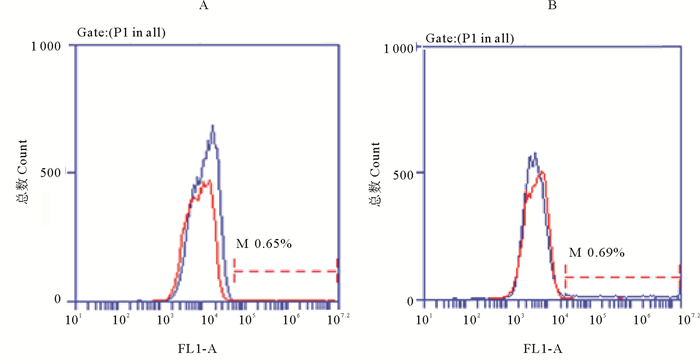
流式细胞术检测结果显示,常规转染后消化下来的贴壁细胞转染效率极低,仅为0.65%(见图 3A),难以用于下一步的稳定转染筛选。悬浮法转染后消化下来的贴壁细胞转染效率为6.9%,显著高于常规转染法(见图 3B)。
|
(A.常规转染法细胞荧光强度直方图;B.悬浮法转染细胞荧光强度直方图;横坐标代表细胞在FL1通道的荧光强度,纵坐标代表对应荧光强度下的细胞数量,红线为阴性对照组,蓝线为转染组,M指示转染细胞阳性比例。A. The histogram of fluorescence intensity of MDCK cells transfected by conventional transfection method; B. The histogram of fluorescence intensity of MDCK cells transfected by suspension transfection method. The abscissa represented the fluorescence intensity of the cell in the FL1 channel, and the ordinate represented the number of cells in the corresponding fluorescence intensity. The red and blue line represented the negative control and transfection group respectively. M indicated the proportion of positive cells transfected.) 图 3 常规转染法与悬浮法转染36 h后细胞流式细胞术检测结果 Fig. 3 Cell flow cytometry results after transfection for 36 h with conventional transfection and suspension transfection method |
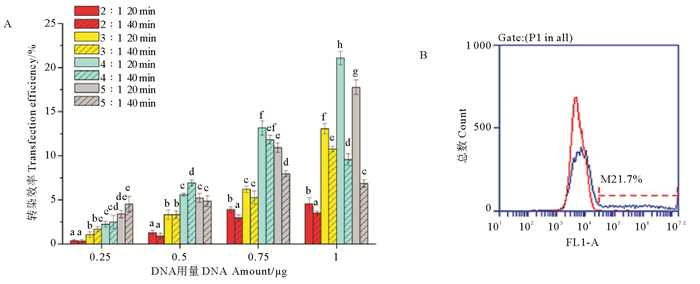
对悬浮法转染所用的DNA用量、脂质体/DNA比例和悬浮孵育时间3个参数进行优化,由流式细胞术测得32个参数组合的转染效率(见图 4A)。结果显示,当DNA用量为0.25 μg时,转染效率与脂质体/DNA比例及悬浮孵育时间成正比,在脂质体/DNA比例为5:1、悬浮孵育40 min时的转染效率最高,为4.53% ± 0.87%。然后随着DNA用量增加,转染效率与DNA用量呈现正相关依赖关系;在DNA用量相同时,转染效率随着脂质体/DNA比例的升高而呈现先上升后下降的趋势。DNA用量为0.5 μg时,脂质体/DNA比例为4:1、悬浮孵育40 min组的转染效率最高(6.93% ± 0.33%)。当DNA用量为0.75和1 μg时,悬浮孵育20 min组的转染效率峰值均高于40 min组,且最高值均出现在脂质体/DNA比例为4:1时,分别为13.17% ± 0.81%和21.07% ± 0.76%;悬浮孵育40 min条件下,分别在脂质体/DNA比例为4:1和3:1时转染效率最高(11.83% ± 0.5%和10.77% ± 0.31%)。综合32个参数组的结果,DNA用量为1 μg、脂质体/DNA比例为4:1、悬浮孵育时间为20 min时,转染效率最高(见图 4B)。
|
(A. 32个优化条件分组的转染效率,图中不同的字母表示在DNA用量相同时各组转染效率的差异性(P<0.05;n=3)。B.转染效率最高时的细胞荧光强度直方图。A. Transfection efficiency under the 32 optimized condition groups. Different letters denote significant differences among groups at the same time(P<0.05, n=3). B. The histogram of fluorescence intensity of cells with the highest transfection efficiency.) 图 4 悬浮法不同转染条件下的转染效率 Fig. 4 Transfection efficiency under different transfection conditions by suspension method |
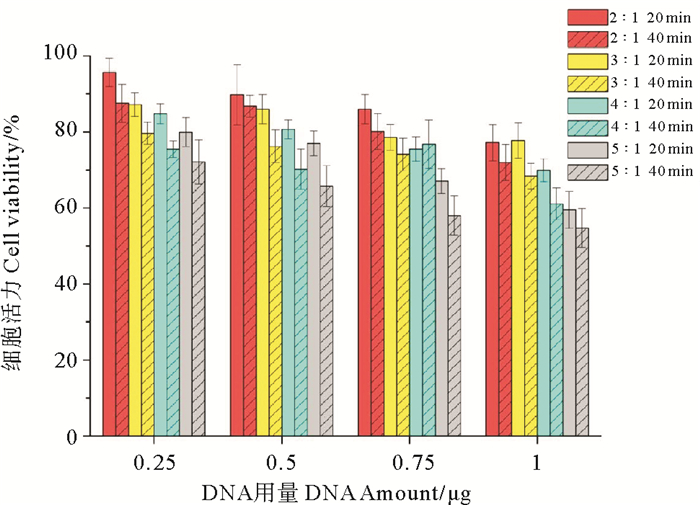
用CCK-8试剂盒检测不同转染条件下的细胞活力,结果显示,细胞活力随DNA用量的增加、脂质体/DNA比例的提高和悬浮孵育时间的延长而降低(见图 5)。当DNA用量(0.25 μg)和脂质体/DNA比例(2:1)最低、悬浮孵育20 min时细胞活力最高(95.67% ± 3.72%),而DNA用量(1 μg)和脂质体/DNA比例(5:1)最高、悬浮孵育40 min时,细胞活力最差(54.74% ± 5.06%)。转染效率最高(DNA 1 μg、脂质体/DNA比例4:1、悬浮孵育20 min)时的细胞活力为69.95% ± 3.01%。
|
图 5 悬浮法不同转染条件下的细胞活力 Fig. 5 Cell viability under different transfection conditions by suspension transfection method |
脂质体转染原理是表面带有正电荷的阳离子脂质体与带负电荷的DNA结合形成DNA-脂质体复合物,吸附在带负电荷的细胞膜表面,借助细胞膜的内吞作用进入胞内[16]。因此不同类型细胞的转染效率受到细胞膜的带电量和脂类组成的限制,也与细胞的通透性和吸收颗粒的能力有关[17-18]。研究者通常从这些特性着手,对常规的脂质体转染方法进行改进。尹晓光等[19]在脂质体介导的细胞转染过程中,通过玻璃滴管吹吸细胞悬液的机械外力作用,造成细胞膜的瞬间损伤,以增加DNA进入细胞的机会。Zhang等[20]在没有细胞培养液的情况下,直接用DNA-脂质体转染复合物重悬细胞沉淀,孵育20 min后接种贴壁细胞,大大提高了小鼠脑神经细胞、人类鼻咽癌细胞、人类胎盘纤维细胞和小鼠胚胎干细胞的转染效率。有学者为提高细胞的整体通透性,使用刚复苏、细胞密度较低的细胞进行转染,增加了DNA-脂质体转染复合物进入胞内的机会[21]。本文中MDCK细胞贴壁紧密,DNA-脂质体转染复合物较难进入胞内,因此使用常规转染方法时转染效率极低,只有在漂浮的死细胞中可见绿色荧光蛋白的表达,通过将转染方式改进为悬浮法,将MDCK细胞消化下来,悬浮在转染复合物中全方位接触转染试剂,有利于更多的质粒DNA被内吞进入细胞,从而显著提高了转染效率。
获得高质量的质粒和状态良好、生长旺盛的细胞是转染成功的关键。本文制备的质粒纯度好,超螺旋比例高,有利于脂质体的瞬时转染;经过除内毒素亲和柱处理,不仅可以提高转染效率,还可以避免内毒素对细胞产生的毒性影响[22]。维持转染细胞良好的生长状态同样是提高转染效率的重要条件,本文使用复苏后15代以内、处于指数生长期的MDCK细胞,并在转染前一天传代使它们处于分裂旺盛的状态。对于常规转染法,细胞在转染当天的汇合程度对最终转染效果有很大影响,细胞密度过高或过低均会使转染效率降低,一般选用细胞汇合度为70%~90%[23]。而本文改进的悬浮法由于细胞在悬浮状态下与DNA-脂质体转染复合物孵育一段时间再接种到培养板上,排除了细胞汇合度对转染效率的影响。
DNA用量和脂质体/DNA比例是影响转染效率的两个至关重要的因素,决定了转染复合物的颗粒大小和表面电荷[24]。本文中增加DNA用量和脂质体/DNA比例,转染效率呈现升高的趋势,但脂质体/DNA比例超过一定值后转染效率却下降,这可能是由于细胞吸收DNA量具有一定饱和度,过量DNA可能会对细胞产生毒性[25]。脂质体/DNA比例对DNA-脂质体复合物的粒径和电荷有影响,进而影响到转染效率[4],阳离子脂质体由于带有很强的正电荷,会导致细胞膜损伤。当脂质体浓度过高,或者与高浓度的DNA-脂质体复合物孵育时间过长时,会造成细胞形态的变化,甚至细胞漂浮死亡,贴壁细胞的转染效率也因此降低[26-28]。本文中DNA用量为1 μg、脂质体与DNA比例为4:1、悬浮孵育时间为20 min时转染效率最高。
细胞活力是脂质体转染效果的重要评价指标之一,使用GFP作为真核细胞转染的报告基因,采用倒置荧光显微镜和流式细胞术能简便、高效、可靠地观察转染效果,不需要额外的组织化学染色[29]。但是通过流式细胞术对细胞活力进行分析的结果可能有误差,因为只有在转染换液和胰蛋白酶消化之后存活的细胞才被检测到[30],漂浮的阳性细胞在流式检测之前可能会丢失,这可能也是常规转染阳性率极低的一个原因。本文采用CCK-8细胞毒性试剂盒,操作简便,灵敏度高,细胞活力检测发现在DNA用量(0.25 μg)和脂质体/DNA比例最低(2:1)、悬浮孵育20 min时细胞活力最高(95.67% ± 3.72%),随脂质体和DNA用量的提高、孵育时间的延长,细胞活力逐渐降低;而转染效率最高时,细胞活力为69.95% ± 3.01%,因此,需要综合考虑细胞活力和转染效率来选择合适的转染条件。
本文建立的脂质体悬浮法转染MDCK细胞的转染效率显著高于常规法,而且转染时不受贴壁细胞汇合度的影响。优化了DNA用量、脂质体/DNA比例和悬浮孵育时间等条件参数,综合转染效率和细胞活力研究结果,确定最优条件组合为DNA用量1 μg、脂质体与DNA比例4:1、悬浮孵育20 min时,所得转染效率最高,为21.07% ± 0.76%,细胞活力为69.95% ± 3.01%。
| [1] |
Irvine J D, Takahashi L, Lockhart K, et al. MDCK (Madin-Darby canine kidney) cells: A tool for membrane permeability screening[J]. Journal of Pharmaceutical Sciences, 1999, 88(1): 28. DOI:10.1021/js9803205
(  0) 0) |
| [2] |
亓宏, 巫冠中. 药物跨膜转运细胞模型影响因素及应用[J]. 现代生物医学进展, 2014, 14(25): 4987-4990. QI Hong, WU Guanzhong. Important applications and influence factors of cell monolayers in the study of the drug transport[J]. Progress in Modern Biomedicine, 2014, 14(25): 4987-4990. (  0) 0) |
| [3] |
Claypool S M, Dickinson B L, Yoshida M, et al. Functional reconstitution of human FcRn in Madin-Darby canine kidney cells requires co-expressed human beta 2-microglobulin[J]. Journal of Biological Chemistry, 2002, 277(31): 28038-28050. DOI:10.1074/jbc.M202367200
(  0) 0) |
| [4] |
康赐明, 陈远志, 王一文, 等. 稳定表达可视化hFcRn的MDCK细胞株构建[J]. 生物技术, 2017(2): 123-128. KANG Ciming, CHEN Yuanzhi, WANG Yiwen, et al. Establishment of MDCK cell lines which stably express visualable human neonatal Fc receptor[J]. Biotechnology, 2017(2): 123-128. (  0) 0) |
| [5] |
Kaetzel C S. The polymeric immunoglobulin receptor: Bridging innate and adaptive immune responses at mucosal surfaces[J]. Immunological Reviews, 2005, 206(1): 83-99.
(  0) 0) |
| [6] |
Emmerson C D, Van d V E J, Braam M R, et al. Enhancement of polymeric immunoglobulin receptor transcytosis by biparatopic VHH[J]. PLoS One, 2011, 6(10): E26299. DOI:10.1371/journal.pone.0026299
(  0) 0) |
| [7] |
Mostov K, Su T, Beest M T. Polarized epithelial membrane traffic: Conservation and plasticity[J]. Nature Cell Biology, 2003, 5(4): 287-93. DOI:10.1038/ncb0403-287
(  0) 0) |
| [8] |
Zuo T, Feng X, Zhang N, et al. Establishment of a functional secretory IgA transcytosis model system in vitro for functional food screening[J]. Applied Microbiology and Biotechnology, 2015, 99(13): 5535-5545. DOI:10.1007/s00253-015-6501-9
(  0) 0) |
| [9] |
Xu G J, Zhan W B, Ding B J, et al. Molecular cloning and expression analysis of polymeric immunoglobulin receptor in flounder (Paralichthys olivaceus)[J]. Fish & Shellfish Immunology, 2013, 35(3): 653-660.
(  0) 0) |
| [10] |
马永贺. FcRn胞质尾区序列影响小鼠IgG代谢和转运的研究[D].北京: 中国农业大学, 2017. MA Yonghe. Effects of the FcRn Cytoplasmic Tail on IgG Metabolism and Transfer in Mice[D]. Beijing: China Agricultural University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10019-1017294794.htm (  0) 0) |
| [11] |
Wasungu L, Hoekstra D. Cationic lipids, lipoplexes and intracellular delivery of genes[J]. Journal of Controlled Release, 2006, 116(2): 255-264. DOI:10.1016/j.jconrel.2006.06.024
(  0) 0) |
| [12] |
赵云鹤, 王若楠, 杨桂姣, 等. 脂质体介导转染N2a细胞的优化方法[J]. 中国组织工程研究, 2014, 18(29): 4669-4674. ZHAO Yunhe, WANG Ruonan, YANG Guijiao, et al. Optimization of N2a cell transfection mediated by liposome[J]. Chinese Journal of Tissue Engineering Research, 2014, 18(29): 4669-4674. DOI:10.3969/j.issn.2095-4344.2014.29.014 (  0) 0) |
| [13] |
Tao J, Ding W F, Che X H, et al. Optimization of a cationic liposome-based gene delivery system for the application of miR-145 in anticancer therapeutics[J]. International Journal of Molecular Medicine, 2016, 37(5): 1345. DOI:10.3892/ijmm.2016.2530
(  0) 0) |
| [14] |
Abul-Hassan K, Walmsley R, Boulton M. Optimization of non-viral gene transfer to human primary retinal pigment epithelial cells[J]. Current Eye Research, 2000, 20(5): 361-366. DOI:10.1076/0271-3683(200005)2051-1FT361
(  0) 0) |
| [15] |
高岑, 史书龙, 张旭, 等. 脂质体介导法转染mIMCD-3细胞的可行性及最佳转染条件[J]. 中国组织工程研究, 2011, 15(15): 2739-2742. GAO Cen, SHI Shulong, Zhang Xu, et al. Optimization of transfection efficiency of mIMCD-3 cells mediated by liposome[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2011, 15(15): 2739-2742. DOI:10.3969/j.issn.1673-8225.2011.15.019 (  0) 0) |
| [16] |
Wang W, Li W, Ma N, et al. Non-viral gene delivery methods[J]. Current Pharmaceutical Biotechnology, 2013, 14(1): 46-60.
(  0) 0) |
| [17] |
Bailey A L, Cullis P R. Membrane fusion with cationic liposomes: Effects of target membrane lipid composition[J]. Biochemistry, 1997, 36(7): 1628-1634. DOI:10.1021/bi961173x
(  0) 0) |
| [18] |
Coppola S, Cardarelli F, Pozzi D, et al. The role of cytoskeleton networks on lipid-mediated delivery of DNA[J]. Therapeutic Delivery, 2013, 4(2): 191-202. DOI:10.4155/tde.12.151
(  0) 0) |
| [19] |
尹晓光, 吴秀丽, 万敏, 等. 脂质体介导哺乳动物细胞转染的改良方法[J]. 中国免疫学杂志, 2007, 23(3): 260-262. YIN Xiaoguang, WU Xiuli, Wan Min, et al. The modified method of Lipofectin mediated transfer to mammal cell[J]. Chinese Journal of Immunology, 2007, 23(3): 260-262. DOI:10.3321/j.issn:1000-484X.2007.03.017 (  0) 0) |
| [20] |
Zhang M, Guller S, Huang Y. Method to enhance transfection efficiency of cell lines and placental fibroblasts[J]. Placenta, 2007, 28(8): 779-782.
(  0) 0) |
| [21] |
王华, 尹晓光, 王莉, 等. 用线性载体稳定转染P815细胞的脂质体转染方法的优化[J]. 吉林大学学报(医学版), 2008, 34(4): 721-724. WANG Hua, YIN Xiaoguang, WANG Li, et al. Optimization of liposomal transfection methods for stably transfecting P815 cells with linear vectors[J]. Journal of Jilin University (Medicine Edition), 2008, 34(4): 721-724. (  0) 0) |
| [22] |
De L V J, Braak B T, Azzoni A R, et al. Impact of plasmid quality on lipoplex-mediated transfection[J]. Journal of Pharmaceutical Sciences, 2013, 102(11): 3932-3941. DOI:10.1002/jps.23709
(  0) 0) |
| [23] |
Dass C R. Lipoplex-mediated delivery of nucleic acids: factors affecting in vivo transfection[J]. Molecular Medicine, 2004, 82(9): 579-591.
(  0) 0) |
| [24] |
Neuhuber B, Huang D I, Daniels M P, et al. High efficiency transfection of primary skeletal muscle cells with lipid-based reagents[J]. Muscle & Nerve, 2002, 26(1): 136-140.
(  0) 0) |
| [25] |
潘宁, 章蔼然, 侯颖春. 脂质体介导法转染肿瘤细胞效率的优化[J]. 生物技术, 2008, 18(6): 47-50. PAN Ning, ZHANG Airan, HOU Yingchun. Optimization of transfection efficiency of tumor cell mediated by liposome[J]. Biotechnology, 2008, 18(6): 47-50. (  0) 0) |
| [26] |
叶寒青, 陈松林, 沙珍霞. 三种脂质体介导的花鲈胚胎干细胞转化效率的比较[J]. 水产学报, 2006, 30(6): 721-726. YE Hanqing, CHEN Songlin, SHA Zhenxia. Comparison of efficiency of three lipsomes mediated transformation to embryonic stem cells derived from Lateolabrax japonicas[J]. Journal of Fisheries of China, 2006, 30(6): 721-726. (  0) 0) |
| [27] |
粟文俊, 蒋泓, 唐冬生, 等. 脂质体转染巴马猪胎儿成纤维细胞条件的优化[J]. 中国农学通报, 2011, 27(7): 300-303. SU Wenjun, JIANG Hong, TANG Dongsheng, et al. Optimization of parameters of exogene transfection of Luchuan Pig fetal fibroblasts in vitro mediated by liposome[J]. Chinese Agricultural Science Bulletin, 2011, 27(7): 300-303. (  0) 0) |
| [28] |
李凤娥, 向国艳, 孔繁利, 等. pEGFP-N1脂质体转染方法的优化及其应用[J]. 吉林大学学报(医学版), 2016, 42(3): 612-616. LI Fenge, XIANG Guoyan, KONG Fanli, et al. Optimization of liposome-mediated transfection of pEGFP-N1 and its applification[J]. Journal of Jilin University (Medicine Edition), 2016, 42(3): 612-616. (  0) 0) |
| [29] |
Van Tendeloo V F I, Ponsaerts P, Van Broeckhoven C, et al. Efficient generation of stably electrotransfected human hematopoietic cell lines without drug selection by consecutive FAC sorting[J]. Cytometry, 2000, 41(1): 31. DOI:10.1002/(ISSN)1097-0320
(  0) 0) |
| [30] |
Dodds E, Dunckley M G, Naujoks K, et al. Lipofection of cultured mouse muscle cells: A direct comparison of Lipofectamine and DOSPER[J]. Gene Therapy, 1998, 5(4): 542-551. DOI:10.1038/sj.gt.3300604
(  0) 0) |
 2018, Vol. 48
2018, Vol. 48


