中华绒螯蟹(Eriocheir sinensis)俗名河蟹,为方蟹科(Grapsidae)绒螯蟹属(Eriocheir)的重要经济甲壳品种之一,主要分布在我国东部自辽宁至福建各省的通海水域中,是传统的水产养殖珍品,2019年养殖河蟹产量达到77.87万t[1]。河蟹养殖主要集中在长江中下游的江苏、湖北、安徽等地,2016年起农业农村部大力推广稻渔综合种养,促进了黄河以北地区河蟹养殖业的发展。目前河蟹已成为华北和东北地区稻渔综合种养的重要养殖经济品种。随着养殖规模的扩大,病害问题随之而来。2020年4—5月,天津地区引自辽宁盘锦地区的扣蟹暂养期间大规模发病死亡,发病率可达90%,死亡率在50%以上。病蟹的典型特征为步足关节膜处呈乳白色,围心腔内可见大量白色乳状液体,“牛奶病”由此得名。
国内外关于中华绒螯蟹病害的研究报道并不多。杨宗英等[2-3]对中华绒螯蟹肝胰腺坏死综合症(水瘪子病)发病原因及致病机理进行深入研究,认为该病为非病原性疾病,主要诱因为菊酯类等药物对蟹肝胰腺造成的不可逆损伤。另一种对河蟹造成严重危害的疾病为河蟹“颤抖病”,病原为中华绒螯蟹螺原体(Spiroplasma eriocheiris)[4]。河蟹“牛奶病”病症与许文军、王印庚、黄增荣等报道的三疣梭子蟹(Portunus trituberculatus) “牛奶病”、“乳化病”较为相似[5-9]。许文军等[6]从患病梭子蟹体内分离到一种酵母菌,通过生化特性分析将其鉴定为假丝酵母(Candida oleophila),证实其为梭子蟹肌肉“乳化病”的病原。史海东等[10]认为冬季暂养期间梭子蟹“牛奶病”的病原为假丝酵母,但8—10月高水温期间梭子蟹“牛奶病”的病原则为血卵涡鞭虫(Hematodinium sp.),这与王印庚等[9]的报道一致,同时王印庚等还报道了一种由微孢子虫引起梭子蟹肌肉白浊病(也称牙膏病)。黄增荣从患“牛奶病”的梭子蟹体内分离到溶藻弧菌(Vibrio alginolyti-cus)、哈维氏弧菌(V. harveyi)、恶臭假单胞菌(Pseudo- monas putida),人工感染试验证实3株菌均对三疣梭子蟹有明显的致病作用[8]。王国良等[7]则认为溶藻弧菌和葡萄牙假丝酵母(Candida lusitaniae) 为梭子蟹肌肉“乳化病”的病原菌,其中溶藻弧菌为引起梭子蟹死亡的主致病病原,葡萄牙假丝酵母为继发感染引起梭子蟹出现牛奶样病变的病原。
2020年10月,马红丽等[11]首次报道了辽宁地区的河蟹“牛奶病”,从病蟹体内分离到病原菌,通过浸浴感染试验证实其对河蟹的致病性,病原菌经18S rRNA序列分析及部分生理生化特性鉴定为二尖梅奇酵母(Metschnikowia bicuspidate)。Bao等[12]于2021年报道了辽宁地区的河蟹“牛奶病”,通过注射感染试验证实其对河蟹的致病性,病原菌经26S rRNA基因序列分析鉴定为二尖梅奇酵母,并观察了病蟹心脏、鳃及肌肉的组织病理变化。为进一步确定河蟹“牛奶病”的病原,本文以发病河蟹作为研究材料,分离病原,构建了病原菌多个基因的系统发育树,对病原的生理生化特性进行详细分析,并排除其它病原的混合感染,采用不同感染方式进一步确认了病原菌的致病性,调研了该病的流行情况,以期为河蟹“牛奶病”的防治提供科学依据。
1 材料方法 1.1 病蟹来源病蟹取自天津宝坻区黄庄镇、八门城镇河蟹暂养池,平均体质量为(8.6±0.4) g,扣蟹于2020年4月8日购自辽宁盘锦地区,暂养十余天后陆续发病死亡,暂养密度为375~1 500 kg/hm2,暂养期间投喂河蟹配合饲料(蛋白含量36%,来自于沈阳禾丰水产饲料有限公司)。健康蟹取自天津宝坻区,为2019年购自盘锦光合蟹业有限公司的大眼幼体在本地区养成的扣蟹,平均体质量(7.8±0.6) g,经检测不携带特定病原后用于人工感染实验。
1.2 主要仪器和试剂光学显微镜(Olympus BX51),扫描电子显微镜(HitachiSU8100),组织切片及染色系统来自于Leica Biosystems。BHI培养基、孟加拉红培养基、TCBS培养基等购自青岛海博生物。无维生素酵母基础培养基购自青岛日水生物技术有限公司。
1.3 病蟹初检活体解剖症状典型的濒死河蟹,取少量组织制作水浸片镜检,观察病蟹鳃、肝胰腺、肌肉中是否有寄生虫;抽取病蟹血淋巴涂片镜检;抽取河蟹围心腔内白色乳液涂片镜检,观察是否有寄生虫等。另取河蟹鳃及血淋巴,以快速DNA提取检测试剂盒(Tiangen)提取基因组DNA,采用PCR技术检测样品中是否携带中华绒螯蟹螺原体、对虾白斑综合征病毒(White spot syndrome virus, WSSV)、血卵涡鞭虫[13-15]。
1.4 病菌分离无菌条件下从病蟹肝胰腺、白色乳液中接菌,分别划线接种于BHI培养基、孟加拉红培养基、TCBS培养基,28 ℃培养24 h以上,挑取优势单菌落进一步纯化,保种备用。
1.5 人工感染实验挑取病原菌菌株单菌落于YPD液体培养基中培养48 h后,收集并洗涤菌体,采用平板倾注法计数,以无菌生理盐水调整菌悬液密度。
分别采用注射、浸浴、饲喂3种途径对健康河蟹进行人工感染,感染实验于体积为64 cm×46 cm×39 cm、水深30 cm的塑料箱中进行,分4组(3组实验组,1组对照组),每组25尾健康河蟹,连续充气,暂养7 d后进行感染实验。实验期间水温21 ℃,每日换水1/3,每日按河蟹体质量的2%投喂河蟹配合饲料。每天观察河蟹活动、摄食及记录死亡数量,取濒死蟹做病原菌分离。
注射组调整菌悬液密度为2×107 CFU/mL,以第4步足底节关节膜进行注射(50 μL/尾)。
浸浴组把体表无损伤的健康河蟹,用无菌剪刀去除1~2条步足,置于菌悬液密度为2×107 CFU/mL的水体中连续浸泡3 h,转入清水中养殖。
饲喂组调整菌悬液密度为2×108 CFU/mL,按2×107 CFU/g的量与河蟹配合饲料混合均匀,再加入生物藻胶搅拌,室温阴干1 h后于4 ℃冰箱保存,替代河蟹基础饲料每日投喂。
对照组注射等剂量的0.85%无菌盐水。
1.6 病原鉴定 1.6.1 形态观察挑取纯培养菌株,于YPD固体培养基上分区划线,于28 ℃培养48 h,观察菌落形态,革兰氏染色观察菌体形态。
1.6.2 生理生化特性应用法国生物梅里埃(Biomerieux)公司的VITEK2酵母菌鉴定卡进行,并参照《酵母菌的特征与鉴定手册》进行其它相关指标测定[16]。
1.6.3 分子生物学鉴定提取病原菌基因组DNA,采用通用引物18S1、18S2扩增病原菌18SrRNA基因,通用引物NL-1、NL-4扩增病原菌26SrRNA基因,通用引物ITS1、ITS4扩增病原菌ITS基因[5, 17]。PCR产物由生工Sangon Biotech进行测序。测序所得序列提交至GeneBank数据库中进行BLAST比对,根据返回的结果从GeneBank中选择同源性较高的菌株基因序列,采用Clustalx软件比对后,分别以18S rRNA、26S rRNA、ITS为遗传标记,用系统发育分析软件Mega X基于邻接法(Neighbor-joining) 构建系统发育树,Bootstraps重复检验1 000次。
1.7 扫描电镜样品制备取具有典型症状的濒死河蟹肝胰腺及肌肉,迅速分割成1 mm3的小块,2.5%戊二醛固定,4 ℃冰箱保存,经脱水干燥喷金后,HitachiSU8100扫描电子显微镜观察并拍照。
1.8 河蟹“牛奶病”的流行情况调查2020年4—10月,对天津地区养殖的河蟹“牛奶病”流行情况进行调查,分别采集养殖扣蟹样品15批551尾,成蟹样品27批345尾,采用孟加拉红培养基分离河蟹“牛奶病”病原,同时采用PCR技术检测河蟹是否同时感染WSSV[14]。
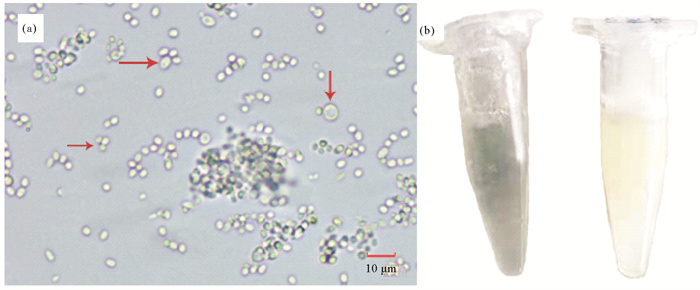
2 结果 2.1 病蟹典型症状与初步检查患病河蟹不食,活动力差,对外界刺激反应慢或基本不反应,步足散开僵直,螯足不再紧贴于身体前缘,行动缓慢,步足关节膜处呈白色,切断步足,断口处有乳白色液体流出。打开蟹盖,围心腔内蓄有大量白色乳液(见图 1(b)),因此养殖户称之为“牛奶病”。河蟹肝胰腺呈鲜黄色,三角瓣及心脏呈乳白色,部分河蟹鳃丝变黑,鳃水浸片发现鳃黏液中有大量病原菌,鳃丝排列混乱,已无正常的鳃结构。肝胰腺、心脏等组织的水浸片镜检也发现大量病原菌,河蟹围心腔内白色乳液涂片观察未见寄生虫,可见大量病原菌,行出芽生殖,单个或成簇存在(见图 2(a))。血淋巴也由蓝色变为乳白色(见图 2(b)),镜检发现河蟹血细胞数量极少,视野中均为病原菌。各组织镜检均未发现微孢子虫及血卵涡鞭虫。采用PCR技术检测收集的85尾病蟹样品所携带的病原,其中19尾样品WSSV检测结果呈阳性,占比22.35%,未检出螺原体及血卵涡鞭虫。

|
图 1 对照组正常蟹(a)与发病蟹(b)的解剖照片 Fig. 1 Photographs of healthy crab(a) and diseased crab(b) |
|
图 2 河蟹围心腔内白色乳液涂片(a)与正常蟹(左)与发病蟹(右)的血淋巴(b) Fig. 2 Photograph of pathogen from fresh smears of the milky liquid in crab pericardial cavity(a) and the hemolymph of healthy crab(left) and diseased crab(right)(b) |
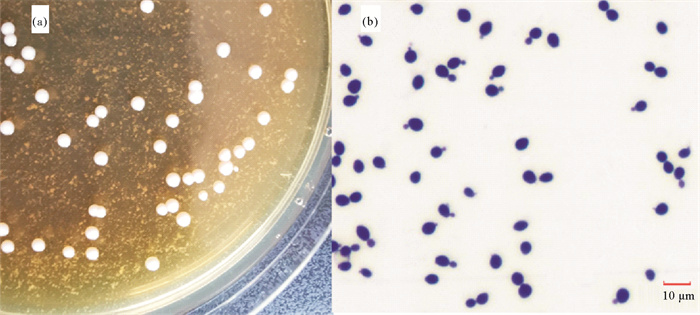
无菌条件下从病蟹的肝胰腺和围心腔内白色乳液中划线接菌,分别接种于不同平板培养基上。28 ℃培养24 h后,BHI、孟加拉红平板和TCBS平板上均无菌落生长,48 h后3种培养基上均出现大量形态一致的乳白色、圆形菌落,菌落湿润,边缘光滑(见图 3(a))。挑取单菌落进一步纯化,编码JMB-1,保种备用。
|
图 3 病原酵母JMB-1的菌落(a)及菌体形态(b) Fig. 3 Photograph of colonies(a) and cells(b) of the pathogenic yeast strain JMB-1 |
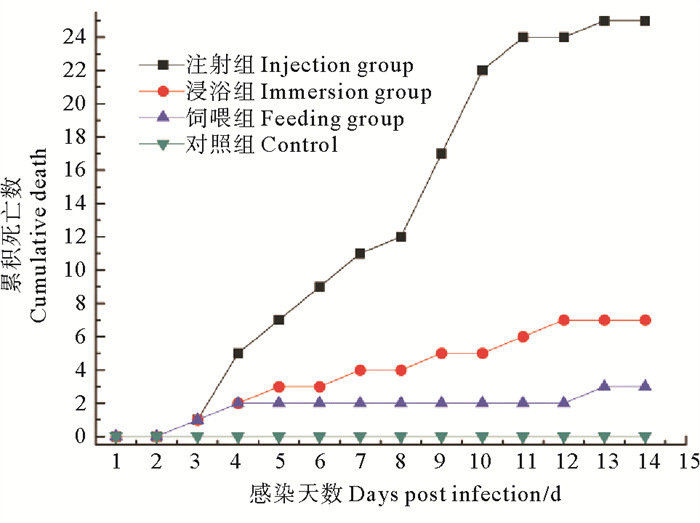
采用纯化后的菌株JMB-1进行人工感染实验,结果显示,河蟹感染后第3天各试验组均出现死亡,注射组河蟹第2天开始不再摄食,第7天观察到明显的行动反应迟缓,第9天、第10天死亡量最大,至第14天全部死亡,累积死亡率为100%,第6天死亡的河蟹出现明显的“牛奶病”症状,取人工感染发病蟹白色乳液涂片观察,可见大量与菌株JMB-1形态一致的菌体。浸浴组河蟹第3天即开始出现死亡,至14 d试验结束,累积死亡率为28%,初期死亡的河蟹,未表现出明显的牛奶病症状,但从其肝胰腺中分离到的菌株菌落及菌体形态与JMB-1一致,从第9天死亡的河蟹围心腔内观察到较为明显的白色乳液。饲喂组河蟹第3天开始出现死亡,摄食减少,至感染实验结束,累积死亡率为12%,但死亡河蟹未表现出明显的牛奶病症状。对照组至试验结束,无一死亡,摄食活动良好(见图 4)。
|
图 4 JMB-1菌株人工感染试验结果 Fig. 4 Results of the infection experiments of JMB-1 strain |
感染试验结束后从饲喂组剩余河蟹(22尾)肝胰腺分离病原,其中1尾河蟹处分离到的菌株与JMB-1菌落及菌体形态相同,占比4.5%。从浸浴组剩余河蟹(18尾)肝胰腺分离病原,其中3尾河蟹处分离到的菌株与JMB-1菌落及菌体形态相同,占比16.7%。
2.3 病原菌鉴定 2.3.1 菌体形态与生化特性挑取JMB-1单菌落于YPD液体培养基中,28 ℃培养48 h后培养液表面有菌膜,底部有白色菌体沉淀。滴片后革兰氏染色,显微镜下可见大量形态一致的、深蓝色圆形或卵圆形菌体,直径为3~7 μm,细胞大多单个存在,多边芽殖(见图 3(b))。菌株JMB-1生化指标检测结果见表 1,不利用硝酸盐、柠檬酸盐,能利用硫酸铵,不能水解尿素,重氮基蓝B(DBB)反应阴性,该菌的生理生化特征参照Barnett等[16]的《酵母菌的特征与鉴定手册》,与二尖梅奇酵母较为接近。
|
|
表 1 菌株JMB-1与二尖梅奇酵母生化特征的比较 Table 1 Comparison of physiological and chemical characteristics of strain JMB-1 and M. bicuspidata |
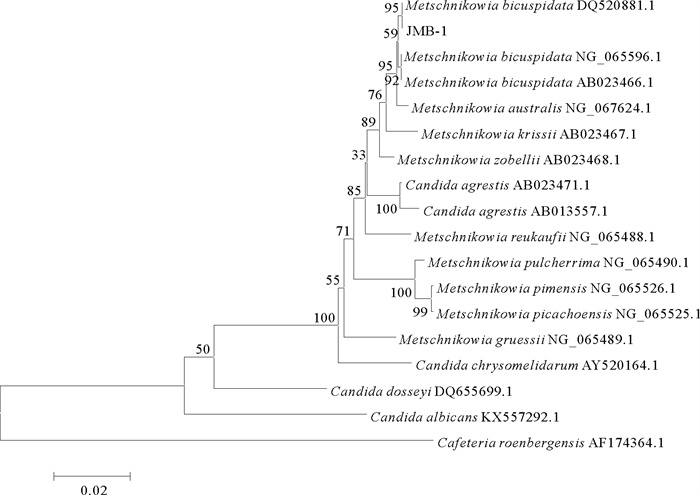
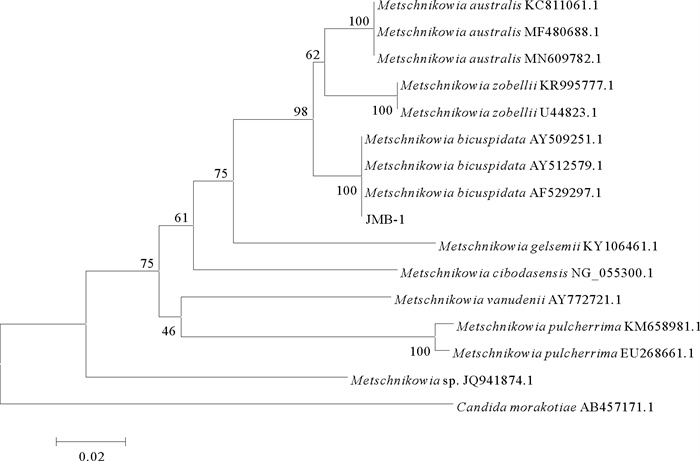
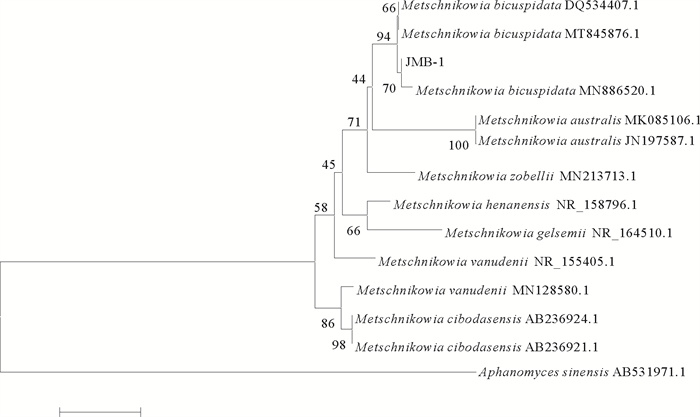
为确定菌株JMB-1的分类位置,扩增其18S rRNA基因、26S rRNA基因D1/D2区和ITS基因并测序。所获得的18S rRNA基因序列为1 704 bp,26S rRNA基因D1/D2区序列为506 bp,ITS基因序列为360 bp,提交至GeneBank数据库,登录号分别为MW793499、MW799824、MW793713。所得序列与NCBI序列数据库中已知酵母菌相应序列进行比对,结果显示所分离菌株JMB-1的3个基因与二尖梅奇酵母同源性均在98%及以上,表明其具有较近的亲缘关系。分别基于酵母菌18S rRNA基因、26S rRNA基因D1/D2区序列、ITS基因序列进行聚类分析构建系统进化树,均将病原菌JMB-1与二尖梅奇酵母聚为一支(见图 5~7)。
|
图 5 酵母菌JMB-1基于18S rRNA基因序列的聚类分析结果 Fig. 5 The tree of phylogenetic evolution of yeast strain JMB-1 based on the 18S rRNA sequences |
|
图 6 酵母菌JMB-1基于26S rRNA基因序列D1/D2区的聚类分析结果 Fig. 6 The tree of phylogenetic evolution of yeast strain JMB-1 based on the D1/D2 domain of 26S rRNA sequences |
|
图 7 酵母菌JMB-1基于ITS rRNA基因序列的聚类分析结果 Fig. 7 The tree of phylogenetic evolution of yeast strain JMB-1 based on the ITS rRNA sequences |
结合菌株JMB-1的形态、生理生化反应鉴定的结果,将此次河蟹“牛奶病”病原酵母JMB-1鉴定为二尖梅奇酵母。
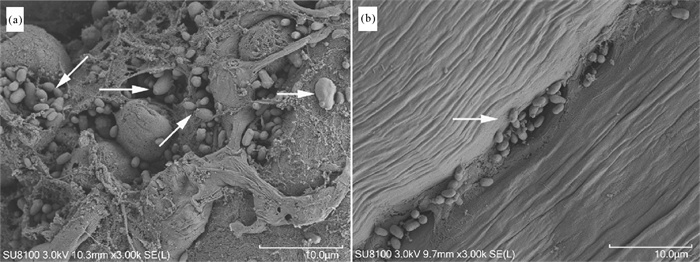
2.4 扫描电镜观察采用扫描电镜观察患病河蟹的肝胰腺和肌肉组织,结果显示患病河蟹的肝胰腺、肌肉组织间隙中均存在大量单一的、出芽生殖的病原菌(见图 8),尤其是肝胰腺,几乎遍布整个组织,肌肉中病原菌主要存在于肌间隙及肌丝断裂处。
|
图 8 患“牛奶病”中华绒螯蟹肝胰腺(a)和肌肉(b)的扫描电镜 Fig. 8 Scanning electron microscope(SEM) of hepatopancreas(a) and muscle(b) of Eriocheir sinensis with milky disease |
2020年4—10月在天津地区调查稻田养殖河蟹“牛奶病”流行情况,收集河蟹样品42批,检测二尖梅奇酵母及WSSV携带情况。本地养殖大眼幼体主要来自于天津立达海水资源开发有限公司、辽宁盘锦光合蟹业有限公司以及辽宁盘锦其他公司,扣蟹主要来自于辽宁盘锦及天津本地(大眼幼体引自辽宁盘锦)。所收集的15批扣蟹养殖样品中,未检出二尖梅奇酵母,WSSV阳性样品为4批,占比26.67%,均来自辽宁盘锦;27批养殖成蟹样品中,二尖梅奇酵母阳性样品为4批34尾,占比14.81%,阳性个体数占比为9.86%,均为5—6月来自辽宁盘锦的扣蟹,批内阳性率为24.14%~40.00%,WSSV阳性样品为11批15尾,占比40.74%,阳性个体数占比4.35%,批内阳性率为3.45%~25.00%。
3 分析与讨论有关酵母菌作为水产动物病原的报道较少,徐荣彬、孙玉华等[18-19]先后报道了可感染罗氏沼虾( Macrobrachium rosenbergii)的两种酵母菌——汉逊德巴利酵母(Debaryomyces hansenii) 和莫格球拟酵母菌(Torulopsis mogii);Chen等[20]的研究发现二尖梅奇酵母与粪肠球菌(Enterococcus faecium) 共感染导致了约25%的罗氏沼虾死亡;以携带二尖梅奇酵母的卤虫(Artemia franciscana) 饲喂大鳞大麻哈鱼(Chinook salmon),35 d后34.5%的大鳞大麻哈鱼死亡,远高于对照组(4.3%)[21]。本研究从天津地区患“牛奶病”河蟹处分离到单一病原,分别采用注射、浸浴、饲喂3种方式进行回感试验,回感试验复现相同的发病症状,证实所分离菌株JMB-1为病原菌,能够引起河蟹发生“牛奶状”病变。分别扩增菌株JMB-1的18S rRNA、26S rRNA和ITS基因序列,构建系统发育树,结果显示菌株JMB-1与二尖梅奇酵母聚为一支,这与马红丽等[11]、Bao等[12]的研究结果一致。菌株JMB-1的多项生理生化指标均与Branett等[16]所述生化特性一致,但该菌在无硫胺素的培养基中能够生长,甚至在无维生素的酵母基础培养基中也可生长,这与Branett等[11]所述生化特性不一致,但与Wang等[17]报道的三疣梭子蟹“乳化病”病原二尖梅奇酵母WCY的生化特性一致,可能为不同地理株所致。依据菌株JMB-1的多项生理生化特性及多个基因的系统发育分析结果,将菌株JMB-1鉴定为二尖梅奇酵母。
为进一步明确病原,排除其它病原的混合感染,本研究从多尾不同程度患病的河蟹中采用BHI平板划线分菌,培养24 h后,无大量单一优势菌落生长,培养48 h后平板上出现大量形态一致的乳白色菌落,经鉴定为二尖梅奇酵母,排除弧菌或假单胞菌等细菌性病原的原发感染。在病蟹围心腔中白色乳液及鳃水浸片中,未发现血卵涡鞭虫及微孢子虫,仅见大量形态一致、行多边出芽生殖的酵母菌。采用PCR技术对病蟹血淋巴进行检测,未检出中华绒螯蟹螺原体及血卵涡鞭虫,检出WSSV阳性样品19例,占比22.35%,但在正常养殖的扣蟹及成蟹中,也有3.45%~25%的河蟹携带WSSV,推测WSSV与河蟹“牛奶病”并无直接关联,排除微孢子虫、血卵涡鞭虫、中华绒螯蟹螺原体及WSSV的原发感染。二尖梅奇酵母为本次河蟹“牛奶病”分离到的唯一确定病原。
为初步探明病原的感染途径,本研究分别采用注射、浸浴、饲喂3种方式进行回感试验,其中注射组死亡率最高,14 d内全部死亡,试验蟹逐渐出现不食,反应迟缓,四肢僵直、步足关节膜白浊等症状,多数河蟹在出现明显症状后死亡。浸浴组死亡率为28%,且第9天后的病死蟹出现明显的“牛奶病”的症状,14 d后未死河蟹酵母菌携带率为16.7%,感染率相对较低,可能与河蟹血淋巴具有很强的凝聚能力有关,断足后伤口血液迅速凝结、愈合,保护河蟹不受外界病原侵袭。有研究认为该酵母菌可能先进入河蟹肠道进而引起全身系统性感染[22],而本研究中,饲喂组死亡率为12%,且未表现出“牛奶病”症状,未死河蟹酵母菌携带率为4.5%,死亡率和感染率远低于浸浴组及体腔注射组,因此推测河蟹“牛奶病”的病原酵母可能是通过伤口进入体内。北方地区越冬时河蟹密度较高,操作不当很容易使河蟹断足,低温河蟹不摄食,抗病力下降,养殖环境中的酵母菌进入蟹体并随开放式血液循环进入各组织,春天后随着温度上升,病原繁殖也加快,将蟹体作为一个培养基而大量繁殖,造成全身系统性感染。患病河蟹鳃腔、心脏、肌肉、肝胰腺均发生严重病变,出现不同程度的断裂、溶解、坏死等[11-12]。然而自然条件下病原酵母对河蟹的感染机理及传播途径有待进一步研究。
据报道,河蟹“牛奶病”2018年10月首次在辽宁盘锦地区养殖成蟹中发生,2019年4月在该地区养殖扣蟹中发生,估计总体发病率为30%[11]。2020年3—5月,发病规模进一步扩大,江西、河北、天津、吉林、黑龙江等地购自辽宁盘锦区的扣蟹,陆续发病。2020年5—10月,对天津地区养殖扣蟹及成蟹酵母菌携带情况调查显示,来自天津地区或辽宁盘锦区的大眼幼体,均不携带酵母菌;在成蟹养殖中仅在2020年5月购自于辽宁盘锦地区的4批扣蟹样品中检测到34尾携带二尖梅奇酵母,占比9.86%,批内阳性率为24.14%~40%,但来自于天津宝坻或宁河区的扣蟹并未检测到该酵母。2020年6—10月,在天津地区稻田养殖扣蟹至成蟹过程中未检出酵母菌,说明本次河蟹“牛奶病”病原是来自于盘锦地区的越冬扣蟹。从本地区河蟹“牛奶病”的发病情况来看,发病主要集中在2020年4月中旬至5月中旬的暂养期间,经长途运输后的越冬扣蟹,在暂养密度高、池底淤泥较厚、有机质丰富、投饵不足的池塘,发病率和死亡率在90%以上,河蟹互相残伤又进一步加剧了病原的传播。而暂养条件较好的池塘死亡率约50%。2020年5月下旬河蟹进入稻田后,即使部分河蟹携带病原,也未暴发“牛奶病”,推测该病的发生与病原及养殖环境密切相关。
目前针对水产真菌性病原,一般的抗菌素类药物无作用,即便是抗真菌药物其作用亦不显著,且价格昂贵,也超过了对河蟹的药物安全浓度,在养殖生产中难以应用[6],王麟等以二尖梅奇酵母WCY为研究对象,筛选出5株能够分泌嗜杀因子杀灭该病原菌的海洋酵母[17],王祥红等优化了酵母菌生产嗜杀因子的最佳培养条件,纯化后分析了其抑菌效果及特性,应用海洋酵母嗜杀因子杀灭二尖梅奇酵母可以作为一个研究方向[5]。另有研究表明一种生物表面活性剂马索亚内酯在体外能够有效杀灭病原酵母,最小抑菌浓度和最小杀菌浓度分别为0.15和0.34 mg/L,但未进行河蟹体内实验,也未验证马索亚内酯在对河蟹的安全浓度[22]。从实际生产出发,河蟹“牛奶病”的防治应主要从改善环境、提高河蟹抗病力入手,暂养期间加强投喂,保持良好的水质条件,降低暂养密度,池塘清淤改底等措施是控制该病的关键。
4 结语本研究从患河蟹体内分离病原菌,分别采用浸浴、注射、饲喂3种方式确认了病原菌的致病性,排除了其它病原的混合感染,进一步明确了河蟹“牛奶病”的病原为二尖梅奇酵母;调研了天津地区河蟹二尖梅奇酵母携带情况,推测“牛奶病”的发生与病原及养殖环境密切相关,研究结果为河蟹“牛奶病”的防治提供了参考。
| [1] |
张显良, 崔利锋, 李书民, 等. 2020中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2020. Zhang X L, Cui L F, Li S M, et al. China Fisheries Statistical Yearbook 2020[M]. Beijing: China Agriculture Press, 2020. (  0) 0) |
| [2] |
Huang X, Feng Y, Xiong G, et al. A cross-sectional study of Bayesian belief network modeling: Risk factors for hepatopancreatic necrosis syndrome of the Chinese mitten crab(Eriocheir sinensis) in China[J]. Aquaculture, 2020, 524: 735293. DOI:10.1016/j.aquaculture.2020.735293
(  0) 0) |
| [3] |
杨宗英, 张一柳, 胡鲲, 等. 中华绒螯蟹肝胰腺坏死综合症病原及病理学研究[J]. 水生生物学报, 2018, 42(1): 17-25. Yang Z Y, Zhang Y L, Hu K, et al. Etiological and histopathological study on hepatopancreatic necrosis syndrome in Eriocheir sinensis[J]. ACTA Hydrobiologica Sinica, 2018, 42(1): 17-25. (  0) 0) |
| [4] |
Wang W, Gu W, Gasparich G E, et al. Spiroplasma eriocheiris sp. nov., a novel species associated with mortalities in Eriocheir sinensis, Chinese mitten crab[J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61: 2745-2752. DOI:10.1099/ijs.0.026336-0
(  0) 0) |
| [5] |
Wang X H, Chi Z M, Yue L X, et al. A marine killer yeast against the pathogenic yeast strain in crab(Portunus trituberculatus) and an optimization of the toxin production[J]. Microbiological Research, 2007, 162: 77-85. DOI:10.1016/j.micres.2006.09.002
(  0) 0) |
| [6] |
许文军. 梭子蟹"乳化病"研究[D]. 青岛: 中国海洋大学, 2005. Xu W J. Studies on Pathogen and Pathology of "Emulsification" Disease of Portunus trituverculatus[D]. Qingdao: Ocean University of China, 2005. (  0) 0) |
| [7] |
王国良, 金珊, 李政, 等. 三疣梭子蟹(Portunus trituberculatus) 乳化病的组织病理和超微病理研究[J]. 海洋与湖沼, 2006, 37(4): 297-303. Wang G L, Jin S, Li Z, et al. On histopathology and ultrastructure of Portunus trituverculatus suffered from "Emulsion Disease"[J]. Oceanologia Et Limnologia Sinica, 2006, 37(4): 297-303. DOI:10.3321/j.issn:0029-814X.2006.04.002 (  0) 0) |
| [8] |
黄增荣. 三疣梭子蟹(Portunus trirubercularus)"牛奶病"病原的鉴定及其组织病理学研究[D]. 杨凌: 西北农林科技大学, 2006. Huang Z R. Identification of the Bacterial Pathogen of the Milky Disease of Cultured Wwimming Crab(Portunus trirubercularus) and Study on the Histopathology[D]. Yangling: Northwest A&F University, 2006. (  0) 0) |
| [9] |
王印庚, 杨洋, 张正, 等. 津冀地区养殖三疣梭子蟹大量死亡的病原和病理分析[J]. 中国水产科学, 2017, 24(3): 596-605. Wang Y G, Yang Y, Zhang Z, et al. Etiological and pathological analyses of massive mortality in cultured crab Portunus trituberculatus along the coasts of Tianjin and Hebei, China[J]. Journal of Fishery Sciences of Chin, 2017, 24(3): 596-605. (  0) 0) |
| [10] |
史海东. 梭子蟹"牛奶病"病原及综合防治技术研究[D]. 青岛: 中国海洋大学, 2009. Shi H D. Studies on the Pathogen and Prevention & Control Technology of "Milky Disease"of Crab Portunus trituberculatus[D]. Qingdao: Ocean University of China, 2009. (  0) 0) |
| [11] |
马红丽, 孙娜, 陆晓岑, 等. 辽宁地区中华绒螯蟹"牛奶病" 的病原分离与鉴定[J]. 大连海洋大学学报, 2020, 35(5): 714-718. Ma H L, Sun N, Lu X C, et al. Isolation and identifaction of pathogen in milky disease of Chinese mitten crab Eriocheir sinensis in Liaoning Province[J]. Journal of Dalian Ocean University, 2020, 35(5): 714-718. (  0) 0) |
| [12] |
Bao J, Jiang H B, Shen H B, et al. First description of milky disease in the Chinese mitten crab Eriocheir sinensis caused by the yeast Metschnikowia bicuspidata[J]. Aquaculture, 2021, 532: 735984. DOI:10.1016/j.aquaculture.2020.735984
(  0) 0) |
| [13] |
Ding Z, Bi K, Wu T, et al. A simple PCR method for the detection of pathogenic spiroplasmas in crustaceans and environmental samples[J]. Aquaculture, 2007, 265: 49-54. DOI:10.1016/j.aquaculture.2007.01.032
(  0) 0) |
| [14] |
何俊强, 刘荭, 黄倢, 等. SN/T 1151.2-2011. 对虾白斑病检疫技术规范[S]. 北京: 中华人民共和国国家质量监督检验检疫总局, 2011. He J Q, Liu H, Huang J, et al. Quarantine Protocol for White Spot Disease-SN/T 1151.2-2011[S]. Beijing: General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, 2011. (  0) 0) |
| [15] |
Small J H, Shields D J, Hudson L K, et al. Molecular detection of Hematodinium sp. infecting the blue crab, Callinectes sapidus[J]. Journal of Shellfish Research, 2009, 26: 131-139.
(  0) 0) |
| [16] |
Branett J A, Payne R W, Yarrow D. Yeast: Characteristics and Identification[M]. 3rd Edition. Cambridge: Cambridge University Press, 2000.
(  0) 0) |
| [17] |
Wang L, Yue L X, Chi Z M, et al. Marine killer yeasts active against a yeast strain pathogenic to crab Portunus trituberculatus[J]. Diseases of Aquatic Organisms, 2008, 80: 211-218. DOI:10.3354/dao01943
(  0) 0) |
| [18] |
徐荣彬, 刘正义. 养殖淡水长脚大虾感染酵母菌之研究[C] //中国台湾农业委员会渔业特刊第四十七号-鱼病研究专集(15). 台北: 农业委员会, 1994. Xu R B, Liu Z Y. Study on saccharomycete infection in Macrobrachium rosenbergii culture[C]//47th Fisherises Series of Taiwan Agricultural Committee-Reports on Fish Disease Research(15). Taipei: Agricultural Committee, 1994. (  0) 0) |
| [19] |
孙玉华, 孙其焕. 罗氏沼虾亲虾暴发性疾病病原的研究及防治[J]. 水产学报, 1998, 22(1): 56-60. Sun Y H, Sun Q H. Studies on pathogenic organism and prevention and cure of outbreak epidemic disease of parent prawn of Macrobrachium rosenbergii[J]. Journal of Fisheries of China, 1998, 22(1): 56-60. (  0) 0) |
| [20] |
Chen S C, Chen T H, Wang P C, et al. Metschnikowia bicuspidata and Enterococcus faecium co-infection in the giant freshwater prawn Macrobrachium rosenbergii[J]. Diseases of Aquatic Organisms, 2003, 55: 161-167. DOI:10.3354/dao055161
(  0) 0) |
| [21] |
Moore M M, Strom M S. Infection and mortality by the yeast Metschnikowia bicuspidata var. bicuspidata in chinook salmon fed live adult brine shrimp(Artemia franciscana)[J]. Aquaculture, 2003, 220(1-4): 43-57. DOI:10.1016/S0044-8486(02)00271-5
(  0) 0) |
| [22] |
Zhang H Q, Chi Z, Liu G L, et al. Metschnikowia bicuspidate associated with a milky disease in Eriocheir sinensis and its effectitve treatment by Massoialactone[J]. Microbiological Research, 2021, 242: 126641. DOI:10.1016/j.micres.2020.126641
(  0) 0) |
 2021, Vol. 51
2021, Vol. 51


