鱼粉因其氨基酸组成平衡且适口性好, 是水产养殖饲料中最主要的蛋白质来源[1]。然而,随着全球鱼粉供应的稀缺和价格的上涨,使用植物蛋白源替代鱼粉已成为水产饲料研究领域的一个重要课题[2]。与鱼粉相比,大多数植物性蛋白质源的必需氨基酸组成不平衡,而赖氨酸是许多植物蛋白质源(如玉米蛋白粉)的第一限制性氨基酸。对于完全依靠饲料来满足所有营养需求的养殖鱼类来说,适宜的氨基酸组成对维持最佳的生长性能至关重要。适量添加赖氨酸能够促进其他必需氨基酸发挥作用,提高鱼类的生长速率[3]。因此,鱼类赖氨酸需求量的准确信息对于开发营养均衡、经济高效的鱼饲料至关重要[4]。
研究表明[5-6],赖氨酸是影响蛋白质合成和其他氨基酸利用的重要因素。赖氨酸不仅是蛋白质生物合成的底物,也是内分泌激素释放的调节剂,可促进生长激素、胰岛素和胰岛素样生长因子Ⅰ的合成和分泌。此外,赖氨酸也是肉碱合成的前体,与长链脂肪酸穿过线粒体膜的运输有关,其可以促进脂肪酸的β-氧化以加快能量的产生[7]。因此,赖氨酸对于维持鱼类生长和正常代谢必不可少[8]。之前的研究发现,适当的赖氨酸添加量可以促进某些鱼类的生长和饲料效率,饲料赖氨酸缺乏会对鱼类产生各种负面影响:饲料赖氨酸水平过低会刺激肌肉生长抑素的表达,同时抑制生肌调节因子,造成鱼体肌肉生长受阻[9]。Yang等[10]研究表明,低赖氨酸饲料会导致大口黑鲈(Micropterus salmoides)血浆营养物质浓度的降低和GH-IGF信号转导通路的失活,并进一步损害脂质代谢功能,诱导肾脏炎症的发生。对杂交石斑鱼(Epinephelus fuscoguttatus♀×Epinephelus lanceolatus♂)的研究发现,饲料赖氨酸含量不足不仅降低了IGF-Ⅰ的表达,还抑制了TOR信号通路的活性,对鱼体生长造成不良影响[11]。另一项在大口黑鲈上的研究表明,低赖氨酸水平的饲料能激活氨基酸应答通路,抑制TOR信号通路的活性,使蛋白质合成代谢受阻[12]。Teixeira等[13]研究得出,赖氨酸缺乏抑制了大盖巨脂鲤(Colossoma macropomum)生长,并进一步导致蛋白沉积率下降和鱼体脂质累积。赖氨酸缺乏会促进细鳞鲳(Piaractus mesopotamicus)肌肉中氨基酸选择性分解代谢和脂肪积累,增加氮排泄[14]。此外还有许多研究证实了赖氨酸缺乏的不良反应,如生长迟缓、免疫抑制、代谢失衡或死亡率增加[15-17]。
过量的赖氨酸水平也会对某些鱼类的机体造成不良影响,例如肠道溶菌酶活力的降低以及诱导肠道炎症的发生等[18-21]。Chiu等[22]研究发现,过量的饲料赖氨酸水平不仅抑制了虹鳟(Oncorhynchus mykiss)的生长和饲料利用率,还对鱼体产生了毒害作用。Wang等[23]研究得出,过量的赖氨酸会降低肝脏和肌肉中IGF-I的表达,从而导致鱼体生长受阻。赖氨酸水平过高还会导致鱼类氨基酸失衡,加重脱氨效应[24]。Abidi和Khan[25]认为,过量的赖氨酸水平会导致赖氨酸和精氨酸的拮抗作用。赖氨酸和精氨酸均为碱性氨基酸,在机体内共享一套转运系统,所以在消化、吸收和代谢方面它们存在着明显的竞争抑制作用。赖氨酸是精氨酸酶的有效抑制剂,过高的赖氨酸会通过减少精氨酸的利用率导致机体精氨酸缺乏,降低饲料效率和蛋白质沉积,进而影响生长性能。
大菱鲆(Scophthalmus maximus L.)是一种珍稀低温经济鱼类,因生长迅速、肉质鲜美、经济价值高,其已成为我国北方重要的水产养殖品种。目前,虽然已有较多关于大菱鲆氨基酸需求量的研究[26-29],但赖氨酸水平对大菱鲆肠道消化酶活性及其对鱼体免疫情况的影响鲜有报道。因此,本文进一步量化大菱鲆的饲料赖氨酸需求,评估饲料赖氨酸水平对大菱鲆血浆生化参数、消化酶活性以及抗氧化和免疫相关基因表达的影响。
1 材料和方法 1.1 饲料制备以鱼粉和玉米蛋白粉为主要蛋白质来源,鱼油和大豆卵磷脂为主要脂肪来源,制备了5种等氮(约50%粗蛋白)、等脂(约12.5%粗脂肪)的实验饲料,其赖氨酸含量分别为1.69%、2.49%、3.32%、4.11%和4.90%(干质量),并添加晶体氨基酸谷氨酸以维持这5种饲料的氮平衡。所有原料成分通过178 μm的筛孔研磨成细粉末,与鱼油混合。通过颗粒制备机自动制备成大小适宜的颗粒,并在45 ℃的通风烘箱中干燥12 h。饲料储存于-20 ℃待用。饲料配方及其所含营养成分见表 1。
|
|
表 1 饲料配方及近似组成(干物质) Table 1 Formulation and proximate composition of experiment diets (dry matter) |
实验用大菱鲆鱼苗购自当地养殖场(山东青岛),养殖实验在青岛亿海丰水产有限公司的室内海水流水养殖系统中进行。此次实验正式开始前,先暂养大菱鲆2周,使其适应养殖环境及投喂方式。暂养结束后,禁食48 h,之后将大菱鲆(平均初始体质量为(43.11±0.10) g)随机分配于15个玻璃纤维罐(300 L)中,每个玻璃纤维罐40条鱼。每天7:00和19:00投喂,直到表观饱食。养殖实验持续10周。在实验期间,每天记录死鱼的数量和质量,并保证水温在18~21 ℃之间,盐度为29~32,溶解氧约为7 mg/L,氨氮和亚硝酸盐含量低于0.1 mg/L。
1.3 样品采集本研究中的所有程序都严格按照中国海洋大学实验动物指南中的建议进行。实验结束时,所有鱼禁食24 h,用丁香酚(1∶10 000)麻醉后称重。每个养殖桶收集5条鱼进行全身成分分析。此外,从每个养殖桶中取出5条鱼,从尾静脉采集血样,收集内脏团和肝脏并称重,测量鱼的长度以计算形体指标,包括肝体比(Hepatosomatic index, HSI)、脏体比(Viscerosomatic index, VSI)和肥满度(Condition factor, CF)。血液样本在4 ℃下以3 000g离心10 min,然后储存在-80 ℃冰箱至使用。最后,从每个养殖桶中采集5条鱼,收集其肝脏和肠道作为样本,立即置于液氮中速冻,取样结束后转移至-80 ℃冰箱,待进一步分析。
1.4 鱼体成分分析根据AOAC指南(1997)对饲料及鱼体成分进行分析。在105 ℃下将样品干燥至恒重,分析水分含量。通过使用凯氏定氮法(Kjeltec TM 8400, FOSS, Sweden)测定粗蛋白质。使用索氏抽提法(Buchi 36680,瑞士)在乙醚萃取后测量粗脂肪。在马弗炉中550 ℃燃烧16 h后进行灰分的检测。饲料样品用冷冻干燥机(ALPHA1-2 LDplus, Christco, Ltd, Germany)干燥,在110 ℃的盐酸溶液(6 mol/L)中消化22 h,然后用超纯水稀释至5 mL。在氮气下蒸发溶剂溶液,然后添加0.02 mol/L HCl。水解产物通过0.22 μm尼龙注射器过滤器过滤,然后由L-8900氨基酸分析仪(日本日立)进行自动分析。饲料中氨基酸组成如表 2所示。
|
|
表 2 饲料中的氨基酸组成(干物质) Table 2 Amino acid composition of diets (dry matter) |
使用商用比色分析试剂盒(中国南京建成生物技术研究所)测量血浆生化指标水平和肠道消化酶活性,包括葡萄糖(Glucose, GLU)、甘油三酯(Triglyceride, TG)、总胆固醇(Total cholesterol, T-CHO)、高密度脂蛋白胆固醇(High density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(Low density lipoprotein cholesterol, LDL-C)、α-淀粉酶、脂肪酶和胰蛋白酶。
1.6 实时荧光定量PCR分析本研究采用Trizol试剂法(Invitrogen,USA)提取肝脏RNA,并使用NanoDrop 2000分光光度计检测提取到的RNA数量和质量,合格后用PrimeScriptTM RT试剂盒(Takara,Japan)反转录成cDNA。采用iCycler iQTM real-time PCR detection system (BIO-RAD, USA)进行qRT-PCR的检测。以EF1α为内参基因。读取的数值采用2-ΔΔCt方法计算目的基因的表达量[30]。所有的引物序列如表 3所示。
|
|
表 3 实时荧光定量PCR引物序列 Table 3 Primer sequences used for qRT-PCR |
增重率(Weight gain rate, WGR)=(终末体质量(g)-初始体质量(g))/初始体质量(g)×100%;
特定生长率(Specific growth rate, SGR)=(ln终末体质量(g)-ln初始体质量(g))/养殖天数(d)×100%;
饲料效率(Feed efficiency rate, FER)=增重量(g)/饲料摄食量干质量(g);
蛋白质效率(Protein efficiency ratio, PER)=增重量(g)/饲料蛋白摄入量(g);
摄食率(Feed intake, FI)=饲料摄食量干质量(g)/(((终末体质量(g)+初始体质量(g))/2)/养殖天数(d))×100%;
存活率(Survival rate, SR)=终末鱼数/初始鱼数×100%;
肝体比(Hepatosomatic index, HSI)=肝质量(g)/体质量(g)×100%;
脏体比(Viscerosomatic index, VSI)=内脏团质量(g)/体质量(g)×100%;
肥满度(Condition factor, CF)=体质量(g)/体长3(cm3)×100%。
使用SPSS 19.0软件对实验产生的数据进行处理分析,结果以平均值±标准误(Mean±SE)的形式表示。使用单因素方差分析(One-way ANOVA)处理数据,若产生显著性差异,则采用Tukey’s多重比较检验,p < 0.05表示处理组间存在差异显著。
2 实验结果 2.1 生长及饲料利用如表 4所示,对初始体质量(43.11±0.01) g的大菱鲆进行为期10周的饲养实验后,大菱鲆的最终体质量、增重率、特定生长率、蛋白质利用率、饲料利用率和摄食率随着饲料赖氨酸水平的增加而上调,直至饲料赖氨酸水平达到3.32%,此后呈稳定趋势。
|
|
表 4 不同饲料赖氨酸水平对大菱鲆的生长性能和饲料利用的影响 Table 4 Effects of different dietary lysine levels on growth performance and feed utilization of turbot |
经过二次回归分析,大菱鲆的特定生长率与饲料赖氨酸水平之间的关系如图 1所示。基于SGR,大菱鲆的最佳赖氨酸需求量为饲料干质量的3.19%(饲料蛋白质的6.39%)。
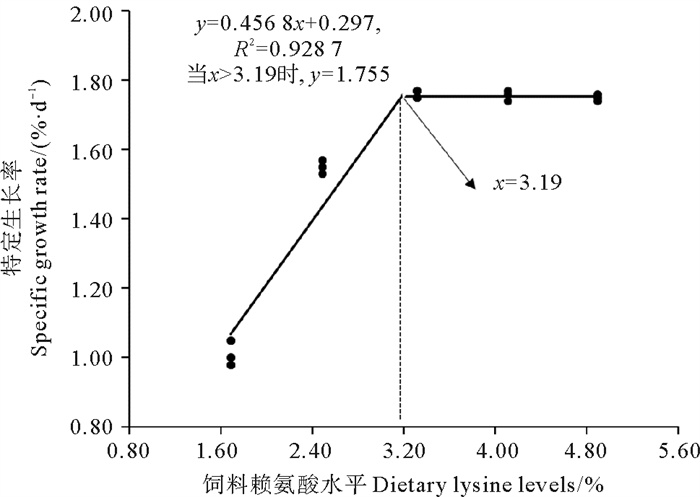
|
图 1 饲料赖氨酸水平与大菱鲆特定生长率的关系 Fig. 1 Relationship of dietary lysine levels with specific growth rate of turbot |
在形体指标方面,赖氨酸缺乏组(1.69%组)大菱鲆的肝体指数(HSI)最高,且随着赖氨酸水平的增加,肝体指数逐渐降低。饲料赖氨酸水平对大菱鲆的脏体比(VSI)和肥满度(CF)无显著影响(p>0.05)(见表 5)。而鱼体组成部分,1.69%组的鱼体蛋白质含量最低,而1.69%组和2.29%组的鱼体脂质水平显著高于其他组(p < 0.05)。此外,饲料赖氨酸水平对大菱鲆鱼体的水分和灰分含量无显著影响(p>0.05)(见表 6)。
|
|
表 5 不同饲料赖氨酸水平对大菱鲆形体指标的影响 Table 5 Effects of different dietary lysine levels on body condition indices of turbot |
|
|
表 6 不同饲料赖氨酸水平对大菱鲆鱼体组成成分的影响 Table 6 Effects of different dietary lysine levels on body composition of turbot |
如表 7所示,肠道脂肪酶和胰蛋白酶的活性受饲料赖氨酸水平的影响显著(p < 0.05),但所有处理组之间的淀粉酶无显著差异(p>0.05)。随着赖氨酸水平的升高,肠道脂肪酶和胰蛋白酶的活性先升高后降低。1.69%组的肠道脂肪酶活性显著低于3.32%组(p < 0.05);肠胰蛋白酶活性以3.32%组最高,显著高于其他各组(p < 0.05)。
|
|
表 7 不同饲料赖氨酸水平对大菱鲆肠道消化酶活的影响 Table 7 Effects of different dietary lysine levels on digestive enzyme activities in the intestinal of turbot |
如表 8所示,饲料赖氨酸缺乏时(1.69%组)显著增加了TG和T-CHO含量(p < 0.05),降低了HDL-L含量(p < 0.05)。与其他组相比,3.32%组的LDL-L含量最低,因此HDL-C/LDL-C比率较高。此外,饲料赖氨酸水平对大菱鲆的血糖含量无显著影响(p>0.05)。
|
|
表 8 不同饲料赖氨酸水平对大菱鲆血浆生化指标的影响 Table 8 Effects of different dietary lysine levels on plasma biochemical indices of turbot |
饲料赖氨酸水平对大菱鲆肝脏抗氧化和免疫功能的影响如图 2和图 3所示,在抗氧化相关基因中,3.32%组SOD的表达量显著高于其他组(p<0.05),GPX的表达量也显著高于1.69%和2.49%组(p<0.05),但同4.11%和4.90%组之间并无显著性差异(p>0.05)。在免疫相关基因方面,饲料赖氨酸水平的缺乏(1.69%组)促进了IL-8和TNF-α的表达量,虽然2.49%组与1.69%组相比,TNF-α的表达量并无差异(p>0.05),但同样显著高于3.32%组、4.11%组和4.90%组(p<0.05),IL-1β的表达量在1.69%组、2.49%组和3.32%组虽然都没有显著差异(p>0.05),但仍能看出高的饲料赖氨酸添加量有降低其表达的趋势。随着赖氨酸水平的升高,TGF-β基因的表达量也显著升高(P<0.05),但当赖氨酸水平超过3.32%后,其表达量保持稳定。
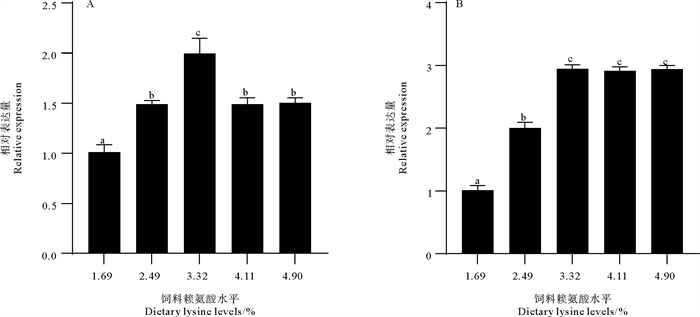
|
( A. 超氧化物歧化酶基因(SOD);B.谷胱甘肽过氧化物酶基因(GPX)。数值以平均值±标准误表示。图中不同的上标字母表示差异显著(p<0.05)。A. Superoxide dismutase gene(SOD); B. Glutathione peroxidase gene(GPX). Values were expressed as mean±SE. Values in the figure with different superscripted letters were significantly different (p<0.05). ) 图 2 饲料赖氨酸水平对大菱鲆肝脏抗氧化相关基因表达的影响 Fig. 2 Effects of dietary lysine levels on the expression of antioxidant related genes in the liver of turbot |
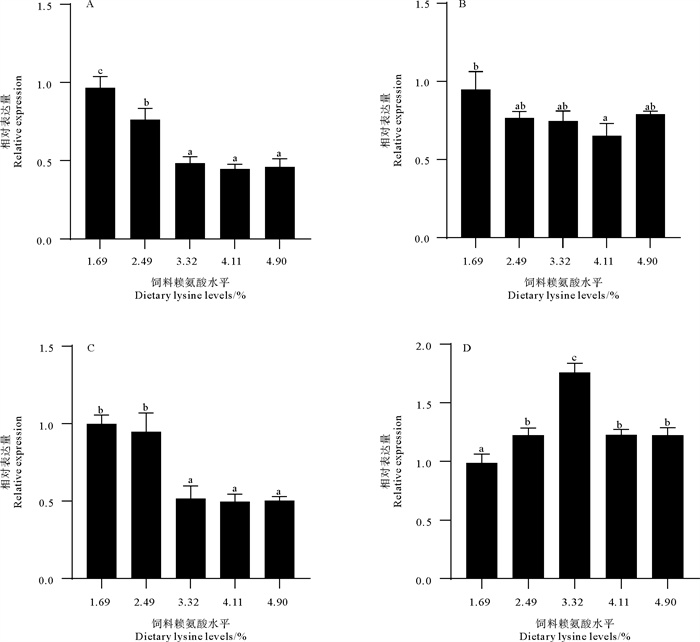
|
( A. 白细胞介素8基因(IL-8);B. 白细胞介素1β基因(IL-1β);C. 肿瘤坏死因子α基因(TNF-α);D. 转化生长因子β基因(TGF-β)。数值以平均值±标准误表示。图中不同的上标字母表示差异显著(p<0.05)。A. Interleukin-8 gene (IL-8); B. Interleukin-1β gene (IL-1β); C. Tumor necrosis factor-α gene (TNF-α); D. Transforming growth factor beta gene (TGF-β). Values were expressed as mean±SE. Values in the figure with different superscripted letters were significantly different (p<0.05). ) 图 3 饲料赖氨酸水平对大菱鲆肝脏免疫相关基因表达的影响 Fig. 3 Effects of dietary lysine levels on the expression of immune related genes in the liver of turbot |
本研究表明,以特定生长率为评价指标,大菱鲆的最适赖氨酸需求量为饲料干质量的3.19%(6.39%饲料蛋白质)。这与日本鲈鱼(Lateolabrax japonicus)幼鱼(5.80%~6.07%的饲料蛋白质)[15]、建鲤(Cyprinus carpio var. Jian)幼鱼(5.90%的饲料蛋白质)[31]和大黄鱼(Pseudosciaena crocea)(6.49%~6.55%的饲料蛋白质)[19]的需求量相似,但高于银鲈(Bidyanus bidyanus)(占膳食蛋白质的5.30%)[32]和团头鲂(Megalobrama amblycephala)(占膳食蛋白质的4.63%)[33]的赖氨酸需求。在本研究中,大菱鲆的最适赖氨酸需求量高于Peres和Oliva-Teles[8]之前的结果(占膳食蛋白质的5.00%),与之前的研究不同,本实验的饲料中植物蛋白的含量更高,且本实验与文献[8]中大菱鲆的初始体质量存在差异(43.11 g vs 18.10 g),这可能会影响大菱鲆的饲料赖氨酸的需求,之前的研究也证明,随着鱼体大小的增加,对膳食氨基酸水平的需求也会减少[29]。此外,氨基酸需求差异可能还会受到鱼的大小、鱼种、环境条件、繁殖条件、饲养方法以及数学和统计方法的影响[34-36]。
之前研究表明,赖氨酸缺乏会显著抑制鱼类的生长和饲料利用[20, 35, 37]。本研究也得到了相似的结果,当饲料赖氨酸水平低于大菱鲆的最佳需求水平时,大菱鲆的终末体质量(FBW)、增重率(WGR)、特定生长率(SGR)、蛋白质利用率(PER)和饲料利用率(FER)显著下降。同时,赖氨酸缺乏可能会使机体的食欲下降,从而造成饲料摄入不足和鱼体生长受到抑制[15, 17]。本研究表明,当赖氨酸需求达到最佳水平,饲料的赖氨酸水平继续增加不会改变其生长性能和饲料利用率,这与建鲤幼鱼[31]和大黄鱼[17]的研究结果一致,这可归因于饲料中的氨基酸处在一个较平衡的状态[38]。但其他研究发现,饲料中过量的赖氨酸会对鱼体的生长和饲料利用产生负面影响[19],这可能由于饲料氨基酸分布不平衡导致大菱鲆产生额外的能量消耗[39-40]。
鱼类的肝体指数会受饲料赖氨酸水平的影响,低赖氨酸水平饲喂的鱼的肝体指数通常高于高赖氨酸水平喂养的鱼[20, 32, 41]。在本研究中,肝体比随着饲料赖氨酸水平的升高而降低,这可能是由于缺乏赖氨酸导致蛋白质合成不足,未用于蛋白质合成的氨基酸可能在脱氨后转化为脂质或糖原并沉积在肝脏中,这解释了较高的肝体比出现的原因[8]。然而,Zhou等[31]报道,建鲤幼鱼的肝体指数随着饲料赖氨酸水平的增加而增加。
在本研究中,鱼体的水分和灰分含量保持相对恒定。随着饲料赖氨酸水平的增加,鱼体粗蛋白水平增加,粗脂肪水平减少,这与银鱼(Trachinotus blochii)[42]的研究结果一致。一方面,赖氨酸是蛋白质合成所必需的[43],赖氨酸的补充会增加机体蛋白质含量[21, 41, 44];另一方面,饲料中赖氨酸含量不足会抑制其他氨基酸合成蛋白质,这些多余的氨基酸可以为脂质合成提供更多的碳骨架,从而加速体内脂质的积累[45]。
消化酶活性在一定程度上反映了鱼类消化和吸收营养物质的能力,鱼类的生长取决于营养物质的消化和吸收[46]。氨基酸作为一种重要的营养物质,会直接或间接地影响鱼类的消化能力。研究发现[47],在以植物蛋白为基础的饲料中补充赖氨酸和蛋氨酸可以增加鱼类的消化酶活性。对草鱼(Ctenopharyngodon idella)和大黄鱼的研究也进一步证实,最适的饲料赖氨酸水平可以增加胰蛋白酶活性[19, 48]。本研究表明,当饲料赖氨酸水平为3.32%时,胰蛋白酶和脂肪酶的活性最高,这表明摄入适量的赖氨酸能够提高肠道消化能力,促进鱼类饲料营养物质的利用,而淀粉酶活性不受赖氨酸水平的影响。当饲料赖氨酸水平过高时,脂肪酶活性和胰蛋白酶活性降低,这可能是因为在赖氨酸水平过高的情况下,鱼类表现出对饲料氨基酸失衡的适应性,即赖氨酸水平过高会抑制肠道消化酶活性。
血浆葡萄糖、甘油三酯和总胆固醇与动物健康相关[19, 49]。之前的研究已经证实,血浆甘油三酯和胆固醇含量受动物营养状况的影响,尤其受饲料中的赖氨酸水平的影响[31, 45, 50]。在本研究中,各组之间的血糖浓度无显著差异,但饲料赖氨酸水平缺乏显著增加了血浆中甘油三酯和总胆固醇含量,这一结果与太平洋白虾(Penaeus vannamei)的研究结果一致[19]。LDL将胆固醇从肝脏输送到外周组织,而HDL将胆固醇从外周组织输送到肝脏[51-52],因此,HDL-C/LDL-C比值可作为胆固醇转运的标志。本研究结果显示,与其他赖氨酸水平组相比,3.32%组的血浆HDL-C/LDL-C比值更高,这表明适当水平的赖氨酸提高了鱼类将胆固醇从外周组织运送到肝脏的能力。因此,1.69%组的血脂含量较高与HDL-C/LDL-C比值降低有关。
在动物正常的代谢过程中,活性氧自由基(ROS)的产生和清除处于动态平衡[53]。但当动物受到压力时,ROS含量增加并破坏了机体的氧化平衡,从而产生氧化应激[54]。抗氧化剂能够消除ROS,以保护细胞免受自由基的攻击而造成氧化损伤[55]。SOD和GPX是重要的抗氧化物酶,它们能够协同催化自由基,产生无毒的化合物[56]。在本研究,随着赖氨酸水平升至3.32%,大菱鲆肝脏中SOD和GPX基因表达量显著上升,但当赖氨酸水平超过3.32%后,这一指标缓慢下降,但并未与3.32%组产生显著差异,这表明适宜的赖氨酸水平可以提高大菱鲆的抗氧化能力,这与在草鱼[48]和斜带石斑鱼(Epinephelus coioides)[57]中的研究结果一致,而过量的赖氨酸并未对鱼体的抗氧化能力产生明显的负面效果。TNF-α是一种有效的促炎细胞因子,在维持机体免疫稳态方面具有重要的调节作用[58]。此外,IL-1β和IL-8也是免疫调节中的两种促炎细胞因子[59]。之前在大口黑鲈上的研究表明,饲料赖氨酸的限制增加了促炎因子IL-1β、IL-8和TNF-α的表达[10]。同样,本研究结果也显示,饲料赖氨酸水平的缺乏显著上调了大菱鲆肝脏中IL-1β、IL-8和TNF-α的表达水平,这意味着适宜的赖氨酸水平能够有效增强鱼体的非特异性免疫。TGF-β是一种重要的抗炎细胞因子,与1.69%组相比,3.32%组显著提高了鱼体TGF-β的表达水平。有研究表明,抗炎细胞因子TGF-β的表达抑制可能与NF-κB的激活有关[60],因此,我们推测饲料赖氨酸含量的不足可能激活NF-κB信号通路,导致大菱鲆发生炎症反应。
4 结语本研究结果表明,以特定生长率为评价指标,大菱鲆的最适赖氨酸需求量为饲料干质量的3.19%(饲料蛋白质的6.39%)。饲料赖氨酸水平显著影响大菱鲆的生长、饲料利用和血浆生化指标,适当的饲料赖氨酸水平可以更好地提高肠道胰蛋白酶和脂肪酶的活性。此外,赖氨酸缺乏诱导了大菱鲆的氧化应激和炎症反应的发生,适宜的赖氨酸水平能够恢复鱼体去除活性氧自由基的能力,并增强鱼体的非特异性免疫。
| [1] |
Jobling M. National Research Council (NRC): Nutrient requirements of fish and shrimp[J]. Aquaculture International, 2011, 20(5): 601-602. (  0) 0) |
| [2] |
Daniel N. A review on replacing fish meal in aqua feeds using plant protein sources[J]. International Journal of Fisheries and Aquatic Studies, 2018, 6(2): 164-179. (  0) 0) |
| [3] |
Kerr B, Easter R. Effect of feeding reduced protein, amino acid-supplemented diets on nitrogen and energy balance in grower pigs[J]. Journal of Animal Science, 1995, 73(10): 3000-3008. DOI:10.2527/1995.73103000x (  0) 0) |
| [4] |
Bureau D P, Encarnação P M. Adequately defining the amino acid requirements of fish: The case example of lysine[J]. Avances en Nutrición Acuicola, 2006, 15(11): 29-54. (  0) 0) |
| [5] |
Katsumata M, Kawakami S, Kaji Y, et al. Differential regulation of porcine hepatic IGF-I mRNA expression and plasma IGF-I concentration by a low lysine diet[J]. The Journal of Nutrition, 2002, 132(4): 688-692. DOI:10.1093/jn/132.4.688 (  0) 0) |
| [6] |
Takenaka A, Oki N, Takahashi S I, et al. Dietary restriction of single essential amino acids reduces plasma insulin-like growth factor-I (IGF-I) but does not affect plasma IGF-binding protein-1 in rats[J]. The Journal of Nutrition, 2000, 130(12): 2910-2914. DOI:10.1093/jn/130.12.2910 (  0) 0) |
| [7] |
Walton M, Cowey C, Adron J. The effect of dietary lysine levels on growth and metabolism of rainbow trout (Salmo gairdneri)[J]. British Journal of Nutrition, 1984, 52(1): 115-122. DOI:10.1079/BJN19840077 (  0) 0) |
| [8] |
Peres H, Oliva-Teles A. Lysine requirement and efficiency of lysine utilization in turbot (Scophthalmus maximus) juveniles[J]. Aquaculture, 2008, 275(1-4): 283-290. DOI:10.1016/j.aquaculture.2007.12.015 (  0) 0) |
| [9] |
Prabu E, Felix N, Uma A, et al. Effects of dietary L-lysine supplementation on growth, body composition and muscle-growth-related gene expression with an estimation of lysine requirement of GIFT tilapia[J]. Aquaculture Nutrition, 2020, 26(2): 568-578. DOI:10.1111/anu.13018 (  0) 0) |
| [10] |
Yang P, Wang W, Chi S, et al. Effects of dietary lysine on regulating GH-IGF system, intermediate metabolism and immune response in largemouth bass (Micropterus salmoides)[J]. Aquaculture Reports, 2020, 17: 100323. DOI:10.1016/j.aqrep.2020.100323 (  0) 0) |
| [11] |
Li X J, Wu X Y, Dong Y, et al. Effects of dietary lysine levels on growth, feed utilization and related gene expression of juvenile hybrid grouper (Epinephelus fuscoguttatus♀×Epinephelus lanceolatus♂)[J]. Aquaculture, 2019, 502: 153-161. DOI:10.1016/j.aquaculture.2018.12.035 (  0) 0) |
| [12] |
Wang W Q, Xu Y J, Chi S Y, et al. Dietary lysine regulates body growth performance via the nutrient-sensing signaling pathways in largemouth bass (Micropterus salmoides)[J]. Frontiers in Marine Science, 2020, 7: 595-682. DOI:10.3389/fmars.2020.00595 (  0) 0) |
| [13] |
Teixeira S O, Nunes Z M P, Junior A d S P, et al. Optimal dietary lysine improves growth performance, increases protein deposition and reduces lipid accumulation in tambaqui (Colossoma macropomum) juveniles[J]. Aquaculture Research, 2020, 51(12): 5065-5073. DOI:10.1111/are.14845 (  0) 0) |
| [14] |
Abimorad E G, Ducatti C, Castellani D, et al. Dietary lysine deficiency increases the incorporation rate of nitrogen-free compounds in muscle of pacu (Piaractus mesopotamicus)[J]. Aquaculture, 2017, 479: 522-527. DOI:10.1016/j.aquaculture.2017.06.033 (  0) 0) |
| [15] |
Mai K S, Zhang L, Ai Q H, et al. Dietary lysine requirement of juvenile Japanese seabass, Lateolabrax japonicus[J]. Aquaculture, 2006, 258(1-4): 535-542. DOI:10.1016/j.aquaculture.2006.04.043 (  0) 0) |
| [16] |
Smriga M, Mori M, Torii K. Circadian release of hypothalamic norepinephrine in rats in vivo is depressed during early L-lysine deficiency[J]. The Journal of Nutrition, 2000, 130(6): 1641-1643. DOI:10.1093/jn/130.6.1641 (  0) 0) |
| [17] |
Zhang C X, Ai Q H, Mai K S, et al. Dietary lysine requirement of large yellow croaker, Pseudosciaena crocea R[J]. Aquaculture, 2008, 283(1-4): 123-127. DOI:10.1016/j.aquaculture.2008.06.035 (  0) 0) |
| [18] |
Bicudo Á J, Sado R Y, Cyrino J E. Dietary lysine requirement of juvenile pacu Piaractus mesopotamicus (Holmberg, 1887)[J]. Aquaculture, 2009, 297(1-4): 151-156. DOI:10.1016/j.aquaculture.2009.09.031 (  0) 0) |
| [19] |
Xie F J, Ai Q H, Mai K S, et al. Dietary lysine requirement of large yellow croaker (Pseudosciaena crocea, Richardson 1846) larvae[J]. Aquaculture Research, 2012, 43(6): 917-928. DOI:10.1111/j.1365-2109.2011.02906.x (  0) 0) |
| [20] |
Zehra S, Khan M A. Dietary lysine requirement of fingerling Catla catla (Hamilton) based on growth, protein deposition, lysine retention efficiency, RNA/DNA ratio and carcass composition[J]. Fish Physiology and Biochemistry, 2013, 39: 503-512. DOI:10.1007/s10695-012-9715-0 (  0) 0) |
| [21] |
Li W J, Wei F X, Xu B, et al. Dietary lysine requirement of juvenile Protonibea diacanthus[J]. Aquaculture Nutrition, 2020, 26(4): 1289-1294. DOI:10.1111/anu.13084 (  0) 0) |
| [22] |
Chiu Y N, Austic R E, Rumsey G L. Interactions among dietary minerals, arginine and lysine in rainbow trout (Salmo gairdneri)[J]. Fish Physiology and Biochemistry, 1987, 4: 45-55. DOI:10.1007/BF02073865 (  0) 0) |
| [23] |
Wang L G, Zhao D, Tan P, et al. Dietary lysine affects growth performance, whole-body composition and growth-related gene expression in the yellow drum Nibea albiflora[J]. Aquaculture Nutrition, 2020, 26(6): 1970-1980. DOI:10.1111/anu.13139 (  0) 0) |
| [24] |
Zhou F, Shao J, Xu R, et al. Quantitative L-lysine requirement of juvenile black sea bream (Sparus macrocephalus)[J]. Aquaculture Nutrition, 2010, 16(2): 194-204. DOI:10.1111/j.1365-2095.2009.00651.x (  0) 0) |
| [25] |
Fatma Abidi S, Khan M A. Growth, protein retention, and body composition of fingerling Indian major carp, rohu, Labeo rohita (Hamilton), fed diets with various levels of lysine[J]. Journal of the World Aquaculture Society, 2010, 41(5): 791-799. DOI:10.1111/j.1749-7345.2010.00421.x (  0) 0) |
| [26] |
Ma R, Hou H P, Mai K S, et al. Comparative study on the effects of L-methionine or 2-hydroxy-4-(methylthio) butanoic acid as dietary methionine source on growth performance and anti-oxidative responses of turbot (Psetta maxima)[J]. Aquaculture, 2013, 412: 136-143. (  0) 0) |
| [27] |
Zhang K K, Mai K S, Xu W, et al. Effects of dietary arginine and glutamine on growth performance, nonspecific immunity, and disease resistance in relation to arginine catabolism in juvenile turbot (Scophthalmus maximus L.)[J]. Aquaculture, 2017, 468: 246-254. DOI:10.1016/j.aquaculture.2016.10.021 (  0) 0) |
| [28] |
He J Y, Tian L X, Lemme A, et al. Methionine and lysine requirements for maintenance and efficiency of utilization for growth of two sizes of tilapia (Oreochromis niloticus)[J]. Aquaculture Nutrition, 2013, 19(4): 629-640. DOI:10.1111/anu.12012 (  0) 0) |
| [29] |
Zhao Z X, Ren M C, Xie J, et al. Dietary arginine requirement for blunt snout bream (Megalobrama amblycephala) with two fish sizes associated with growth performance and plasma parameters[J]. Turkish Journal of Fisheries and Aquatic Sciences, 2017, 17(1): 171-179. (  0) 0) |
| [30] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 (  0) 0) |
| [31] |
Zhou X Q, Zhao C R, Jiang J, et al. Dietary lysine requirement of juvenile Jian carp (Cyprinus carpio var. Jian)[J]. Aquaculture Nutrition, 2008, 14(5): 381-386. DOI:10.1111/j.1365-2095.2007.00535.x (  0) 0) |
| [32] |
Yang S D, Liu F G, Liou C H. Assessment of dietary lysine requirement for silver perch (Bidyanus bidyanus) juveniles[J]. Aquaculture, 2011, 312(1-4): 102-108. DOI:10.1016/j.aquaculture.2010.12.011 (  0) 0) |
| [33] |
Habte-Tsion H M, Liu B, Ren M, et al. Dietary threonine requirement of juvenile blunt snout bream (Megalobrama amblycephala)[J]. Aquaculture, 2015, 437: 304-311. DOI:10.1016/j.aquaculture.2014.12.018 (  0) 0) |
| [34] |
Baker D H. Problems and pitfalls in animal experiments designed to establish dietary requirements for essential nutrients[J]. The Journal of Nutrition, 1986, 116(12): 2339-2349. DOI:10.1093/jn/116.12.2339 (  0) 0) |
| [35] |
Deng D F, Dominy W, Ju Z Y, et al. Dietary lysine requirement of juvenile Pacific threadfin (Polydactylus sexfilis)[J]. Aquaculture, 2010, 308(1-2): 44-48. DOI:10.1016/j.aquaculture.2010.07.041 (  0) 0) |
| [36] |
Kim K I, Kayes T B, Amundson C H. Requirements for lysine and arginine by rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1992, 106(3-4): 333-344. DOI:10.1016/0044-8486(92)90265-M (  0) 0) |
| [37] |
Cai W C, Liu W B, Jiang G Z, et al. Lysine supplement benefits the growth performance, protein synthesis, and muscle development of Megalobrama amblycephala fed diets with fish meal replaced by rice protein concentrate[J]. Fish Physiology and Biochemistry, 2018, 44: 1159-1174. DOI:10.1007/s10695-018-0503-3 (  0) 0) |
| [38] |
Madrid J, Pohlenz C, Viana M T, et al. Dietary lysine requirement for juvenile, Totoaba macdonaldi[J]. Aquaculture, 2019, 500: 92-98. DOI:10.1016/j.aquaculture.2018.10.003 (  0) 0) |
| [39] |
Kaushik S, Fauconneau B. Effects of lysine administration on plasma arginine and on some nitrogenous catabolites in rainbow trout[J]. Comparative Biochemistry & Physiology Part A Physiology, 1984, 79(3): 459-462. (  0) 0) |
| [40] |
Kaushik S, Fauconneau B, Terrier L, et al. Arginine requirement and status assessed by different biochemical indices in rainbow trout (Salmo gairdneri R.)[J]. Aquaculture, 1988, 70(1-2): 75-95. DOI:10.1016/0044-8486(88)90008-7 (  0) 0) |
| [41] |
Zhou Q C, Wu Z H, Chi S Y, et al. Dietary lysine requirement of juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2007, 273(4): 634-640. DOI:10.1016/j.aquaculture.2007.08.056 (  0) 0) |
| [42] |
Ebeneezar S, Vijayagopal P, Srivastava P, et al. Dietary lysine requirement of juvenile Silver pompano, Trachinotus blochii (Lacepede, 1801)[J]. Aquaculture, 2019, 511: 734234. (  0) 0) |
| [43] |
D'mello J F. Amino Acids in Animal Nutrition[M]. London: CABI Publishing, 2003.
(  0) 0) |
| [44] |
Luo Z, Liu Y J, Mai K S, et al. Quantitative L-lysine requirement of juvenile grouper Epinephelus coioides[J]. Aquaculture Nutrition, 2006, 12(3): 165-172. DOI:10.1111/j.1365-2095.2006.00392.x (  0) 0) |
| [45] |
Wang S, Liu Y J, Tian L X, et al. Quantitative dietary lysine requirement of juvenile grass carp Ctenopharyngodon idella[J]. Aquaculture, 2005, 249(1-4): 419-429. (  0) 0) |
| [46] |
Wei L, Zhang X M, Wang L B. Digestive enzyme and alkaline phosphatase activities during the early stages of Silurus soldatovi development[J]. Zoological Research, 2010, 31(6): 627-632. (  0) 0) |
| [47] |
Jiang J, Xu S X, Feng L, et al. Lysine and methionine supplementation ameliorates high inclusion of soybean meal inducing intestinal oxidative injury and digestive and antioxidant capacity decrease of yellow catfish[J]. Fish Physiology and Biochemistry, 2018, 44: 319-328. DOI:10.1007/s10695-017-0437-1 (  0) 0) |
| [48] |
Li X Y, Tang L, Hu K, et al. Effect of dietary lysine on growth, intestinal enzymes activities and antioxidant status of sub-adult grass carp (Ctenopharyngodon idella)[J]. Fish Physiology and Biochemistry, 2014, 40: 659-671. DOI:10.1007/s10695-013-9874-7 (  0) 0) |
| [49] |
Zhou Q C, Wu Z H, Tan B P, et al. Optimal dietary methionine requirement for juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2006, 258(1-4): 551-557. DOI:10.1016/j.aquaculture.2006.03.035 (  0) 0) |
| [50] |
Li X, Zhou L, Mo H, et al. Interaction effects of dietary lipid and lysine on growth feed utilization and body composition of juvenile grass carp (Ctenopharyngodon idella)[J]. Aquaculture International, 2017, 25: 1591-1606. DOI:10.1007/s10499-017-0132-3 (  0) 0) |
| [51] |
Chen J Y, Chen J C, Wu J L. Molecular cloning and functional analysis of zebrafish high-density lipoprotein-binding protein[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2003, 136(1): 117-130. DOI:10.1016/S1096-4959(03)00181-7 (  0) 0) |
| [52] |
Deng J, Mai K S, Ai Q H, et al. Interactive effects of dietary cholesterol and protein sources on growth performance and cholesterol metabolism of Japanese flounder (Paralichthys olivaceus)[J]. Aquaculture Nutrition, 2010, 16(4): 419-429. (  0) 0) |
| [53] |
Liang X P, Li Y, Hou Y M, et al. Effect of dietary vitamin C on the growth performance, antioxidant ability and innate immunity of juvenile yellow catfish (Pelteobagrus fulvidraco Richardson)[J]. Aquaculture Research, 2017, 48(1): 149-160. DOI:10.1111/are.12869 (  0) 0) |
| [54] |
Liu F, Shi H Z, Guo Q S, et al. Effects of astaxanthin and emodin on the growth, stress resistance and disease resistance of yellow catfish (Pelteobagrus fulvidraco)[J]. Fish & Shellfish Immunology, 2016, 51: 125-135. (  0) 0) |
| [55] |
Oost R V D, Beyer J, Vermeulen N P E. Fish bioaccumulation and biomarkers in environmental risk assessment: A review[J]. 2003, 13(2): 1-149.
(  0) 0) |
| [56] |
Tan X H, Lin H Z, Huang Z, et al. Effects of dietary leucine on growth performance, feed utilization, non-specific immune responses and gut morphology of juvenile golden pompano Trachinotus ovatus[J]. Aquaculture, 2016, 465: 100-107. DOI:10.1016/j.aquaculture.2016.08.034 (  0) 0) |
| [57] |
王学武. 两个生长阶段斜带石斑鱼对赖氨酸和蛋氨酸最适需要量的研究[D]. 湛江: 广东海洋大学, 2014. Wang X W. The Requirement of Lysine and Methionine for Grouper(Epinephelus coioides) at Two Growth Stage[D]. Zhanjiang: Guangdong Ocean Univerisity, 2014. (  0) 0) |
| [58] |
Giraudo E, Primo L, Audero E, et al. Tumor necrosis factor-α regulates expression of vascular endothelial growth factor receptor-2 and of its co-receptor neuropilin-1 in human vascular endothelial cells[J]. Journal of Biological Chemistry, 1998, 273(34): 22128-22135. DOI:10.1074/jbc.273.34.22128 (  0) 0) |
| [59] |
Corripio-Miyar Y, Bird S, Tsamopoulos K, et al. Cloning and expression analysis of two pro-inflammatory cytokines, IL-1β and IL-8, in haddock (Melanogrammus aeglefinus)[J]. Molecular Immunology, 2007, 44(6): 1361-1373. DOI:10.1016/j.molimm.2006.05.010 (  0) 0) |
| [60] |
Lawrence T. The nuclear factor NF-κB pathway in inflammation[J]. Cold Spring Harbor Perspectives in Biology, 2009, 1(6): a001651. (  0) 0) |
 2024, Vol. 54
2024, Vol. 54


