2. 山东省海洋生物研究院,青岛市海洋生物种质资源挖掘与利用工程实验室, 山东 青岛 266104
日本蟳(Charybdis japonica)俗称石甲红,石钳爬,花盖蟹,属节肢动物门(Arthropoda)甲壳纲(Crustacea)十足目(Decapoda)梭子蟹科(Portunidae)蟳属(Charybdis),分布于日本、马来西亚、红海、台湾岛以及中国大陆的广东、福建、浙江、山东半岛等地[1]。其肉质鲜美、营养价值高,且具有滋补、清热等药用价值,是经济价值较高的一类海产蟹类。目前,中国对于虾蟹类的研究较少,主要有锐脊单肢虾(Sicyona ingentis)[2]、南美白对虾(Litopenaeus vannamd)[3]、锯缘青蟹(Scylla serrata)[4]、中华绒螯蟹(Eriocheir sinensis)[5]、三疣梭子蟹(Portunus trituberculatus)[6]、日本蟳(Charybdis japonica)[7]等的研究。中国对于日本蟳的研究多主要集中在日本蟳的群落特征[8-9]、生理生化[10-11]、养殖繁殖方面[12-13],对于精子方面的研究较少,本研究旨在通过筛选多种不同的精子获取方法和冷冻保护剂组合选择最适的日本蟳超低温冷冻保存的方法,为日本蟳生殖调控与育种提供科学依据。日本蟳精子超低温冷冻保存在保护物种多样性方面有着广泛的研究意义和应用前景,对于提高日本蟳种质、选择培育日本蟳优良品种、提高养殖产量具有重要的意义。
1 材料与方法 1.1 实验材料实验所采用的性腺成熟日本蟳来自于山东省莱州市,体重(212.9±34.2) g、壳长(7.25±1.76) cm、壳宽(9.55±0.97) cm、壳高(3.55±0.46) cm。将日本蟳放入3%的高锰酸钾浸泡30 min,用灭菌的解剖刀、镊子将精巢部分迅速解剖,取出输精管,置于装有少量无钙离子人工海水(Ca2+ -FASW)[14]的小玻璃皿中,4 ℃保存,备用。
1.2 实验方法 1.2.1 精子的制备机械法:称取一定量的输精管,置于研钵中,加入一定量灭菌的去钙人工海水,轻轻均匀研磨3 min,匀浆液转移到1.5 mL的离心管,离心弃上清,加入Ca2+ -FASW,打成精子悬着液,4 ℃保存待检,计算精子浓度[14]。
搓洗法:称取一定量的输精管,分别置于250、300、350、400、450、500目的筛绢上,搓洗,加入一定量的灭菌无钙海水,释出精子,将透过筛绢的匀浆液全部转移到灭菌的离心管中,经离心弃上清,加入Ca2+-FASW,打成精子悬着液,4 ℃保存待检,计算精子的浓度[14]。
胰蛋白酶消化法:称取一定量的输精管,设置不同浓度胰蛋白酶浓度(0.012 5%、0.025%、0.05%、0.1%、0.15%、0.2%)、处理时间(5、10 min)、处理温度37 ℃,消化完成后使用小牛血清蛋白终止实验,去掉多余酶液,加入适量的Ca2+ -FASW,打成精子悬着液,4 ℃保存待检,计算精子的浓度、存活率[7]。
1.2.2 稀释液种类对日本蟳精子超低温冷冻保存的影响选取8种不同的稀释液(天然海水、去钙人工海水、任氏液、人工海水、NaCl -KCl溶液、10%NaCl溶液、5%NaCl溶液、柠檬酸钠-甘氨酸溶液)以5%(V/V)DMSO为保护液,精液与保护液按1:4混合,平衡20 min使用程序降温仪(Kyro360-1.7),采用-5 ℃/min降至-20 ℃;-20 ℃平衡5 min, -10 ℃/min降至-80 ℃;-80 ℃平衡5 min降温程序进行程序降温,后置于液氮中保存。
1.2.3 保护剂种类对日本蟳精子超低温冷冻保存的影响以去钙人工海水为稀释液,设置不同浓度(5%、10%和15%)的GLY、DMSO、PG抗冻保护液混合。实验中其他条件均与1.2.2相同。
1.2.4 平衡时间对日本蟳精子超低温冷冻保存的影响以去钙人工海水为稀释液,设置0、10、20、30和40 min,5组不同的平衡时间。其他条件均与1.2.2相同。
1.2.5 降温程序对日本蟳精子超低温冷冻保存的影响以去钙人工海水为稀释液,设置6种不同的降温程序(见表 1)。其他条件均与1.2.2相同。
|
|
表 1 不同降温程序 Table 1 Different cooling procedures |
以去钙人工海水为稀释液,室温解冻为对照组,设置30、35、37.5、40 ℃为实验组。其他条件等均与1.2.2相同。
1.3 精子质量与浓度的测定采用曙红染色法,用精子计数板(清华同方)计数游离精子。在光学显微镜下,存活精子形态正常、结构完整,且不被染色。死精子被染成红色,每个实验组计数5次,计算精子的浓度[15]。
1.4 数据处理使用统计软件SPSS17.0和EXCEL进行数据统计分析。用方差分析(One-way ANOVA)来检验精子冷冻前后活性差异的显著性,并利用EXCEL软件做柱状图。
2 实验结果 2.1 精子制备方法 2.1.1 机械法在采用机械研磨法破碎精荚,获得游离的精子实验中,精子的密度可达2.78×1012个/mL,精子的存活率为84.90%。
2.1.2 搓洗法选择不同目数的筛绢进行精荚的破碎,获得游离精子实验结果见表 2,结果最好的是500目的筛绢,精子浓度达3.84×1012个/mL。其次是450目的筛绢,精子浓度达3.05×1012个/mL。效果最差的是300目筛绢,精子浓度为1.01×1012个/mL。
|
|
表 2 不同筛绢目数处理后精子的浓度 Table 2 Sperm density after treated with different sieve number |
选择不同浓度的胰蛋白酶消化5、10 min,实验结果见表 3,效果最好的是低浓度的胰蛋白酶。0.05%的胰蛋白酶消化5 min,精子的死亡率为12.16%,其次是0.012 5%的胰蛋白酶消化5 min,效果最差的是0.2%的胰蛋白酶消化10 min,精子的死亡率高达83.73%,其次是0.2%的胰蛋白酶消化5 min。
|
|
表 3 不同浓度胰蛋白酶处理精荚后精子的死亡率 Table 3 Mortality of spermatozoa after treatment with different concentrations of trypsin |
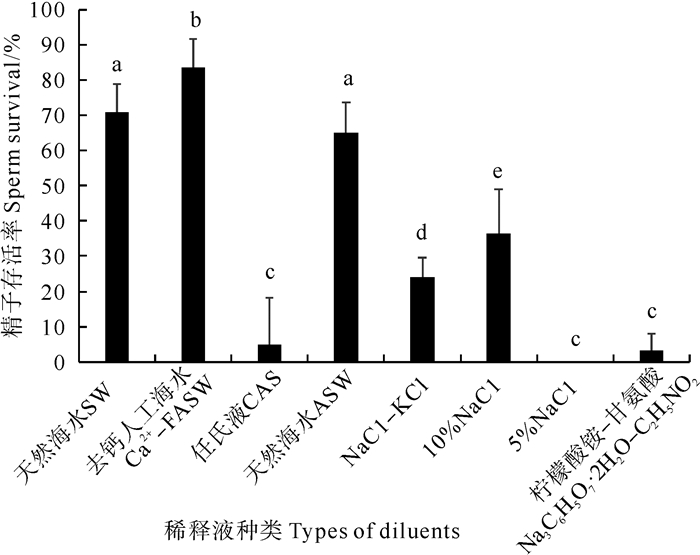
如图 1所示,不同稀释液冷冻保存日本蟳精子,冻精复苏后存活率差异显著,效果最好的是去钙人工海水,精子存活率达83.76%,其次是天然海水,精子存活率达70.0%,效果最差的是5%NaCl溶液,精子存活率为0。次之是柠檬酸钠-甘氨酸,存活率仅为3.32%。实验结果表明,稀释液对精子的存活率有较大的影响,适宜的稀释液可以使得精子在超低温冷冻保存后仍能保持较高的存活率,不适宜的稀释液可以使得精子在超低温冷冻保存后精子全部死亡。
|
(相同字母表示差异不显著(P > 0.05), 不同字母表示差异显著(P < 0.05)。The same letter means that the difference is not significant(P > 0.05), and the different letter means that the difference is significant(P < 0.05). ) 图 1 不同稀释液种类对日本蟳精子超低温冷冻保存的影响 Fig. 1 Effects of different diluent types on cryopreservation of C. japonica sperm |
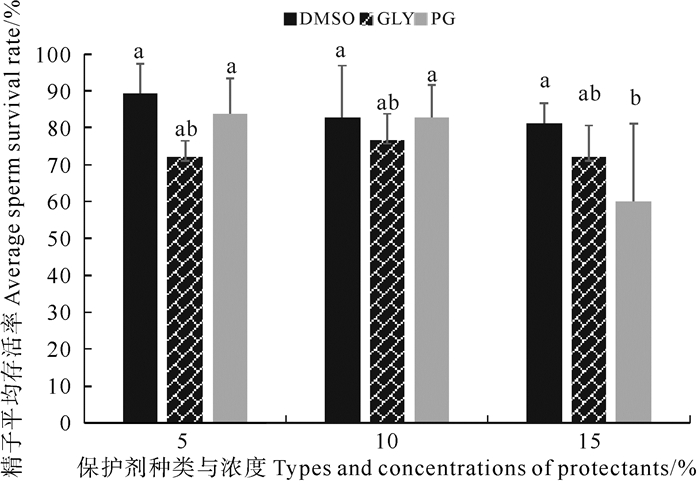
如图 2所示,不同的精子冷冻保护剂中,冻精复苏效果最好的为5% DMSO,精子存活率达89.24%;其次是5% PG,存活率为83.71%;效果较差的是5% GLY和15% GLY,但精子存活率仍能达70%以上。综合来看DMSO是3种抗冻保护剂中最适合的抗冻保护剂,且随着浓度的增加,精子冷冻保存的效果随之减弱。PG的效果次之,抗冻保护的趋势与DMSO相似。GLY是3种抗冻保护剂中效果最差的,10% GLY的效果是3种浓度梯度中最好的。
|
(相同字母表示差异不显著(P > 0.05), 不同字母表示差异显著(P < 0.05)。The same letter means that the difference is not significant(P > 0.05), and the different letter means that the difference is significant(P < 0.05). ) 图 2 保护剂种类对日本蟳精子超低温冷冻保存的影响 Fig. 2 Effects of protective agents on cryopreservation of C. japonica sperm |
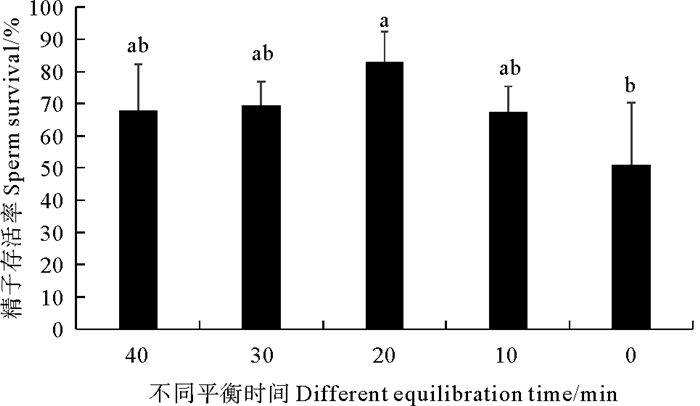
如图 3所示,不同平衡时间对日本蟳精子冷冻保存后,冻精的存活率有着明显的差异。其中,平衡20 min的实验组冷冻保存效果最好,其精子存活率达83.25%;其次是平衡30、40 min,精子存活率分别为69.33%、68.08%;效果最差的是没有平衡的实验组,存活率仅为51.90%。最适平衡时间是平衡20 min,超过20 min或者低于20 min都会降低精子冷冻保存的存活率,且超过或者低于20 min的时间越长,精子的冷冻保存的存活率越低。
|
(相同字母表示差异不显著(P > 0.05), 不同字母表示差异显著(P < 0.05)。The same letter means that the difference is not significant(P > 0.05), and the different letter means that the difference is significant(P < 0.05). ) 图 3 不同平衡时间对日本蟳精子超低温冷冻保存的存活率 Fig. 3 Survival rate of cryopreservation of C. japonica sperm at different equilibration time |
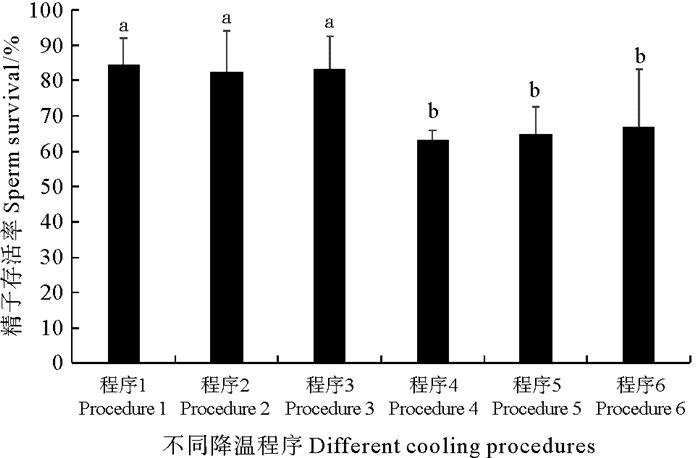
如图 4所示,程序1的冷冻保存效果最好,达84.53%;其次为程序3、程序2,精子的存活率分别为83.13%、82.41%。效果最差的是程序4,存活率仅为63.23%,其次是程序5、程序6,精子存活率为64.77%、66.88%。实验结果表明,在精子超低温冷冻保存中,在0~-80℃的降温过程中需要一个缓冲的时间段。
|
(相同字母表示差异不显著(P > 0.05), 不同字母表示差异显著(P < 0.05)。The same letter means that the difference is not significant(P > 0.05), and the different letter means that the difference is significant(P < 0.05). ) 图 4 不同降温程序对日本蟳精子超低温冷冻保存的影响 Fig. 4 Effects of different cooling procedures on cryopreservation of C. japonica sperm |
如图 5所示,不同复苏条件下,冻精存活率效果最好的是水浴37.5 ℃,精子存活率可达87.83%,其次是35 ℃水浴解冻,存活率85.45%。40和30 ℃的效果较接近,分别为82.12%、80.22%。效果最差的是24 ℃室温条件下的解冻,存活率为78.20%。
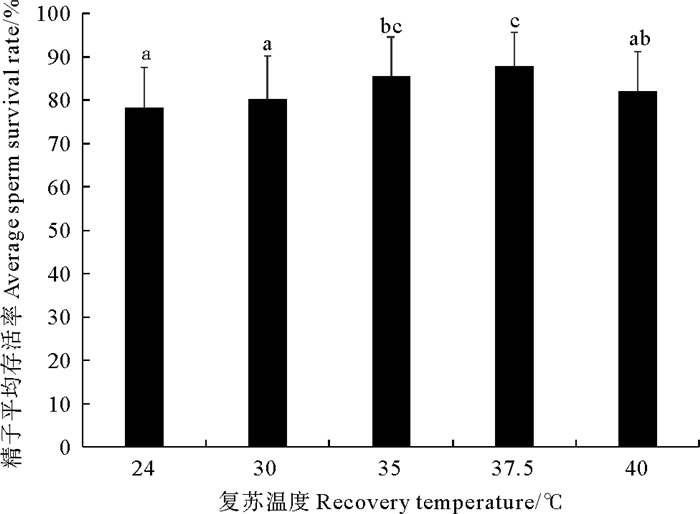
|
(相同字母表示差异不显著(P > 0.05), 不同字母表示差异显著(P < 0.05)。The same letter means that the difference is not significant(P > 0.05), and the different letter means that the difference is significant(P < 0.05). ) 图 5 不同复苏温度对日本蟳精子超低温冷冻保存的影响 Fig. 5 Effects of different resuscitation temperatures on cryopreservation of C. japonica sperma |
十足目甲壳动物具有比较特殊的生殖系统,精子是以精荚的形式在生殖系统中成熟发育的。如需要获得游离的精子必须破坏精荚壁,在这个过程中势必会对精子造成损伤。目前常见的获取精子的方式有:机械研磨法、搓洗法和胰蛋白酶消化法。本次研究中对3种精子获取的方法进行比较,选择最适合的日本蟳精子的获取方式,尽量增加精子的游离浓度,减少机械损伤。机械研磨法由于操作简单,已经在中国绒螯蟹[16]、日本蟳[7]、凡纳滨对虾[17]中使用。实验中,研磨法获得的游离的精子的数量少,且精子的破损严重,死亡率高,不利于后期实验的继续开展。胰蛋白酶是一类专一水解赖氨酸氨基和精氨酸羟基所形成的肽键的酶类。十足目甲壳类动物精荚的主要成分就是粘多糖,使用胰蛋白酶能够较有效的消化精荚壁获得游离的精子。本次实验对胰蛋白酶的浓度和消化时间进行研究,结果表明,低浓度的胰蛋白酶消化精荚的效果最好,较高浓度的胰蛋白酶会对精子造成损伤,致使精子畸形,使得大部分的精子发生顶体反应。马强等在河蟹精子的制备过程中采用了0.2%的胰蛋白酶消化5 min,获得较高的游离精子数[18]。产生差异的原因有可能是两者精荚大小的差别,日本蟳的精荚要比河蟹的小的多,胰蛋白酶所需的浓度就小一些。搓洗法操作简单快速,精子的畸形率比较低,但是仍然无法避免对精子的损伤,而且要选择合适的筛绢,以求获得足够数量的游离精子。本次实验对筛绢目数进行筛选,得出500目的筛绢是实验效果最好的,获得的游离的精子数最多,可以保障后期实验的需要。张彬等在凡纳滨对虾精子的制备过程进行比较发现搓洗法是最适合凡纳滨对虾的精子制备方法[19]。
3.2 稀释液与保存液的筛选超低温保存研究中,精子冷冻保存液主要由稀释液和抗冻剂组成,目的是为了在冷冻过程中给精子提供适宜的生理环境,调节渗透压排出多余水分,防止冰晶造成的冻伤,从而保护精子完整的细胞膜,获得高精子活力[20]。为了提高精子的保存年限和解冻后的精子质量,科研工作者对精子冷冻保护液以及解冻复苏的优化进行了大量研究,包括精液稀释比例、保护液种类、平衡时间、解冻复活温度的筛选等[21]。
实验以天然海水为对照组,参考选择不同鱼虾蟹精子冷冻保存实验中选择的稀释液,进行精子冷冻保存实验。1996年,柯亚夫等就以天然海水为稀释液对中国对虾进行冷冻保存的实验,认为稀释液中缺少Mg2+、Ca2+、K+都会降低精子冷冻保存后的存活率[22]。Vuthiphandchai等对斑节对虾的纳精囊冷冻保存进行了研究,使用无钙人工海水作为稀释液时保存效果最佳解冻后存活率达71.6%~72.2%[23]。本实验结果表明,去除Ca2+的人工海水的效果最好,天然海水和人工海水的效果均不如Ca2+ -FASW。Ca2+是血浆的重要成分,苏德学认为白斑狗鱼精子在CaCl2溶液中活力减弱,引起精子聚集现象,影响精子活力[24]。柴毅等在研究几种化学因子对白缘鱼央精子活力的影响中也得到相似的观点[25]。因此推断Ca2+的存在也可能对日本蟳精子产生抑制作用,发生聚集反应,降低了精子的存活率,使得精子在超低温冷冻保存中存活率下降。
保护剂能够自由的穿透细胞膜,减小冷冻和解冻过程中细胞渗透性损伤,并阻止冰晶形成。冷冻保护剂本身对精子也有一定的损伤[26]。不同动物种质细胞对保护剂的适应性和敏感性不同。目前最常用的抗冻剂有DMSO、PG、GLY等,其中GLY和DMSO是许多水生无脊椎动物精子的良好冷冻保护剂。2008年,廖馨等[27]采用8% DMSO作为冷冻保护剂保存青虾精子,获得60%的存活率。王文琪等[28]以7.5%的PG为保护剂对3种虾进行精子冷冻保存,获得成功。Bhavanishankar S等[4]发现GLY中冷冻保存的锯缘青蟹精子比在DMSO中有更高的成活率,在12.5% GLY精子的成活率最高。Anchordoguy等保存锐脊单肢虾时,发现5% DMSO保存效果最好,精子复苏后存活率最高[2]。本实验中,3种抗冻保护剂的效果差异并不明显,3种抗冻保护剂都对日本蟳精子冷冻保存产生了较好的保护作用,其中DMSO的效果最好,5% DMSO的保护效果最好,且随着浓度的增加,精子冷冻保存的效果随之减弱。PG的效果次之,抗冻保护的趋势与DMSO相似。GLY是3种抗冻保护剂中效果最差的,但精子存活率仍能达70%以上。实验结果表明选择最适的稀释液后,3种常见的抗冻保护剂对精子的存活率的影响并不大。
冻液与精液混合液进行平衡,这样有利于抗冻剂更好地发挥作用。精子随着温度下降其代谢活动也降低,平衡可以对低温冷冻有一个逐步适应的过程,不至于突然过冷导致死亡。青虾精子4 ℃平衡30 min,很有必要[27]。许星鸿等认为日本蟳精子样品先于4 ℃冰箱中平衡30 min,效果较好[7]。不同平衡时间对日本蟳精子超低温冷冻保存的影响不同,本实验研究结果表明平衡时间不同效果差别明显,平衡时间为0~40 min。随着平衡时间的减少,精子存活率上升,当平衡时间低于20 min后,精子的存活率下降。最适的精子平衡时间为20 min,过长或过短都会造成精子存活率的降低。
3.3 精子降温程序与复苏程序的筛选降温速率是决定冷冻成功与否的重要因素,降温速度过慢会使精子在0~-60 ℃温域内停留时间过长,胞外环境中水分可能首先结冰使渗透压升高,胞内水分渗出以平衡渗透压,而导致胞内因电解质过高带来不利影响,甚至导致细胞严重脱水、收缩变形,最终死亡;降温速度过快时,胞内水分可能来不及渗出胞外而在胞内形成冰晶,对细胞产生机械损伤,降温速率是决定冷冻成功与否的重要因素[20]。Anchordoguy等[2]保存锐脊单肢虾时认为比较慢的降温速率能取得较高的存活率,这与柯亚夫等对中国对虾精子冷冻保存的研究结果相近。本实验表明在0~-80 ℃过程中应给日本蟳精子一个缓冲的时间段,即在-20 ℃条件下,平衡5 min,会使得日本蟳精子的存活率明显的上升。
复苏方法是否合适很大程度上影响冷冻保存的效果,应针对不同的冷却过程选择不同复苏方法,复苏速度本身的效果又与细胞的种类、冷冻时使用的保护液、降温速度以及控制降温的温度(即移入液氮前所达到的温度)有关。绿壳贻贝精子冷冻复苏方法是室温条件下,在盛有海水的容器中解冻,融解后才开始测定其各项指标[29]。Shishova等[30]研究欧洲青蛙精子冷冻,用40 ℃水浴对冻精解冻。Embong等[31]报道了非洲鲶鱼(Clarias gariepirrus)冻精复苏,采用在30 ℃水浴解冻30 s。本实验中采取37.5 ℃对日本蟳精子进行解冻,与大部分实验选择的解冻温度接近。
| [1] |
刘洪军. 海水经济蟹类养殖技术[M]. 北京: 中国农业出版社, 2002: 246. Liu H J. Marine Economic Crab Culture Technology[M]. Beijing: China Agriculture Press, 2002: 246. (  0) 0) |
| [2] |
Anchordoguy T J, Crogwe J H, Griffin F J, et al. Cryopreservation of sperm from the marine shrimp Sicyonia ingentis[J]. Cryobiology, 1988, 25: 238-243. DOI:10.1016/0011-2240(88)90031-4
(  0) 0) |
| [3] |
杨春玲, 赵永贞, 陈秀荔, 等. 南美白对虾精子超低温冷冻保存技术研究[J]. 南方农业学报, 2013, 44(8): 1382-1389. Yang C L, Zhao Y Z, Chen X L, et al. Cryopreservation of sperm of Penaeus vannamei[J]. Journal of Southern Agriculture, 2013, 44(8): 1382-1389. DOI:10.3969/j:issn.2095-1191.2013.8.1382 (  0) 0) |
| [4] |
Bhavanishankar S, Subraminiam T. Cryopreservation of spermatozoa of the edible mud crab Scylla serrata (Forskal)[J]. Journal Experunmantal Zoology, 1997, 277: 326-333.
(  0) 0) |
| [5] |
陈东华, 周忠良, 范丽君, 等. 保存液及保存条件对中华绒螯蟹精子存活率的影响[J]. 华东师范大学学报(自然科学版), 2007(4): 86-94. Chen D H, Zhou Z L, Fan L J, et al. Effect of preservation solution and conditions on sperm survival rate of Eriocheir sinensis[J]. Journal of East China Normal University (Natural Science Edition), 2007(4): 86-94. DOI:10.3969/j.issn.1000-5641.2007.04.012 (  0) 0) |
| [6] |
周帅, 朱冬发, 王春琳, 等. 三疣梭子蟹精子保存研究[J]. 海洋科学, 2007(7): 37-42. Zhou S, Zhu D F, Wang C L, et al. Sperm preservation of Portunus trituberculatus[J]. Marine Science, 2007(7): 37-42. DOI:10.3969/j.issn.1000-3096.2007.07.008 (  0) 0) |
| [7] |
许星鸿, 阎斌伦, 徐加涛, 等. 日本蟳精子超低温冷冻保存技术的研究[J]. 水产科学, 2010, 29(10): 601-604. Xu X H, Yan B L, Xu J T, et al. Cryopreservation of Charybdis japonica spermatozoa[J]. Fisheries Science, 2010, 29(10): 601-604. DOI:10.3969/j.issn.1003-1111.2010.10.008 (  0) 0) |
| [8] |
丁金强, 刘萍, 李健, 等. 中国沿海日本蟳4个地理群体的形态差异比较分析[J]. 中国水产科学, 2012, 19(4): 604-610. Ding J Q, Liu P, Li J, et al. Comparative analysis of morphological differences among four geographical groups of Charybdis japonica in coastal China[J]. China Fisheries Science, 2012, 19(4): 604-610. (  0) 0) |
| [9] |
郑伟, 贾翠华, 韩志强. 中国沿海日本蟳地理群体的形态学变异研究[J]. 浙江海洋学院学报(自然科学版), 2013, 32(6): 477-483. Zheng W, Jia C H, Han Z Q. Study on the morphological variation of Charybdis japonica geographic population along the coast of China[J]. Journal of Zhejiang Ocean University (Natural Science Edition), 2013, 32(6): 477-483. DOI:10.3969/j.issn.1008-830X.2013.06.002 (  0) 0) |
| [10] |
王娜泠, 胡则辉, 卞光明, 等. 6种蟹类DNA条形码鉴定技术研究[J]. 安徽农业科学, 2017, 45(26): 131-132 + 135. Wang N L, Hu Z H, Bian G M, et al. Study on the identification technology of six kinds of crab DNA bar code[J]. Anhui Agricultural Science, 2017, 45(26): 131-132 + 135. DOI:10.3969/j.issn.0517-6611.2017.26.040 (  0) 0) |
| [11] |
王娜泠, 胡则辉, 卞光明, 等. 5种蟹类线粒体Cyt b基因序列分析及其系统发育[J]. 浙江海洋大学学报(自然科学版), 2017, 36(4): 315-319. Wang N L, Hu Z H, Bian G M, et al. Sequence analysis and phylogeny of mitochondrial Cyt b genes in five species of crabs[J]. Journal of Zhejiang Ocean University (Natural Science Edition), 2017, 36(4): 315-319. (  0) 0) |
| [12] |
许星鸿, 徐加涛, 阎斌伦, 等. 日本蟳人工育苗技术研究[J]. 黑龙江水产, 2009(5): 8-10. Xu X H, Xu J T, Yan B L, et al. Study on artificial breeding technology of Charybdis japonica[J]. Heilongjiang Fisheries, 2009(5): 8-10. (  0) 0) |
| [13] |
王春琳, 蒋霞敏, 陈惠群, 等. 日本蟳繁殖生物学的初步研Ⅱ.雄性繁殖习性及胚胎发育[J]. 东海海洋, 2000(1): 43-49. Wang C L, Jiang X M, Chen H Q, et al. Preliminary study on reproductive biology of Charybdis japonica Ⅱ. Male reproductive habits and embryonic development[J]. Donghai Ocean, 2000(1): 43-49. DOI:10.3969/j.issn.1001-909X.2000.01.007 (  0) 0) |
| [14] |
Leung T J R, Lawrence A L. Observation on the decline in sperm quality of Penaeus setiferus under laboratory conditions[J]. Aquaculture, 1987(65): 363-370.
(  0) 0) |
| [15] |
Clark W H Jr, Kleeve M G, Yudin A I. An acrosome reaction in natantian sperm[J]. Journal Experunmantal Zoology, 1981, 218: 279-291.
(  0) 0) |
| [16] |
陈东华.中华绒螯蟹(Eriocheir sinensis)精子低温保存的研究[D].武汉: 华东师范大学, 2006. Chen D H. Cryopreservation of Spermatozoa of Eriocheir sinensis[D]. Wuhan: East China Normal University, 2006. (  0) 0) |
| [17] |
赵晶.凡纳滨对虾精巢组织细胞的培养及精荚低温保存方法的建立[D].南宁: 广西大学, 2014. Zhao J. Culture of Testis Cells of Litopenaeus vannamei and Establishment of Cryopreservation Method of Spermatophore[D]. Nanning: Guangxi University, 2014. (  0) 0) |
| [18] |
马强, 王群, 李恺, 等. 酶消化法和匀浆法获得河蟹游离精子的比较研究[J]. 华东师范大学学报(自然科学版), 2006(2): 82-87. Ma Q, Wang Q, Li K, et al. Comparative study on trypinsinse digestion and homogenization in acquiring free sperms from Eriocheir Sinensis[J]. Journal of East China Normal University (Natural Science Edition), 2006(2): 82-87. DOI:10.3969/j.issn.1000-5641.2006.02.013 (  0) 0) |
| [19] |
张彬, 韦嫔媛, 熊建华, 等. 凡纳滨对虾精液制备及精子质量评价的初步研究[J]. 西南农业学报, 2014, 27(6): 2700-2705. Zhang B, Wei B Y, Xiong J H, et al. Preliminary study on semen preparation and sperm quality evaluation of Litopenaeus vannamei[J]. Journal of Southwest Agriculture, 2014, 27(6): 2700-2705. (  0) 0) |
| [20] |
Chen S L. Progress and prospect of cryopreservation of fish gametes and embryos[J]. Journal of Fisheries of China, 2002, 26(2): 161-168.
(  0) 0) |
| [21] |
杨爱国, 王清印, 孔杰, 等. 扇贝精液超低温冷冻保存技术的研究[J]. 海洋与湖沼, 1999, 30(6): 624-628. Yang A G, Wang Q Y, KONG J, et al. Studies on spermatozoa cryopreservation of scallop[J]. Ocean and Limnology, 1999, 30(6): 624-628. DOI:10.3321/j.issn:0029-814X.1999.06.007 (  0) 0) |
| [22] |
柯亚夫, 蔡难儿. 中国对虾精子超低温保存的研究[J]. 海洋与湖泊, 1996(1): 187-193. Ke Y F, Cai N E. Cryopreservation of sperm of Penaeus chinensis[J]. Oceans and Lakes, 1996(1): 187-193. (  0) 0) |
| [23] |
Vuthiphandchai V, Nimrat S, Kotcharat S, et al. Development of a cryopreservation protocol for long-termstorage of black tiger shrimp (Penaeus monodon) spermatophores[J]. Thenogenology, 2007, 68(8): 1192-1199. DOI:10.1016/j.theriogenology.2007.08.024
(  0) 0) |
| [24] |
苏德学, 严安生, 田永胜, 等. 钠、钾、钙和葡萄糖对白斑狗鱼精子活力的影响[J]. 动物学杂志, 2004(1): 16-20. Su D X, Yan A S, Tian Y S, et al. Effects of sodium, potassium, calcium and glucose on sperm motility of Esox lucius[J]. Journal of Zoology, 2004(1): 16-20. (  0) 0) |
| [25] |
柴毅, 李罗新, 张彦宁, 等. 几种化学因子对白缘鱼央精子活力的影响[J]. 长江大学学报(自然科学版), 2009, 6(2): 30-31, 41. Chai Y, Li L X, Zhang Y N, et al. Effect of several chemical factors on the motility of spermatozoa in the central part of Liobagrus marginatus Günther[J]. Journal of Changjiang University (Natural Science Edition), 2009, 6(2): 30-31, 41. (  0) 0) |
| [26] |
Watsom P E, Plummer J M. Relationship betweet calcium binding sites and membrane fusion during the acrosome reaction induced by ionophore in ram spermetozoa[J]. Journal Experunmantal Zoology, 1986, 23: 811-813.
(  0) 0) |
| [27] |
Liao X, Ge J C, Ding S Y, et al. Study on cryopreservation of the sperm of freshwater prawn Macrobrachium nipponense[J]. Journal of Nanjing University (Natural Sciences), 2008, 44(4): 421-426.
(  0) 0) |
| [28] |
王文琪, 杨敬昆, 许世宏, 等. 3种对虾精子超低温冷冻保存技术研究[J]. 海洋科学, 2017, 41(9): 81-86. Wang W Q, Yang J K, Xu S H, et al. Cryopreservation of sperm of three species of prawn[J]. Marine Science, 2017, 41(9): 81-86. (  0) 0) |
| [29] |
Smith J, Adams S, Gale S, et al. Cryopreservation of GreenshellTM mussel (Perna canaliculusi) sperm establishment of freezing protocol[J]. Aquaculture, 2012(334-337): 199-204.
(  0) 0) |
| [30] |
Shishova N R, Uteshev V K, Kaurova S A, et al. Cryopreservation of hormonally induced sperm for the conservation of threatened amphibians with Rana temporaria as a model research species[J]. Theriogenology, 2011, 75(2): 220-232. DOI:10.1016/j.theriogenology.2010.08.008
(  0) 0) |
| [31] |
Embong W, Kamaruding N, Abdullah R. Development of cryopreservation technique from fresh sperm baseline information of african catfish (Clarias gariepinus)[C]. 2011 2nd International Conference on Agricultural and Animal Science. Singapore: IACSIT Press, 2011: 10-14.
(  0) 0) |
2. Shandong Institute of Marine Biology, Engineering Laboratory For Exploration and Utilization of Marine Germplasm Resources of Qingdao, Qingdao 266104, China
 2020, Vol. 50
2020, Vol. 50


