多溴联苯醚(Poly brominated diphenyl ethers, PBDEs)因阻燃效率高、成本低而成为重要的溴代阻燃剂,普遍存在于人们日常用品、工业材料中[1]。但同时,PBDEs也因具有生物蓄积性、持久性和高毒性等典型POPs的特性引起广泛关注。目前已经在海洋沉积物等环境介质中检测到大量PBDEs的存在,研究报道韩国工业化海湾的PBDEs最高干质量浓度为2 253 ng/g,日本沿海为PBDEs为5.2~33 ng/g,东印度洋PBDEs干质量浓度为(173±62) pg/g,而在中国沿海沉积物中PBDEs干质量浓度为0.004~4 212 ng/g,普遍高于其他国家地区[2-4]。各个海区虽然浓度有差异,但PBDEs组成相似,以BDE-209和BDE-47为主[5]。而且大量生物研究也证明了PBDEs可以富集到海洋浮游动物中,并通过食物链向更高营养级转移[6]。Liu等[7]在中国渤海的18个物种(包括浮游生物、无脊椎动物和鱼类)中测定了PBDEs富集水平,其中BDE-47检出率最高,值为100%,在所有PBDEs同系物中的脂质量浓度也最高。相关的生物毒性研究也多有展开,主要集中于探索PBDEs对鱼类的毒性作用,BDE-47已被证明可诱导氧化损伤导致鱼类的生殖和代谢抑制[8-10]。浮游动物也被证明可直接受到PBDEs的影响,表现为摄食、游泳、种群动态(尤其是生殖)等受到抑制[11-12],以及氧化损伤和内稳态紊乱[13],而氧化损伤引起的卵巢病变被认为是PBDEs抑制生殖的主要原因[14]。
旧型溴系阻燃剂的使用受到限制促使替代产品的需求量急剧增加,因而结构和理化性质方面同PBDEs相似的十溴二苯乙烷(DBDPE)已经基本替代了PBDEs在各类产品中的应用[15],而中国DBDPE的产量更是远高于其他国家[16]。环境调查也发现类似趋势,日本海域沉积物中检出DBDPE浓度为0.07~0.85 ng/g,韩国高度工业化海湾沉积物中检出DBDPE干质量浓度为(11.6±17.5) ng/g,中国黄海和东海河口处沉积物中检出DBDPE干质量浓度为0.18~49.9 ng/g,海域表层沉积物中检出DBDPE的干质量浓度为0.04~9.47 ng/g[17-19]。且DBDPE在海洋环境中的浓度也有赶超PBDEs的趋势[20-21]。但是对以DBDPE为主的新型溴系阻燃剂在生物暴露风险的进一步认知都还处于空白状态。
褶皱臂尾轮虫(Brachionus plicatilis)是海洋中常见的浮游动物,是众多污染物进入海洋的第一道“生物过滤网”,具有易培养、生殖快、对环境变化敏感等优点,是毒理试验中一种较为理想的受试动物[22]。它的生殖力和存活力是掌握浮游动物种群变化的重要指标,其中产幼率可衡量种群的净增长量,存活力可表征种群的稳定[23]。作为海洋生态系统食物链的初级消费者,褶皱臂尾轮虫的种群稳定关乎初级生产力的利用率,更影响高营养级的种群发展[24]。
为填补新型溴系阻燃生物毒性研究的空白,并进一步探究新、旧溴系阻燃剂联合作用下生物毒性效应的变化,进而揭示其作用规律,本研究选择在海洋环境中PBDEs的主要同系物BDE-47和其主要替代品DBDPE为胁迫因子,以褶皱臂尾轮虫为受试动物,分析饱食和饥饿状态下轮虫生殖力和存活力的响应特征,为重新全面认识溴系阻燃剂的环境潜在危害提供基础依据,同时也为适时有效的保护海洋生态系统的健康提供理论指导。
1 材料与方法 1.1 实验动物培养实验用褶皱臂尾轮虫休眠卵购自浮田生物(浙江宁波),在灭菌海水中孵化,并在实验前驯化培养至少2周,驯化条件:盐度为22,温度为20~25 ℃,pH值为6~9,光照强度为60 mol/(m2·s),且明暗比为12 L∶12 D。驯化过程中,投喂饵料(小球藻(Chlorella vulgaris)),密度保持在1×106 cell/mL。实验所用海水(盐度约为30)取自青岛鲁迅公园附近海域,经沉淀和0.45滤膜过滤,121.3 ℃灭菌20 min,冷却后使用。
1.2 胁迫体系设置本研究胁迫因子,BDE-47(纯度>99.99%,GC级,白色固体粉末)购自美国AccuStandard公司,DBDPE(纯度>96.00%,白色固体粉末)购自日本Tokyo Chemical Industry公司,用助溶剂二甲亚砜(DMSO)分别配制成母液,常温避光下保存。实验前,用灭菌海水依次稀释至实验设定的浓度梯度。
1.3 实验设计试验在24孔板中进行,挑选刚孵化2~3 h、活泼健壮的幼轮虫为实验对象,每10只幼虫放到一个孔内作为一个样品,每孔内最终实验体积为1 mL,并进行6次重复。
所有实验组按饵料投喂的密度不同分为饱食组和饥饿组。饱食组小球藻密度同驯化期保持一致,为1×106 cell/mL,饥饿组小球藻密度较低,为0.7×106 cell/mL。实验过程采取半连续培养,每24 h分别更换80%的BDE-47或DBDPE培养液,并重新投喂小球藻,以保证毒性条件和饵料藻含量的稳定。
根据胁迫物质加入情况,实验分为空白对照组、BDE-47单一作用组、DBDPE单一作用组和等浓度联合作用组。BDE-47和DBDPE单一作用组均根据环境本底值及预实验,以环境中PBDEs浓度上限为低浓度组,并取其10倍和100倍为中、高浓度,由此设置了3个浓度梯度:低浓度(Low concentration)5 μg/L、中浓度(Middle concentration)50 μg/L、高浓度(High concentration)500 μg/L。联合作用组的3个浓度梯度设置同单一作用组浓度梯度设置一致,并在实验时按等浓度同时加入BDE-47和DBDPE。为方便起见,实验体系中,BDE-47、DBDPE单一作用和联合作用3个组每组的3个浓度梯度都标记为低浓度(5)、中浓度(50)、高浓度(500)。
实验过程中,每12 h观察1次,记录出现新生幼虫从开始到结束的时间(生殖期)、轮虫新生幼虫数和存活个体的数量,并及时将新生幼虫和死亡的成虫移出,直到初始的10只轮虫全部死亡。通过计算每12 h产生的后代数量比存活数可得其特定年龄产幼率,通过计算每12 h存活轮虫数比初始轮虫数可得其特定年龄存活率。进而计算出各个作用方式下的生殖期和产幼数的抑制率。
本文采用合用指数值(Q值)法评价联合毒作用模式[25],根据公式(1)计算Q值:Q>1.15代表 2种抑制剂的抑制作用存在协同作用;0.85 < Q < 1.15代表 2种抑制剂的抑制作用存在相加作用;Q < 0.85代表 2种抑制剂的抑制作用存在拮抗。
| $ Q=E_{\mathrm{AB}} /\left(E_{\mathrm{A}}+E_{\mathrm{B}}-E_{\mathrm{A}} E_{\mathrm{B}}\right)。$ | (1) |
式中:EA、EB分别为2种药物A和B的总有效率;EAB为合用组总有效率。
1.4 数据统计与分析所有实验数据的统计分析应用数据处理软件IBM SPSS statistics 25进行,图片利用Origin软件绘制,图中数据点为平均值±标准误(mean±SE)。相应的实验组与对照组的比较采用方差分析,组间两两比较采用LSD检验,检验水准α=0.05。
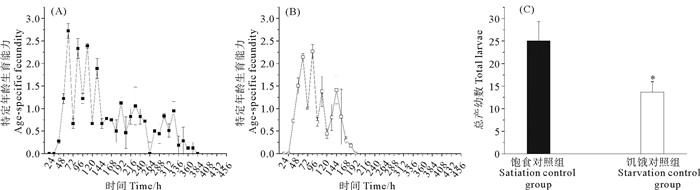
2 结果与分析 2.1 BDE-47和DBDPE单一及联合作用对褶皱臂尾轮虫的生殖力的影响无胁迫时,饱食和饥饿培养条件下的空白对照组褶皱臂尾轮虫的生殖力变化如图 1。饱食情况下,轮虫的生殖期从36 h开始,至384 h结束,产幼在初期快速增加并在60 h进入生殖高峰期,达到产幼的生殖峰平均值(2.72 ind.),持续到132 h,随后产幼数量减少(见图 1(A)),总产幼平均数为20.06 ind.(见图 1(C))。饥饿情况下,轮虫的生殖期同样是从36 h开始,但结束提前至192 h,产幼初期也为快速增长,60 h达到产幼的高峰期,但84 h才达到生殖峰平均值(2.26 ind.),随后结束产幼高峰期(见图 1(B)),总产幼平均数为13.69 ind.(见图 1(C))。饥饿培养下的轮虫较饱食状态生殖期缩短,生殖峰值降低,总产幼数显著低于饱食对照组(P<0.05),表现为生殖力低于饱食培养下的轮虫。
|
( (A)饱食组特定年龄产幼率;(B)饥饿组特定年龄产幼率;(C)饱食组和饥饿组总产幼数。P值为相同营养条件对照组比较的结果,*:P<0.05. (A) Satiation control group; (B) Starvation control group; (C) The total larval number of satiation control group and starvation control group. The P value was the result of comparison with the control group under the same nutritional conditions.*:P<0.05. ) 图 1 不同饵料藻密度下褶皱臂尾轮虫的生殖力的变化 Fig. 1 Under different feed concentrations, the change of B. plicatilis fecundity |
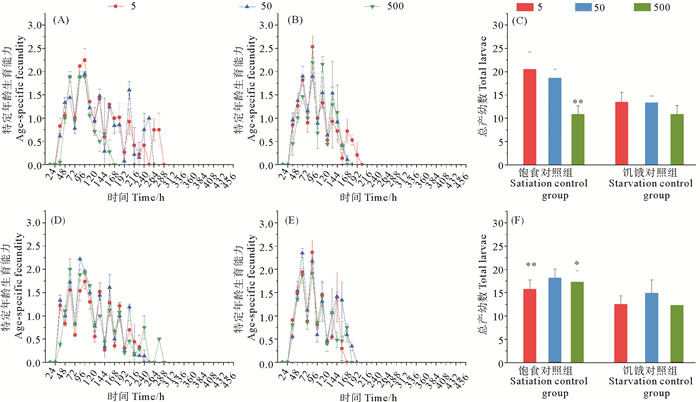
BDE-47和DBDPE单一作用下,褶皱臂尾轮虫的生殖力变化如图 2。饱食培养下,BDE-47单一作用组轮虫生殖期的起始时间与对照组基本相同,但生殖期的结束时间明显受到影响,低浓度组(5 μg/L)提前至288 h,中浓度组(50 μg/L)提前至264 h,而高浓度组(500 μg/L)在168 h就结束(见图 2(A))。相比于对照组,BDE-47单一作用组生殖期在低浓度受到显著抑制(P < 0.05),中、高浓度受到极显著抑制(P < 0.01, 见表 1)。生殖峰值也推迟到96 h出现,并随浓度升高逐渐降低,低浓度时的生殖峰平均值为2.25 ind.,中浓度时的生殖峰平均值为1.94 ind.,高浓度时的生殖峰平均值为1.89 ind.。饥饿组的生殖期结束时间较饱食组整体提前:低浓度204 h,中浓度180 h,高浓度168 h(见图 2(B))。但和饥饿组的空白对照相比,生殖期没有受到显著抑制(P>0.05, 见表 1)。但生殖峰平均值却在低浓度时表现出兴奋效应,为2.53 ind.,中、高浓度受到抑制。总体产幼数结果表明随着浓度的升高,产幼数量先升高后下降,且虽然饱食组产幼数量整体高于饥饿组,但和对照组相比饱食组受抑制更明显,在高浓度组受到极显著抑制(P < 0.01, 见图 2(C))。DBDPE表现出相反的变化趋势(见图 2(D)、(E)),随着浓度的升高轮虫的生殖期延长,饱食培养条件下,低浓度为240 h,中浓度为252 h,高浓度为288 h;饥饿培养下,低浓度为168 h,中浓度为180 h,高浓度为192 h,但无论是生殖期还是峰值都小于对照组。DBDPE作用下,总体产幼数结果同样随着浓度的升高,产幼数量先升高后下降(见图 2(F)),但在低浓度时表现出更强的抑制,而在高浓度时表现出抑制较弱,但均未呈现显著差异(P>0.05)。
|
( 5,50,500分别为BDE-47或DBDPE浓度5,50和500 μg/L。(A) BDE-47作用于饱食组;(B) BDE-47作用于饥饿组;(C) BDE-47作用下饱食组和饥饿组总产幼数;(D) DBDPE作用于饱食组;(E) DBDPE作用于饥饿组;(F) DBDPE作用下饱食组和饥饿组总产幼数。P值为和相同营养条件对照组比较的结果,*:P < 0.05,**:P < 0.01。5, 50, 500 refer to BDE-47 or DBDPE concentration 5, 50 and 500 μg/L, respectively. (A) BDE-47 on satiation group; (B) BDE-47 on starvation group; (C) BDE-47 on the total larval number of satiation group and starvation group; (D) DBDPE on satiation group; (E) DBDPE on starvation group; (F) DBDPE on the total larval number of satiation group and starvation group. The P value was the result of comparison with the control group under the same nutritional conditions, ,*: P < 0.05,**: P < 0.01. ) 图 2 不同饵料藻密度下,BDE-47和DBDPE单一作用对褶皱臂尾轮虫的生殖力的影响 Fig. 2 Under different feed concentrations, effects of single action of BDE-47 and DBDPE on fecundity of B. plicatilis |
|
|
表 1 BDE-47和DBDPE单一和联合作用下,轮虫生殖期和总产幼数抑制情况 Table 1 The inhibition of rotifer reproductive stage and total larvae number under the single and combined action of BDE-47 and DBDPE |
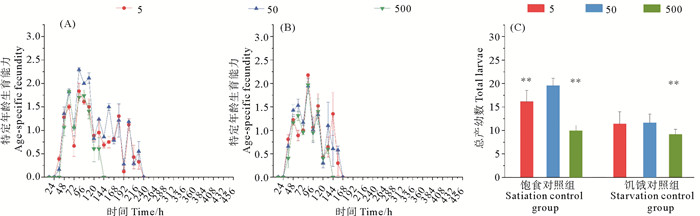
等浓度BDE-47和DBDPE联合作用组对轮虫生殖力的影响如图 3。饱食培养时,低、中浓度组的轮虫均在240 h就结束生殖期,高浓度受抑制最严重,在144 h结束(见图 3(A))。饥饿培养时,低、中、高浓度的生殖期结束都较对照组提前(见图 3(B)),且中、高浓度生殖期分别呈现显著(P < 0.05)和极显著抑制(P < 0.01, 见表 1)。低、中浓度组的生殖峰同样在84 h,高浓度组提前至60 h,且峰值也受到一定程度的抑制。总产幼数变化呈现随浓度升高,先升高后降低,低浓度组和高浓度组都呈现极显著抑制(P < 0.01),在高浓度组受抑制最严重,总产幼平均数为10.01 ind.(见图 3(C))。总产幼数始终低于高密度组,变化趋势也为先升高后降低,在高浓度显著低于饥饿对照组(P < 0.01)。
|
( 5,50,500分别为BDE-47和DBDPE浓度5,50和500 μg/L。(A) 联合作用于饱食组;(B) 联合作用于饥饿组;(C) 联合作用下饱食组和饥饿组总产幼数。P值为和相同营养条件对照组比较的结果,*:P < 0.05,**:P < 0.01。5, 50, 500 refer to BDE-47 and DBDPE concentration 5, 50 and 500 μg/L, respectively. (A) Combined action on satiation group; (B) Combined action on starvation group; (C) Combined action on the total larval number of satiation group and starvation group. The P value was the result of comparison with the control group under the same nutritional conditions, *: P < 0.05,**: P < 0.01. ) 图 3 不同饵料藻密度下,BDE-47和DBDPE联合作用对褶皱臂尾轮虫的生殖力的影响 Fig. 3 Under different feed concentrations, effects of combined action of BDE-47 and DBDPE on fecundity of B. plicatilis |
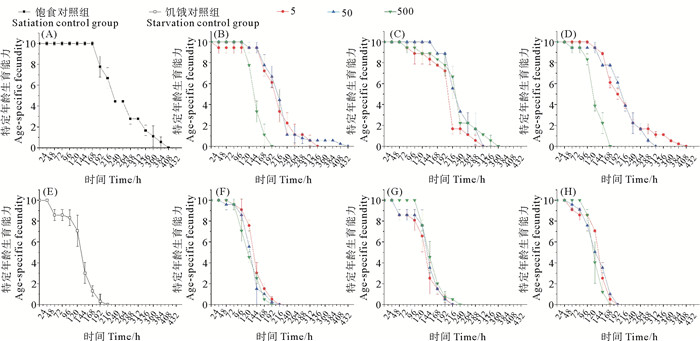
BDE-47和DBDPE单一和联合作用对轮虫的存活情况影响如图 4所示。饱食培养的对照组从168 h开始出现死亡个体,在408 h初始轮虫个体都死亡(见图 4(A)),饥饿对照组则从48 h就出现死亡个体,192 h全部轮虫死亡(见图 4(B))。饱食培养时,BDE-47单一作用低浓度组24 h就出现死亡个体,336 h全部个体。中浓度和高浓度出现死亡个体时间晚于低浓度组,但高浓度组大量死亡,特定年龄存活率曲线陡于其他组,192 h全部个体死亡,存活时间减少(见图 4(B))。而饥饿时,轮虫对BDE-47单一作用响应趋势类似(见图 4(F)),高浓度组存活时间最短(192 h)。DBDPE单一作用组在饱食培养组时(见图 4(C)),中浓度组出现死亡个体最迟(168 h),但高浓度组存活时间最长(360 h)。而DBDPE单一作用于饥饿培养组时(见图 4(G)),则是高浓度组出现死亡个体最迟(120 h),且存活时间最长(216 h)。联合作用于饱食培养组时,在中、高浓度组最早出现死亡个体(48 h),且存活时间受到显著抑制,其中高浓度组受抑制最严重,168 h全部死亡(见图 4(D))。而当联合作用于饥饿培养组时,高浓度组存活时间相同为168 h,低、中浓度组则呈现受抑制更明显,均为192 h(见图 4(H))。
|
( (A) 饱食对照组;(B) BDE-47作用于饱食组;(C) DBDPE作用于饱食组;(D) 联合作用于饱食组;(E) 饥饿对照组;(F) BDE-47作用于饥饿组;(G) DBDPE作用于饥饿组;(H) 联合作用于饥饿组。(B)、(F) 中,5,50,500为BDE-47浓度5,50和500 μg/L;(C)、(G) 中,为DBDPE浓度5,50和500 μg/L;(D)、(H) 中,为BDE-47和DBDPE浓度5,50和500 μg/L。(A) Satiation control group; (B) BDE-47 on satiation group; (C) DBDPE on satiation group; (D) Combined action on satiation group; (E) Starvation control group; (F) BDE-47 on starvation group; (G) DBDPE on starvation group; (H) Combined action on starvation group. In (B) and (F), 5,50,500 refer to BDE-47concentration 5, 50 and 500 μg/L; in (C) and (G), refer to DBDPE concentration 5, 50 and 500 μg/L; in (D) and (H), BDE-47 and DBDPE concentration 5, 50 and 500 μg/L. ) 图 4 不同饵料藻密度下,BDE-47和DBDPE单一及联合作用对褶皱臂尾轮虫特定年龄存活率的影响 Fig. 4 Effects of single and combined action of BDE-47 and DBDPE on survival of B. plicatilis under different feed concentrations |
从20世纪70年代起,PBDEs作为阻燃剂中的主力军一直被大量生产并应用,其主要同系物BDE-47也成为海洋环境中的主要污染物之一。而随着PBDEs的禁用,以DBDPE为代表的新型阻燃剂如今在应用方面已经取代了PBDEs的地位,并逐渐向环境中释放,形成更加多样的海洋环境,并造成更加复杂的海洋生物暴露风险。本研究以海洋的第一道防线-浮游动物褶皱臂尾轮虫(B. plicatilis)为对象,选取BDE-47和DBDPE为旧型和新型溴系阻燃剂代表,通过研究生殖力和存活力的毒性效应变化,探究BDE-47和DBDPE联合作用下毒性效应变化规律。
从生殖力结果看,BDE-47或DBDPE都可以抑制褶皱臂尾轮虫的生殖期持续时间、生殖峰值及总产幼率,两者联合作用时表现出更强的抑制作用,而饵料藻的减少虽然在总体上抑制了生殖力,但在一定程度上也减弱了BDE-47和DBDPE的抑制作用。BDE-47已被证明可以通过诱导ROS含量增加,导致氧化应激,进而降低轮虫的生殖力[26]。DCF-DA荧光探针实验也显示轮虫卵巢中的ROS远高于其他器官,同时伴有氧化损伤现象[14]。这是由于卵巢中脂肪含量丰富,易成为脂溶性BDE-47富集的靶器官。作为一种新兴污染物,DBDPE的靶组织和主要毒性尚不清楚,但有少量研究支持DBDPE主要存在于肾脏和卵巢中[27]。在特定组织中的靶向积累会造成直接接触并导致相应的生殖毒性,大鼠实验证明,DBDPE可通过诱导大鼠性腺端粒功能障碍及相关细胞衰老和凋亡[28-29]。
已有研究证明,DBDPE对水蚤(Daphnia)有剧毒,EC50值为19 μg/L,且DBDPE降低了暴露的斑马鱼卵的孵化率,并显著提高了孵化幼虫的死亡率[30]。同时对BDE-47研究也发现,其对水蚤的EC50值为0.058 mg/L,远远大于DBDPE,表现为更高的生物毒性[31]。Feng等的研究也证明BDE-209具有比DBDPE更高的氧化应激诱导能力,表现为抗氧化酶活性显著抑制和谷胱甘肽还原水平降低,并指示脂质过氧化水平丙二醛含量升高。而BDE-209作为BDE-47同系物,其毒性远小于BDE-47,这也间接证明了BDE-47毒性大于DBDPE[32]。通过本文对B. plicatilis的生殖期研究发现,除饱食培养下的高浓度联合作用组,所有组都可在36 h内产生新的幼虫,但是各组生殖期结束时间有明显差异,导致不同组的生殖期持续时间差异较大(见表 1)。BDE-47单一作用时,随浓度升高,生殖期持续时间逐渐受到抑制,DBDPE单一作用组则随浓度升高生殖期持续时间逐渐升高,表现出一定的兴奋效应,且高浓度DBDPE单一作用的生殖期持续时间较BDE-47单一作用的生殖期持续时间长,表明对于生殖期等浓度的DBDPE的毒性弱于BDE-47。本文结果同以往研究结果一致,DBDPE诱导的生物毒性弱于BDE-47。
二者联合作用于轮虫生殖力相关指标的抑制趋势和BDE-47单一作用类似,并呈现更强的抑制作用,联合作用的饱食组生殖期仅为96 h,饥饿组为108 h。BDE-47和DBDPE联合作用下,轮虫生殖期作用模式如表 2所示。在饱食时,低、中浓度BDE-47和DBDPE两者联合作用时表现为拮抗作用,在高浓度时表现为相加作用。而在饥饿时,3个浓度均表现为协同作用。推测首先是因为饱食培养时,充足的食物供给为轮虫提供充足的物质保障,进而产生足够的抗性物质和酶。研究证明对于长期饥饿的鲈鱼(Dicentrarchus labrax),重新喂养后会大量增加其体内谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)等抗氧化酶的活性,并增加Hsp 90等抗性物质含量,使其生物抗性增加[33]。Zengin等[34]的研究也证明喂食的虹鳟鱼(Oncorhynchus mykiss)体内抗氧化防御相关的物质含量普遍高于饥饿状态的黑鱼,涉及的抗氧化物质包括谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)等抗氧化剂,以及SOD、CAT、谷氨酸过氧化物酶(GSHpx)、谷胱甘肽还原酶(GR)等抗氧化酶。而随着浓度升高,饱食组BDE-47和DBDPE联合作用由拮抗作用转变为协同作用,因为外界饵料藻密度不变的情况下,轮虫自身摄食能力受到抑制。研究证明BDE-47可以导致轮虫滤食率和摄食率的减少,并诱导其消化酶活性降低[35]。同时DBDPE作为PBDEs的替代品,具有相似的理化性质,因此在生物体内应对这2种物质的生理保护机制是共享的,因此BDE-47和DBDPE以非致死性浓度同时作用时,一种胁迫因子刺激增强生物体对另一种胁迫因子的耐受性,既交叉耐受性[36-37]。并且相关研究也证明,一定程度上,盐度胁迫强度的增加会使昆虫种群表现出更强的交叉耐受性[38]。大型水蚤可以通过诱导体内金属硫蛋白和Hsp70含量的提高对Cd和热胁迫产生交叉耐受性,并且随着Cd的浓度升高,金属球蛋白的表达量也上调,呈现更强的耐受性[39]。而虽然饥饿组生殖期普遍比饱食组短,但同对照组相比,饱食组呈现更高强度的抑制,进而导致交叉耐受性响应更强,表现出拮抗作用。饱食培养下的轮虫受到PBDE的相对抑制更强这可能是由于高密度的饵料藻会导致轮虫在摄食过程中伴随性摄入更多的毒物,进而受到的胁迫更强,而饥饿受食物限制,摄入毒物也较少。因此饱食培养时,轮虫可能受到的外源胁迫更强,体现出生殖期的相对抑制率更高,而同时充足的食物供给又保障了轮虫抗氧化系统的活跃,进而使联合作用表现出拮抗效应。
|
|
表 2 BDE-47和DBDPE联合作用下,轮虫生殖期和总产幼数作用模式 Table 2 The action mode of rotifer reproductive stage and total larvae number under combined action of BDE-47 and DBDPE |
在饥饿培养时,轮虫生殖期和对照组相比的相对抑制较低(见表 1),除了低摄食可能导致的污染物低生物富集,还可能因为饥饿在一定程度上增加生物的抗性。因为饥饿可以使生物产生一定程度的氧化应激,进而更及时的应对外源毒物的胁迫。而饱食虽然可以保障抗氧化物质原料的供给,但抗氧化系统初始活跃度低,导致生物响应迟缓。研究证明暴露于急性Cu胁迫时,高日粮鱼的敏感性是低日粮鱼的2倍,减少食物摄入量可以降低急性Cu暴露的影响[40]。Higashimoto等研究证明了在连续禁食期间小鼠肝脏金属硫蛋白(MT)的显著增加,这可能是抗性增加的原因之一[41]。同时,在饥饿培养条件下,虽然轮虫保持氧化应激的战备状态,但是调动需要大量抗性物质积累的交叉耐受性能力弱,进而表现出联合作用时出现协同作用。
除生殖期外,生殖力的另一指标总产幼数表现出相似的变化规律,但整体敏感度弱于生殖期,表明轮虫受胁迫时倾向于短时间大量产卵。有研究证明BDE-47虽然会抑制褶皱臂尾轮虫种群的密度,降低其环境容纳量,但在增长期可以在一定程度上提高轮虫种群的最大瞬时增长率[42]。饥饿培养时,轮虫的总产幼数整体较低,但单一或联合作用组的抑制率要低于同条件饱食培养组的轮虫。BDE-47在总产幼数方面抑制率在低、中浓度引起的兴奋效应不尽相同,但在高浓度时的抑制率高于DBDPE的抑制率,同生殖期结果相一致,同样可能受摄食行为的调控。通过比较表 2中的总产幼的Q值,在饱食时,BDE-47和DBDPE联合作用下总产幼数同生殖期一致,在低、中浓度组均表现为拮抗作用,在高浓度组表现为协同作用。
从存活力结果看,饱食培养下的轮虫虽然比饥饿培养下的轮虫存活期更长,但同对照组相比,相对受抑制程度更强,小密度饵料培养时,除了联合作用高浓度组,其他组基本没有受到明显抑制。这是因为一方面研究证明饥饿会加速生物的衰老,表现出免疫系统、内分泌系统和生殖系统活力的迅速衰退[43],进而减少了轮虫的存活时间。而另一方面生物的存活力主要受基础代谢控制,而轮虫作为孤雌生殖个体,种群基本全为雌性个体,体内往往为了生殖而有更丰富的物质储备,因此应对外源胁迫的能力更强[44]。从存活期抑制情况看,BDE-47毒性同样强于DBDPE,联合作用时表现毒性增加(见表 3)。并且存活的整体抑制程度也弱于生殖力,这是因为同主要受基础代谢控制的存活不同,轮虫的生殖力既受基础代谢控制,还需足够的外源物质补充,即摄食情况控制,因此敏感程度更高[45]。且生物的生殖器官往往含有丰富的脂质,成为脂溶性毒物的重要靶标,更容易受到胁迫。对暴露于4种多环芳烃的海胆(Evechinus chloroticus)研究表明,在性腺组织中发现增加蛋白质和脂质的氧化损伤会导致产卵率下降[46]。Xu等的研究也证明了氨胁迫下,萼花臂尾轮虫(Brachionus calyciflorus)生殖所需物质供给不足,产生后代数目减少,种群增长受到限制[47]。BDE-47和DBDPE联合对轮虫作用模式如表 4所示,饱食培养时除高浓度组为相加作用,低、中浓度组均表现为拮抗作用;饥饿培养时,均表现为协同作用,总产幼数同生殖期结果一致。
|
|
表 3 BDE-47和DBDPE单一和联合作用下,轮虫存活期抑制情况 Table 3 The inhibition of rotifer survival period under the single and combined action of BDE-47 and DBDPE |
|
|
表 4 BDE-47和DBDPE联合作用下,轮虫存活期作用模式 Table 4 The action mode of rotifer survival period under combined action of BDE-47 and DBDPE |
BDE-47和DBDPE的单一作用都显著影响褶皱臂尾轮虫的生殖力和存活力,具体表现在对总产幼数的减少,生殖期和存活时间的缩短,BDE-47单一作用呈现出比DBDPE更强的生物毒性。其中主要受摄食行为调控的生殖期是较敏感指标。BDE-47和DBDPE联合作用抑制效应在轮虫饥饿时表现为对生殖力和存活力的协同作用,而在轮虫饱食时,在低、中浓度表现出对生殖力和存活力的拮抗作用,而在高浓度组基本表现为相加作用。本研究表明充足的食物供给可使生物表现出交叉耐受性, 减弱BDE-47和DBDPE同时作用时的生物毒性。
| [1] |
孟范平, 李卓娜. 多溴联苯醚(PBDEs)在海洋环境中的行为研究进展[J]. 中国海洋大学学报(自然科学版), 2009, 39(2): 285-289. Meng F P, Li Z N. Research progress on the behavior of polybrominated diphenyl ethers (PBDEs) in marine environment[J]. Periodical of Ocean University of China, 2009, 39(2): 285-289. (  0) 0) |
| [2] |
Qiu Y W, Wang D X, Zhang G. Assessment of persistent organic pollutants (POPs) in sediments of the eastern Indian Ocean[J]. Science of the Total Environment, 2019, 710: 136-335. (  0) 0) |
| [3] |
Anh H Q, Aono D, Watanabe I, et al. Contamination levels and temporal trends of legacy and current-use brominated flame retardants in a dated sediment core from Beppu Bay, southwestern Japan[J]. Chemosphere, 2020, 266: 129180. (  0) 0) |
| [4] |
Yin H, Tang Z, Meng T, et al. Concentration profile, spatial distributions and temporal trends of polybrominated diphenyl ethers in sediments across China: Implications for risk assessment[J]. Ecotoxicology and Environmental Safety, 2020, 206(S1): 111-205. (  0) 0) |
| [5] |
Li H, Guardia M L, Liu H, et al. Brominated and organophosphate flame retardants along a sediment transect encompassing the Guiyu, China e-waste recycling zone[J]. Science of The Total Environment, 2019, 646(PT. 1-1660): 58-67. (  0) 0) |
| [6] |
Sørmo E G, Jussi I, Jussi M, et al. Thyroid hormone status in gray seal (Halichoerus grypus) pups from the baltic sea and the atlantic ocean in relation to organochlorine pollutants[J]. Environmental Toxicology & Chemistry, 2010, 24(3): 610-616. (  0) 0) |
| [7] |
Liu Y, Cui S, Ma Y, et al. Brominated flame retardants (BFRs) in marine food webs from Bohai Sea, China[J]. Science of the Total Environment, 2021, 772: 145036. DOI:10.1016/j.scitotenv.2021.145036 (  0) 0) |
| [8] |
赵静. 多溴联苯醚对鱼类毒性效应的研究进展[J]. 上海第二工业大学学报, 2015, 32(3): 177-184. Zhao J. Research progress on the investigation of toxic effects of polybrominated diphenyl ethers in fish[J]. Journal of Shanghai Second Polytechnic University, 2015, 32(3): 177-184. DOI:10.3969/j.issn.1001-4543.2015.03.001 (  0) 0) |
| [9] |
范灿鹏, 王奇, 刘昕宇, 等. 四溴联苯醚对剑尾鱼毒性及其抗氧化系统的影响[J]. 环境科学学报, 2011, 31(3): 642-648. Fan C P, Wang Q, Liu X Y, et al. Toxicity and effect of tetrabromodiphenyl ether upon the antioxidant defense system of swordtail fish (Xiphophorus helleri)[J]. Acta Scientiae Circumstatine, 2011, 31(3): 642-648. (  0) 0) |
| [10] |
Liu C, Wang B, Zhou B, et al. The responses of Oncorhynchus mykiss coping with BDE-47 stress via PXR-mediated detoxification and Nrf2-mediated antioxidation system[J]. Aquatic Toxicology, 2019, 207: 63-71. DOI:10.1016/j.aquatox.2018.11.026 (  0) 0) |
| [11] |
Sha J, Wang Y, Chen H, et al. Using population demographic parameters to assess impacts of two polybrominated diphenyl ethers (BDE-47, BDE-209) on the rotifer Brachionus plicatilis[J]. Ecotoxicology & Environmental Safety, 2015, 119: 106-115. (  0) 0) |
| [12] |
Zhang J, Wang Y, Tang X X, et al. The toxic effects of polybrominated diphenyl ethers on rotifer Branchionus plicatilis[J]. Advanced Materials Research, 2013, 807-809: 385-391. DOI:10.4028/www.scientific.net/AMR.807-809.385 (  0) 0) |
| [13] |
沙婧婧, 王悠, 王鸿, 等. 2种多溴联苯醚(BDE-47、BDE-209)对褶皱臂尾轮虫单一和联合毒性效应研究[J]. 中国海洋大学学报(自然科学版), 2015, 45(9): 69-77. Sha J J, Wang Y, Wang H, et al. Study on single and joint toxic effects of two PBDEs (BDE-47, BDE-209) on rotifer Brachionus plicatilis[J]. Periodical of Ocean University of China, 2015, 45(9): 69-77. (  0) 0) |
| [14] |
Wang H, Tang X, Sha J, et al. The reproductive toxicity on the rotifer Brachionus plicatilis induced by BDE-47 and studies on the effective mechanism based on antioxidant defense system changes[J]. Chemosphere, 2015, 135: 129-137. DOI:10.1016/j.chemosphere.2015.03.090 (  0) 0) |
| [15] |
Li X, Liu J, Zhou G., et al. BDE-209 and DBDPE induce male reproductive toxicity through telomere-related cell senescence and apoptosis in SD rat[J]. Environment International, 2021, 146(6): 106-307. (  0) 0) |
| [16] |
Shen K, Li L, Liu J, et al. Stocks, flows and emissions of DBDPE in China and its international distribution through products and waste[J]. Environmental Pollution, 2019, 250: 79-86. DOI:10.1016/j.envpol.2019.03.090 (  0) 0) |
| [17] |
Lee H K, Lee S, Lim J E, et al. Legacy and novel flame retardants in water and sediment from highly industrialized bays of Korea: Occurrence, source tracking, decadal time trend, and ecological risks[J]. Marine Pollution Bulletin, 2020, 160: 111-639. (  0) 0) |
| [18] |
Xie J, Sun Y, Cheng Y, et al. Halogenated flame retardants in surface sediments from fourteen estuaries, South China[J]. Marine Pollution Bulletin, 2021, 164: 112099. DOI:10.1016/j.marpolbul.2021.112099 (  0) 0) |
| [19] |
Li Y, Zhen X, Liu L, et al. Halogenated flame retardants in the sediments of the Chinese Yellow Sea and East China Sea[J]. Chemosphere, 2019, 234: 365-372. DOI:10.1016/j.chemosphere.2019.06.115 (  0) 0) |
| [20] |
Zhao J, Wang P, Wang C, et al. Novel brominated flame retardants in West Antarctic atmosphere (2011—2018): Temporal trends, sources and chiral signature[J]. Science of the Total Environment, 2020, 720: 137-557. (  0) 0) |
| [21] |
Zuiderveen A, Slootweg C, Boer J. Novel brominated flame retardants-A review of their occurrence in indoor air, dust, consumer goods and food[J]. Chemosphere, 2020, 255: 126-816. (  0) 0) |
| [22] |
Zhang J, Wang Y, Zhou B, et al. Effects of two polybrominated diphenyl ethers (BDE-47, BDE-209) on the swimming behavior, population growth and reproduction of the rotifer Brachionus plicatilis[J]. Journal of Environmental Sciences, 2015, 28(2): 54-63. (  0) 0) |
| [23] |
Leone I C, Mantelatto F L. Maternal investment in egg production: Substrate- and population-specific effects on offspring performance of the symbiotic crab Pachycheles monilifer (Anomura: Porcellanidae)[J]. Journal of Experimental Marine Biology & Ecology, 2015, 464: 18-25. (  0) 0) |
| [24] |
Li X D, Wang X Y, Xu M E, et al. Progress on the usage of the rotifer Brachionus plicatilis in marine ecotoxicology: A review[J]. Aquatic Toxicology, 2020, 299: 105678. (  0) 0) |
| [25] |
裴晓华, 樊英怡. 三氧化二砷与粉防己碱联合作用对MCF-7细胞的影响[J]. 南京中医药大学学报, 2009, 25(2): 7. Pei X H, Fan Y Y. Effect of arsenic trioxide combined with tetrandrine on MCF-7 cells[J]. Journal of Nanjing University of Traditional Chinese Medicine, 2009, 25(2): 7. (  0) 0) |
| [26] |
Zhang J, Wang Y, Sun K M, et al. A study of oxidative stress induced by two polybrominated diphenyl ethers in the rotifer Brachionus plicatilis[J]. Marine Pollution Bulletin, 2016, 113(1-2): 408-413. (  0) 0) |
| [27] |
Zheng X B, Luo X J, Zheng J, et al. Contaminant sources, gastrointestinal absorption, and tissue distribution of organohalogenated pollutants in chicken from an e-waste site[J]. Science of the Total Environment, 2015, 505: 1003-1010. (  0) 0) |
| [28] |
Li X, Liu J, Zhou G, et al. BDE-209 and DBDPE induce male reproductive toxicity through telomere-related cell senescence and apoptosis in SD rat[J]. Environment International, 2021, 146(6): 106307. (  0) 0) |
| [29] |
Shi F, Qiu J, Zhang J, et al. The toxic effects and possible mechanisms of decabromodiphenyl ethane on mouse oocyte[J]. Ecotoxicology and Environmental Safety, 2020, 207: 111290. (  0) 0) |
| [30] |
Nakari T, Huhtala S. In vivo and in vitro toxicity of decabromodiphenyl ethane, a flame retardant[J]. Environmental Toxicology, 2010, 25(4): 333-338. (  0) 0) |
| [31] |
Yuan S, Liang C, Li W, et al. A comprehensive system for detection of behavioral change of D. magna exposed to various chemicals[J]. Journal of Hazardous Materials, 2020, 402: 123731. (  0) 0) |
| [32] |
Feng M, Li Y, Qu R, et al. Oxidative stress biomarkers in freshwater fish Carassius auratus exposed to decabromodiphenyl ether and ethane, or their mixture[J]. Ecotoxicology, 2013, 22(7): 1101-1110. (  0) 0) |
| [33] |
Antonopoulou E, Kentepozidou E, Feidantsis K, et al. Starvation and re-feeding affect Hsp expression, MAPK activation and antioxidant enzymes activity of European Sea Bass (Dicentrarchus labrax)[J]. Comparative Biochemistry and Physiology. Part A, Molecular & Integrative Physiology, 2013, 165(1): 79-88. (  0) 0) |
| [34] |
Zengin H. The effects of feeding and starvation on antioxidant defence, fatty acid composition and lipid peroxidation in reared Oncorhynchus mykiss fry[J]. Scientific Reports, 2021, 11(1): 1-13. (  0) 0) |
| [35] |
Yy A, Xj C, Xta B, et al. Feeding behavior toxicity in the marine rotifer Brachionus plicatilis caused by 2, 2', 4, 4'—tetrabromodiphenyl ether (BDE-47): Characteristics and mechanisms[J]. Chemosphere, 2021, 271. (  0) 0) |
| [36] |
Hintz W D, Jones D K, Relyea R A. Evolved tolerance to freshwater salinization in zooplankton: Life-history trade-offs, cross-tolerance and reducing cascading effects[J]. Philosophical Transactions Biological Sciences, 2019, 374(1764): 20180012. (  0) 0) |
| [37] |
Hua J, Jones D K, Relyea R A. Induced tolerance from a sublethal insecticide leads to cross-tolerance to other insecticides[J]. Environmental Science & Technology, 2014, 48(7): 4078. (  0) 0) |
| [38] |
Pallarés S, Botella-Cruz M, Arribas P, et al. Aquatic insects in a multistress environment: Cross-tolerance to salinity and desiccation[J]. Journal of Experimental Biology, 2017, 220(7): 1277. (  0) 0) |
| [39] |
Haap T, Schwarz S, Köhler H. R. Metallothionein and Hsp70 trade-off against one another in Daphnia magna cross-tolerance to cadmium and heat stress[J]. Aquatic Toxicology, 2016, 170: 112-119. (  0) 0) |
| [40] |
Hashemi S, Blust R, Boeck G D. The effect of starving and feeding on copper toxicity and uptake in Cu acclimated and non-acclimated carp[J]. Aquatic Toxicology, 2008, 86(2): 142-147. (  0) 0) |
| [41] |
Higashimoto M, Sano M, Kondoh M, et al. Different responses of metallothionein and leptin induced in the mouse by fasting stress[J]. Biological Trace Element Research, 2002, 89(1): 75-84. (  0) 0) |
| [42] |
Liu C, Tang X, Zhou B, et al. Is it photosensitization or photodegradation when UV-B irradiation is combined with BDE-47? Evidence from the growth and reproduction changes of rotifer Brachionus plicatilis[J]. Science of the Total Environment, 2018, 628-629: 562. (  0) 0) |
| [43] |
Lematre J F, Ronget V, Gaillard J M. Female reproductive senescence across mammals: A high diversity of patterns modulated by life history and mating traits[J]. Mechanisms of Ageing and Development, 2020, 192: 111377. (  0) 0) |
| [44] |
Lee R F, Hagen W, Kattner G. Lipid storage in marine zooplankton[J]. Marine Ecology Progress Series, 2006, 307: 273-306. (  0) 0) |
| [45] |
Finiguerra M. B, Dam H. G, Avery D. E, et al. Sex-specific tolerance to starvation in the copepod Acartia tonsa[J]. Journal of Experimental Marine Biology and Ecology, 2013, 446: 17-21. (  0) 0) |
| [46] |
Lister, Kathryn N, Lamare, et al. Dietary pollutants induce oxidative stress, altering maternal antioxidant provisioning and reproductive output in the temperate sea urchin Evechinus chloroticus[J]. Aquatic Toxicology, 2016, 177: 106-115. (  0) 0) |
| [47] |
Xu H, Niu C. Effect of maternal ammonia stress on population dynamics of the rotifer Brachionus calyciflorus offspring[J]. Aquatic Toxicology, 2021, 239: 105960. (  0) 0) |
 2023, Vol. 53
2023, Vol. 53


