2. 中国海洋大学海洋生命学院, 山东 青岛 266003;
3. 国家海藻海参工程科学与技术研发中心 山东 烟台 264003;
4. 海藻遗传改良和高效栽培山东省重点实验室, 山东 烟台 264003;
5. 山东东方海洋科技股份有限责任公司, 山东 烟台 264003;
6. 中国海洋大学海洋生物多样性与进化研究所, 山东 青岛 266003
不等鞭毛总门的褐藻与后鞭毛生物(如动物和真菌)和植物(植物、绿藻和红藻等)的进化存在平行性, 两类生物有相似的先天免疫机制和胁迫防御反应机制[1-3]。先天免疫机制不同于胁迫防御应答机制。防御机制可经受体引发对病原体的抵抗[4-5]。最近, 在模式褐藻长襄水云基因组中就找到了防御有关的受体[6]。过氧化物爆发导致局部活性氧簇(Radical oxygen species, ROS)浓度急剧升高, 是防御应答机制之一。这一机制在人[7]、植物[8]和褐藻[2]中都存在。病原体感染导致膜释放十八碳(植物)和二十碳(动物)脂肪酸, 用于合成氧脂素(Oxylipin)。海带同时存在这两类氧脂素生物合成途径[9-14]。
海带(Saccharina japonica)属于囊泡藻界, 不等鞭毛总门, 褐藻纲, 海带目, 海带科, 海带属。上1920—1930年代日本引入中国栽培。海带是孢子体世代和配子体世代交替型生活史, 从幼嫩孢子体长为成熟孢子体的过程中面临诸多环境胁迫。中国海带栽培主要是“浮绳网藻体倒置避夏”栽培模式。海带的生长区直接面对强紫外线、强阳光、高温度和频繁的光照和温度波动, 而藻体的梢部却指向弱光、相对低温的海底。海带栽培集约化程度高, 面积大, 藻体密集, 经常与动物养殖空间重叠。大尺度、大范围的环境温度波动和海水酸化, 海水富营养化也逐步演变成不可忽略的环境影响因子。这些因素单独或组合作用, 导致海带孢子体处于持续性的免疫和防御状态。有报道称L. digitata受环境刺激后可识别其细胞壁多糖的分解碎片, 触发局部过氧化物爆发[15-16], 防御相关基因的表达, 释放游离脂肪酸[17]、加强卤素代谢[18]。
褐藻是唯一利用无机碘抵抗细胞外氧化胁迫的生物。碘合成可高效去除过氧化物爆发产生的过量过氧化氢和过氧根离子[19]。催化卤素合成的钒依赖卤素过氧化物酶(Vanadium-dependent halogenperoxidase, vHPO)是一类过氧化物酶, 依其对卤素离子催化效率的不同, 分为钒依赖氯过氧化物酶(vCPO)、钒依赖溴过氧化物酶(vBPO)和钒依赖碘过氧化物酶(vIPO)三类。3种过氧化物酶中, vCPO只存在于陆地植物中, 而另外两种存在于海洋藻类, 尤其是褐藻中。研究发现vBPO基因能催化碘离子与过氧化氢反应生成次碘酸, 而次碘酸进一步将碘离子氧化为碘分子。反应过程为:I-+H2O2→HIO+OH-; HIO+I-+H+→I2+H2O。
vBPO在海带免疫应答和防御中发挥重要作用[2]。为弄清海带vBPO基因的表达模式随海带生长发育的变化关系及其与藻体碘含量的关系, 探究海带在生长发育过程中免疫防御反应的变化, 本研究通过转录组分析研究了正常栽培海带不同生长发育时期vBPO基因的表达模式。
1 材料和方法 1.1 RNA提取和转录组测序本研究所用的海带孢子体为东方7号[20], 分别在4个发育时期, 即薄嫩期(Mushroom stage)、厚成期(Adult stage)、成熟期(Mature stage)和衰老期(Aging stage)采集两株, 取其生长点组织, 用无菌海水彻底清洗表面粘液后, 在液氮中研磨成粉末, 用除多糖多酚的RNA提取试剂盒提取RNA, 溶于DEPC处理过的重蒸水, 用NanoDrop测定浓度, 经1%琼脂糖凝胶电泳检测RNA完整度和可能的基因组DNA污染。合格RNA迅速置于-80℃冰箱中保存。
用Oligo(dT)磁珠富集mRNA, 片段化后用六碱基随机引物合成第一链cDNA, 然后用DNA polymerase I和RNase H合成第二链cDNA, 再用AMPure XP beads纯化双链cDNA。末端修饰并加A尾后与测序接头连接, 再用AMPure XP beads选择片段大小, PCR扩增, 用AMPure XP beads纯化PCR产物, 富集150~200 bp的cDNA形成测序文库。将文库用Qubit2.0定量, 稀释至1.5 ng/μL, 用Agilent 2100检测片段大小, 合格后用Q-PCR方法进行准确定量(文库有效浓度>2nmol/L), 在Illumina HiSeq平台上测序。
去除含接头、不确定碱基比例大于0.1%、Q≤20碱基数≥50%的初始读序(raw reads)获得净读序(cleanreads)。将净读序用Trinity[21]进行拼接(k=25, 最小kmer覆盖度=2)。用FPKM方法校正转录本丰度, 消除序列长度和测序深度影响[21], 实现丰度标准化。
1.2 碘含量测定与转录组测序用海带孢子体同步采集4个生长时期的东方7号海带孢子体, 每时期3株, 通风处晒干后用粉碎机粉碎成≤400目的颗粒, 均匀混合后用NaNO2-尿素法测量碘的含量[22]。
1.3 海带vBPO基因表达模式分析海带4个时期转录组测序获得的组装物(unigene, 后续分析转称为基因)针对Nr数据库进行注释, 根据注释信息获取海带vBPO基因及其对应各时期的转录本丰度。利用OmicShare tools2.0(www.omicshare.com)绘制vBPO基因表达热图。
1.4 海带vBPO分子系统学分析和结构域预测从海带4个生长发育时期的转录组分析数据中提取vBPO基因的序列, 用Unipro UGENE软件(http://www.x64bitdownload.com/download/t-64-bit-unipro-ugene-64-bit-download-jheuyjsm.html)获得其开放阅读框(openreadingframe, ORF)并推导其氨基酸序列。在NCBI蛋白质数据库中下载不同物种的vBPO序列。将这些序列用MAFFT(http://www.softpedia.com/get/Science-CAD/MAFFT.shtml)进行对位分析, 然后用MrBayes3.2(http://mrbayes.csit.fsu.edu/)构建分子系统树。最后获取的系统树是1 000次重复计算的结果。为进一步确定海带vBPO基因, 用NCBI的CD-Search(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)结构域预测工具对其进行了结构域的预测。
2 结果 2.1 海带vBPO基因表达模式海带孢子体4个生长发育时期的转录组测序共获得196 238 671条净读序, 组装成133 516条不重复基因(Unigene, 以下改称基因)。这些基因中, 只有33.84%可针对NR数据库进行功能注释, 19.25%针对SwissProt数据库进行功能注释, 32.95%针对PFAM数据库进行功能注释, 33.06%针对GO数据库进行功能注释。另外, 可注释的基因中, 绝大部分是病毒、转座子等先关蛋白。海带是非模式物种, 进化上与已知模式物种亲缘关系较远。这给我们基于基因的功能注释理解海盗生长发育时期的生理学变化造成巨大困难。
幸运的是针对NR数据库的功能注释获得59条可能编码vBPO的基因(见表 1)。因为海带基因组序列碎片化严重, 无参转录组分析可能使转录本组装也碎片化, 我们转而将133 457个基因的平均丰度作为59个vBPO基因转录本丰度的参照。我们发现海带vBPO基因转录本平均丰度是相应生长发育时期的9~19倍, 平均13倍。这说明, vBPO基因在海带孢子体生长发育过程中始终高表达, 间接地反映出栽培海带孢子体很可能持续性处于胁迫响应生理状态。
|
|
表 1 海带不同生长发育时期vBPO基因的表达丰度和转录组分析组装长度 Table 1 The abundance and length of the kelp vBPO gene transcripts |
海带孢子体不同发育时期, 59个vBPO基因表达模式不同(见图 1)。在薄嫩期、厚成期、成熟期和衰老期, 这些基因的转录本丰度(表达量)存在显著差异。相对而言, vBPO基因在成熟期和衰老期的表达模式更相似, 而薄嫩期和厚成期更相似。海带孢子体不同发育时期碘含量逐期增加, 薄嫩期为(0.30±0.00)‰, 厚成期为(0.38±0.07)‰, 成熟期为(1.57±0.05)‰, 衰老期为(2.32±0.09)‰。碘含量与vBPO基因平均表达量成正相关(相关系数0.974)。

|
(①Mushroom stage; ②Adult stage; ③Mature stage; ④Aging stage。(A)vBPO基因表达丰度热图; (B)FPKM值≥10的vBPO基因表达丰度折线图; (C)FPKM值≥1但 < 10的vBPO基因表达丰度折线图; (D)FPKM值>0但 < 1的vBPO基因表达丰度折线图。(A) The heatmap of kelp vBPO genes; (B) The line chart of kelp vBPO genes with FPKM values≥10; (C) The line chart of kelp vBPO genes with FPKM values≥1 but < 10; (D) The line chart of kelp vBPO genes with FPKM values>0 but < 1. ) 图 1 海带vBPO基因在四个发育时期的表达模式 Fig. 1 The expression abundance heatmap of kelp vBPO genes during its growth and development |
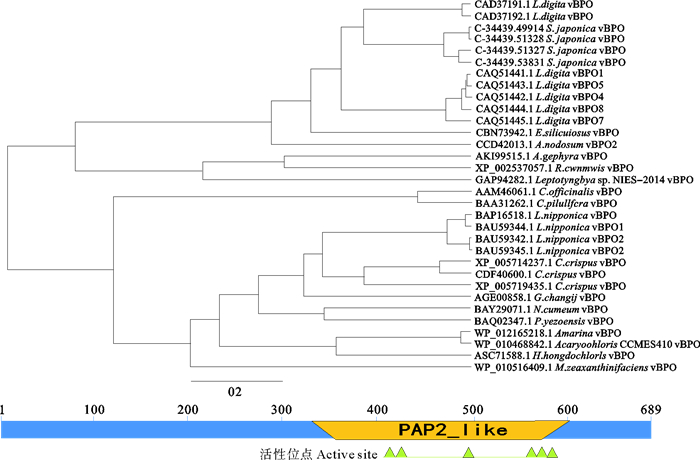
表达模式分析是基于注释信息进行的。为进一步证实这些组装物是vBPO基因, 我们将59个注释为vBPO基因中包含完整开放阅读框的4个vBPO基因(GenBank存取号:MH430667、MH430668、MH430669、MH430670)逆翻译(推导)成氨基酸序列, 从NCBI数据库下载16个物种的28条vBPO氨基酸序列, 用这些序列构建分子系统树。分析发现海带4条vBPO氨基酸序列与掌状海带的vBPO亲缘关系近, 与所有褐藻vBPO氨基酸序列聚在一起。说明这4条海带vBPO基因确实是vBPO基因(见图 2)。
|
图 2 从有完整开放阅读框的海带vBPO基因推导的氨基酸序列与其他物种vBPO的分子系统学关系(上)及结构域(下) Fig. 2 Phylogenetic relationship of the deduced amino acid sequences from annotated kelp vBPO genes containing the whole open reading frame with those retrieved from GenBank(above) and their structural domain (below) |
对4条海带vBPO基因对应的氨基酸序列进行结构域预测, 发现它们的结构域相同, 第339~602位氨基酸组成PAP2_like蛋白结构域, 具有组氨酸磷酸酶和钒依赖卤素过氧化物酶催化活性基团, 第418~426位的KWQVHRMLR序列、从第493~495位的SGH序列和从第575~584位的RSHLGVHWRMD的序列是钒结合位置(见图 2)。
PAP2_like蛋白是组氨酸磷酸酶和钒依赖卤素过氧化物酶等组成的酶超家族, 有磷脂酸磷酸酶、磷酸酯磷酸酶、葡萄糖-6磷酸酶、叶绿体膜脂磷酰甘油磷酸酶B、钒依赖氯/溴过氧化物酶等亚家族, 有些酶是跨膜蛋白。本研究中未发现海带vBPO的跨膜区。Colin等发现第409~418位氨基酸和第475~492位氨基酸是钒结合区[23]。第409~418位氨基酸为KWQVHRMLRP, 这一区域与海带vBPO第418~427位氨基酸序列完全一致。结构域分析也证实注释为海带vBPO的基因确实是vBPO。
3 讨论本研究用转录组测序的方法分析了海带孢子体包括薄嫩期、厚成期、成熟期和衰老期在内4个生长发育时期vBPO基因的表达模式, 并通过分子系统学分析和结构域比较验证了海带的这些基因确实是vBPO基因; 发现海带vBPO基因转录本在4个发育时期的平均丰度是相应时期全部基因转录本的平均丰度的9~19倍, 平均13倍, 说明海带天然免疫和防御应答机制之一的碘富集过程持续性处于活跃状态; 发现海带vBPO基因的表达量与海带孢子体碘含量呈正相关。这些认知对海带抗病抗逆生理机制解析具有重要意义, 是海带抗病抗逆机制研究的新尝试。
海带基因组测序已经测序[24]。同源性搜索已在发表的海带基因组中找到了丰富的vBPO基因拷贝。但是已发表的海带基因组序列片段化严重, 达不到参考基因组的程度, 搜索结果只能说明海带基因组存在丰富的vBPO基因。如果是有参转录组分析, 我们就能了解不同基因的转录特征。但是, 由于已发表基因组序列的局限性, 我们可能遗漏有关基因。基于这样的考虑, 我们选择了无参转录组分析。分析过程中发现多数转录本组装物不完整。这又可能影响平均表达丰度的计量。因此, 参考基因组质量的海带基因组序列对转录组分析具有重要的意义。然而, 我们不得不等待高质量基因组序列的发表。值得庆幸的是已经有用实时单分子测序(三代测序)技术结合二代测序测定海带孢子体基因组获得参考基因组质量的海带基因组序列的工作(个人了解)。这将为深入研究海带抗病抗逆机制提供背景数据基础。
多拷贝基因的表达调控效率是比较低的, 海带需要在不同胁迫条件、不同发育时期选择不同拷贝基因的表达并协调这些基因的作用。海带不同vBPO基因结构、它们的表达模式及其与生长发育时期和不同胁迫条件的关系为深入研究海带多拷贝基因的系统表达提供了一个切入点。
海带vBPO基因转录本相对丰度是与全部转录本平均丰度比较获得的相对值。我们最初想选择四个时期表达量基本恒定的基因群的平均表达量作为内参来确定vBPO基因的相对表达量, 但这些基因的表达量只是相对恒定。与vBPO基因一样, 无参组装获得的这些基因的序列也存在不完整性。既然都不完整, 且是在相同的分析条件下比较。我们选择了全部组装物的平均丰度做对照来确定vBPO基因的相对表达丰度。海带基因的表达分析也可以参考其他物种选择内参基因。基于相似的考虑, 我们没有这样做。
需要特别强调的是, 本研究的表达分析针对的是多拷贝基因。基因序列高度相似。在这样的情况下, 实时定量PCR方法很难设计引物来区分不同的基因拷贝。但基于测序的转录组分析可以克服这一限制, 实现不同基因拷贝的区分。在方法上, 本研究将为多拷贝基因的表达分析提供一种方法学借鉴。
4 结语分子系统学和结构域分析证实转录组分析注释的海带vBPO基因确实是vBPO基因。海带vBPO基因存在多个拷贝, 在4个时期持续性选择性地表达, 且平均表达量远高于总体基因平均表达量。这说明现行栽培模式下, 海带孢子体有可能处于持续性胁迫响应状态, 为解释频发的生理性病害提供了一种可能性。转录组分析组装获得多条vBPO基因序列, 这与海带基因组存在众多vBPO基因拷贝对应, 但这些基因的结构、表达模式及其与生长时期和胁迫环境间的关系尚需进一步研究。
| [1] |
Hoffmann J A, Kafatos F C, Janeway C A, et al. Phylogenetic perspectives in innate immunity[J]. Science, 1999, 284: 1313-1318. DOI:10.1126/science.284.5418.1313
(  0) 0) |
| [2] |
Cosse A, Leblanc C, Potin P. Dynamic defense of marine macroalgae against pathogens: From early activated to gene-regulated responses[J]. Advances in Botanical Research, 2007, 46(Sup 8): 221-266.
(  0) 0) |
| [3] |
Weinberger F. Pathogen-induced defense and innate immunity in macroalgae[J]. Biological Bulletin, 2007, 213(3): 290-302. DOI:10.2307/25066646
(  0) 0) |
| [4] |
Ausubel F. Are innate immune signaling pathways in plants and animals conserved?[J]. Nature Immunology, 2005, 6(10): 973-979. DOI:10.1038/ni1253
(  0) 0) |
| [5] |
Staal J, Dixelius C. Tracing the ancient origins of plant innate immunity[J]. Trends in Plant Science, 2007, 12(8): 334-342. DOI:10.1016/j.tplants.2007.06.014
(  0) 0) |
| [6] |
Zambounis A, Elias M, Sterck L, et al. Highly dynamic exon shuffling in candidate pathogen receptors. What if brown algae were capable of adaptive immunity[J]. Molecular Biology and Evolution, 2012, 29(4): 1263-1276. DOI:10.1093/molbev/msr296
(  0) 0) |
| [7] |
Baldridge C W, Gerard R W. The extra respiration of phagocytosis[J]. American Journal of Physiology, 1933, 103(1): 235-236.
(  0) 0) |
| [8] |
Wojtaszek P. Oxidative burst: An early plant response to pathogen infection[J]. Biochemical Journal, 1997, 322(3): 681-692. DOI:10.1042/bj3220681
(  0) 0) |
| [9] |
Potin P, Bouarab K, Salaün J P, et al. Biotic interactions of marine algae[J]. Current Opinion in Plant Biology, 2002, 5: 308-317. DOI:10.1016/S1369-5266(02)00273-X
(  0) 0) |
| [10] |
Yaqoob P. Fatty acids as gatekeepers of immune cell regulation[J]. Trends in Immunology, 2003, 24(12): 639-645. DOI:10.1016/j.it.2003.10.002
(  0) 0) |
| [11] |
Harizi H, Corcuff J B, Gualde N. Arachidonic-acid-derived eicosanoids: Roles in biology and immunopathology[J]. Trends in Molecular Medicine, 2008, 14(10): 461-469. DOI:10.1016/j.molmed.2008.08.005
(  0) 0) |
| [12] |
Stanley D, Miller J, Tunaz H. Eicosanoid actions in insect immunity[J]. Journal of Innate Immunity, 2009, 1(4): 282-290. DOI:10.1159/000210371
(  0) 0) |
| [13] |
Zoeller M, Stingl N, Krischke M, et al. Lipid profiling of the Arabidopsis hypersensitive response reveals specific lipid peroxidation and fragmentation processes: Biogenesis of pimelic and azelaic acid[J]. Plant Physiology, 2012, 160(1): 365-378. DOI:10.1104/pp.112.202846
(  0) 0) |
| [14] |
Yu K, Soares J, Mandal M K, et al. A feed-back regulatory loop betweenglycerol-3-phosphate and lipid transfer proteins DIR1 and AZI1 mediates azelaic-acid-induced systemic immunity[J]. Cell Reports, 2013, 3(4): 1266-1278. DOI:10.1016/j.celrep.2013.03.030
(  0) 0) |
| [15] |
Küpper F C, Kloareg B, Guern J, et al. Oligoguluronates elicit an oxidative burst in the brown algal kelp Laminaria digitata[J]. Plant Physiology, 2001, 125(1): 278-291. DOI:10.1104/pp.125.1.278
(  0) 0) |
| [16] |
Küpper F C, Müller D G, Peters A F, et al. Oligoalginate recognition and oxidative burst play a key role in natural and induce dresistance of sporophytes of Laminariales[J]. Journal of Chemical Ecology, 2002, 28(10): 2057-2080. DOI:10.1023/A:1020706129624
(  0) 0) |
| [17] |
Goulitquer S, Ritter A, Thomas F, et al. Release of volatile aldehydes by the brown algal kelp Laminaria digitata in response to both biotic and abiotic stress[J]. Chem Bio Chem, 2009, 10(6): 977-982. DOI:10.1002/cbic.200900004
(  0) 0) |
| [18] |
Cosse A, Potin P, Leblanc C. Patterns of gene expression induced by oligoguluronates reveal conserved and environment-specific molecular defense responses in the brown alga Laminaria digitata[J]. New Phytologist, 2009, 46(1): 221-266.
(  0) 0) |
| [19] |
Küpper F C, Carpenter L J, Mcfiggans G B, et al. Iodide accumulation provides kelp with an inorganic antioxidant impacting atmospheric chemistry[J]. Proceedings of the National Academy of Sciences of the USA, 2008, 105(19): 6954-6958. DOI:10.1073/pnas.0709959105
(  0) 0) |
| [20] |
Li X, Zhang Z, Qu S, et al. Improving seedless kelp (Saccharina japonica) during its domestication by hybridizing gametophytes and seedling-raising from sporophytes[J]. Scientific Reports, 2016, 6: 21255. DOI:10.1038/srep21255
(  0) 0) |
| [21] |
Grabherr M G, Haas B J, Yassour M, et al. Full-length transcriptome assembly from RNA-Seq data without a reference genome[J]. Nature Biotechnology, 2011, 29(7): 644-652. DOI:10.1038/nbt.1883
(  0) 0) |
| [22] |
Shang D, Ning J, Zhao Y, et al. Establishment of the determination method of alginate content[J]. Food Science and Technology, 2011, 36(8): 252-254.
(  0) 0) |
| [23] |
Colin C, Leblanc C, Michel G, et al. Vanadium-dependent iodoperoxidases in Laminaria digitata, a novel biochemical function diverging from brown algal bromoperoxidases[J]. Journal of Biological Inorganic Chemistry, 2005, 10(2): 156-166. DOI:10.1007/s00775-005-0626-8
(  0) 0) |
| [24] |
Ye N, Zhang X, Miao M, et al. Saccharina genomes provide novel insight into kelp biology[J]. Nature Communications, 2015, 6: 6986. DOI:10.1038/ncomms7986
(  0) 0) |
2. College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China;
3. National Engineering Science Research and Development Center of Algae and Sea Cucumbers of China Yantai 264003, China;
4. Provincial Key Laboratory of Genetic Improvement and Efficient Culture of Marine Algae of Shandong Yantai 264003, China;
5. Shandong Oriental Ocean Sci-tech Co., Ltd., Yantai, Shandong 264003, China;
6. Institutes of Evolution and Marine Biodiversity, Ocean University of China, Qingdao 266003, China
 2019, Vol. 49
2019, Vol. 49


