2. 山东省海洋资源与环境研究院,山东省海洋生态修复重点实验室,山东 烟台 264006;
3. 江苏省海洋生物资源与环境重点实验室,江苏海洋大学,江苏 连云港 222005;
4. 江苏省海洋资源开发研究院,江苏 连云港 222005
甲烷(CH4)和二甲基硫(DMS)是具有重要环境意义的挥发性生源活性气体,在全球碳和硫循环过程中扮演着重要角色。甲烷可以通过吸收地球长波辐射增加地球表明温度,是二氧化碳以外最重要的温室气体,而DMS扩散进入大气以后可以被氧化形成硫酸盐气溶胶颗粒,增加对太阳光的反射,降低地球表面温度,是重要的反温室气体。海洋是全球大气CH4和DMS的重要自然源,每年通过海-气扩散进入大气的CH4约占全球大气CH4来源的5%,而DMS是海水中最重要,含量最丰富的挥发性生源硫化物,其海-气通量为15~33 Tg·a-1,占海洋硫通量的90%以上[1]。鉴于CH4和DMS在全球碳循环、硫循环及调控全球气候方面的重要作用,国际大型研究计划上层海洋-低层大气研究(SOLAS)将CH4和DMS列为重要研究内容。
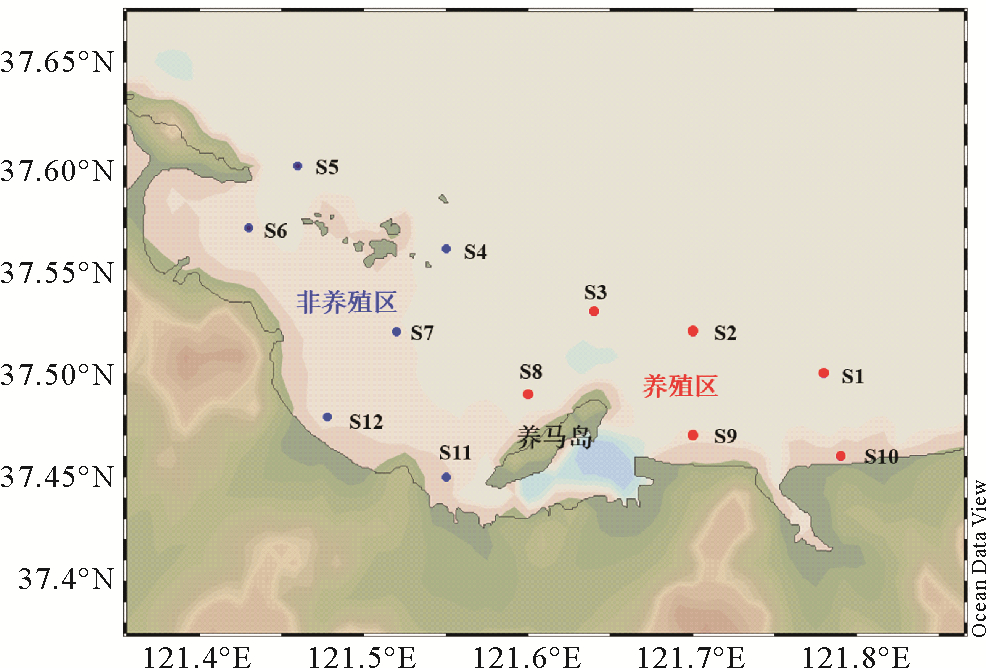
目前我国学者对于溶存CH4、DMS及其前体物质二甲基巯基丙酸(DMSP)的研究区域已经涵盖了东海[2-3]、黄海[4-5]、南海[6-7]及长江[8-9],黄河[10]等主要河口陆架区,但是对于近岸养殖海域溶存CH4、DMS和DMSP的研究报道并不多见。虽然近岸海区只占全球海洋面积的一小部分,但是甲烷释放量却占到了全球海洋释放总量的68%[11]。近几十年来,由于海洋渔业资源的锐减使得近海养殖业得到迅猛发展,全球的海水养殖每年以10%的速度增加[12]。中国的海水养殖业在养殖面积,放养种类以及产量等方面也得到了很大的发展。同时,大规模发展海水养殖也导致近岸水体各种理化因子发生改变和底泥环境的恶化。研究表明,海水养殖区的悬浮物、总氮、总磷、生化需氧量(BOD)、化学需氧量(COD)一般均高于对照区,并且海水养殖区的沉降量比非养殖区大得多,导致水产养殖区的底泥中,碳、氮、磷的含量比周围水体沉积物中要高[13]。水产养殖引起的近岸水体和沉积物环境的改变必然会对CH4和DMS在海水中的迁移转化及排放通量产生影响。烟台近岸海域位于山东半岛东北部,毗邻黄海,是一个半封闭海域,其独特的地理环境使其成为中国北方重要的扇贝养殖基地,养殖面积达150 km2,年产量约为180万t,包括人工鱼礁、底播养殖和筏式养殖,其中筏式养殖面积占总养殖面积的2/3以上[12]。目前,烟台近海的筏式扇贝养殖品种主要为海湾扇贝,大都集中在养马岛以东海域,养殖周期为每年的4—11月,而养马岛以西海域由于政府规划已经禁止进行渔业养殖活动(见图 1),因此烟台近海是研究扇贝养殖对CH4和DMS释放的理想场所,并于2019年5、6、7、8、9和11月分别对烟台近海进行现场调查(调查站位如图 1所示),探究筏式扇贝养殖对烟台近海CH4和DMS分布与释放通量的影响。
|
(蓝色为非养殖站位,红色为养殖站位。Blue dots represent non-farming stations, and red dots represent farming stations. ) 图 1 调查站位图 Fig. 1 Location of the survey station |
利用5 L Niskin Rosette采水器采集烟台近海表层与底层海水,采样站位的海水T、S等水文参数由CTD设备在采集海水样品时同步测定,DO采用碘量法测定,Chl a、CH4、DMS和DMSP的保存与测定方法如下:
Chl a的测定:取800 mL海水样品通过0.70 μm玻璃纤维滤膜(Whatman)过滤,用锡纸将滤膜包好,在-20 ℃下避光冷冻保存。测定时,用10 mL 90%的丙酮溶液在4 ℃条件下避光萃取滤膜24 h,之后离心10 min,取上清液使用F-4500荧光仪(日本日立)测定其荧光信号,方法检测限为0.01 μg·L-1。
CH4的测定:采用顶空平衡-气相色谱法,水样预处理时,通过气密性进样针定量注入30 mL高纯N2(纯度优于99.999%),使同体积的水样从样品瓶中排出,顶空样品瓶内形成气液两相共存的密闭体系.再将样品瓶固定于振荡器上剧烈振荡5 min,避光环境下(25 ℃)静置2 h,使CH4在气液两相达到分配平衡。样品测定时,首先用针筒将预处理时排出的水样匀速注回样品瓶,迫使顶空气沿进气管路进入串联的定量环(1 mL),然后通过色谱柱(6 inch×3 mm,Paropak-Q填充柱)进入GC-FID(2010Plus,Shimadzu,日本),测定顶空气中CH4的浓度。柱箱恒温60 ℃,进样口和FID的工作温度分别为150和300 ℃,该方法检测CH4的精密度和准确度均优于2%。
DMS的测定:采用吹扫捕集-气相色谱法[3],用玻璃注射器取2 mL海水样品注入到样品瓶中,通入40 mL·min-1的高纯N2进行吹扫,吹扫出的DMS通过Nafion渗透管(Perma Pure,美国)除去水分,并通过六通阀(Valco,美国)富集于浸在液氮中的1/8 Teflon捕集管中;吹扫3 min后将捕集管放入热水(>90 ℃)中进行加热解析,在载气(高纯氮气)携带下通过色谱柱(DB-Sulfur SCD,60 m×0.32 mm)进入到GC-FPD气相色谱(2010Plus,Shimadzu,日本)中进行测定。柱箱恒温150 ℃,进样口和FPD的工作温度分别为240和250 ℃,该方法DMS的检出限约为0.2 nmol/L DMS,精密度优于5%。
DMSP的保存和测定:取10 mL海水样品置于离心管中,加入50 μL 50%的浓硫酸,常温避光保存。DMSP的测定采用DMSP在强碱环境(pH≥13)中完全裂解为DMS的原理进行间接分析测定。主要步骤为:取2 mL保存的海水样品,加入200 μL 10 mol/L的NaOH溶液,4 ℃下密闭保存24 h,待其碱解完全后测定DMS含量,并等比例换算为DMSP浓度。
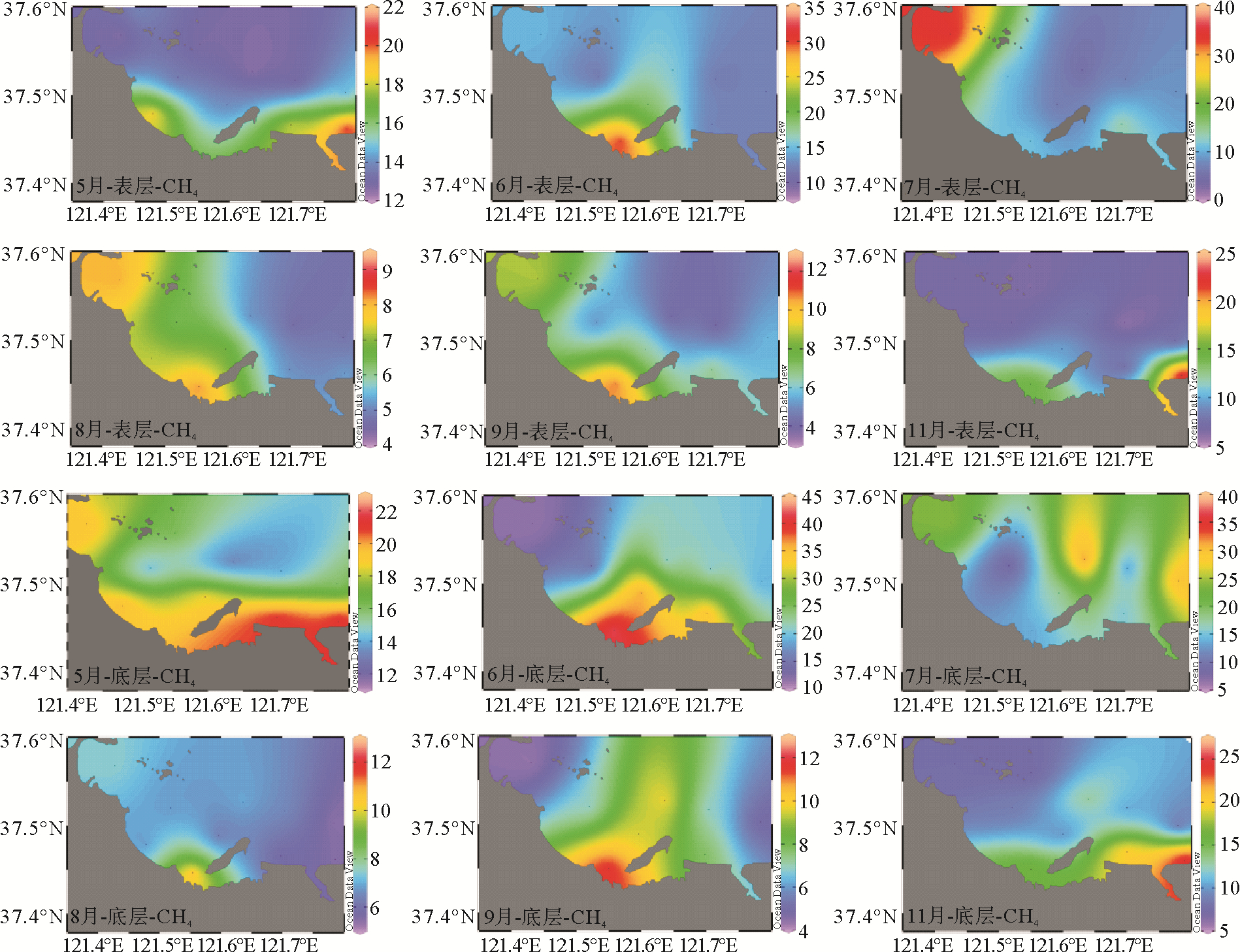
2 结果与讨论 2.1 扇贝养殖季烟台近海CH4的时空分布特征及影响因素调查海域不同月份表层和底层海水中的CH4浓度及其变化范围如表 1所示。整体而言,烟台近海的CH4浓度高于渤海[14]、黄海及东海,低于桑沟湾养殖区[15],5、6、7三个月份的CH4浓度明显高于8、9、11三个月份,并且各个月份的底层海水CH4浓度均高于表层。如图 2所示,调查海域CH4浓度的高值区主要集中在近岸海域,最高值通常出现在S10站位和S11站位。7、8月份表层和底层的CH4分布情况略有不同,表层高值区主要集中在调查海域西侧的S5、S6站位。
|
|
表 1 烟台近海不同月份表层和底层海水中CH4、DMS和DMSP浓度 Table 1 CH4 DMS and DMSP concentrations in the surface and bottom seawater of Yantai offshore in different months |
|
图 2 扇贝养殖季烟台近海CH4(nmol/L)的时空分布 Fig. 2 Temporal and spatial distributions of CH4(nmol/L) in the coastal waters of Yantai during the scallop farming period |
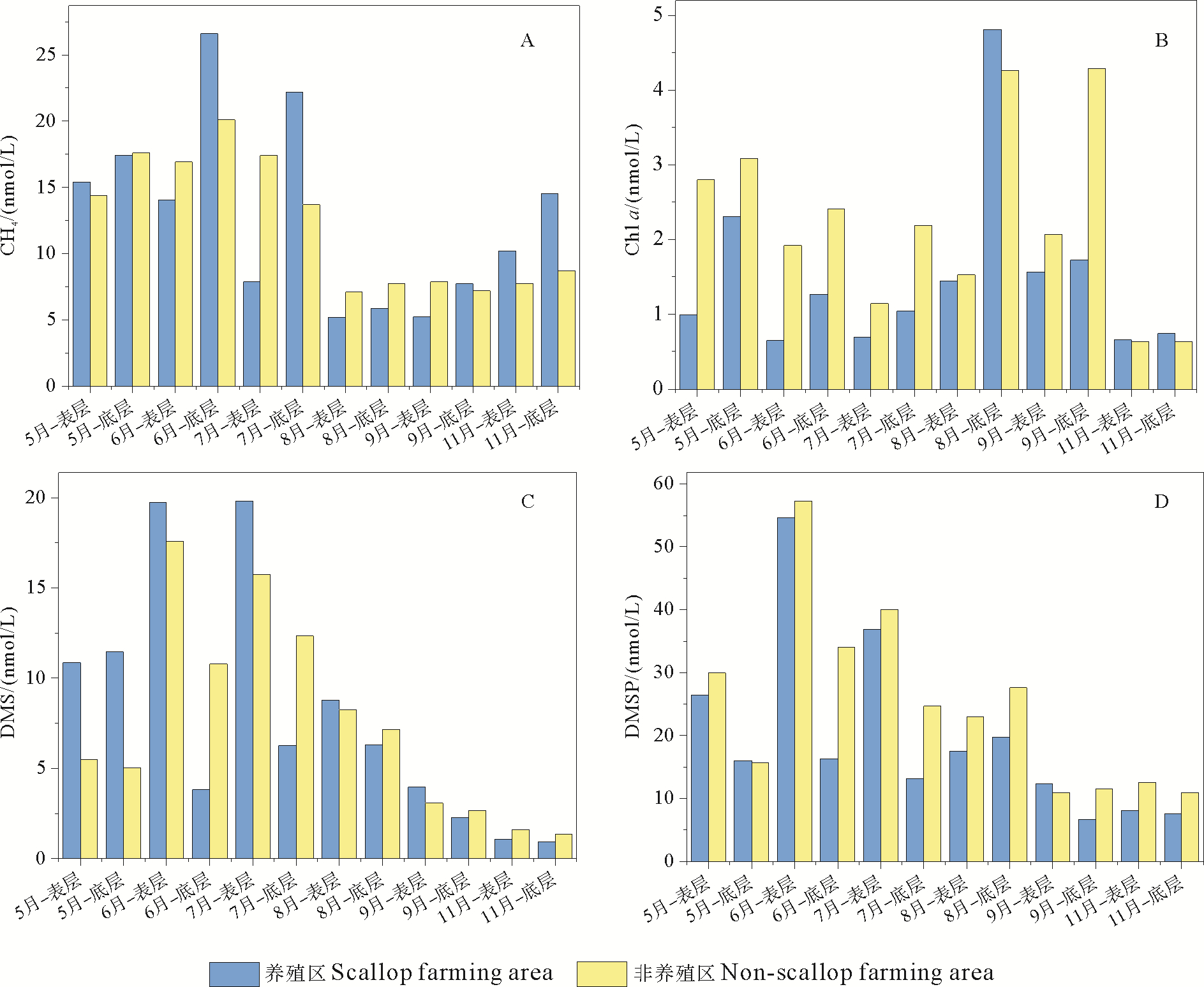
在整个扇贝养殖周期内,调查海域CH4与DO、Chl a之间不存在明显的相关性,这与谭丹丹等[14]在黄渤海的调查结果一致,表明在烟台近海DO和Chl a可能不是控制海水中CH4浓度的主要因素。通过对比养殖海域与非养殖海域发现,养殖区底层平均CH4浓度为15.73 nmol/L,非养殖区底层平均CH4浓度为12.52 nmol/L,养殖区底层CH4平均浓度比非养殖区高25.64%(见图 3A)。滤食性贝类可以将海水中的有机物摄入体内,而其中大部分未被摄取,并以粪便的形式排出体外,间接将水中的大量有机物质输入沉积物中,同时,筏式养殖也可以在一定程度上减缓水体的流动,加快颗粒物质的沉降,导致水产养殖区沉积物中相对较高的碳、氮、磷含量,这可能是养殖区底层CH4平均浓度明显高于非养殖区的原因。养殖区表层平均CH4浓度为9.65 nmol/L,非养殖区表层平均CH4浓度为11.91 nmol/L,与底层相反,养殖区表层CH4平均浓度比非养殖区低23.42 %。通过图 3D可以看出,养殖区表层CH4浓度低于非养殖区的时间集中在海水温度比较高的6—9月。在此期间,养殖海域层化现象显著,并且多次出现季节性缺氧现象[16]。通过调查期间底层DO的浓度也可以看出,7、8和9月扇贝养殖区底层海水的DO浓度要低于非养殖区。因此,推断是由于养殖海域海水的层化减慢了CH4由底层向表层的扩散,增加了CH4在水体的保留时间,导致6—9月养殖区表层CH4平均浓度反而低于非养殖区。张福绥等[17]通过对海湾扇贝肥满度的研究发现,扇贝生长一年有春、秋两个高峰,春季为5月中旬—7月中旬,盛期为6月,秋季为9—10月,盛期为9月,最佳收获期为养殖当年的11—12月。通过对比扇贝不同生长时期CH4浓度可以看出,扇贝收获季(11月)养殖区底层CH4浓度比非养殖区高66%,这一比例明显高于扇贝生长盛期(31%和7%),这表明成熟扇贝可以更高效的将水中的有机物质输入到沉积物中,更利于甲烷的生产释放。
|
图 3 烟台近海养殖区与非养殖区DMS,DMSP及CH4浓度平均值对比 Fig. 3 Comparison of average DMS, DMSP, and CH4 concentrations between scallop farming area and non-scallop farming area |
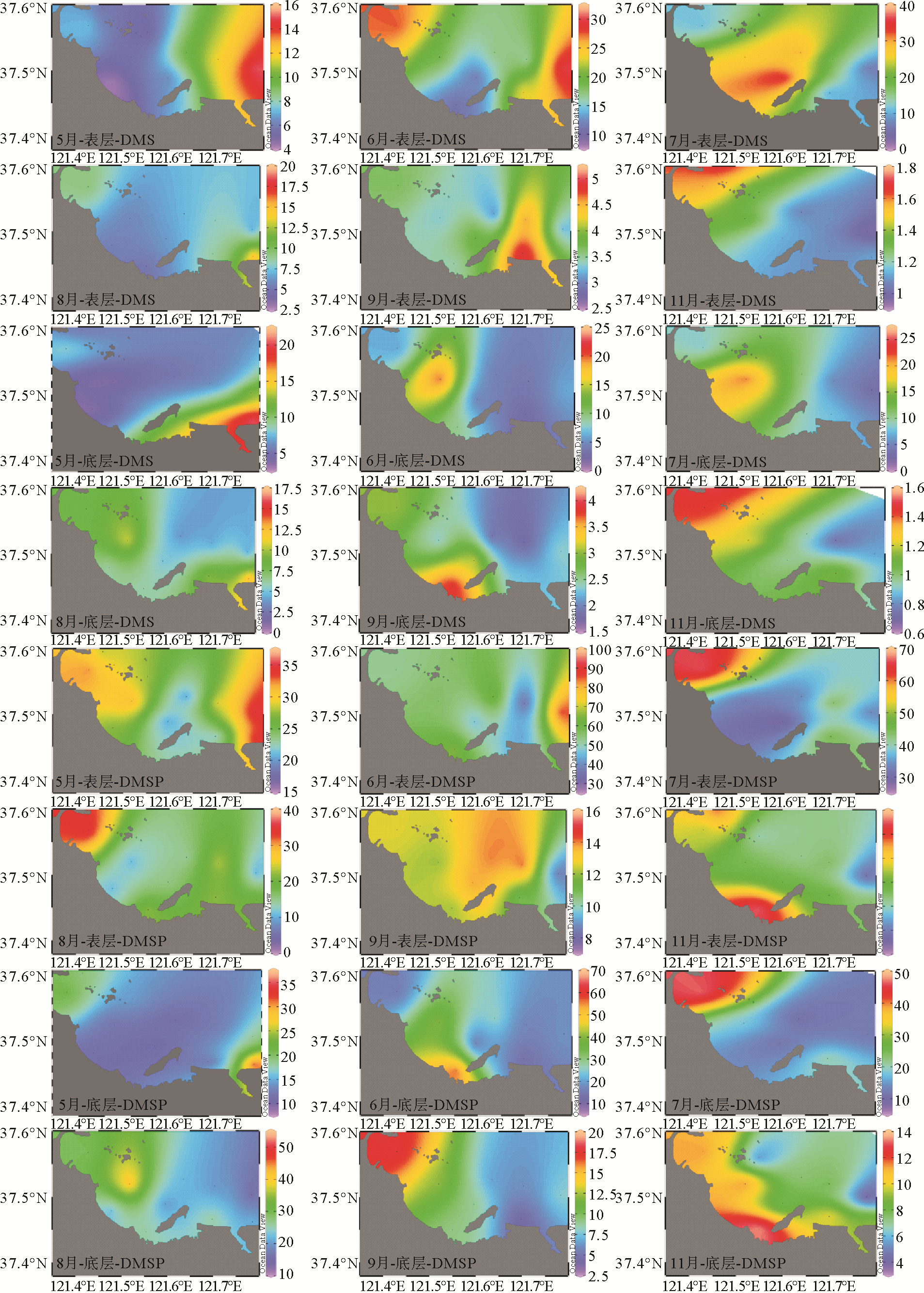
调查海域不同月份表层和底层海水中的DMS、DMSP浓度及其变化范围如表 1所示。与CH4相同,6月份的DMS、DMSP平均浓度最高,春夏两季的DMS、DMSP平均浓度明显高于秋季,并且不同月份不同水层的DMS、DMSP分布趋势不尽相同(见图 4)。浮游植物生物量是影响海水DMS和DMSP浓度的关键因素之一,并且多个研究已表明我国渤海、黄海及东海海域DMS、DMSP与Chl a存在显著的正相关关系[3, 5]。然而,在烟台近岸海域,整个扇贝养殖周期内并未发现DMS、DMSP与Chl a之间存在显著的正相关关系,这表明影响近岸水体中DMS和DMSP迁移转化过程的因素更为复杂。
|
图 4 扇贝养殖季烟台近海DMS(nmol/L)、DMSP(nmol/L)的时空分布 Fig. 4 Temporal and spatial distributions of DMS(nmol/L) and DMSP(nmol/L) in the coastal waters of Yantai during the scallop farming period |
养殖区和非养殖区不同月份Chl a、DMS、DMSP的平均浓度分别如图 3B、图 3C、图 3D所示,整个扇贝养殖期间内养殖区表层水体Chl a、DMS、DMSP的平均浓度分别为1.00 μg/L、10.70 nmol/L和25.99 nmol/L,非养殖区Chl a、DMS、DMSP的平均浓度分别1.68 μg/L、8.62 nmol/L和28.97 nmol/L。与非养殖区相比,养殖区的Chl a和DMSP浓度分别降低了68%和11%,而DMS浓度增加了24%。贝类的生物过滤作用对水体中浮游生物及颗粒物质有着巨大的影响,在胶州湾,养殖贝类对浮游植物的消耗量占该生态系统浮游植物总消耗量的90%[18]。同时,Kasamatsu等[19]的研究表明,贝类摄取的浮游植物及有机颗粒物中DMSP大部分并未参与代谢过程,而是以粪便DMSP的形式排除。因此虽然养殖区的Chl a浓度降低了68.00%,而DMSP浓度仅仅降低了11.47%。另外,侯兴等[20]的研究表明,贝类粪便中的DMSP可以扩散到海水中,并导致水体中悬浮颗粒态DMSP的增加。DMSP作为微生物食物网中的关键化合物[21],可以为细菌的生长提供所需的硫源和碳源,贝类粪便中的DMSP可以吸引附着细菌,增加DMSP向DMS的转化,进而导致养殖区表层水体的DMS浓度高于非养殖区。通过计算不同月份扇贝养殖区和非养殖区的DMS、DMSP浓度得出,5月养殖区的DMS浓度比非养殖区高99%,DMSP浓度低12%,6月养殖区的DMS浓度比非养殖区高12%,DMSP浓度低5%,7月养殖区的DMS浓度比非养殖区高26%,DMSP浓度低8%,9月养殖区的DMS浓度比非养殖区高28%,DMSP浓度低13%,11月养殖区的DMS浓度比非养殖区低34%,DMSP浓度低36%。综合整个扇贝养殖周期和不同月份养殖区和非养殖区的DMS、DMSP浓度差异,可以看出扇贝养殖对DMS释放的促进作用主要集中在其生长繁殖期,扇贝成熟后,其滤食能力的增强会显著降低表层水体的DMSP浓度,反而不利于DMS的生产释放。
2.3 DMS、DMSP与CH4的相关关系海洋中大部分CH4是在厌氧环境条件下,氧气和无机氧化剂(NO3-,Fe2+,SO42-)耗尽环境中作为电子给予体而形成的氧化产物[22]。因此,对海洋CH4循环的研究主要集中于缺氧的沉积物中。然而,诸多调查研究发现,部分海域的大洋区、陆架区和海湾区真光层海水中也普遍存在不同程度的CH4过饱和状态,如中国的黄东海[4]、南海北部陆坡[23],智利中部大陆架[24],亚热带北太平洋[25],黑海[26],波罗的海[27],北极水域[28]等。近年来,关于导致表层水体“CH4悖论”的成因众说纷纭,而越来越多的证据表明有氧环境下的CH4生成可能与海洋中含硫的甲基化合物密切相关。Althoff等[29]的研究表明有机硫化物可在高氧条件下被铁(Ⅱ/Ⅲ)转化为CH4;Damm等[30]在斯瓦尔巴特岛南部陆架Storfjorden地区的调查结果显示DMSP可以作为甲基营养型产CH4过程中潜在的营养基质,本次调查研究发现一些站位表层海水中的DMSP与CH4浓度高值高度重合且其表层CH4浓度高于底层,例如7月份S6、S7站位,这表明研究海域表层水体中存在CH4的其他来源。通过对整个扇贝养殖周期内的DMS、DMSP与CH4进行相关性分析,发现表层水体中DMSP与CH4呈现显著正相关关系(见图 5),而DMS与CH4之间不存在显著的相关性,该结果与Zindler[31]在日本至澳大利亚的一条南北通道表层水体中的调查结果一致。尽管Damm等[30]指出DMSP降解过程中产生的DMS也可能是生成CH4的潜在前体物质,耿澜涛[32]也发现表层海水中可溶有机质和DMS在光照条件下能产生CH4,并且CH4的产量和生成速率与可光降解物质的光照时长和浓度密切相关,但调查结果显示在太阳辐射最强的7、8月份,烟台近海DMS与CH4的高值区并不吻合,并且DMS与CH4之间不存在显著的正相关关系。这表明7月份S6、S7站位CH4的高值可能来源于DMSP而非DMS,但关于他们之间的转换机制、途径和影响因素还需要进一步的深入研究。
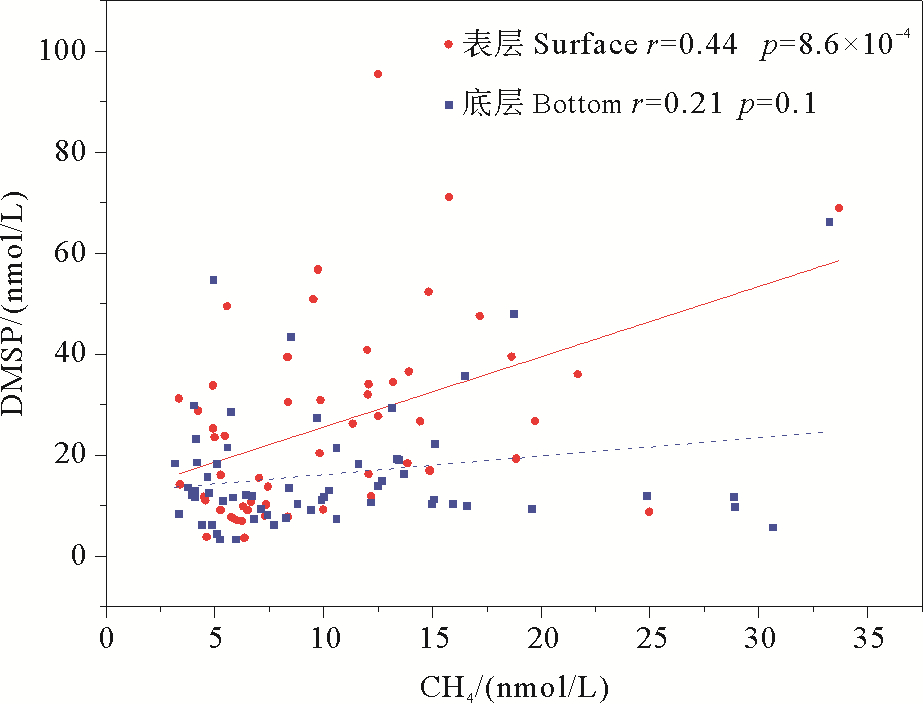
|
图 5 DMSP与CH4的相关关系 Fig. 5 Correlation between DMSP and CH4 |
海水中溶存CH4的饱和度R和海-气通量F计算公式如下:
| $ R=C_{\text {obs }} / C_{\text {eq } } 。$ | (1) |
| $ \begin{gathered} F=K_{\mathrm{w}} \times\left(C_{\text {obs }}-C_{\text {eq }}\right) 。\end{gathered} $ | (2) |
式中:Cobs为CH4在表层海水中的实测浓度;Ceq为气体在表层海水与大气达到平衡时的浓度,根据Wiesenburg公式计算得出;Kw为气体交换速率。
DMS的海-气通量计算公式为:
| $ F=K\left(c_{\mathrm{w}}-c_{\mathrm{g}} / H\right) \approx K c_{\mathrm{w}} \text { 。} $ | (3) |
式中:K为海-气交换速率;cw和cg分别为DMS在大气和海水中的浓度;H为亨利常数;cg/H远小于cw,可忽略不计。CH4和DMS的海-气交换速率均采用W2014法[33]计算。
计算结果表明烟台近海5、6、7、8、9和11月CH4饱和度平均值分别为606.2%、691.2%、588.8%、284.4%、284.2%、331.8%,海-气通量平均值分别为10.80、9.26、5.65、2.15、2.60和5.60 μmol/(m2·d),DMS为5.76、11.33、7.87、4.07、1.89和1.01 μmol/(m2·d)。通过Bigemap GIS Office软件估算调查海域面积约为560 km2,大致估算出烟台近海扇贝养殖季的甲烷海-气通量为9.69×106 g,DMS海-气通量为3.33×107 g。
3 结论(1) 烟台近岸海域表层海水CH4浓度处于过饱和状态,DMSP可能是表层海水中CH4重要的潜在来源。尽管扇贝养殖区底层CH4平均浓度比非养殖区高25.64%,但是由于夏季养殖区海水层化较为严重,增加了CH4在海水中的氧化,导致养殖区表层CH4浓度反而低于养殖区,整个扇贝养殖周期内调查海域甲烷的海-气通量约为9.69×106 g。
(2) 扇贝养殖可以影响DMS和DMSP的迁移转化过程,贝类滤食过程可以将浮游植物体内的DMSP转化为海水中的颗粒态DMSP,增加DMSP向DMS的转化。与非养殖区相比,养殖区的DMSP浓度降低了11.47%,DMS浓度增加了24.13%。整个扇贝养殖周期内调查海域DMS的海-气通量约为3.33×107 g。
致谢: 本文所用的DO和Chl a数据由中科院牟平海岸带环境综合试验站提供,作者对此表示诚挚谢意。
| [1] |
Lana A, Bell T G, Simó R, et al. An updated climatology of surface dimethlysulfide concentrations and emission fluxes in the global ocean[J]. Global Biogeochemical Cycles. DOI:10.1029/2010GB003850 (  0) 0) |
| [2] |
臧家业. 东海海水中的溶存甲烷[J]. 海洋学报, 1998, 20(2): 52-59. Zang J Y. Dissolved methane in sea water of the East China Sea[J]. Acta Oceanologica Sinica, 1998, 20(2): 52-59. (  0) 0) |
| [3] |
Zhang S H, Sun J, Liu J L, et al. Spatial distributions of dimethyl sulfur compounds, DMSP-lyase activity, and phytoplankton community in the East China Sea during fall[J]. Biogeochemistry, 2017, 133(1): 59-72. DOI:10.1007/s10533-017-0308-y (  0) 0) |
| [4] |
张桂玲. 中国近海部分海域溶解甲烷和氧化亚氮的生物地球化学过程[D]. 青岛: 中国海洋大学, 2004. Zhang G L. Study on Biogeochemistry of Dissolved Methane and Nitrous Oxide in the Coastal Water of China[D]. Qingdao: Ocean University of China, 2004. (  0) 0) |
| [5] |
Zhang S H, Yang G P, Zhang H H, et al. Spatial variation of biogenic sulfur in the south Yellow Sea and the East China Sea during summer and its contribution to atmospheric sulfate aerosol[J]. Science of the Total Environment, 2014, 488-489: 157-167. DOI:10.1016/j.scitotenv.2014.04.074 (  0) 0) |
| [6] |
Zhai X, Zhang H H, Yang G P, et al. Distribution and sea-air fluxes of biogenic gases and relationships with phytoplankton and nutrients in the central basin of the South China Sea during summer[J]. Marine Chemistry, 2018, 200: 33-44. DOI:10.1016/j.marchem.2018.01.009 (  0) 0) |
| [7] |
马立杰, 崔迎春. 南海中部和北部上层海水中溶存甲烷浓度及海气交换通量[J]. 热带海洋学报, 2013, 32(2): 94-101. Ma L J, Cui Y C. Dissolved methane concentration and sea-to-air transfer flux of dissolved methane in the upper seawater of the central and northern South China Sea[J]. Journal of Tropical Oceanography, 2013, 32(2): 94-101. (  0) 0) |
| [8] |
Zhang G, Zhang J, Liu S, et al. Methane in the Changjiang (Yangtze River) Estuary and its adjacent marine area: Riverine input, sediment release and atmospheric fluxes[J]. Biogeochemistry, 2008, 91(1): 71-84. DOI:10.1007/s10533-008-9259-7 (  0) 0) |
| [9] |
Jian S, Zhang H H, Yang G P, et al. Variation of biogenic dimethylated sulfur compounds in the Changjiang River Estuary and the coastal East China Sea during spring and summer[J]. Journal of Marine Systems, 2019, 199: 103222. DOI:10.1016/j.jmarsys.2019.103222 (  0) 0) |
| [10] |
顾培培, 张桂玲, 李佩佩, 等. 调流调沙对黄河口及邻近海域溶存甲烷的影响[J]. 中国环境科学, 2011, 31(11): 1821-1828. Gu P P, Zhang G L, Li P P, et al. Effect of the water-sediment regulation on dissolved methane in the lower Yellow River estuary and it's adjacent marine area[J]. China Environmental Science, 2011, 31(11): 1821-1828. (  0) 0) |
| [11] |
Bange H W, Bartell U H, Rapsomanikis S, et al. Methane in the Baltic and North Seas and a reassessment of the marine emissions of methane[J]. Global Biogeochemical Cycles, 1994, 8(4): 465-480. DOI:10.1029/94GB02181 (  0) 0) |
| [12] |
Yang B, Gao X, Zhao J, et al. The influence of summer hypoxia on sedimentary phosphorus biogeochemistry in a coastal scallop farming area, North Yellow Sea[J]. Science of the Total Environment, 2020, 759(1): 143486. (  0) 0) |
| [13] |
陈慧娟. 海水养殖对海洋生态环境的影响及其对策[J]. 福建水产, 2007(3): 47-50. Chen H J. The impact of mariculture on marine ecological environment and its countermeasures[J]. Journal of Fujian Fisheries, 2007(3): 47-50. DOI:10.3969/j.issn.1006-5601.2007.03.011 (  0) 0) |
| [14] |
谭丹丹, 张洪海, 翟星, 等. 冬季黄渤海DMS, DMSP和CH4的分布及影响因素[J]. 中国环境科学, 2019, 39(5): 2143-2153. Tan D D, Zhang H H, Zhai X, et al. Distributions of dimethylsulfide, dimethylsulfoniopropionate, methane and influencing factors in the Yellow Sea and Bohai Sea during winter[J]. China Environmental Science, 2019, 39(5): 2143-2153. DOI:10.3969/j.issn.1000-6923.2019.05.043 (  0) 0) |
| [15] |
孙明爽. 东、黄海及桑沟湾海域溶解甲烷的分布、释放和产生研究[D]. 青岛: 中国海洋大学, 2014. Sun M S. Distribution, Emission and Production of Methane in the Yellow Sea, East China Sea and Sanggou Bay[D]. Qingdao: Ocean University of China, 2014. (  0) 0) |
| [16] |
张福绥, 马江虎, 何义朝, 等. 胶州湾海湾扇贝肥满度的研究[J]. 海洋与湖沼, 1991, 22(2): 97-103. Zhang F S, Ma J H, He Y C, et al. A study on the meat condition of the bay scallop in Jiaozhou Bay[J]. Oceanologia et Limnologia Sinica, 1991, 22(2): 97-103. (  0) 0) |
| [17] |
张文静, 董志军, 孙西艳, 等. 2018年烟台四十里湾及其邻近海域网采浮游植物群落结构的时空变化[J]. 海洋与湖沼, 2020, 51(5): 1151-1161. Zhang W J, Dong Z J, Sun X Y, et al. Spatial and temporal distribution of net-sampled phytoplankton community in Sishili Bay and its adjacent water, Yantai in 2018[J]. Oceanologia et Limnologia Sinica, 2020, 51(5): 1151-1161. (  0) 0) |
| [18] |
Han D, Chen Y, Zhang C, et al. Evaluating impacts of intensive shellfish aquaculture on a semi-closed marine ecosystem[J]. Ecological Modelling, 2017, 359: 193-200. DOI:10.1016/j.ecolmodel.2017.05.024 (  0) 0) |
| [19] |
Kasamatsu N, Kawaguchi S, Watanabe S, et al. Possible impacts of zooplankton grazing on dimethylsulfide production in the Antarctic Ocean[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2004, 61(5): 736-743. DOI:10.1139/f04-072 (  0) 0) |
| [20] |
侯兴, 王颖, 刘天红, 等. 4种常见经济滤食性贝类摄食活动对球等鞭金藻产生二甲基硫化物的影响[J]. 渔业科学进展, 2021, 42(5): 124-131. Hou X, Wang Y, Liu T H, et al. Effects of feeding activities by four common economic bivalves on the production of dimethyl sulfur compounds from Isochrysis galbana[J]. Progress in Fishery Sciences, 2021, 42(5): 124-131. (  0) 0) |
| [21] |
Stefels J, Steinke M, Turner S, et al. Environmental constraints on the production and removal of the climatically active gas dimethylsulphide (DMS) and implications for ecosystem modelling[J]. Biogeochemistry, 2007, 83(1): 245-275. (  0) 0) |
| [22] |
陈烨, 孙治雷, 吴能友, 等. 海洋沉积物中甲烷代谢微生物的研究进展[J]. 海洋地质与第四纪地质, 2022, 42(6): 82-92. Chen Y, Sun Z L, Wu N Y, et al. Advances in the study of methane-metabolizing microbial communities in marine sediments[J]. Marine Geology & Quaternary Geology, 2022, 42(6): 82-92. (  0) 0) |
| [23] |
Zhou H, Yin X, Yang Q, et al. Distribution, source and flux of methane in the western Pearl River Estuary and northern South China Sea[J]. Marine Chemistry, 2009, 117(1-4): 21-31. (  0) 0) |
| [24] |
Florez-Leiva L, Damm E, Farías L. Methane production induced by dimethylsulfide in surface water of an upwelling ecosystem[J]. Progress in Oceanography, 2013, 112-113: 38-48. (  0) 0) |
| [25] |
Holmes M E, Sansone F J, Rust T M, et al. Methane production, consumption, and air-sea exchange in the open ocean: An evaluation based on carbon isotopic ratios[J]. Global Biogeochemical Cycles, 2000, 14(1): 1-10. (  0) 0) |
| [26] |
Schmale O, Beaubien S E, Rehder G, et al. Gas seepage in the Dnepr paleo-delta area (NW-Black Sea) and its regional impact on the water column methane cycle[J]. Journal of Marine Systems, 2010, 80(1-2): 90-100. (  0) 0) |
| [27] |
Schmale O, Wäge J, Mohrholz V, et al. The contribution of zooplankton to methane supersaturation in the oxygenated upper waters of the central Baltic Sea[J]. Limnology and Oceanography, 2018, 63(1): 412-430. (  0) 0) |
| [28] |
Shakhova N, Semiletov I, Salyuk A, et al. Extensive methane venting to the atmosphere from sediments of the East Siberian Arctic Shelf[J]. Science, 2010, 327(5970): 1246-1250. (  0) 0) |
| [29] |
Althoff F, Benzing K, Comba P, et al. Abiotic methanogenesis from organosulphur compounds under ambient conditions[J]. Nature Communications, 2014, 5(1): 1-9. (  0) 0) |
| [30] |
Damm E, Kiene R P, Schwarz J, et al. Methane cycling in Arctic shelf water and its relationship with phytoplankton biomass and DMSP[J]. Marine Chemistry, 2008, 109(1-2): 45-59. (  0) 0) |
| [31] |
Zindler C, Bracher A, Marandino C A, et al. Sulphur compounds, methane, and phytoplankton: Interactions along a north-south transit in the western Pacific Ocean[J]. Biogeosciences, 2013, 10(5): 3297-3311. (  0) 0) |
| [32] |
耿澜涛. 加拿大北极亚北极海水中溶解甲烷的分布及其生物地球化学研究[D]. 武汉: 中国地质大学, 2017. Geng L T. Studies on the Distribution of Dissolved Methane and Its Biogeochemistry in Canadian Arctic and Sub-Arctic Seas[D]. Wuhan: China University of Geosciences, 2017. (  0) 0) |
| [33] |
Wanninkhof R. Relationship between wind speed and gas exchange over the ocean revisited[J]. Limnology and Oceanography: Methods, 2014, 12(6): 351-362. (  0) 0) |
2. Shandong Marine Resource and Environment Research Institute, Shandong Key Laboratory of Marine Ecological Restoration, Yantai 264006, China;
3. Jiangsu Key Laboratory of Marine Bioresources and Environment, Jiangsu Ocean University, Lianyungang 222005, China;
4. Jiangsu Institute of Marine Resources Development, Lianyungang 222005, China
 2024, Vol. 54
2024, Vol. 54


