2. 中国科学院大连化学物理研究所,辽宁 大连116032;
3. 齐鲁工业大学生物工程学院,山东 济南 250353
微藻种类繁多且代谢系统丰富多样,特别是真核藻类,具有巨大的基因调控潜力,被认为是最具潜力的下一代生物质提供者[1-2]。莱茵衣藻(Chlamydomonas reinhardtii)是目前研究最充分的微藻:可直接获得的野生或人工株系超过3 000株(chlamycollection.org中心保藏),其核基因组编码基因超过15 000个;在phytozome(phytozome.jgi.doe.gov)的V5.5版本数据库中收录超过130个典型培养条件下的转录组数据;叶绿体和线粒体基因组也已完成测序。作为光合真核微藻,其表达系统具有翻译后修饰能力和细胞器表达能力(叶绿体和线粒体),兼具植物和微生物表达系统的优势。上述莱茵衣藻的特点为其在基因工程、代谢工程和合成生物学方面的应用提供了丰富的选择性[3]。
常见的真核微藻表达系统分为2类。一种是利用细胞器作为表达系统,如将外源基因重组到叶绿体DNA中进行表达[4-5],其优点是外源蛋白可以在叶绿体内高含量存在,其缺点是叶绿体基因组中可操作的位点及可插入片段长度、数量有限。另一种是利用核表达系统,将外源基因重组到核基因组,在胞质内表达蛋白。相比而言,对真核微藻核基因组的操作选择性更为多样,且胞质内蛋白表达的方式更丰富,可以根据不同目的选择不同的策略。
在光合微藻和高等植物中,1, 5-二磷酸核酮糖羧化/加氧酶(Ribulose-1, 5-bisphosphate carboxylase/oxygenase, Rubisco)是参与光合作用和光呼吸过程的关键酶,也是胞内含量最丰富的蛋白质。该蛋白有4个大亚基(RbcL)和4个小亚基(RbcS)组成,其中RbcL是叶绿体编码蛋白,RbcS是核编码蛋白[6]。已有研究表明,莱茵衣藻基因组中有2个RbcS编码基因,相似度极高,其中RbcS2(Cre02.g120150.t1.1)具有表达量高且相对稳定的特点[7],因此已被广泛用于微藻重组蛋白表达载体的构建[1]。
内外源基因的表达按其目标来说可以分为2类:一类是以蛋白本身作为产物,如利用代谢工程、合成生物学等手段构建细胞工厂,用来高效获得正确折叠的蛋白;另一类是以研究基因/蛋白的功能为目标的,作为工具研究生物学机制。相比之下,微藻内外源基因表达的第二类应用具有更广阔的需求。影响内外源基因在微藻细胞中表达效率的因素有很多,其中,启动子在基因表达系统中就是关键元件[2],有研究表明,热休克蛋白Hsp70A启动子能提升外源基因的表达,并能缓解衣藻中转入基因的沉默[8]。Schroda等利用热休克蛋白Hsp70A启动子的特点,在2002年提出构建Hsp70A-RbcS2嵌合启动子,随后,在Hsp70A-RbcS2上引入更多的调控组件[9],包括RbcS2的第一个内含子和3’-UTR等,使Hsp70A-RbcS2逐渐成为莱茵衣藻蛋白表达效果最好且应用最为广泛的系统[1]。Invitrogen公司基于上述研究推出了GeneArt ® Chlamydomonas Engineering Kits表达系统,主要是在RbcS2启动子引发的表达系统中加入了不同的调控元件,其中pChlamy_1表达系统中引入了RbcS2的第一内含子序列,提升了外源蛋白的表达量;pChlamy_3表达系统进一步在pChlamy_1终止密码子后引入了RbcS2基因的3’-UTR序列,进而实现了相对稳定的蛋白表达量。
作为一种典型的研究体系,莱茵衣藻氮胁迫条件下储能物质的积累规律一直为大家所关注。本实验室前期工作中,借助修饰蛋白质组技术识别出莱茵衣藻在受到氮胁迫时,叶绿体型磷酸甘油醛脱氢酶(Glycera-ldehyde-3-phosphate dehydrogenase, GAPDH)发生了显著的泛素化[10]。通常GAPDH作为糖酵解的关键酶参与糖的利用,并且叶绿体型GAPDH,在卡尔文循环中也是光合固碳的重要环节。那么叶绿体型GAPDH对储能物质的积累起到何种作用?为了探索其生理功能,本研究以经典的野生型莱茵衣藻藻株cc-137c为宿主,分别以上述2种不同表达水平的表达系统为基础,构建相应的转化株,考察其生长和储能物质积累过程的变化,进而对叶绿体型GAPDH的功能加以推测。
1 材料与方法 1.1 藻株及质粒介绍莱茵衣藻cc-137c购买自Chlamycollection中心,编号cc-124 wild type mt-[137c]。pChlamy_1直接来源于Invitrogen公司,pChlamy_3载体在pChalmy_1的基础上利用RF克隆技术[11]插入3’-UTR序列并测序验证。研究使用的GAPDH(NCBI:XM_001689819.1)委托金为智公司合成获得,GAPDH基因片段为1 144 bp。莱茵衣藻使用标准TAP培养基[12],24 h连续光照,光强为50 μmol·m-2·s-1,摇床振荡培养,转速为100 r/min。
1.2 方法 1.2.1 转化质粒的构建本文使用2种表达载体构建重组质粒pChlamy_1-GAPDH和pChlamy_3-GAPDH,其图谱如图 1所示。利用人工合成得到pChlamy_1-GAPDH,通过PCR扩增技术得到莱茵衣藻cc-137c藻细胞中的3’-UTR(234 bp)片段,利用RF克隆方法,其中RF的第二步(RF2)反应体系如表 1所示,获得pChlamy_3-GAPDH。上述PCR反应中所用的Cr3U-F/R引物序列如表 2所示,且均是在TakaraPrimeSatrmaxPremixkit的50μL体系中进行。
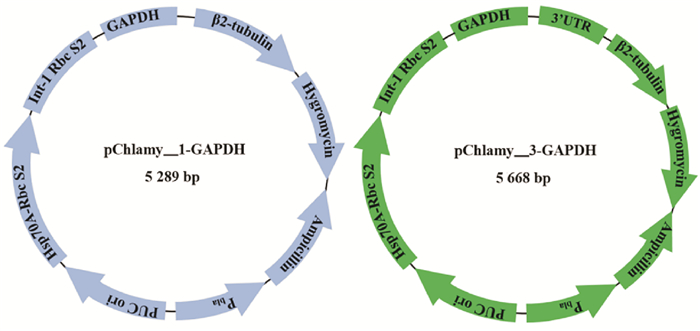
|
图 1 pChlamy_1-GAPDH和pChlamy_3-GAPDH重组质粒图 Fig. 1 The map of pChlamy_1-GAPDH and pChlamy_3-GAPDH |
|
|
表 1 重组质粒pChlamy_3-GAPDH的RF2反应体系 Table 1 Recombinant plasmidspChlamy_3-GAPDH of RF2 clone reaction system |
|
|
表 2 引物序列 Table 2 Primer sequence |
莱茵衣藻RbcS2的3’-UTR序列扩增过程如下:将0.5 mL生长至指数生长期末期的cc-137c细胞(OD750吸光度值约1.0)离心收集,用20 μL无菌水重悬,100 ℃加热裂解5 min。冷却后,取1 μL作为模板进行PCR扩增。
将纯化后的RF克隆产物转化至感受态细胞E.coli DH5α,然后涂布于含有氨苄抗生素的LB培养皿上,37 ℃过夜培养,挑取单克隆,提取质粒后由宝生物公司进行测序验证。
1.2.2 重组质粒转化及转化藻株筛选各取3 μg待转化重组质粒,利用限制性内切酶Pvu I进行线性化,用于电击转化。具体步骤如下:将莱茵衣藻cc-137c接种至TAP培养基中,接种OD750约0.05,培养至OD750至0.3~0.5之间,取15 mL藻细胞,离心取上清,用250 μL 40 mmol/L的蔗糖TAP溶液重悬藻细胞,加入电击杯中,再加入2~3 μg的线性化质粒,轻轻振荡混匀(空白对照不加质粒,只加对应体积的无菌水),使用Bio-Rad® Gene Pulser® Ⅱ进行电转,参数为:600 V,50 μF,电阻无穷大。电击结束后,按照每125 μL接种至5 mL 40 mmol/L蔗糖TAP溶液的比例,在六孔板中光照培养24 h。随后,取1~2 mL藻液在2 500 r/min下离心10 min,用150 μL的40 mmol/L蔗糖TAP溶液重悬藻细胞,涂布在10 μg·mL-1潮霉素平板进行初筛。随后,对2种转化株的单克隆分别进行单藻落PCR验证。第一轮引物为载体上的通用引物PC-F/R;第二轮为阳性克隆使用对应的特异性引物GAPDH-F/R,进行第二次PCR扩增验证。引物序列如表 2所示。
1.2.3 转化藻株培养 1.2.3.1 转化藻株在TAP平板培养挑选每种转化藻株中的阳性克隆,在含有抗生素的TAP琼脂培养基上划线,培养温度为(25±1)℃,光强为50 μmol photons·m-2·s-1,在光照14 h:黑暗10 h光照条件下,倒置培养2~3 d,观察藻细胞在TAP固体培养基上的生长情况。
1.2.3.2 转化藻株在TAP溶液培养转化藻株在含有10 μg·mL-1潮霉素的液体TAP培养基中进行5代传代培养后,用于进一步评价。为了保证评价过程中藻细胞不受到抗生素的影响,选择在正常的TAP培养基进行摇瓶培养。培养温度为(25±1)℃,在24 h光强为50 μmol photons·m-2·s-1的光照条件下,将起始密度OD750在0.07~0.09的100 mL微藻培养于250 mL摇瓶中,设置3个平行。在100 r/min摇床上连续培养5 d,每天定时取样测定OD750、叶绿素荧光参数Fv/Fm、干重。取样遵循不放回原则,同时培养野生型莱茵衣藻cc-137c作为对照。剩余藻细胞冷冻离心,放入液氮中速冻,在-80 ℃冰箱保存。
1.2.4 细胞生长的测定微藻细胞密度:采用Jasco V-530紫外分光光度计测定,测定波长为750 nm,当藻液吸光度值大于1时,进行稀释重新测定。
细胞干重测定:取5~20 mL藻液,4 000 r/min离心10 min后,弃上清液,用0.5 mol·L-1碳酸氢铵溶液洗涤,过滤到预先烘干并称重的玻璃纤维滤膜上,烘干(60 ℃,24 h)后称重[13],计算干重(mg·mL-1)。
1.2.5 叶绿素荧光的测定采用Water-PAM(Walz,德国)叶绿素荧光仪测定光合系统Ⅱ(Photosystem Ⅱ,PS Ⅱ)最大光化学量子产量Fv/Fm。具体过程为:微藻细胞经过暗适应10 min后,先用检测光(ML,15 μmol·m-2·s-1)照射,测定初始荧光值为Fo;再用强饱和脉冲光(SP, 0.6 s, 330 μmol·m-2·s-1)激发,测定最大荧光值为Fm;最后计算出PS Ⅱ的最大光化学量子产量[14],即Fv/Fm值,Fv/Fm = (Fm-Fo)/Fm。
1.2.6 Westernblot验证在每种藻细胞中加入1 mL裂解液和蛋白酶抑制剂[10],放在组织细胞破碎仪(SCIENTZ-48)进行破碎,完成后在冰上放置1~2 h,以便藻细胞被充分裂解,冷冻离心取上清液,得到蛋白样品,并利用考马斯亮蓝法测定每个样品的蛋白浓度。将蛋白和loadingbuffer(Coomassie Brilliant Blue G-250)混匀加热变性,在10%的SDS-PAGE胶中进行恒压90 V电泳,完成后,切去SDS-PAGE胶的浓缩胶部分,将与胶大小相同的PVDF膜放入甲醇溶液中活化10 min,组装好PVDF膜和胶,在电转仪(Bio-rad)中进行电转,设定250 mA恒流电转1 h,完成后,将PVDF膜在5%牛奶中封闭1 h,用TBST溶液洗膜后,放入一抗溶液中孵育过夜,同种样品分别孵育在His-Taq(ABclonal.NO:AE003)和GAPDH(CST 5174, XP® Rabbit)一抗中,抗体均以1:1 000比例稀释,一抗孵育结束后,洗膜,放入二抗稀释液中孵育2 h,完成后洗膜,采用Tanon TMHigh-sig ECL Western Blotting Substrate显色液显色,在Multifunctional imager:FUSION-FX5-820进行曝光[15]。
1.2.7 总糖测定称量2~3 mg的干燥藻粉置于5 mL EP管中,加入2 mL去离子水,超声破碎细胞,将藻细胞破碎液定容至5 mL。配制葡萄糖浓度为0,0.02、0.04、0.06、0.08和0.10溶液各1 mL,各藻液样品也稀释为1 mL,每个样品加入5 mL蒽铜试剂,振荡混匀后沸水浴10 min。水浴结束后,以去离子水为空白调零,于621 nm处测定吸光度[16]。制作“葡萄糖浓度-吸光度”标准曲线得到回归方程。计算藻细胞中总糖含量,总糖含量(%)=稀释后的葡萄糖浓度(mg·mL-1)×稀释倍数×定容体积/藻粉质量(mg)×100%。
1.2.8 脂肪酸测定按照文献[17-18]介绍的方法测定藻细胞中脂肪酸组分和含量,称取5 mg左右藻粉于10 mL圆底烧瓶,加入内标碳十七烷酸甘油三酯(SigmaAldrich),并加入5 mL的2%硫酸-甲醇溶液(v/v),70℃水浴1 h,转酯化的反应结束后,待样品冷却,加入0.75 mL去离子水和2 mL正己烷,磁力搅拌器上搅拌1 min,静置分层,取上层己烷层加入到含有适量无水硫酸钠的离心管中除水,转移到样品瓶中采用带有FID检测器的Agilent GC 7890A进行测定。
2 实验结果与分析 2.1 质粒构建PCR结果所构建的质粒经过测序,碱基序列与设计一致。
2.2 转化藻株的初步筛选与PCR验证在抗性平板中,涂布第二天即出现肉眼可见转化株,如图 2E、F所示,该转化株出现时间要早于试剂盒以及本实验室其它转化实验中约3~5 d。在抗生素初筛基础上挑选出优先生长出来的单克隆,进行PCR的验证,如图 2所示:A和B是代表pChlamy_1-GAPDH转化株,C和D是代表pChlamy_3-GAPDH转化株。
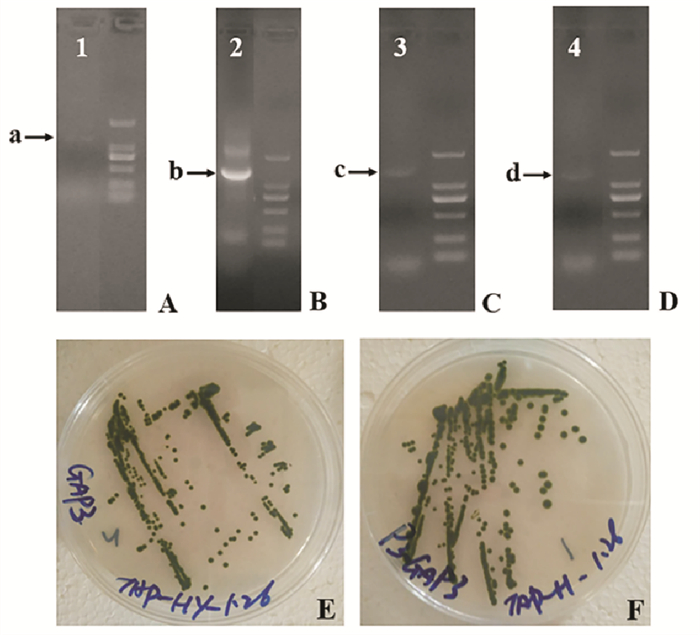
|
(图A~D为转化株的PCR验证结果,其中A、C使用的是载体通用引物对,B、D使用的是外源GAPDH特异性引物对,箭头所示为目标条带。图E和F为挑选出pChlamy_1-GAPDH和pChlamy_3-GAPDH转化株在抗性平板生长情况照片。A~D. Results of PCR verification by general primers and gene specific primers. A、C: By general primers; B、D: By gene specific primers. E and F. Transformants of pChlamy_1-GAPDH and pChlamy_3-GAPDH on agar plates.) 图 2 转化藻株的PCR验证和转化藻株的平板培养 Fig. 2 The PCR verification of transformed algae andthe cultivation of transformed algae |
对比每种转化株阳性克隆的个数,如表 3所示,其中pChlamy_1-GAPDH重组质粒转化率达22%,pChlamy_3-GAPDH重组质粒转化率达27%,这两个体系的转化率符合GeneArt® Chlamydomonas Engineering Kits说明书中介绍通常约有20%的阳性克隆。
|
|
表 3 转化藻株的PCR筛选 Table 3 The PCR screen of transformed algae |
野生型cc-137c(WT),pChlamy_1-GAPDH,pChlamy_3-GAPDH 3种藻株连续培养5 d,其叶绿素荧光动力学参数Fv/Fm变化如图 3所示。3种藻株的Fv/Fm在相同的水平,不存在显著差异。
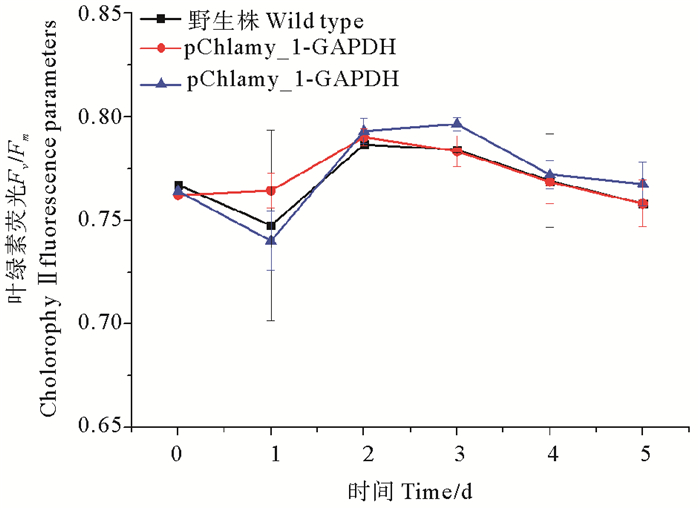
|
图 3 转化株和WT的叶绿素荧光变化 Fig. 3 Changes in chlorophyll fluorescence of transformed algae and WT |
这3种藻株的OD750尽管略有差异,但变化趋势基本保持一致,如图 4A所示,均在培养第3天时,细胞密度达到最大值,即OD750达到1.9~2.0,随后进入生长稳定期;如图 4B所示,对比各干重变化趋势,在培养第3天时,转化株pChlamy_1-GAPDH和pChlamy_3-GAPDH的干重均达到0.6 mg·mL-1以上,而WT的干重在0.53 mg·mL-1左右。
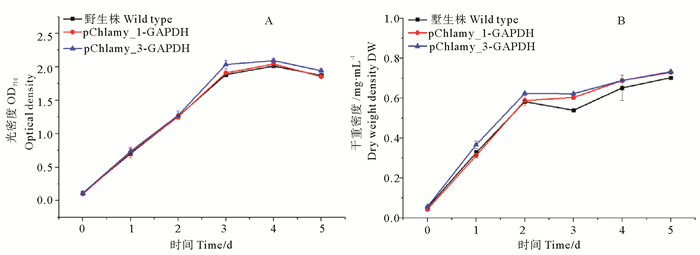
|
(A:转化株和WT的生长曲线变化;B:转化株和WT的干重变化。A: Changes in the growth curve of transformed algae and WT; B: Changes in the dry weight of transformed algae and WT.) 图 4 转化株和WT的生长曲线和干重变化 Fig. 4 Changes in the growth curve and dry weight of transformed algae and WT |
经过优化,分别使用40 μg pChlamy_1-GAPDH总蛋白和150 μg pChlamy_3-GAPDH总蛋白进行Western blot验证。结果表明,pChlamy_1-GAPDH的表达量变化较大,如图 5A中a-1和a-2所示,在第一天时含量较低,但是随着细胞生长至稳定期而明显增多;相比而言,整体上pChlamy_3-GAPDH的表达量处于比较稳定水平,相对丰度如图 5A中b所示,未有pChlamy_1-GAPDH的表达量高。这也与Invitrogen公司对这两种表达系统的介绍相一致,pChlamy_3相对于pChlamy_1能够提供更稳定的外源蛋白表达。

|
(A:转化株和WT总糖含量变化和转化株GAPDH western blot;a-1:pChlamy_1-GAPDH培养第一天样品western blot结果,a-2:pChlamy_1-GAPDH培养第三天样品western blot结果;b:pChlamy_3-GAPDH培养第四天样品western blot结果;G:代表目的蛋白GAPDH条带,C:代表内参蛋白条带。B:转化株和WT总脂肪酸含量变化。A: Changes of carbohydrate content of transformed algae and WT and western blot of GAPDH; a-1: Western blot results of the pChlamy_1-GAPDH in the first day, a-2: Western blot results of the pChlamy_1-GAPDH in the third day; b: Western blot results of the pChlamy_3-GAPDH in the fourth day; G: The target protein GAPDH, C: The internal control protein. B: Changes of lipid content of transformed algae and WT.) 图 5 转化株和WT总糖和总脂肪酸含量变化以及转化株GAPDH westernblot验证 Fig. 5 The total carbohydrate and lipid content and westernblotof GAPDH |
WT、pChlamy_1-GAPDH和pChlamy_3-GAPDH 3种藻株的总糖含量如图 5A所示,表现出了明显的规律性。其中WT相对转化株总糖含量最少,约占干重的9%~13%;pChlamy_1-GAPDH和WT在起始阶段总糖含量在同一水平,但伴随着GAPDH表达量的提升,而进入一个较高水平,在第二天达到干重的17%,随后有所下降;而pChlamy_3-GAPDH的总糖含量变化趋势与WT相接近,但是一致保持高于WT,从接种时的17%下降至指数生长期的11%,随着进入稳定期而逐渐回升。
2.6 脂肪酸含量测定与分析转化株与WT的脂肪酸含量变化如图 5B所示。因为是富营养培养,所以WT中脂肪酸含量保持稳定,在10%~11%左右;pChlamy_1-GAPDH转化株的脂肪酸含量呈现出与生长曲线类似的变化趋势,由初始时与WT相同水平的10%含量,在第4天脂肪酸含量开始迅速上升至13%,并维持,而这也与该阶段外源GAPDH表达量的变化相一致;相比之下,pChlamy_3-GAPDH转化株的脂肪酸含量一直维持稳定且高水平,脂肪酸含量在15%左右。
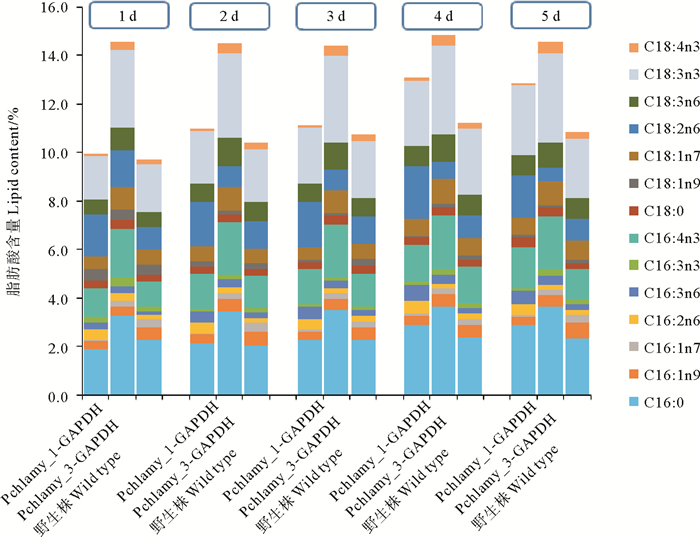
进一步分析脂肪酸构成的变化,如图 6和7所示。对比转化株主要发生变化的脂肪酸组分,发现pChlamy_3-GAPDH脂肪酸含量增加最明显的主要包括C16:0、C16:4n3、C18:3n3这3种脂肪酸,其中C16:0是脂肪酸代谢的起始阶段的脂肪酸代表,而C16:4n3,C18:3n3是被认为在叶绿体中所特有的脂肪酸[18];pChlamy_1-GAPDH的脂肪酸主要是在C16:0,C16:4n3和C18:2n6,脂肪酸含量的上升与GAPDH蛋白表达量相关,其中C16:0和C16:4n3是随着转化株的培养而增高的。
|
图 6 转化株和WT的脂肪酸各组分的含量 Fig. 6 The content of each composition of fatty acids in dry weight of transformants and WT |

|
图 7 转化株和WT的脂肪酸组成 Fig. 7 Fatty acid composition of transformed algae and WT |
结合2.5中的结果,说明GAPDH的转入,能够显著促进莱茵衣藻固碳后储能物质的积累。如表 4所示,pChlamy_3-GAPDH中的最大脂肪酸日积累量为44.8 mg·L-1,相对于WT提高了55.2%;而pChlamy_1-GAPDH中最大脂肪酸日积累量为33.5 mg·L-1,相对于WT提高了15.9%。同时,以总糖和总脂肪酸含量之和作为总储能物质生产的指标,进行对比,发现转化株的最大日储能物质量分别为84.2和91.8 mg·L-1,通过比较各种藻株的最大储能物质产率,发现2种转化藻株的总体固碳能力均有明显提高,相对于WT分别提高了60.7%和75.2%。
|
|
表 4 GAPDH转化对cc-137储能物质生产能力的影响 Table 4 Effectsof exogenous GAPDH on the energy storage compounds productivity |
微藻作为最有潜力的第三代生物质能源提供者,如何实现其高效光合固碳生产能源制品,一直是微藻技术发展领域的重点方向[19-20]。同时,作为一种重要水产饵料,微藻的高效定向培养也一直是拓宽饵料应用的重要一环[21-22]。这二者的发展均离不开微藻光合培养效率的提升。本文也正是基于此目的,希望从关键固碳蛋白的角度对这一领域的发展做出贡献。
光合固碳离不开卡尔文循环,人们在试图提升微藻和植物的固碳效率过程中,常常将关注点集中在CO2直接固定的Rubisco复合体上,因为这是由无机碳变为有机碳的第一步。在植物与微藻中,Rubisco不仅仅是固碳的关键酶,也是重要的氮库,在氮缺乏条件下,Rubisco将优先发生降解释放氮元素用于其它必需生理过程。因此,其含量具有很高的冗余度。相比而言,卡尔文循环中其他酶的研究则相对较少。GAPDH是卡尔文循环中光合产物葡萄糖分解过程中的重要酶[23]。一般来说,GAPDH在生物体内表达水平稳定,是研究转录和蛋白表达重要的内参,但是我们前期实验发现,叶绿体型GAPDH在氮缺乏条件下会显著的发生聚泛素化,这引起了我们对该蛋白的关注。相比胞质内的GAPDH,人们对叶绿体型GAPDH的功能知之甚少。因此,本文工作将首先从GAPDH的过表达入手,进行探索以期加深对叶绿体型GAPDH的认识。
由于莱茵衣藻内外源蛋白的表达具有一定的不稳定性和随机性,我们选用了目前商用典型的2个表达体系:pChlamy_1和pChlamy_3,其中pChlamy_1只具有莱茵衣藻RbcS2部分表达调控序列,表达蛋白的量具有一定的生长相关性,而pChlamy_3在pChlamy_1的基础上增加了3’-UTR序列,能够使外源基因得到稳定表达。因此,分别构建了上述2个系统的转化株,通过比较,发现2种转化株储能物质的含量均提高,但是对微藻储能物质积累的影响规律并不相同。具体而言,在持续稳定表达外源GAPDH的pChlamy_3-GAPDH转化株中,储能物质得到了稳定且持续的生产,最终获得了更高的产率;而pChlamy_1-GAPDH中GAPDH的表达量与生长关联,因此,当GAPDH进入高表达期时,储能物质才迅速提升。从结果可以看出,过表达叶绿体型GAPDH可明显提升转化株的储能物质生产效率。
综合实验结果,过表达叶绿体型GAPDH不仅能够强化CO2转化成碳水化合物,并且能够进一步通过强化糖酵解过程使碳水化合物向油脂转化。这为我们通过基因工程手段及合成生物学技术开发高效储能物质生产工程藻株提供了有力的借鉴。同时,在后续工作中,我们将延续这一思路,考察卡尔文循环中其它几个与碳水化合物代谢相关酶过表达的影响,如fructose-bisphosphate aldolase(EC: 4.1.2.13)。
4 结论(1) 构建了含有叶绿体型GAPDH基因,具有不同表达模式的2种转化株,通过对其生长和生物质组分的测定,发现叶绿体型GAPDH的过表达将强化光合储能物质生产,其中具有RbcS2的3’-UTR的pChlamy_3-GAPDH表达系统更为稳定。
(2) 与WT相比,转化株pChlamy_1-GAPDH和pChlamy_3-GAPDH分别实现了脂肪酸最大产率15.9%和55.2%的提升,总储能物质积累量60.7%和75.2%的提升,说明在莱茵衣藻中提升叶绿体型GAPDH的表达量能够显著的促进其储能物质生产效率的提升。
| [1] |
Scranton M A, Ostrand J T, Georgianna D R, et al. Synthetic promoters capable of driving robust nuclear gene expression in the green alga Chlamydomonas reinhardtii[J]. Algal Research, 2016, 15(1): 135-142.
(  0) 0) |
| [2] |
Urtubia H O, Betanzo L B, Vásquez M. Microalgae and Cyanobacteria as green molecular factories: Tools and perspectives[M].//Thajuddin N, Dhanasekaran D. Algae-Organisms for Imminent Biotechnology. Rijeka: InTech, 2016.
(  0) 0) |
| [3] |
Tardif M, Atteia A, Specht M, et al. PredAlgo: A new subcellular localization prediction tool dedicated to green algae[J]. Molecular Biology and Evolution, 2012, 29(12): 3625-3639. DOI:10.1093/molbev/mss178
(  0) 0) |
| [4] |
Noordally Z B, Ishii K, Atkins K A, et al. Circadian control of chloroplast transcription by a nuclear-encoded timing signal[J]. Science, 2013, 339(6125): 1316-1319. DOI:10.1126/science.1230397
(  0) 0) |
| [5] |
Gutensohn M, Fan E, Frielingsdorf S, et al. Toc, Tic, Tat et al.:Structure and function of protein transport machineries in chloroplasts[J]. Journal of Plant Physiology,, 2006, 163(3): 333-347. DOI:10.1016/j.jplph.2005.11.009
(  0) 0) |
| [6] |
Aigner H, Wilson R H, Bracher A, et al. Plant Rubisco assembly in E. coli with five chloroplast chaperones including BSD2[J]. Science, 358(6368): 1272-1278. DOI:10.1126/science.aap9221
(  0) 0) |
| [7] |
Cerutti H D, Johnson A, Gillham N W, et al. A eubacterial gene conferring spectinomycin resistance on Chlamydomonas reinhardtii: Integration into the nuclear genome and gene expression[J]. Genetics, 1997, 145(1): 97-110.
(  0) 0) |
| [8] |
Strenkert D, Schmollinger S, Schroda M. Heat shock factor 1 counteracts epigenetic silencing of nuclear transgenes in Chlamydomonas reinhardtii[J]. Nucleic Acids Research, 2013, 41(10): 5273-5289. DOI:10.1093/nar/gkt224
(  0) 0) |
| [9] |
Schroda M, Beck C F, Vallon O. Sequence elements within an HSP70 promoter counteract transcriptional transgene silencing in Chlamydomonas[J]. Plant Journal, 2002, 31(4): 445-455. DOI:10.1046/j.1365-313X.2002.01371.x
(  0) 0) |
| [10] |
Li S, Cao X, Wang Y, et al. A method for microalgae proteomics analysis based on modified filter-aidedsample preparation[J]. Applied Biochemistry and Biotechnology, 2017, 183(3): 923-930. DOI:10.1007/s12010-017-2473-9
(  0) 0) |
| [11] |
Den Ent F V, Lowe J. RF cloning: A restriction-free method for inserting target genes into plasmids[J]. Journal of Biochemical and Biophysical Methods, 2006, 67(1): 67-74. DOI:10.1016/j.jbbm.2005.12.008
(  0) 0) |
| [12] |
Harris E H. Chlamydomonas as a model organism[J]. Annual Review of Plant Biology, 2001, 52: 363-406. DOI:10.1146/annurev.arplant.52.1.363
(  0) 0) |
| [13] |
Zhu C J, Lee Y K. Determination of biomass dry weight of marine microalgae[J]. Journal of Applied Phycology, 1997, 9(2): 189-194. DOI:10.1023/A:1007914806640
(  0) 0) |
| [14] |
Schreiber U. Pulse-amplitude-modulation(pam)fluorometry and saturation pulse method: An overview[M].//Papageorgiou G C, Govindjee. Chlorophyll A Fluorescence: A Signature of Photosynthesis. Dordrecht: Springer Netherlands, 2004: 279-319.
(  0) 0) |
| [15] |
Liu Y, Tang L, Zeng J, et al. Global metabolic profiling identifies a pivotal role of proline and hydroxyproline metabolism in supporting hypoxic response in Hepatocellular carcinoma[J]. Clinical Cancer Research, 2018, 24(2): 474-485. DOI:10.1158/1078-0432.CCR-17-1707
(  0) 0) |
| [16] |
郝建军, 康宗利, 于洋. 植物生理学实验技术[M]. 北京: 化学工业出版社, 2007. Hao J J, Kang Z L, Yu Y. Experimental Techniques for Plant Physiology[M]. Benjing: Chemical Industry Press, 2007. (  0) 0) |
| [17] |
Liu J, Liu Y, Wang H, et al. Direct transesterification of fresh microalgal cells[J]. Bioresource Technology, 2015, 176: 284-287. DOI:10.1016/j.biortech.2014.10.094
(  0) 0) |
| [18] |
Yang M, Fan Y, Wu P C, et al. An extended approach to quantify triacylglycerol in microalgae by characteristic fatty acids[J]. Frontiers in Plant Science, 2017, 8: 1949. DOI:10.3389/fpls.2017.01949
(  0) 0) |
| [19] |
Amaro H M, Guedes A C, Malcata F X. Advances and perspectives in using microalgae to produce biodiesel[J]. Applied Energy, 2011, 88(10): 3402-3410. DOI:10.1016/j.apenergy.2010.12.014
(  0) 0) |
| [20] |
Ghasemi Y, Rasoul-Amini S, Naseri A T, et al. Microalgae biofuel potentials[J]. Applied Biochemistry and Microbiology, 2012, 48(2): 126-144. DOI:10.1134/S0003683812020068
(  0) 0) |
| [21] |
Forj N E, Navarro F, Cuaresma M, et al. Microalgae: Fast-growth sustainable green factories[J]. Critical Reviews in Environmental Science and Technology, 2015, 45(16): 1705-1755. DOI:10.1080/10643389.2014.966426
(  0) 0) |
| [22] |
Draaisma R B, Wijffels R H, Slegers P M, et al. Food commodities from microalgae[J]. Current Opinion in Biotechnology, 2013, 24(2): 169-177. DOI:10.1016/j.copbio.2012.09.012
(  0) 0) |
| [23] |
Zhu B, Chen G, Cao X, et al. Molecular characterization of CO2 sequestration and assimilation in microalgae and its biotechnological applications[J]. Bioresource Technology, 2017, 244(120): 7-15.
(  0) 0) |
2. Marine Bioengineering Group, Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116032, China;
3. Department of Bioengineering, Qilu University of Technology, Jinan 250353, China
 2019, Vol. 49
2019, Vol. 49


