2. 海州湾渔业生态系统教育部野外科学观测研究站,山东 青岛 266003;
3. 日照山海天旅游度假区渔政监督管理站,山东 日照 276800;
4. 青岛海洋科学与技术试点国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237
黄海近岸海域具有丰富的营养盐和充足的饵料,哺育了众多鱼类,形成了石岛渔场、吕泗渔场、海州湾渔场等渔场[1]。黄海近岸海域的众多渔场是鱼类、虾类、蟹类等交配、产卵、孵化及育幼的场所,其饵料生物的数量和种类、水文条件及地形地貌等会影响早期补充群体的生长和存活[2]。而早期补充群体的生长和存活率决定了群体资源数量和群体结构特征[3]。早期补充群体数量分布与变化不仅能够反映鱼类产卵场的动态变化,而且对维持海洋生态系统的平衡具有重要作用[4]。因此,了解鱼类的早期补充机制及其资源变动情况,有助于评估鱼类的资源现状和发展趋势,为渔业资源的管理和相关政策的制定提供科学依据。
鱚属(Sillago)鱼类隶属硬骨鱼纲(Osteichthyes)鲈形目(Perciformes)鱚科(Sillaginidae)[5]。中国沿海的鱚属鱼类有少鳞鱚(Sillago japonica)、中国鱚(Sillago sinica)和多鳞鱚(Sillago sihama)等[5-6]。鱚属鱼类多栖息于砂质海区,营养级较高,主要捕食底栖生物和游泳生物,在黄海海域的食物网和生态系统中占有重要的地位[7]。目前国内外关于鱚属鱼类的研究主要涉及形态学、遗传学、人工繁育和摄食生态等方面[5, 8-9],关于其分布与环境因子关系的研究较少,对鱼卵的生态特征更是缺乏深入的认识。鱚属鱼类鱼卵多为浮性卵,本身不具备活动能力,随波漂流[10-11]。因此,鱼卵的空间分布受到流速、流向、水文条件等海洋环境因素的限制[3]。通过研究鱚属鱼类鱼卵资源分布与环境因子的关系,有助于深入了解其产卵场的生境特征,及时掌握其早期补充状态及其资源变动趋势。在全球环境变化的大趋势下,可预测其产卵场的大致分布范围,为划定其保护区提供理论依据。
Hastie等[12]在20世纪90年代提出了广义可加模型(Generalized Additive Model,GAM),该模型多用于分析因变量和多个自变量之间的关系。然而,常规GAM模型概率密度函数不允许存在大量零值的情况。因此,在实际渔业调查中,必须对由于渔具选择性、调查海区和调查时间等因素导致出现大量零值的情况进行处理,从而提高模型预测精度。Shono[13]对比了Catch-NB模型、ad hoc方法、Delta-lognormal模型和Tweedie分布在渔获量出现大量零值情况下的性能,结果表明Tweedie分布性能最好。针对处理生物调查数据中常见的零膨胀问题,Tweedie-GAM模型在渔业研究中得到了广泛应用。例如, 王浩展[14]运用了Tweedie-GAM模型研究了拟锥齿鲨(Pseudocarcharias kamoharai)单位捕捞努力量渔获量与环境因子的关系;张云雷等[15]运用Tweedie-GAM模型研究了小黄鱼(Larimichthys polyactis)丰度与栖息环境的关系。
本研究以2014—2018年5—8月黄海中南部的鱼卵调查数据为基础,采用基于Tweedie分布的GAM模型,研究鱚属鱼类鱼卵的时空分布及其与环境因子的关系,以期掌握鱚属鱼类的资源时空变动及生境特征,为鱚属鱼类资源的合理利用和管理提供基础资料。
1 材料与方法 1.1 调查时间和海域本研究在黄海中南部近岸海域展开大面调查,范围为33°00′N—36°00′N,119°00′E—122°00′E,定点设置站位[16](见图 1)。调查时间如表 1所示,共进行了15个航次的鱼卵调查,且每年调查船的数量和船型是相同的。本研究将月份作为自变量,根据调查日期合并分为上、中、下旬,并以此进行分析。
|
图 1 2014—2018年5—8月黄海中南部海域鱼卵调查站位 Fig. 1 Survey stations of fish eggs in the central and southern Yellow Sea from May to August, 2014 to 2018 |
|
|
表 1 5—8月黄海中南部鱚属鱼类鱼卵的调查时间及站位数 Table 1 Survey time and station number of eggs of Sillago species in the central and southern Yellow Sea from May to August |
调查网具为带流量计的大型浮游生物网(网衣长2.80 m,网口直径0.80 m,网目0.505 mm)、专项网(网衣长6.0 m,网口直径1.30 m,网目0.505 mm)、浅水Ⅰ型浮游生物网(网衣长1.40 m,网口直径0.50 m,网目0.505 mm),采样方式为表层水平拖网,拖曳时长10 min,拖速2.0 kn。网口处安装流量计,记录滤水量。采集的样品用5%的甲醛溶液进行固定保存。同时,采用RBR-XR-420型CTD采集每个站位的水深(Depth)、海水表层温度(Sea surface temperature,SST)、海水底层温度(Sea bottom temperature,SBT)、海水表层盐度(Sea surface salinity,SSS)、海水底层盐度(Sea bottom salinity,SBS)。从FVCOM(Finite volume community ocean model)中提取流速,空间分辨率为0.5(′)×0.5(′),从而与实际环境数据相吻合,充分模拟复杂的地形和海岸线[17]。
1.3 数据标准化根据滤水体积,将鱼卵计数数量标准化为丰度,计算公式如下:
| $\rho=100 \mathrm{~N} / \mathrm{V}_{\circ}$ |
式中:ρ是每100 m3海水中鱚属鱼类鱼卵的卵粒数(ind./100 m3);N是全网鱚属鱼类鱼卵的卵粒数(ind.);V为滤水体积(m3)。
1.4 模型选择Tweedie类分布能拟合包含大量零值的全部数据,其性能优于常规GAM模型。不同的能效参数P对应不同的分布类型。例如当P=0、1、2时分别对应正态分布、泊松分布、伽马分布,当1 < P < 2时,对应Tweedie分布中的复合泊松分布(泊松分布和伽马分布的复合分布)[15]。
Tweedie-GAM模型表达式为:
| $\left\{\begin{array}{l}Y \sim T_{W P}(\theta, \varphi) \\ \mu=E(Y) \\ \ln \mu=X \cdot \alpha+s(F)\end{array}\right.$ 。 |
式中:μ=E(Y)为鱚属鱼类鱼卵丰度的期望值;解释变量中X为线性部分的影响因子的指示变量;向量α为模型的待估计参数;s为自然样条平滑;F为因子变量。
通过调用R 3.5.1统计软件中Tweedie软件包里相应的Tweedie.Profile函数中能效参数结果进行检验[13, 18],进而确定鱼卵丰度数据服从的分布类型。
使用PerformanceAnalytics函数对各环境因子之间的相关性进行分析,以去除具有多重共线性的因子。相关系数值介于[-1, 1]之间,其绝对值越大,表明两个变量间的相关性越高;绝对值越小,表明变量间的相关性越低。本研究去除相关系数大于0.5的其中一个因子。
依照赤池信息准则(Akaike information criterion,AIC)[15],在AIC最小的单因子预测函数的基础上依次加入其他因子,进而得到双因子预测模型,再不断重复上面的选择过程,直到模型的AIC值不会随着新因子的加入而减小为止,此时的模型拟合效果最好。
AIC准则公式如下:
| $\mathrm{AIC}=D+2 d_f \cdot \varphi_{\circ}$ |
式中:D为偏差(残差平方和);φ为离差参数(方差);df为有效自由度。
利用Surfer软件绘制鱼卵资源量分布随着月份变化的关系图。
最后采用交叉验证的方法对该模型的预测性能进行检验。从全部数据中随机选取70%的数据进行建模,剩余30%的数据进行验证,该过程重复100次,根据得出的均方根误差(Root mean squared error, RMSE)和决定系数R2来判断该模型的预测性能[4]。RMSE越小,观测值与真值之间的偏差越小,表明该模型的稳定性越好;R2越大,表明该模型的预测效果越好。
均方根误差公式如下:
| $\mathrm{RMSE}=\sqrt{\frac{1}{n} \sum\limits_{i=1}^n\left(O_i-P_i\right)^2}$ |
式中:Oi为实际观测值;Pi为模型预测值。
2 结果 2.1 相关性检验本研究对调查采集的环境数据进行相关性分析,排除环境因子共线性对于模型的影响,结果如表 2所示。SST与SBT有极强的相关性,SSS与SBS有极强的相关性,SBT、SBS与水深有极强的相关性,SST、SSS与流速存在较弱的相关性。因此,本研究筛选出环境因子(流速、SST、SSS)、时间因子(月份)和空间因子(经纬度交互项)进行模型的构建。
|
|
表 2 2014—2018年各环境因子的相关系数 Table 2 Correlation coefficient of environmental factors from 2014 to 2018 |
根据AIC最小准则,以鱚属鱼类鱼卵丰度为响应变量,采用向前逐步回归,最终选择经纬度交互项、月份、流速、SSS、SST作为解释变量共同构建最优模型(见表 3)。
|
|
表 3 Tweedie-GAM模型变量筛选及影响因子的参数分析 Table 3 The variable screening process for Tweedie-GAM and parameters analysis of influencing factors |
通过计算得出鱚属鱼类鱼卵Tweedie分布中的能效参数P为1.70。该能效参数P介于(1和2)之间,残差服从Tweedie分布。最佳模型及各影响因子的相关参数表明(见表 4),影响黄海中南部鱚属鱼类鱼卵丰度的变量为经纬度交互项、月份、流速、SSS、SST,累积偏差解释率为47.20%,其中偏差解释率最大的因子为经纬度交互项(29.20%),最小为SSS(0.40%)。
|
|
表 4 响应变量分析 Table 4 Analysis on the response variables |
通过交叉验证得到Tweedie-GAM模型的均方根误差为2.410±0.076,其决定系数R2为0.198±0.023。
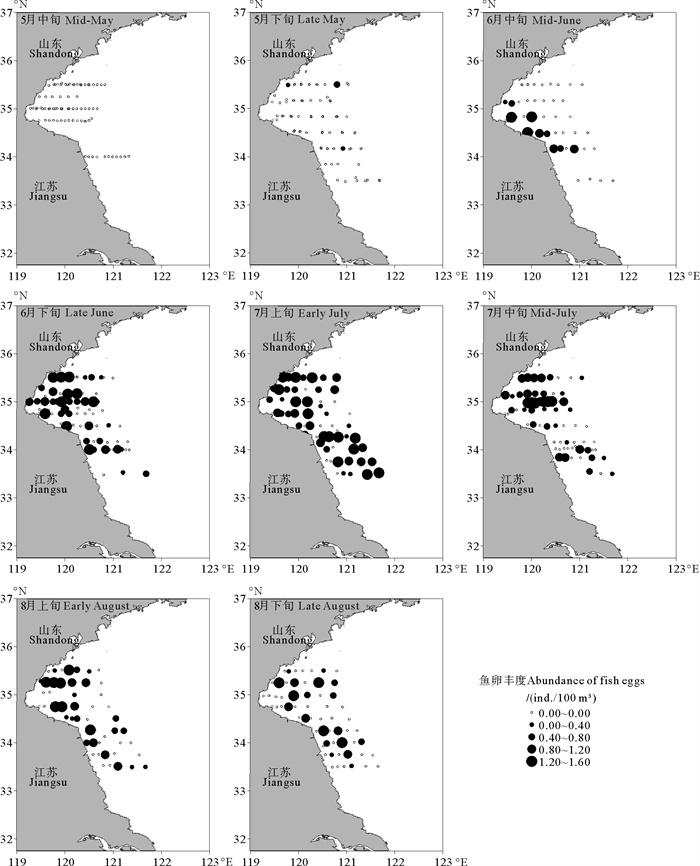
2.3 鱚属鱼类鱼卵丰度的时空分布随着时间推移鱚属鱼类鱼卵丰度的变化如图 2所示。5月中旬未采集到鱼卵,从5月下旬至8月下旬,鱼卵丰度先增加后减少,在7月上旬达到最大值,分布较分散。在产卵期间,鱼卵主要分布在近岸海域。
|
图 2 黄海中南部海域不同月份鱚属鱼类鱼卵丰度的空间分布 Fig. 2 Spatial distribution of abundance of Sillago species eggs in the central and southern Yellow Sea by months |
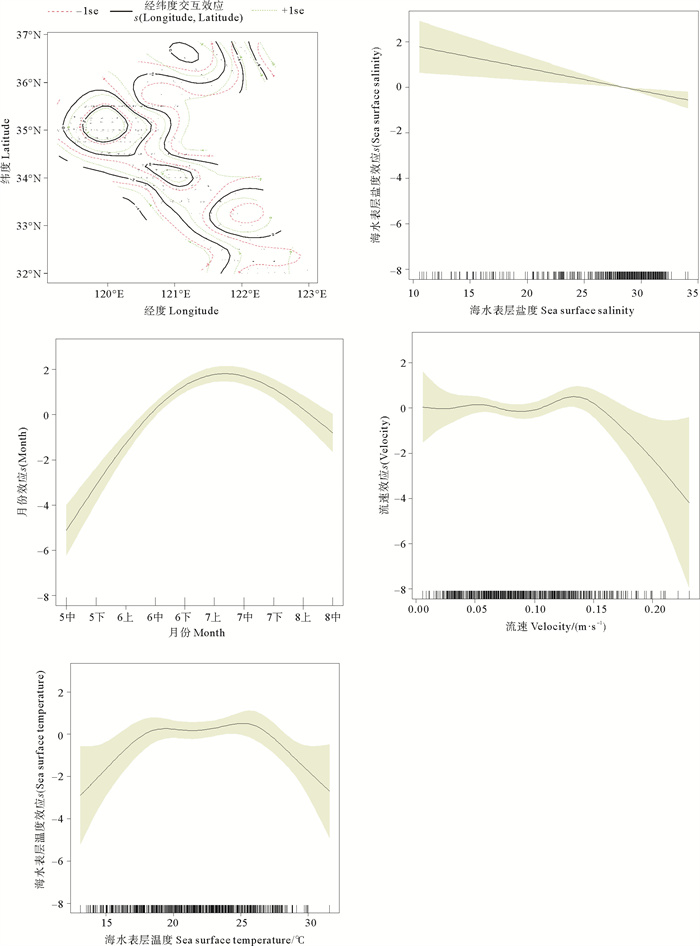
Tweedie-GAM模型结果显示(见图 3),鱚属鱼类鱼卵主要分布在海州湾(34°00′N—36°00′N,119°00′E—121°00′E)。在调查时间范围内,鱼卵的较适宜时间为6月中旬—8月上旬,7月上旬鱼卵分布出现峰值;鱼卵适宜的流速为0.12~0.16 m/s,当流速大于0.16 m/s时,鱼卵丰度随着流速的增大而剧烈下降;其鱼卵集中分布在海水表层盐度为28~33的海域;鱼卵丰度随着海水表层温度的增长呈现先上升后下降的趋势,适宜鱼卵的海水表层温度为23~27 ℃。
|
(-1se:区间下限The lower limited of the interval;+1se:区间上限The upper limited of the interval。) 图 3 不同因子对鱚属鱼类鱼卵丰度的影响 Fig. 3 Effects of different factors on abundance of Sillago species eggs |
本文通过2014—2018年间15个航次的鱼卵调查数据,采用基于Tweedie分布的GAM模型,研究黄海中南部鱚属鱼类鱼卵的时空分布及其主要环境影响因素。当传统GAM模型被用于分析零膨胀的试验数据时,概率密度函数会呈偏态分布,容易导致结果偏离实际[15]。因此,采用Tweedie分布来处理零值较多的情况,更加灵活地对其变量进行分析。本研究中鱼卵数据存在大量零值,Tweedie分布的能效参数为1.70,说明该模型选择合理,可以较好地拟合黄海中南部鱚属鱼类鱼卵的时空分布及其与环境因子的关系。此外值得注意的是,当仅由流速、SSS、SST这三个环境因子构建模型时,其AIC值(5 327.94)高于本研究最优模型的AIC值(5 095.60),累积偏差解释率(23.50%)远低于本研究最优模型的累积偏差解释率(47.20%)(见表 3),这表明空间效应可以提高模型的拟合效果。
黄海中南部鱚属鱼类鱼卵主要分布在海州湾及其邻近海域,其余海域少有分布,其原因可能是海州湾内受到江苏沿岸流、鲁南沿岸流及黄海暖流的控制,形成该海域特有的潮流[19-20]。同时,大量的河川分布带来了丰富的陆源性营养盐,从而形成该海域鱼卵多聚集于沿岸的分布特征[21]。此外,独特的地理位置及环境条件为产卵群体提供了适宜的温度、盐度及丰富的营养盐、饵料生物[5]。该海域所产生的上升流、潮汐锋辐聚作用,为鱼卵的聚集提供了条件[22],为产卵群体繁殖活动提供场所。资料显示鱚属鱼类多栖息于砂质海滩,而海州湾底质以细砂和粗砂为主,地形地貌复杂,为产卵群体提供了理想的产卵环境[23-24]。另一方面,鱚属鱼类产卵群体主要摄食个体较大的多毛类,其次是桡足类、甲壳类[24],结合王晓[21]对海州湾多毛类生物量分布的研究,发现鱼卵密度高值区与多毛类生物资源分布的高值区重叠。季相星等[25]对海州湾底栖生物多样性调查中发现各年度多毛类丰度占比均为最高。可见,海州湾作为产卵场,可为产卵前的成鱼和孵化后的幼鱼提供充足的饵料,有利于幼鱼索饵和生长。同样,Mbaye等[26]发现金色小沙丁鱼(Sardinella aurita)潜在产卵场的季节性变化与浮游生物数量相关,表明饵料生物的分布在一定程度上影响了产卵场的分布。
结合以往对鱚属鱼类鱼卵的众多研究,发现其产卵期大致为春、夏季节,主要集中于6、7月[8, 24, 27],这与本研究发现的鱚属鱼类鱼卵于7月上旬达到高峰期的结果相符。时间对鱼卵丰度的影响可能是生物因素和非生物因素综合作用的结果。在春、夏季,温度、光照强度、冷暖水团、浮游生物的大量繁殖等多因素协同作用形成最适合鱼卵生存的环境。总体而言,时间是一项综合性分析变量,与潮汐、海流、温度等多种因素相关。因此,对于时间与鱼卵丰度的相关研究需要结合更多的调查数据进行综合分析。
了解海洋环境变化对鱼类早期生活史补充动态的驱动机制,一直是预测种群丰度和渔业管理的一个关键问题。流速影响着雌鱼产卵的过程,是鱼卵生存发育的关键因素[28]。鱚属鱼类鱼卵多分布在流速较小的区域,其原因可能是当流速过大时,雌鱼的能量一部分用于产卵繁殖,另一部分还要用于保持游动,从而导致体力过度消耗,不利于产卵活动[29]。适宜的流速可使雌鱼最大化地利用能量进行产卵活动。此外,当流速大于0.16 m/s,鱼卵丰度随着流速增大而减少,其原因有可能是过快的流速会冲散一部分鱼卵,导致鱼卵无法聚集,同时也会对卵粒造成损伤,不利于卵子的受精[4]。水动力学特征与鱼卵的分布紧密联系,可以通过影响鱼卵的分散与聚集,从而间接影响亲体对产卵场的选择[30]。此外,流速可能影响与鱚属鱼类相关的浮游生物、微粒、热量、氧气、营养物质等分布,进而影响鱼卵丰度[31]。
盐度在鱼类繁殖中也发挥着重要作用。盐度会对鱼类的精子活力、孵化率及畸形率等造成影响[31-32]。本研究中适宜鱚属鱼类鱼卵的海水表层盐度为28~33,与以往研究相比[21, 33],该盐度范围较合理。文献[34]指出少鳞鱚鱼卵在盐度为23~38时,孵化率较高。Lee[35]等的研究指出多鳞鱚鱼卵在10.6~38.1均可孵化,且盐度变化对孵化率影响不大,多鳞鱚鱼卵的孵化率高达50%。可见,鱚属鱼类鱼卵对盐度的耐受范围较大。此外,本研究中海水表层盐度偏差解释率较低,鱼卵多分布于28~33的原因可能是其他环境因子对鱼卵分布的限制。
温度对鱼类的新陈代谢、繁殖及洄游分布等有着不同程度的影响,这些综合影响也会直接或间接影响亲体对产卵地点的选择[19, 36]。历史研究表明33 ℃为少鳞鱚的初始致死温度,该温度下雌鱼不能进行产卵活动[37]。此外,随着纬度升高,温度降低,鱚属鱼类产卵群体的产卵月份也相对延迟[10]。可见,鱚属鱼类产卵群体对温度的响应较敏感,其产卵活动和产卵时间均受到温度的影响,而适宜的温度可为成体性腺的发育和鱼卵的孵化提供有利条件。王晓[21]研究发现,适宜多鳞鱚鱼卵的海水表层温度为23.60~25.89 ℃。Gao[33]等的研究指出少鳞鱚鱼卵孵化温度大致为22~27 ℃。本研究中,适宜鱚属鱼类鱼卵的海水表层温度为23~27 ℃,与前人研究的结果相差不大。
4 结语本研究基于2014—2018年5—8月黄海中南部鱼卵的调查数据,应用Tweedie-GAM模型分析了鱚属鱼类鱼卵的时空分布特征及其与环境因子的关系。研究结果表明,鱚属鱼类鱼卵主要分布在海州湾及其邻近海域。产卵期为6月中旬至8月上旬,7月上旬鱼卵数达到峰值。鱚属鱼类鱼卵的时空分布受到经纬度、月份、流速、海水表层温度以及海水表层盐度的影响。除了环境因子的影响以外,饵料生物以及其他竞争物种的分布也会对鱚属鱼类鱼卵的分布产生较大影响。今后的研究中,应综合考虑重要因素的影响,以期更全面深入地分析鱚属鱼类鱼卵的时空分布特征, 为鱚属鱼类资源的合理利用提供基础资料。
| [1] |
郭炳火, 黄振宗, 刘广远, 等. 中国近海及邻近海域海洋环境[M]. 北京: 海洋出版社, 2004. Guo B H, Huang Z Z, Liu G Y, et al. Marine Environment in China's Offshore and Adjacent Seas[M]. Beijing: Ocean Press, 2004. (  0) 0) |
| [2] |
陆尧. 粤西海域主要经济鱼类产卵场时空分布的环境效应研究[D]. 上海: 上海海洋大学, 2020. Lu Y. Environmental Effects of Spatial-Temporal Distribution of Spawning Ground of Major Economic Fishes in the Western Guandong Waters, South China Sea[D]. Shanghai: Shanghai Ocean University, 2020. (  0) 0) |
| [3] |
张云雷, 孙霄, 刘晓慧, 等. 气候变化对黄海中南部斑鰶产卵场适宜性的影响[J]. 水产学报, 2022, 46(2): 215-223. Zhang Y L, Sun X, Liu X H, et al. Impacts of climate changes on the habitat suitability of spawning ground for Konosirus punctatus in the central and southern Yellow Sea[J]. Journal of Fisheries of China, 2022, 46(2): 215-223. (  0) 0) |
| [4] |
孙霄, 张云雷, 徐宾铎, 等. 海州湾及邻近海域短吻红舌鳎产卵场的生境适宜性[J]. 中国水产科学, 2020, 27(12): 1505-1514. Sun X, Zhang Y L, Xu B D, et al. Habitat suitability of spawning ground of Cynoglossus joyneri in Haizhou Bay and adjacent waters[J]. Journal of Fishery Sciences of China, 2020, 27(12): 1505-1514. (  0) 0) |
| [5] |
肖家光, 张少秋, 高天翔, 等. 浙江近海鱚属鱼类形态描述及中国鱚属鱼类分子系统发育分析[J]. 水生生物学报, 2018, 42(1): 99-105. Xiao J G, Zhang S Q, Gao T X, et al. Morphological description of Sillago species in the coastal waters of Zhejiang and phylogenetic analysis of Sillago species in China[J]. Acta Hydrobiologica Sinica, 2018, 42(1): 99-105. (  0) 0) |
| [6] |
周银环, 黄海立, 杜涛, 等. 多鳞鱚幼鱼盐度适应性研究[J]. 渔业研究, 2017, 39(1): 22-26. Zhou Y H, Huang H L, Du T, et al. Study on adaptability of juvenile of Sillago sihama to salinity[J]. Journal of Fisheries Research, 2017, 39(1): 22-26. (  0) 0) |
| [7] |
肖家光. 基于线粒体基因组全序列的鱚属鱼类系统发育研究[D]. 青岛: 中国海洋大学, 2015. Xiao J G. The Complete Mitochondrial Genomes and Phylogenetic Analysis of Sillago Species[D]. Qingdao: Ocean University of China, 2015. (  0) 0) |
| [8] |
黄洋, 杜涛, 黄海立. 多鳞鱚(Sillago sihama Forskál)人工繁殖研究[J]. 广东海洋大学学报, 2013, 33(1): 15-21. Huang Y, Du T, Huang H L. A study on artificial breeding of Sillago sihama Forskál[J]. Journal of Guangdong Ocean University, 2013, 33(1): 15-21. (  0) 0) |
| [9] |
Gunn J S, Milward N E. The food, feeding habits and feeding structures of the whiting species Sillago sihama (Forsskål) and Sillago analis Whitley from Townsville, North Queensland, Australia[J]. Journal of Fish Biology, 1985, 26(4): 411-427. DOI:10.1111/j.1095-8649.1985.tb04281.x (  0) 0) |
| [10] |
万瑞景, 姜言伟. 渤黄海硬骨鱼类鱼卵与仔稚鱼种类组成及其生物学特征[J]. 上海水产大学学报, 2000(4): 290-297. Wan R J, Jiang Y W. The species and biological characteristics of the eggs and larvae of osteichthyes in The Bohai Sea and Yellow Sea[J]. Journal of Shanghai Fishery University, 2000(4): 290-297. (  0) 0) |
| [11] |
Lou F R, Zhang Y, Song N, et al. Comprehensive transcriptome analysis reveals insights into phylogeny and positively selected genes of Sillago species[J]. Animals, 2020, 10(4): 633. (  0) 0) |
| [12] |
Hastie T, Tibshirani R. Generalized additive models for medical research[J]. Statistical Methods in Medical Research, 1995, 4(3): 187-196. (  0) 0) |
| [13] |
Shono H. Application of the Tweedie distribution to zero-catch data in CPUE analysis[J]. Fisheries Research, 2008, 93(1-2): 154-162. (  0) 0) |
| [14] |
王浩展, 戴小杰, 官文江, 等. 基于Tweedie-GAM模型的热带大西洋拟锥齿鲨单位捕捞努力量渔获量与环境因子的关系[J]. 应用生态学报, 2017, 28(6): 2024-2032. Wang H Z, Dai X J, Guan W J, et al. Relationship between the environmental factors and the CPUE (catch per unit effort) of Pseudocarcharias kamoharai in tropical Atlantic Ocean based on the GAM-Tweedie model[J]. Chinese Journal of Applied Ecology, 2017, 28(6): 2024-2032. (  0) 0) |
| [15] |
张云雷, 徐宾铎, 张崇良, 等. 基于Tweedie-GAM模型研究海州湾小黄鱼资源丰度与栖息环境的关系[J]. 海洋学报, 2019, 41(12): 78-89. Zhang Y L, Xu B D, Zhang C L, et al. Relationship between the habitat factors and the abundance of small yellow croaker (Larimichthys polyactis) in Haizhou Bay based on the Tweedie-GAM model[J]. Haiyang Xuebao, 2019, 41(12): 78-89. (  0) 0) |
| [16] |
肖欢欢, 张崇良, 徐宾铎, 等. 黄海中南部近岸海域春季鱼类浮游生物群落空间格局研究[J]. 海洋学报, 2017, 39(8): 34-47. Xiao H H, Zhang C L, Xu B D, et al. Spatial pattern of ichthyoplankton assemblage in the coastal waters of central and southern Yellow Sea in the spring[J]. Haiyang Xuebao, 2017, 39(8): 34-47. (  0) 0) |
| [17] |
Xing Q W, Yu H M, Yu H Q, et al. A comprehensive model-based index for identification of larval retention areas: A case study for Japanese anchovy Engraulis japonicus in the Yellow Sea[J]. Ecological Indicators, 2020, 116: 106479. (  0) 0) |
| [18] |
Chen C, Beardsley R C, Cowles G, et al. An Unstructured-grid, Finite-Volume Community Ocean Model: FVCOM User Manual[M]. Cambridge, MA, USA: Sea Grant College Program, Massachusetts Institute of Technology, 2012.
(  0) 0) |
| [19] |
万荣, 张同征, 李增光, 等. 黄海近岸海域短吻红舌鳎夏季产卵场的空间分布及其年际变化[J]. 应用生态学报, 2020, 31(3): 1023-1032. Wan R, Zhang T Z, Li Z G, et al. Spatial distribution and inter-annual variability of spawning grounds of Cynoglossus joyneri in the Yellow Sea coastal waters in summer[J]. Chinese Journal of Applied Ecology, 2020, 31(3): 1023-1032. (  0) 0) |
| [20] |
Park K A, Park J E, Choi B J, et al. An analysis of oceanic current maps of the Yellow Sea and the East China Sea in secondary school science textbooks[J]. Journal of the Korean Earth Science Society, 2014, 35(6): 439-466. (  0) 0) |
| [21] |
王晓. 南黄海浮游动物群落及环境因子对其分布影响的研究[D]. 青岛: 中国海洋大学, 2012. Wang X. Studies on Zooplankton Community and the Effects of Environmental Factors on Its Distribution in the Southern Yellow Sea[D]. Qingdao: Ocean University of China, 2012. (  0) 0) |
| [22] |
李增光. 基于GAM模型的南黄海帆张网主要渔获物分布及海州湾鱼卵、仔稚鱼集群特征的初步研究[D]. 青岛: 中国海洋大学, 2013. Li Z G. Distribution of Main Species of Stow Net in the Southern Yellow Sea Based on GAM and Preliminary Study of Characteristics of Ichthyoplankton Assemblages in Haizhou Bay[D]. Qing-dao: Ocean University of China, 2013. (  0) 0) |
| [23] |
Jaafar Z, Hajisamae S, Chou L M, et al. Community structure of coastal fishes in relation to heavily impacted human modified habitats[J]. Hydrobiologia, 2004, 511(1): 113-123. (  0) 0) |
| [24] |
薛泰强. 鱚科几种鱼类的形态学及遗传学研究[D]. 青岛: 中国海洋大学, 2010. Xue T Q. Study on Morphology and Genetics of Some Sillaginidae Species[D]. Qingdao: Ocean University of China, 2015. (  0) 0) |
| [25] |
季相星, 仲维斌, 王统旺. 2015-2018年春季海州湾大型底栖动物多样性研究[J]. 能源与环境, 2021(1): 78-79. Ji X X, Zhong W B, Wang T W. Study on the diversity of macrobenthos in Haizhou Bay in the spring of 2015-2018[J]. Energy and Environment, 2021(1): 78-79. (  0) 0) |
| [26] |
Mbaye B C, Brochier T, Echevin V, et al. Do Sardinella aurita spawning seasons match local retention patterns in the Senegalese-Mauritanian upwelling region[J]. Fisheries Oceanography, 2015, 24(1): 69-89. (  0) 0) |
| [27] |
Zhang Z X, Xu S Y, Capinha C, et al. Using species distribution model to predict the impact of climate change on the potential distribution of Japanese whiting Sillago japonica[J]. Ecological Indicators, 2019, 104: 333-340. (  0) 0) |
| [28] |
Chen Q, Zhang J, Chen Y, et al. Inducing flow velocities to manage fish reproduction in regulated rivers[J]. Engineering, 2021, 7(2): 178-186. (  0) 0) |
| [29] |
Garcia T, Murphy E A, Jackson P R, et al. Application of the FluEgg model to predict transport of Asian carp eggs in the Saint Joseph River (Great Lakes tributary)[J]. Journal of Great Lakes Research, 2015, 41(2): 374-386. (  0) 0) |
| [30] |
Nataniel A, Lopez J, Soto M. Modelling seasonal environmental preferences of tropical tuna purse seine fisheries in the Mozambique Channel[J]. Fisheries Research, 2021, 243: 106073. (  0) 0) |
| [31] |
徐敏. 盐碱度对3种鱼精子活力、受精率及孵化率的影响[D]. 上海: 上海海洋大学, 2015. Xu M. Effects of Salinity and Alkalinity on Sperm Motility, Fertilization Rate and Hatching Rate of 3 Fish Species[D]. Shanghai: Shanghai Ocean University, 2015. (  0) 0) |
| [32] |
王云峰, 朱鑫华. 盐度对鱼类生态生理学特征的影响[J]. 海洋科学集刊, 2002, 44: 151-158. Wang Y F, Zhu X H. A review on impact of salinity on patterns of fish ecophysiology[J]. Studia Marina Sinica, 2002, 44: 151-158. (  0) 0) |
| [33] |
Gao T X, Yang T Y, Yanagimoto T, et al. Levels and patterns of genetic variation in Japanese whiting (Sillago japonica) based on mitochondrial DNA control region[J]. Mitochondrial DNA Part A, 2019, 30(1): 172-183. (  0) 0) |
| [34] |
Kashiwagi M, Kondo S, Yoshida W, et al. Effects of temperature and salinity on hatching success of Japanese whiting Sillago japonica eggs[J]. Aquaculture Science, 2000, 48(4): 637-642. (  0) 0) |
| [35] |
Lee C S, Hu F, Hirano R. Salinity tolerance of fertilized eggs and larval survival in the fish Sillago sihama[J]. Marine Ecology Progress Series, 1981, 4: 169-174. (  0) 0) |
| [36] |
李雪渡. 海水温度与渔场之间的关系[J]. 海洋学报, 1982, 4(1): 103-113. Li X D. Studies on the correlation between the temperature of sea water and fishing grounds[J]. Acta Oceanologica Sinica, 1982, 4(1): 103-113. (  0) 0) |
| [37] |
Hotta K, Tamura M, Watanabe T, et al. Changes in spawning characteristics of Japanese whiting Sillago japonica under control of temperature[J]. Fisheries Science, 2001, 67(6): 1111-1118. (  0) 0) |
2. Field Observation and Research Station of Haizhou Bay Fishery Ecosystem, Ministry of Education, Qingdao 266003, China;
3. Fishery Administration Supervision and Management Station of Rizhao Shanhaitian Tourist Resort, Rizhao 276800, China;
4. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China
 2022, Vol. 52
2022, Vol. 52


