2. 海洋渔业科学与食物产出过程功能实验室,山东 青岛266071
SOX(SRY-related HMG-box)基因家族是一类SRY(Sex determination region of Y chromosome)相关基因构成的基因超家族。首个发现的SOX基因家族成员是SRY[1]基因,位于哺乳动物的Y染色体上,它含有一个编码79个氨基酸并能与DNA特异性识别和结合的高度保守区域——HMG(High mobility group)盒。所有的SOX基因家族成员都含有这个HMG盒,并且与SRY的HMG盒有至少50%的同源性[2]。目前,根据Bowles等提出的以HMG盒的相似性定义SOX基因的标准,将SOX基因分为A-K 11个亚族[2-4]。SOX基因家族是一类核转录因子,广泛参与了动物的早期胚胎发育过程,包括神经发育[5-8]、骨组织发育[9]、性别决定和分化[10-12]等。
从以往来看,性别决定和分化一直都是SOX基因研究的经典领域,相关的SOX基因有SOX6、SOX9和SOXH等。其中SOXH是SOX基因家族H亚族的唯一成员,在某些物种中也称SOX30。在人和小鼠中,SOX30特异性表达中于睾丸的生殖细胞中,被认为可能在精原细胞的分化和精子的形成过程中起关键作用[13-14]。SOXH曾一度被认为是高等脊椎动物所特有,直到2010年Han等[15]在罗非鱼(Oreochromis niloticus)中将SOX30克隆出来,相继Zhang等[12]又在牡蛎(Crassostrea gigas)中鉴定出Cg-SOX30。但关于无脊椎动物SOXH的功能,目前还缺乏深入的研究。
虾夷扇贝(Patinopecten yessoensis)原产于日本北海道北部和俄罗斯千岛群岛的南部,1982年从日本引进中国以来,经多年的养殖推广,近10年来创造了数十亿元的产值,已成为中国北方最重要的海水养殖贝类之一[16]。大量与虾夷扇贝免疫、繁殖、生长等重要经济性状相关的功能基因被克隆[17-19],多个虾夷扇贝的转录组被报道[20-22]。近期,虾夷扇贝基因组序列图谱完成,更是为贝类功能基因的研究提供了新的契机。本研究将以虾夷扇贝基因组和转录组数据为基础,研究SOXH不同剪接形式在成体性腺及胚胎幼虫发育中的表达情况,为深入解析无脊椎动物SOXH的功能提供基础信息。
1 材料与方法 1.1 材料获取和保存实验样本采自大连市獐子岛渔业集团有限公司,通过为期一年的跟踪取材,获得了虾夷扇贝休止期、增殖期、生长期和成熟期的性腺组织材料,每个时期各取2份样品。一份通过液氮固定后装于冻存管中,在-80℃冰箱中保存备用;另一份经4%的多聚甲醛固定后,置于甲醇中-20℃长期保存。胚胎材料取自虾夷扇贝育苗期间,通过人工促熟产卵、受精和幼虫养殖的方式获得了卵、受精卵、多细胞期、囊胚期、原肠胚期、担轮幼虫、D型幼虫、匍匐幼虫的实验材料。
1.2 SOXH基因及不同剪接形式的鉴定从NCBI下载人、小鼠、爪蟾和果蝇的SOX蛋白序列,通过SMART分析获得这些基因的HMG结构域。将人的SOXH的HMG蛋白序列通过TBLASTN与虾夷扇贝的基因组进行比对,e值设定为1e-10,筛查虾夷扇贝SOXH候选基因;
通过MEGA7.0软件,对不同物种SOX蛋白的HMG结构域构建系统发生树,确定虾夷扇贝SOXH基因。系统发生树采用NJ(Neighbor-Joining)法构建,Bootstrap值设定为1 000;
将鉴定得到的SOXH基因序列与虾夷扇贝性腺转录组数据库[22]进行BLASTN比对,e值设定为1e-10,鉴定SOXH的不同剪接形式。
1.3 性腺的组织学鉴定利用常规的石蜡切片方法对不同发育时期的性腺组织进行固定、脱水、透明、浸蜡和包埋、切片和染色。然后在光学显微镜下进行观察,通过滤泡和生殖细胞的形态特征鉴定性腺的性别及所处发育时期。
1.4 总RNA提取和cDNA合成采用传统的酚氯仿抽提方法,对鉴定的休止期、增殖期、生长期和成熟期雌雄性腺以及胚胎幼虫材料进行RNA提取。通过Nanovue Plus分光光度计进行浓度和纯度的测定,电泳检测总RNA完整性。随即用MMLV(Moloney murine leukemia virus)反转录酶进行第一链cDNA的合成,最终每个样品稀释到50 Mg/mL,用于qRT-PCR分析。
1.5 实时定量PCR利用Primer Premier 5.0进行引物设计,获得各剪接形式特异性的引物(见表 1)。用于胚胎幼虫时期和性腺组织荧光定量PCR分析的内参基因分别为cytochrome B (CB)[23]和elongation factor 1-alpha (EF1A)[22],所有引物由上海生工合成。通过对5个系列梯度稀释样品进行扩增,构建标准曲线,获得引物的扩增效率。仪器和试剂分别采用罗氏公司的480荧光定量PCR仪和Fast Start Universal SYBR Green Master。PCR反应程序如下:94 ℃/10 min;94 ℃/15 s,58 ℃/1 min,72 ℃/30 s,共40个循环。反应结束后,温度由94~55 ℃缓慢降低,连续采集荧光信号并获取熔解曲线,根据峰值是否单一判断引物的特异性。生物学重复和技术重复各3次,相对表达量的计算采用2-ΔΔCt方法,数据在SPSS软件(版本21.0)上进行独立样本T检验,显著性P值< 0.05。成熟期精巢中SOXH不同剪接形式的表达偏好性通过如下方法计算获得:在每个精巢样品中,将SOXH1、SOXH2和SOXH3的表达量求和,分别将各个剪接形式的表达量与总和求比值,获得各个剪接形式表达量的相对百分比。
|
|
表 1 实时定量PCR引物 Table 1 Primers for quantitative real-time PCR |
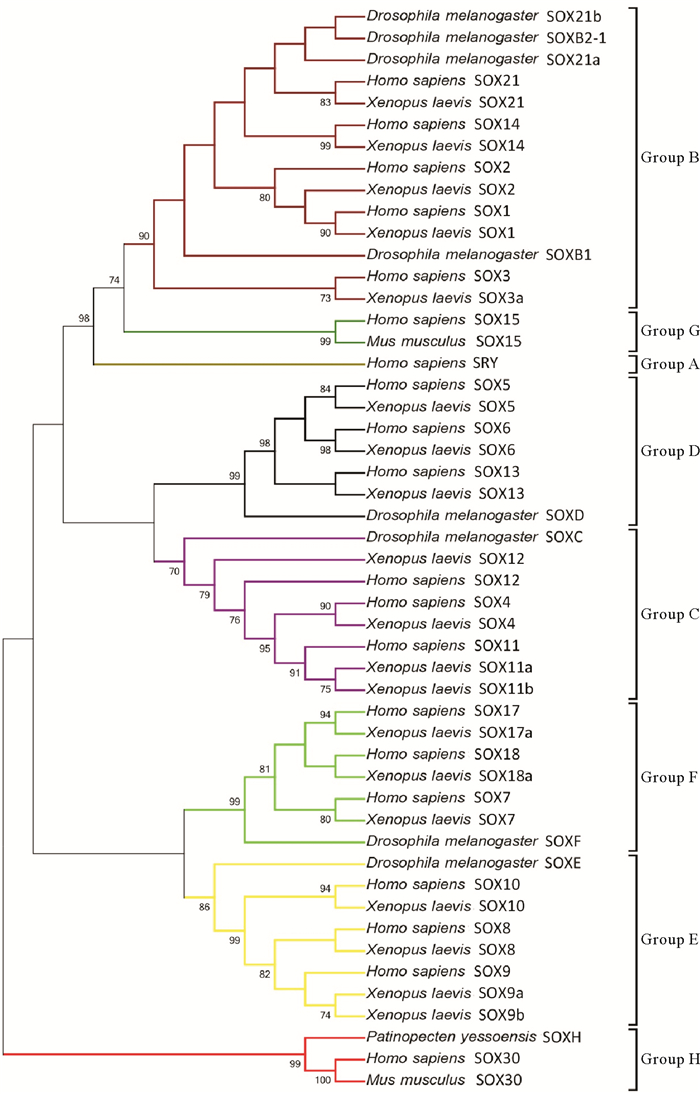
基于虾夷扇贝基因组和转录组数据信息,将人SOXH基因的HMG序列为探针,在本地服务器与虾夷扇贝基因组进行同源性比对,筛选得到SOXH候选基因,通过系统发生分析(见图 1),发现其与人和小鼠的SOX30聚在一支,支持度达到99,验证该候选基因即为虾夷扇贝的SOXH。
|
(通过SMART在线结构域预测软件提取SOX基因的HMG序列,在MEGA7.0中采用NJ方法构建系统发生树,物种包括人(Homo sapiens),小鼠(Mus musculus),果蝇(Drosophila melanogaster)、非洲爪蟾(Xenopus laevis)和虾夷扇贝(Patinopecten yessoensis). HMG domain was predicted by the SMART online domain-predicting program. The tree was built by the neighbor-joining (NJ) method provided by MEGA 7.0. Species include human (Homo sapiens), mouse (Mus musculus), fruit fly (Drosophila melanogaster), African clawed frog (Xenopus laevis) and Yesso scallop (Patinopecten yessoensis).) 图 1 虾夷扇贝SOXH系统发生分析图 Fig. 1 Phylogenetic tree of the Patinopecten yessoensis SOXH |
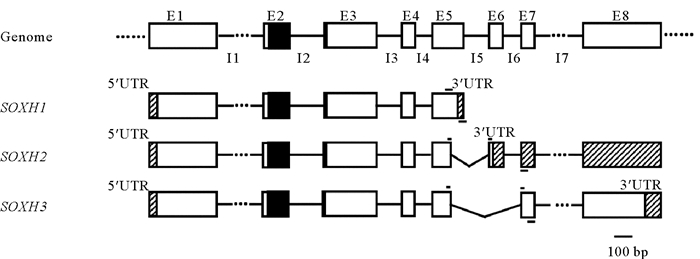
将已鉴定的SOXH与性腺转录组数据比对,最终鉴定出SOXH有3种剪接形式,分别是SOXH1、SOXH2和SOXH3。如表 2所示,SOXH3的cDNA的片段最长,编码氨基酸数目最多,有7个外显子,次之是SOXH2和SOXH1。详细的剪接方式见图 2。3种剪接方式都具有完整的HMG盒,剪接方式的差异部分从第5个外显子开始。与基因组序列相比,SOXH1的E6、E7和E8三个外显子被剪接掉,位于E5的3'UTR区在三者之中最短;SOXH2的E5外显子的末端部分被剪接掉,它的3'UTR区最长,从E6的前半部分开始直到序列尾部;SOXH3的被剪接部分既有与SOXH2相同的E5末端,还有整个E6,3'UTR区长度居于三者之间,在E8的尾部。
|
|
表 2 虾夷扇贝SOXH三种剪接形式的基本信息 Table 2 Basic information of the three splicing patterns of scallop SOXH |
|
(矩形表示外显子(E),实线或虚线表示内含子(I),黑色部分表示HMG盒,阴影部分表示UTR区,外显子上下方的短实线表示引物位置,其中SOXH2和SOXH3的正向引物跨越外显子边界。Rectangle indicates exon (E), solid or dotted lines indicate intron (I), black region indicates HMG-box, shadow region indicates UTR, short lines above or under the exon indicate the position of primers. Note forward primers of SOXH2 and SOXH3 locate at exon-exon junction.) 图 2 SOXH三种剪接形式示意图 Fig. 2 Schematic diagram of three splicing patterns of SOXH |
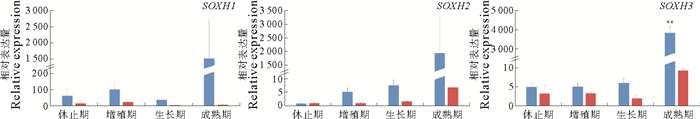
为了研究不同剪接形式在扇贝性腺发育中的功能,本研究检测了休止期、增殖期、生长期和成熟期精巢和卵巢中SOXH1、SOXH2和SOXH3的表达模式,结果见图 3。SOXH的3种剪接形式在性腺中的表达模式相似,即在精巢成熟期高表达,其他3个时期表达量较低;而在卵巢中,4个发育时期表达量均较低。
|
(红色表示卵巢,蓝色表示精巢。显著性差异:* P < 0.05,** P < 0.01,*** P < 0.001。Red bars represent ovary, blue bars represent testis. Significant difference: * P < 0.05, ** P < 0.01, *** P < 0.001.) 图 3 SOXH三种剪接形式在不同发育时期的精巢和卵巢的表达模式图 Fig. 3 Expression profiles of the three splicing patterns of SOXH in testes and ovaries of different developmental stages |
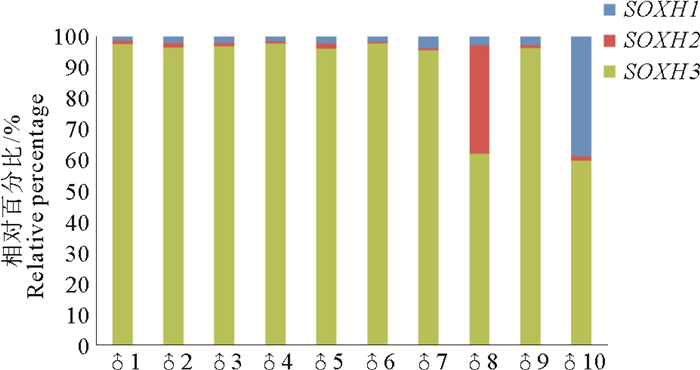
为进一步分析成熟期精巢中SOXH1、SOXH2和SOXH3表达是否存在偏好性,本研究选取10个成熟期精巢样品,进行表达模式的偏好性分析,结果如图 4所示。在检测的10个精巢组织中,SOXH3的表达量一致较高,占三者表达总量的60%以上,其中有8个精巢组织在90%以上;而SOXH2和SOXH1的表达量普遍较低,各有一个精巢组织的表达量相对百分比在30%以上。
|
(蓝色代表SOXH1,红色代表SOXH2,绿色代表SOXH3。Blue, red and green bars represent SOXH1, SOXH2 and SOXH3, respectively.) 图 4 SOXH的3种剪接形式在10个成熟期精巢的相对表达量示意图 Fig. 4 Relative expression of the three splicing patterns of SOXH in ten mature testes |
选取虾夷扇贝从卵到匍匐幼虫共11个胚胎发育时期,分析SOXH的3种剪接形式的表达情况。如图 5所示,在早期发育过程中,SOXH1、SOXH2和SOXH3呈现出不同的表达模式。SOXH1的表达出现在卵、受精卵,以及担轮幼虫之后的各个时期,在壳顶中期表达水平最高;从卵发育到壳顶幼虫后期,SOXH2基本不表达,仅在匍匐幼虫期有明显的上调表达;SOXH3的表达有两个明显的峰值,分别出现在原肠期和壳顶幼虫后期-匍匐幼虫。在多细胞期和囊胚期,三种剪接形式的表达量都很低。
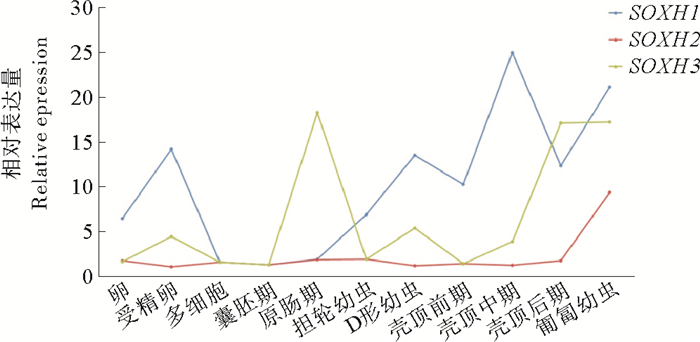
|
(蓝色代表SOXH1,红色代表SOXH2,绿色代表SOXH3 Blue line indicates SOXH1, red line indicates SOXH2, green line indicates SOXH3.卵:Docytes; 受精卵:Fertilized eggs;多细胞:Morulae; 囊胚期:Blastulae; 原肠期:Gastrulae; 担轮幼虫:Trochophores; D形幼虫:D-shaped larvae; 壳顶前期:Early umboperiod.壳顶中期:middle umbo period; 壳顶后期:Find umbo period; 匍匐幼虫:Creeping larvae.) 图 5 SOXH三种剪接形式在早期胚胎幼虫发育阶段的表达情况 Fig. 5 Expression profiles of the three splicing patterns of SOXH in early developmental stages |
前体mRNA的选择性剪接越来越多的被认为是调控基因表达的重要机制,以往的研究表明,人体内超过半数以上的基因都能进行选择性剪接,作用范围涉及到多种生理发育过程和疾病发生等[24]。一段前体mRNA通过不同的剪接方式可以形成多种mRNA,进而翻译出不同的蛋白产物,执行不同的生物学功能。
关于SOX基因具有不同剪接形式的报道并不鲜见,Kanai等在小鼠的精巢中发现了SOX17的两种剪接形式,分别是SOX17和t-SOX17,随着小鼠的精子发生,两种亚型之间的转换暗示了它们可能具有不同调控机制[25];而Takase等在粗皮蛙的精巢中鉴定出SOX9 α和SOX9 β,两种亚型在成体蛙不同组织中的表达量存在差异,尤其是在脑和精巢中[26]。
关于SOXH不同剪接方式的研究,韩飞等[27]在罗非鱼中鉴定出4种亚型的mRNA,分别是、Ⅲ和Ⅵ。除AS-Ⅰ和Ⅱ外,其他两种亚型的的HMG结构域都有缺失,并且它们在精巢和卵巢中表达模式也有很大差异。本研究在虾夷扇贝中共鉴定出3种SOXH的剪接亚型,发生剪接的部分都在HMG结构域之外,位于mRNA的3'端,从第五个外显子开始,通过切除或缺失部分外显子形成。SOXH1由可选择的终止外显子剪接方式获得,3'端的E6、E7和E8全部被剪切,终止密码子在E5上;SOXH2由可选择5'位点剪接方式获得,部分E5被剪切,导致移码突变,终止密码子后移至E6上;而SOXH3则是通过可选择5'位点和外显子跳跃的两种复合剪接方式获得,丢失部分E5和整个E6,同样导致移码突变,将终止密码子后移至E8,并获得最长的翻译区。
虾夷扇贝SOXH的3种剪接亚型都高表达于精巢,而在卵巢中的表达量均较低,这种表达模式与罗非鱼SOXH部分亚型的表达模式相似。比如罗非鱼SOXH的AS-Ⅱ和AS-Ⅲ都只在精巢中特异性表达。与罗非鱼不同的是,虾夷扇贝中没有检测到在卵巢中表达水平高于精巢的亚型,而在罗非鱼中,AS-Ⅵ亚型在卵巢的表达水平则高于精巢。出现这种差异表达模式的原因可能与2个物种SOXH剪接方式的不同有关:罗非鱼AS-Ⅵ亚型的HMG结构域全部被剪切,而虾夷扇贝SOXH3种亚型的剪切部分并不涉及HMG结构域。
虽然虾夷扇贝SOXH的3种剪接亚型在成体性腺中的表达模式较为一致,但是细究它们在精巢成熟期的表达方式,还是存在主次之分,SOXH3是主要的剪接亚型。从三者的基因结构来看,SOXH3编码的氨基酸数目最多,而SOXH1和SOXH2则提前终止,这对蛋白质结构和功能可能造成一定的影响,这是否与虾夷扇贝对三种亚型的偏好有关,有待进一步探究。另外,三种亚型在胚胎幼虫早期发育中的表达模式有明显差异,暗示了它们可能在不同发育时期执行不同的功能,其中SOXH1在大部分时期居高,可能在胚胎幼虫发育中有着重要的作用。上述研究表明虾夷扇贝SOXH的3种剪接形式可能不同程度地参与早期发育和精子发生过程,其具体的功能以及分子机制还需进一步探究。
| [1] |
Gubbay J, Collignon J, Koopman P, et al. A gene mapping to the sex-determining region of the mouse Y chromosome is a member of a novel family of embryonically expressed genes[J]. Nature, 1990, 346(6281): 245-250. DOI:10.1038/346245a0
(  0) 0) |
| [2] |
Bowles J, Schepers G, Koopman P. Phylogeny of the SOX family of developmental transcription factors based on sequence and structural indicators[J]. Developmental Biology, 2000, 227(2): 239-255. DOI:10.1006/dbio.2000.9883
(  0) 0) |
| [3] |
Cui J, Shen X, Zhao H, et al. Genome-wide analysis of Sox genes in Medaka (Oryzias latipes) and their expression pattern in embryonic development[J]. Cytogenetic and Genome Research, 2011, 134(4): 283-294. DOI:10.1159/000329480
(  0) 0) |
| [4] |
Koopman P, Schepers G, Brenner S, et al. Origin and diversity of the SOX transcription factor gene family: Genome-wide analysis in Fugu rubripes[J]. Gene, 2004, 328: 177-186. DOI:10.1016/j.gene.2003.12.008
(  0) 0) |
| [5] |
Hong C S, Saint-Jeannet J P. Sox proteins and neural crest development[J]. Seminars in Cell & Developmental Biology, 2005, 49(4): 694-703.
(  0) 0) |
| [6] |
O′Donnell M, Hong C S, Huang X, et al. Functional analysis of Sox8 during neural crest development in Xenopus[J]. Development, 2006, 133(19): 3817-3826. DOI:10.1242/dev.02558
(  0) 0) |
| [7] |
Pevny LH, Nicolis SK. Sox2 roles in neural stem cells[J]. The International Journal of Biochemistry & Cell Biology, 2010, 42(3): 421-424.
(  0) 0) |
| [8] |
Tanaka S, Kamachi Y, Tanouchi A, et al. Interplay of SOX and POU factors in regulation of the Nestin gene in neural primordial cells[J]. Molecular and Cellular Biology, 2004, 24(20): 8834-8846. DOI:10.1128/MCB.24.20.8834-8846.2004
(  0) 0) |
| [9] |
Bi W, Deng J M, Zhang Z, et al. Sox9 is required for cartilage formation[J]. Nature Genetics, 1999, 22(1): 85-89. DOI:10.1038/8792
(  0) 0) |
| [10] |
Bishop C E, Whitworth D J, Qin Y, et al. A transgenic insertion upstream of sox9 is associated with dominant XX sex reversal in the mouse[J]. Nature Genetics, 2000, 26(4): 490-494. DOI:10.1038/82652
(  0) 0) |
| [11] |
Chaboissier M-C, Kobayashi A, Vidal V I, et al. Functional analysis of Sox8 and Sox9 during sex determination in the mouse[J]. Development, 2004, 131(9): 1891-901. DOI:10.1242/dev.01087
(  0) 0) |
| [12] |
Zhang N, Xu F, Guo X. Genomic analysis of the Pacific oyster (Crassostrea gigas) reveals possible conservation of vertebrate sex determination in a mollusc[J]. G3: Genes Genomes Genetics, 2014, 4(11): 2207-2217.
(  0) 0) |
| [13] |
Osaki E, Nishina Y, Inazawa J, et al. Identification of a novel Sry-related gene and its germ cell-specific expression[J]. Nucleic Acids Research, 1999, 27(12): 2503-2510. DOI:10.1093/nar/27.12.2503
(  0) 0) |
| [14] |
Ballow D, Meistrich M, Matzuk M, et al. Sohlh1 is essential for spermatogonial differentiation[J]. Developmental Biology, 2006, 294(1): 161-167. DOI:10.1016/j.ydbio.2006.02.027
(  0) 0) |
| [15] |
Han F, Wang Z, Wu F, et al. Characterization, phylogeny, alternative splicing and expression of Sox30 gene[J]. BMC Molecular Biology, 2010, 11(1): 1. DOI:10.1186/1471-2199-11-1
(  0) 0) |
| [16] |
傅强. 虾夷扇贝(Patinopecten yessoensis)近交衰退的生物学效应及遗传机理研究[D]. 青岛: 中国海洋大学, 2014. Fu Q. Biological Effects and Genetic Mechanism of Inbreeding Depression in Japanese Scallop(Patinopecten yessoensis)[D]. Qingdao: Ocean university of China, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10423-1014369090.htm (  0) 0) |
| [17] |
Zhang Y, Zhang R, Zou J, et al. Identification and characterization of four ferritin subunits involved in immune defense of the Yesso scallop (Patinopecten yessoensis)[J]. Fish & Shellfish Immunology, 2013, 34(5): 1178-1187.
(  0) 0) |
| [18] |
Tanabe T, Yuan Y, Nakamura S, et al. The role in spawning of a putative serotonin receptor isolated from the germ and ciliary cells of the gonoduct in the gonad of the Japanese scallop, Patinopecten yessoensis[J]. General and Comparative Endocrinology, 2010, 166(3): 620-627. DOI:10.1016/j.ygcen.2010.01.014
(  0) 0) |
| [19] |
Feng L, Li X, Yu Q, et al. A scallop IGF binding protein gene: Molecular characterization and association of variants with growth traits[J]. PloS One, 2014, 9(2): e89039. DOI:10.1371/journal.pone.0089039
(  0) 0) |
| [20] |
Hou R, Bao Z, Wang S, et al. Transcriptome sequencing and de novo analysis for Yesso scallop (Patinopecten yessoensis) using 454 GS FLX[J]. PloS One, 2011, 6(6): e21560. DOI:10.1371/journal.pone.0021560
(  0) 0) |
| [21] |
Ding J, Zhao L, Chang Y, et al. Transcriptome sequencing and characterization of Japanese scallop Patinopecten yessoensis from different shell color lines[J]. Plos One, 2015, 10(2).
(  0) 0) |
| [22] |
Li Y, Zhang L, Sun Y, et al. Transcriptome Sequencing and Comparative Analysis of Ovary and Testis Identifies Potential Key Sex-Related Genes and Pathways in Scallop Patinopecten yessoensis[J]. Marine Biotechnology, 2016, 1-13.
(  0) 0) |
| [23] |
Feng L, Yu Q, Li X, et al. Identification of reference genes for qRT-PCR analysis in Yesso Scallop Patinopecten yessoensis[J]. PloS One, 2013, 8(9): e75609. DOI:10.1371/journal.pone.0075609
(  0) 0) |
| [24] |
Johnson J M, Castle J, Garrett-Engele P, et al. Genome-wide survey of human alternative pre-mRNA splicing with exon junction microarrays[J]. Science, 2003, 302(5653): 2141-2144. DOI:10.1126/science.1090100
(  0) 0) |
| [25] |
Kanai Y, Kanai-Azuma M, Noce T, et al. Identification of two Sox17 messenger RNA isoforms, with and without the high mobility group box region, and their differential expression in mouse spermatogenesis[J]. Journal of Cell Biology, 1996, 133(3): 667-682. DOI:10.1083/jcb.133.3.667
(  0) 0) |
| [26] |
Takase M, Noguchi S, Nakamura M. Two Sox9 messenger RNA isoforms: Isolation of cDNAs and their expression during gonadal development in the frog Rana rugosa[J]. FEBS Letters, 2000, 466(2-3): 249-254. DOI:10.1016/S0014-5793(00)01078-4
(  0) 0) |
| [27] |
韩飞. 鱼类Sox30和Sox6的克隆、表达及其在性腺发育中作用的初步研究[D]. 重庆: 西南大学, 2009. Han F. Molecular Cloning Gene Expression of Sox30 and Sox6 and Their Possible Roles in Gonadal Development ofthe Nile tilapia[D]. Chongqing: Southwest University, 2009. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1995328 (  0) 0) |
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao 266071, China
 2018, Vol. 48
2018, Vol. 48


