2. 山东省海洋生物研究院, 山东 青岛 266104
拟除虫菊酯类农药(Synthetic pyrethroid insecticides,SPIs)是一类以文菊花中的天然成分除虫菊酯合成的仿生农药,其基本结构是具有苯氧基的环丙烷酯[1],具有高效广谱,对哺乳动物低毒和低残留的优点[2]。它是继有机氯、有机磷农药和氨基甲酸酯之后的第三代农药,在农业中得到了广泛的重视[3]。2016年SPIs的全球销售额为16.33亿美元,是全球三大类杀虫剂之一[4]。目前我国杀虫剂用量分别占农药总用量的42%,其中拟除虫菊酯类农药占杀虫剂市场的30%以上[5],已成为有机磷、有机氯杀虫剂的重要取代类型[6]。由于SPIs为非离子型农药,具有高有机碳吸附系数、弱极性以及亲酯疏水性,使得其难溶于水,而易与土壤颗粒结合,从而在沉积物中积累[7]。近年来SPIs也被引入水产养殖中用于防治寄生虫及其敌害生物等,对近海滩涂贝类养殖和生态环境造成潜在威胁。
为保护某一生境中更多的物种,可以采用物种敏感性分布(Species sensitivity distribution, SSD)对SPIs造成的生态风险进行评价。其基本方法是收集多种水生生物的毒性数据,并构建剂量-效应的累计概率模型,即可得到SSD曲线,在SSD曲线上与累积概率5%对应的浓度,即为对5%的水生生物产生危害的浓度HC5,该数值涵义为可保护95%的水生生物的毒物浓度标准[8]。
近海贝类分布广泛且具有重要的生态学意义,因而已被广泛用作海洋和河口污染的指示生物[9]。毛蚶(Scapharca subcrenata)在中国北起鸭绿江,南至广西均有分布,被广泛养殖和食用,具有重要的经济价值[10]。SPIs入海后可能会对贝类产生毒性危害并影响近海生态环境。因此,本实验开展了甲氰菊酯、氯氰菊酯和溴氰菊酯3种SPIs对毛蚶成贝及幼贝的急性毒性效应研究,并结合其它水生生物数据拟合了SSD曲线,旨在补充SPIs对海洋生物的毒性数据库,为其它毒理实验和海洋生态环境的相关评估提供理论依据。
1 材料方法 1.1 受试生物毛蚶幼贝(壳长(2.67±0.15)mm,壳高(1.64±0.11) mm)取自山东省海洋生物研究院,成贝(壳长(4.10±0.28) cm,壳高(3.10±0.30) cm,壳宽(2.20±0.30) cm)取自青岛市南山水产品市场。贝类取回后,将杂质和破损、死亡的个体捡出。于自然海水中暂养一周,自然海水取自青岛太平角海域,暂养以及实验过程中海水温度为(23.5±1.5) ℃,pH为8.0±0.2,溶解氧为(6.3 ±1.0) mg·L-1,盐度为30.5±0.7。每日更换新水100%,不投饵,少量充氧,每日光暗比为18∶6。
1.2 实验药剂二甲基亚砜(≥99.5%),国药集团化学试剂上海有限公司生产,作助溶剂使用;20%甲氰菊酯乳油,购自浙江威尔达化工有限公司;25 g·L-1溴氰菊酯乳油,购自拜耳作物科学(中国)有限公司;100 g·L-1氯氰菊酯乳油,购自巴斯夫上海有限公司。使用时先将3种SPIs用二甲基亚砜稀释至实验浓度,且二甲基亚砜体积不超过实验海水体积的0.01%。
1.3 实验方法根据预实验结果初步确定3种SPIs对毛蚶幼贝及成贝的96 h致死浓度范围后,按照一定的几何级数分别设置5个实验组,以及一个自然海水对照组和0.01%海水体积的二甲基亚砜对照组。挑选规格均匀、健康的毛蚶作为实验对象,每个实验组设置3个平行,每个平行投放10只个体。实验期间不投饵,采用半静水式养殖方法,每24 h换水100%并重新投药,不间断微量充氧,于24、48、72和96 h分别记录各组毛蚶死亡数并在记录后及时将死贝挑出。毛蚶幼贝死亡判断:轻轻摇晃容器,存活毛蚶会伸出足附着于容器底部不随水晃动,将随水晃动的毛蚶取出,单独放入一旁自然海水中,观察5 min后,仍无任何活动的毛蚶即判定为死亡。毛蚶成贝死亡判断:用镊子触碰其两壳缝隙,死亡贝类的双壳会有所松动,活的贝类双壳则依然紧闭。
1.4 毒理数据来源及筛选原则毒理数据主要来自美国EPA的ECOTOX(https://cfpub.epa.gov/ecotox/)数据库、Web of Science(http://apps.webofknowledge.com/)、中国知网(http://www.cnki.net/)和本研究中获得的结果(选取毛蚶幼贝实验结果)。选取急性毒性实验的半数致死浓度(LC50)作为评估终点,暴露时间为24~96 h。全部所采用水生物种分为溞类、桡足类(暴露时间选择48 h);鱼、虾、贝、蟹(暴露时间选择96 h)等。对于同一物种相同暴露时间存在多个可用数据,采用毒性值浓度的几何平均值作为毒理数据,而毒性值差异超过一个数量级的,舍弃离群值数据[11]。
1.5 数据处理实验结果取三次平行的平均值,利用SPSS 25.0中的浓度对数-概率回归方程计算96 h的浓度对数的回归方程,LC50及其95%置信区间。SSD曲线拟合采用ETX 2.0软件以浓度为横轴,累计概率为纵轴建立坐标系,应用蒙特卡罗算法构建SSD曲线并计算HC5值。
2 实验结果 2.1 甲氰菊酯对毛蚶幼贝和成贝急性毒性效应及物种敏感度分布急性毒性实验过程中自然海水和二甲基亚砜对照组中贝类的死亡率均为0。本研究中甲氰菊酯对毛蚶幼贝以及成贝的96 h LC50值分别为286.5和3 931.9 ng·mL-1(见表 1)。成贝96 h LC50值约为幼贝的14倍。在所有时间段内(24、48、72和96 h),幼贝死亡率均呈现显著的浓度-效应关系,而成贝中除24 h时,也均呈现显著的浓度-效应关系。随着时间的延长,幼贝死亡率基本没有变化,而成贝死亡率随时间有显著增加。
|
|
表 1 3种菊酯类农药对毛蚶幼贝和成贝的96 h LC50 Table 1 96 h LC50 values of three synthetic pyrethroid insecticides on juvenile and adult Scapharca subcrenata |
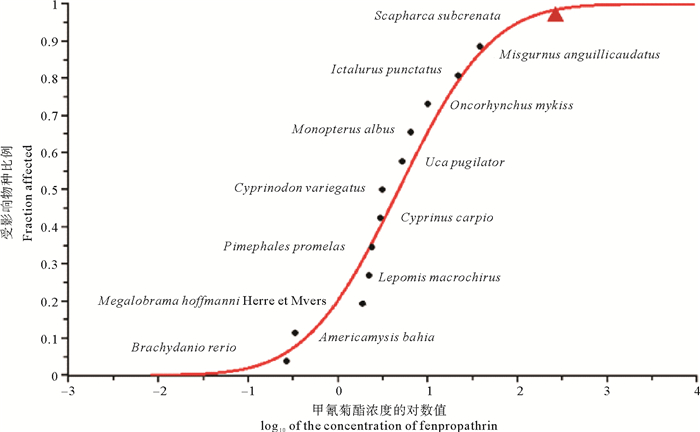
由表 2和图 1可知:甲氰菊酯对水生生物的急性毒性测定值范围为0.27~286.59 ng·mL-1,HC5值为0.20 ng·mL-1。对甲氰菊酯最为敏感的水生生物为斑马鱼(Brachydanio rerio),其次为糠虾(Americamysis bahia)、招潮蟹(Uca pugilator),然后依次为其它9种鱼类的敏感性相近,本研究中受试毛蚶幼贝的敏感性最低。毛蚶幼贝对甲氰菊酯敏感性最低,鱼类与虾蟹类对甲氰菊酯敏感性相近,但因为虾蟹类数据量较少,不确定性较大,在今后的研究中可补充相关数据,增强SSD曲线的可靠性。
|
|
表 2 甲氰菊酯对水生生物的急性毒性数据 Table 2 Acute toxicity data of fenpropathrin to aquatic organisms |
|
( 三角标记代表毛蚶数据。Datum of S. subcrenata was presented by triangle. ) 图 1 甲氰菊酯的水生生物物种敏感度分布曲线 Fig. 1 Sensitivity distribution curve of aquatic species for fenpropathrin |
本研究中溴氰菊酯对毛蚶幼贝以及成贝的96 h LC50值分别为23.3和709.5 ng·mL-1(见表 2),成贝是幼贝的30.34倍。急性毒性实验过程中,24 h时,幼贝所有浓度组均已出现死亡个体,最高死亡率为36.7%;在成贝中,最低浓度组未出现死亡个体,最高死亡率为最高浓度组的26.7%。只有在96 h时,成贝和幼贝中死亡率与浓度成正比。随时间延长,幼贝和成贝中死亡率均逐渐上升。
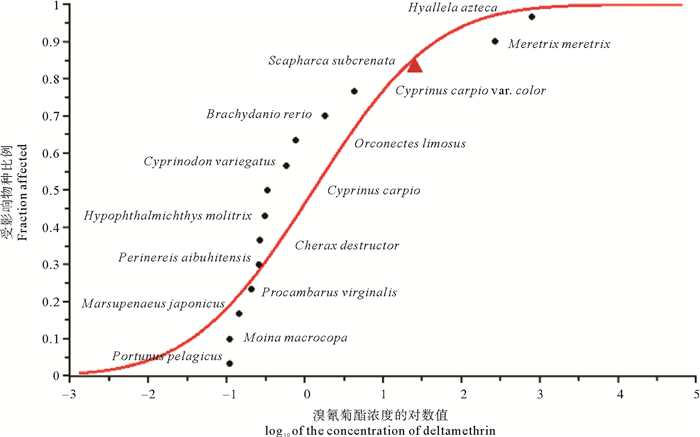
由表 3和图 2可知:溴氰菊酯对水生生物的急性毒性测定值范围为0.11~790.00 ng·mL-1,HC5值为0.01 ng·mL-1。对溴氰菊酯最为敏感的水生生物为远海梭子蟹(Portunus pelagicus),其次为多刺裸腹溞(Moina macrocopa)和日本囊对虾(Marsupenaeus japonicus)。最不敏感的水生生物为钩虾(Hyallela azteca),其次为文蛤(Meretrix meretrix)和本研究中的毛蚶幼贝。总体而言,双壳贝类对溴氰菊酯敏感性最低,其次分别为鱼类、虾蟹类,多毛类和溞类的数据量较少,因此未作比较。
|
|
表 3 溴氰菊酯对水生生物的急性毒性数据 Table 3 Acute toxicity data of deltamethrin to aquatic organisms |
|
( 三角标记代表毛蚶数据。Datum of S. subcrenata was presented by triangle. ) 图 2 溴氰菊酯的水生生物物种敏感度分布曲线 Fig. 2 Sensitivity distribution curve of aquatic species for deltamethrin |
本研究中氯氰菊酯对毛蚶幼贝以及成贝的96 h LC50值分别为17.9和737.7 ng·mL-1(见表 1),成贝是幼贝的41倍。急性毒性实验过程中,24 h时,幼贝所有浓度组均已出现死亡个体,最高死亡率为最高浓度组的66.7 %;在成贝中,最低浓度组未出现死亡个体,最高死亡率仅为13.3 %(2 000 ng·mL-1组)。在96 h时,幼贝死亡率与浓度成正比;72和96 h时,成贝的死亡率与浓度成正比。随时间延长,幼贝和成贝中死亡率均逐渐上升。
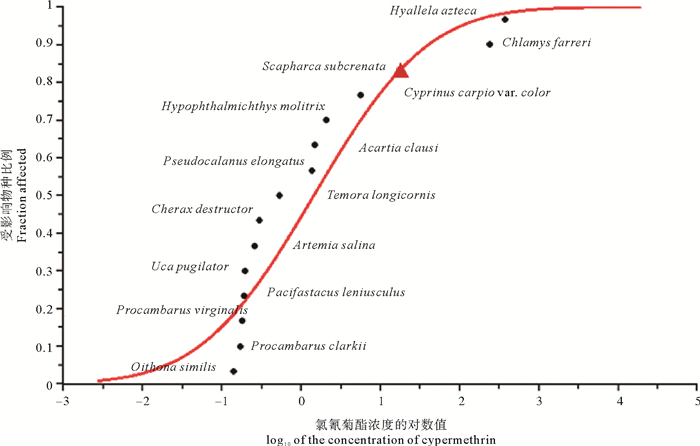
由表 4和图 3可知:氯氰菊酯对水生生物的急性毒性测定值范围为0.14~380.00 ng·mL-1,HC5值为0.02 ng·mL-1。对氯氰菊酯最为敏感的水生生物为拟长腹剑水蚤(Oithona similis),其次为红螯鳌虾(Procambarus clarkii)和美洲龙纹鳌虾(Procambarus virginalis)。最不敏感的水生生物为钩虾,其次为栉孔扇贝(Chlamys farreri)和本研究中的毛蚶幼贝。总体而言,双壳贝类对氯氰菊酯敏感性最低,其次分别为鱼类、桡足类和虾蟹类。
|
|
表 4 氯氰菊酯对水生生物的急性毒性数据 Table 4 Acute toxicity data of cypermethrin to aquatic organisms |
|
( 三角标记代表毛蚶数据。Datum of S. subcrenata was presented by triangle. ) 图 3 氯氰菊酯的水生生物物种敏感度分布曲线 Fig. 3 Sensitivity distribution curve of aquatic species for cypermethrin |
研究表明,SPIs主要通过干扰神经膜上的钠通道而造成神经毒性,除此之外,SPIs还被证明具有多种类型的毒性,如生殖发育毒性、免疫毒性和代谢毒性等。且由于其具有亲脂性,在水中易于进入水生动物的鳃和血液,因此对水生生物的毒性要远高于哺乳动物。根据《新化学物质危害评估导则(HJ/T154-2004)》的毒性评级标准,本研究中的3种SPIs对水生生物毒性值(0.11~790.00 ng·mL-1)均为剧毒级别(小于等于5 mg·kg-1)[12]。目前,对于SPIs对水生生物毒性的研究,Sayeed等使用0.75 ng·mL-1溴氰菊酯处理蓝点石斑鱼(Channa punctatus Bloch),可诱导其肾脏和肝脏中各种抗氧化酶和非酶类抗氧化剂的产生,表明溴氰菊酯对其具有明显的氧化应激诱导作用[13]。彭芳等使用0.10 ng·mL-1溴氰菊酯处理多刺裸腹溞24 h后, 谷胱甘肽转硫酶(GST)活力较对照组显著降低(P<0.05), 表明代谢产生的活性氧(ROS)等氧化物质已不能被机体及时清除, 其累积毒性严重抑制了GST的功能和合成, 裸腹溞解毒代谢功能明显下降[14]。谭晓珍等用浓度范围为0.10~3.98 mg·L-1甲氰菊酯染毒栉孔扇贝,发现甲氰菊酯会引起ATP酶的超常活动[15]。Singh等用0.02 mg·L-1氯氰菊酯对印度囊鳃鲇(Heteropneustes fossilis)进行为期45 d的实验,发现氯氰菊酯可通过下丘脑-垂体-性腺轴影响类固醇生成,从而引起内分泌系统紊乱,并导致精子活力下降[16]。本研究得到的毛蚶成贝和幼贝的急性毒性数据可以为亚慢性、慢性及其他毒理实验接触剂量和观察指标的选择提供参考依据。
由表 1可知,3种SPIs中,甲氰菊酯对毛蚶成贝和幼贝的毒性最低,溴氰菊酯和氯氰菊酯的毒性较高且相近。在毛蚶幼贝中,甲氰菊酯的LC50分别是溴氰菊酯和氯氰菊酯的12和16倍;在毛蚶成贝中,甲氰菊酯的LC50分别是溴氰菊酯和氯氰菊酯的6和5倍。不同SPIs种类之间毒性存在较大差异。赵玉琴等研究了SPIs对7种鱼类的毒性效应,结果表明鱼类中各SPIs的LC50:溴氰菊酯 < 甲氰菊酯 < 氯氰菊酯[17],这与本研究的结果不同,可能是因为SPIs对不同物种的毒性效应有所差异。3种SPIs对毛蚶成贝的毒性均远低于对幼贝的毒性,毛蚶成贝中甲氰菊酯、溴氰菊酯和氯氰菊酯的LC50分别是幼贝中14、30和41倍。陈坚等[18]研究了氨氮和硫化物对文蛤幼贝和成贝存活的影响,得到其96 h半致死浓度分别为36.0 mg·L-1(幼贝)、150.6 mg·L-1(成贝)和16.2 mg·L-1(幼贝)、138.4 mg·L-1(成贝)。幼体对污染物的耐受性均没有成体高,这与本研究所得结果一致。
通过表 2、3、4和图 1、2、3可知,双壳贝类对3种SPIs敏感性最低,且双壳贝类对SPIs的敏感性有物种差异。鱼类与虾蟹类对SPIs敏感性相近且较高,其它水生生物普遍对SPIs的敏感性较高,但因为数据量较少,不确定性较大,在今后的研究中可补充相关数据,增强SSD曲线的可靠性。由于双壳贝类对这些农药的敏感性比较低,从而导致其易在双壳贝类体内富集,特别是可食用的物种会直接对人体的健康产生影响,因此后续可开展相关物种体内SPIs富集情况和对人体安全评估的研究工作。
甲氰菊酯、溴氰菊酯和氯氰菊酯的HC5值分别为0.20、0.01和0.02 ng·mL-1。水生生物对溴氰菊酯的敏感性最高,而对甲氰菊酯的敏感性最低。徐瑞祥和陈亚华构建了4种常用有机磷农药(二嗪磷、对硫磷、杀螟硫磷和马拉硫磷)对淡水生物的SSD曲线,计算了4种有机磷农药的HC5值分别为0.15、0.77、0.29和2.54 ng·mL-1[19]。除二嗪磷HC5值低于甲氰菊酯外,其余有机磷农药HC5值均高于SPIs,说明水生生物对SPIs的敏感性总体高于有机磷农药。目前,关于SPIs的水质标准中,仅在《地表水环境标准(GB 3838—2002)》中规定溴氰菊酯的标准限量为0.02 mg·L-1, 这一标准远高于溴氰菊酯的HC5值(0.01 ng·mL-1),会对水生生物造成影响,而SPIs的其他相关水质标准也有待补充。
| [1] |
骆爱兰, 余向阳, 张存政, 等. 拟除虫菊酯类农药残留分析研究进展[J]. 江苏农业学报, 2004, 20(2): 120-129. Luo A, Yu X, Zhang C, et al. Research progress of residue analysis for pyrethroids[J]. Jiangsu J of Agr Sci, 2004, 20(2): 120-129. (  0) 0) |
| [2] |
高钰一, 沈美芳, 宋红波, 等. 气相色谱法测定水产品中7种拟除虫菊酯的残留量[J]. 水产学报, 2009, 33(1): 132-138. Gao Y, Shen M, Song H, et al. Determination of 7 pyrethroids residues in aquatic product by gas chromatography[J]. Journal of Fisheries of China, 2009, 33(1): 132-138. (  0) 0) |
| [3] |
赵李娜, 赖子尼, 李秀丽, 等. 珠江河口沉积物中拟除虫菊酯类农药污染及毒性评价[J]. 生态环境学报, 2013, 22(8): 1408-1413. Zhao L, Lai Z, Li X, et al. Contamination and toxicity evaluation of pyrethroids in sediments of the Pearl River Estuary[J]. Ecology and Environmental Sciences, 2013, 22(8): 1408-1413. DOI:10.3969/j.issn.1674-5906.2013.08.022 (  0) 0) |
| [4] |
Tang W, Wang D, Wang J, et al. Pyrethroid pesticide residues in the global environment: An overview[J]. Chemosphere, 2018, 191: 990-1007. DOI:10.1016/j.chemosphere.2017.10.115
(  0) 0) |
| [5] |
Zhong G, Tang J, Xie Z, et al. Selected current-use pesticides(CUPs) in coastal and offshore sediments of Bohai and Yellow Seas[J]. Environ Sci Pollut Res, 2015, 22: 1653-1661. DOI:10.1007/s11356-014-2648-7
(  0) 0) |
| [6] |
季芯羽, 叶泰, 袁敏, 等. 菊酯类农药代谢物分子印迹荧光传感器的制备及应用[J]. 分析测试学报, 2019, 38(12): 1487-1492. Ji X Y, Ye T, Yuan M, et al. Preparation and application of a molecularly imprinted fluorescence sensor for pyrethroid pesticide metabolite[J]. Journal of Instrumental Analysis, 2019, 38(12): 1487-1492. DOI:10.3969/j.issn.1004-4957.2019.12.013 (  0) 0) |
| [7] |
Goedkoop W, Peterson M. The fate, distribution, and toxicity of Lindane in tests with Chironomus riparius: Effects of bioturbation and sediment organic matter content[J]. Environmental Toxicology and Chemistry, 2003, 22: 67-76. DOI:10.1002/etc.5620220109
(  0) 0) |
| [8] |
陈波宇, 郑斯瑞, 牛希成, 等. 物种敏感度分布及其在生态毒理学中的应用[J]. 生态毒理报, 2010, 5(4): 491-497. Chen Y, Zheng S, Niu X, et al. Species sensitivity distribution and its application in ecotoxicology[J]. Ecology and Environmental Sciences, 2010, 5(4): 491-497. (  0) 0) |
| [9] |
Goldberg E D. The mussel watch concept[J]. Environmental Monitoring and Assessment, 1986, 7(1): 91-103. DOI:10.1007/BF00398031
(  0) 0) |
| [10] |
Jin J E, Ahn C B, Je J Y. Purification and characterization of antioxidant peptides from enzymatically hydrolyzed ark shell (Scapharca subcrenata)[J]. Process Biochemistry, 2018, 72: 170-176. DOI:10.1016/j.procbio.2018.06.001
(  0) 0) |
| [11] |
Raimodno S, Vivian D N, Delos C, et al. Protectiveness of species sensitivity distribution hazard concentrations for acute toxicity used in endangered species risk assessment[J]. Environmental Toxicology and Chemistry, 2008, 27(12): 2599-2607. DOI:10.1897/08-157.1
(  0) 0) |
| [12] |
国家环境保护总局. HJ/T153—2004新化学物质危害评估导则[S]. 北京: 中华人民共和国环境保护部, 2004. State Environmental Protection Administration. HJ/T153—2004 New Chemical Hazard Assessment Guidelines[S]. Beijing: Ministry of Ecology and Environment of the People's Republic of China, 2004. (  0) 0) |
| [13] |
Sayeed I, Parvez S, Pandey S, et al. Oxidative stress biomarkers of exposure to deltamethrin in freshwater fish, Channa punctatus Bloch[J]. Ecotoxicology and Environmental Safety, 2003, 56: 295-301. DOI:10.1016/S0147-6513(03)00009-5
(  0) 0) |
| [14] |
彭芳, 王茜, 王兰. 溴氰菊酯对多刺裸腹溞急性毒性及解毒代谢的影响[J]. 水生生物学报, 2013, 37(3): 530-534. Peng F, Wang X, Wang L. Effect of deltamethrin on acute toxicity and detoxification metabolism in water flea, Moina macrocopa[J]. Acta Hydrobiologica Sinica, 2013, 37(3): 530-534. (  0) 0) |
| [15] |
谭晓珍, 吴垠, 李韬, 等. 氯氰菊酯和氰戊菊酯对栉孔扇贝的急性毒性[J]. 大连水产学院学报, 2005, 20(3): 203-207. Tan X Zh, Wu Y, Li T, et al. Acute toxicity of cypermethrin and fenvalerate to scallop (Chlamys farreri)[J]. Journal of Dalian Fisheries University, 2005, 20(3): 203-207. (  0) 0) |
| [16] |
Singh P B, Singh V. Cypermethrin induced histological changes in gonadotrophic cells, liver, gonads, plasma levels of estradiol-17b and 11-ketotestosterone, and sperm motility in Heteropneustes fossilis (Bloch)[J]. Chemosphere, 2008, 72(3): 422-431.
(  0) 0) |
| [17] |
赵玉琴, 李丽娜, 李建华. 常见拟除虫菊酯和有机磷农药对鱼类的急性及其联合毒性研究[J]. 环境污染与防治, 2008, 11: 53-57. Zhao Y Q, Li L N, Li J H. Study of acute and joint toxicity of common pyrethroid and organophosphate pesticides to fish[J]. Environmental Pollution & Control, 2008, 11: 53-57. (  0) 0) |
| [18] |
陈坚, 胡一箫, 许丰瑞, 等. 氨氮和硫化物对文蛤幼体及成体的急性毒性试验[J]. 现代农业科技, 2010, 3: 324-325+331. Chen J, Hu Y X, Xu F R, et al. Acute toxicity experiments of ammonia-N and sulfide to the juveniles and adults of Meretrix meretrix[J]. Modern Agricultural Science and Technology, 2010, 3: 324-325+331. (  0) 0) |
| [19] |
徐瑞祥, 陈亚华. 应用物种敏感性分布评估有机磷农药对淡水生物的急性生态风险[J]. 湖泊科学, 2012, 24(6): 811-821. Xu R, Chen Y. Assessing acute ecological risks of organophosphorus pesticides to freshwater organisms by species sensitivity distributions[J]. J Lake Sci, 2012, 24(6): 811-821. (  0) 0) |
2. Marine Biology Institute of Shandong Province, Qingdao 266104, China
 2021, Vol. 51
2021, Vol. 51


