2. 山东省水生生物资源养护管理中心, 山东 烟台 264000
大头鳕(Gadus macrocephalus)又名太平洋鳕鱼,属鲈形目(Perciformes)鳕科(Gadidae)鳕属(Gadus),为冷温性底层鱼类,主要分布于北太平洋,黄海是其分布最南的海区,栖息水深50~80 m[1]。由于对气候较为敏感,黄海大头鳕资源变动很大,具有年代际周期性变化的特性[2]。在1960年代之前,大头鳕是黄海重要的渔业捕捞对象,1959年渔获量最高,达2.6万t。1970年代之后,由于过度捕捞和环境变化,大头鳕资源严重衰退,鳕鱼渔业由专捕转为兼捕,1973年渔获量仅为73 t,之后虽有回升,但仍长期维持在小于0.5万t的状态①。近年大头鳕数量呈波动上升趋势,2003年,中国的渔获量仅0.4万t,2014年达1.4万t,渔获量的上升使大头鳕再次成为黄海重点关注鱼种之一(http://www.seaaroundus.org/)。
黄海是西北太平洋半封闭陆架边缘海,三面被陆地环绕,位于中国和朝鲜半岛之间,呈反“S”形,黄海槽贯穿于黄海中央,深度为60~90 m,北浅南深,东陡西缓,是黄海最突出的地形特征[3]。由于这一特殊的地形和其他热力和动力因素的共同作用,使该海域在暖半年时,在温跃层下覆盖着被10 ℃等温线包围的低温水体,即黄海冷水团(Yellow Sea Cold Water Mass,YSCWM)[4]。黄海冷水团与该区域的初级生产力和渔业产量有一定的关联[5-6],例如夏季整个冷水团海域小型底栖动物丰度和生物量分别是非冷水团海域的2.3和2.1倍[7]。黄海冷水团是秋季鳀鱼分布的最主要控制因素,其边缘、底层水温11~12 ℃等温线是鳀鱼越冬洄游的主要控制边界[8]。而大头鳕作为冷温性底层鱼类,黄海冷水团影响其生长、分布及关键生活史过程,进而影响其补充过程和种群资源量[9]。
目前,对黄海大头鳕的研究较多地集中于其体内化学物质成分、群体遗传学、形态学以及摄食等方面[10-13]。虽然有关于种群年际变动[14]及0龄幼体[9]分布等的相关研究,但关于其当年生和非当年生幼鱼分布和生长的季节变动的相关研究较少。1990年代研究显示,黄海大头鳕年龄组主要由1龄和2龄个体组成①,但本研究的调查结果显示0龄和1龄的幼鱼占95%以上,已经成为大头鳕渔获量的主要组成部分,表明大头鳕的资源结构发生了变化。当年生和非当年生幼鱼继续发育将成为产卵群体中初次达到性成熟的个体,即“补充部分”,与重复性成熟个体所代表的“剩余部分”构成种群的性成熟组成。掌握和积累“补充”和“剩余”的组成资料,不仅可以及时了解种群结构的变化,而且对研究和分析种群数量动态也有着十分重要的意义[15]。本文通过分析黄海冷水团存在时期的春、夏、秋三季大头鳕幼鱼的资源密度与分布及生长的季节变动,结合黄海冷水团形成、发展和消失的过程,探究可能导致大头鳕幼鱼生长和分布出现季节性差异的原因,为黄海大头鳕种群数量变动提供基础数据及参考。
① 烟台海洋渔业公司渔捞调度室.黄渤海经济鱼类-大头鳕.烟台海洋渔业公司渔捞调度室油印本. 1990.
1 材料与方法 1.1 调查采样大头鳕样品来自于2016—2017年开展的“山东近海渔业资源调查”,站位设置如图 1所示,共计118站,基于黄海冷水团存在的秋、春、夏三个季节分别于2016年10月、2017年5和8月进行了底拖网调查。调查船是功率为220 kW的单拖网渔船,白天作业,每站拖曳时间1 h左右,拖速3 kn左右。底拖网的渔具主尺度为网口网衣拉直周长67.84 m×网衣纵向拉直周长400 m(结附网衣的上纲长度为64.45 m)。拖网时网口高度约为7.5 m,宽约15 m,网囊网目尺寸为1 380目。使用CTD现场采集调查位点的深度、表温、表盐、底温、底盐等参数,CTD设置为每秒测定,每次投放前在水面感温10 s,然后以0.5 m/s的速度缓慢下放至水底,再缓慢收回,完成测量。本次调查位于37°N以北(包括37°N)的位点未能获得CTD实测数据,因此三个季节37°N以北的底温和底盐实测数据来自于2010年4月、2016年7月和2012年11月“东方红2号”基金委共享航次的实测数据,反映对应季节冷水团特征的大致规律。黄海冷水团强度和范围虽然存在一定的年际差异[16-17],但由于冷水团具有较为相近的季节变动模式[18-20],因此这三次调查虽然包括了两个自然年的冷水团变动过程,但可代表冷水团的产生、强盛及衰退阶段的特征。
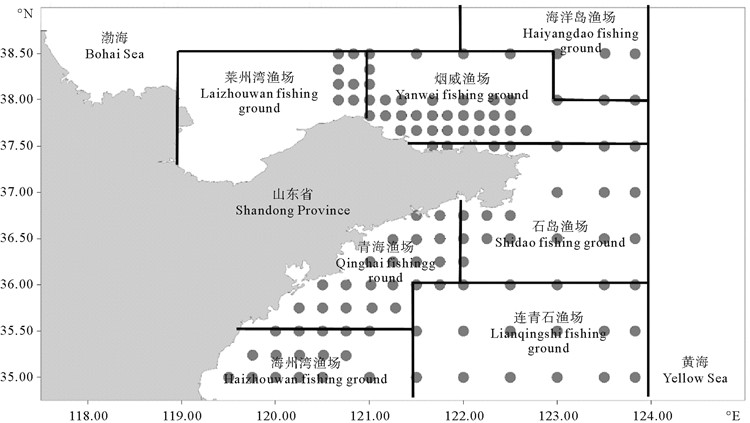
|
图 1 调查站位图及渔场分区 Fig. 1 Sampling stations in Shandong offshore and fishing grounds |
捕获的大头鳕样品冷冻保存,带回实验室解冻后测定。依据陈大刚等[15]的研究,黄海大头鳕为2龄性成熟,后续分析中通过体长分布区分当年生和非当年生幼鱼,雄性个体50%性成熟体长范围为410~530 mm,雌性个体为470~560 mm,考虑到目前大头鳕出现的小型化问题,因此同时参考体长范围和性腺发育状况,从体长小于该范围的个体中挑选出当年生和非当年生幼鱼用于后续分析。开展本研究所捕获到的样品中,共采集到1 381尾大头鳕,仅有2尾成鱼,其余全部为幼鱼。
1.2 分析方法拖网时间标准化为1 h,拖速标准化为3 kn,以各站位的CPUE(kg/h)代表该站位的渔获密度。各季节的渔获密度以该季节各站位的平均渔获量(该季节总生物量与站位数之比,kg/h)、平均渔获尾数(该季节总捕获尾数与站位数之比,ind/h)和出现频率(出现大头鳕的站位数与占总站位数之比)表示。种群的资源丰度分布结合以上三个参数确定。
根据各航次捕获的大头鳕幼鱼的CPUE、平均体长,结合底温数据,借助Surfer软件绘制调查海域内底层温度的等值线图,分析大头鳕幼鱼CPUE和体长组(年龄组)数量分布与底温的关系。夏季航次的调查时间为黄海冷水团强盛时期,为研究此时期黄海冷水团对大头鳕的影响,利用SPSS软件对夏季捕获到大头鳕幼鱼的站位在经纬度方向上进行系统聚类分析,并利用公式计算各部分重心的经纬度,以探究大头鳕幼鱼的分布与黄海冷水团低温中心的关系。重心经纬度的计算公式[21-22]:
| $ \begin{array}{l} X = \frac{{\sum\limits_{i = 1}^k {\left( {{C_i}{X_i}} \right)} }}{{\sum\limits_{i = 1}^k {{C_i}} }}, \\ Y = \frac{{\sum\limits_{i = 1}^k {\left( {{C_i}{Y_i}} \right)} }}{{\sum\limits_{i = 1}^k {{C_i}} }} \circ \end{array} $ |
式中:X、Y分别为分布重心的经纬度;Ci为站位i的CPUE;Xi为站位i中心点的经度;Yi为站位i中心点的纬度;k为各聚类部分的调查站位总个数。
分析采样月份、采样位点经度、纬度、底温、底盐和水深对大头鳕幼鱼CPUE的影响,解释变量之间可能存在共线性,在SPSS中利用两个解释变量间的Pearson相关系数来判断两者的相关性程度,如果解释变量间相关系数较大,则两个解释变量之间通常存在严重共曲线性关系,在模型构建时通常只选取其中一个变量作为解释变量[23]。利用R统计软件中的“mgcv”包构建CPUE与解释变量间的广义相加模型(GAM),从而深入探讨解释变量的交互作用对大头鳕种群密度的影响,模型表达式为:
| $ \begin{array}{l} \ln \left( {{\rm{CPUE}}} \right){\rm{ = }}s\left( {{\rm{lon}}} \right) + s\left( {{\rm{lat}}} \right) + s\left( {{\rm{depth}}} \right) + \\ s\left( {{\rm{SBT}}} \right) + s\left( {{\rm{SBS}}} \right) + {\rm{month}} + \varepsilon \circ \end{array} $ |
式中:ln(CPUE)为CPUE的对数化处理;s为自然样条平滑;lon表示经度;lat表示纬度;depth表示水深(m);SBT表示底温(℃);SBS表示底盐;month表示月份;ε表示误差。根据赤池信息量准则(AIC)对模型解释变量进行优化筛选[24]。
体长和体重的测量值分别精确到1 mm和0.01 g,根据2016年10月、2017年5和8月3个调查航次的拖网数据,分别统计各航次捕获的大头鳕的体长体重,绘制各个季节当年生和非当年生大头鳕幼鱼体长和体重的频率分布直方图,并用幂指函数W=aLb拟合体重-体长关系,式中,W为体重(g), L为体长(cm), 参数a为条件因子(Condition factor),与日期、栖息地和季节等因素相关[25],参数b为异速生长因子(Allometric factor), 反映了个体生长的不均匀性[26]。在统计软件SPSS中利用Pauly[27]的t检验法检验体长与体重回归方程的幂指数b与3之间的差异,公式为:
| $ t = \frac{{SD\left( L \right)}}{{SD\left( W \right)}} \times \frac{{\left| {b - 3} \right|}}{{\sqrt {1 - {R^2}} }} \times \sqrt {n - 2} \circ $ |
式中:SD(L)、SD(W)分别为体长、体重对数值的标准差;n、R分别为样本数和相关系数。当b值与3无显著差异时,表明大头鳕呈等速生长(体重体长等速增长);当b值与3存在显著差异时,表明呈异速生长(b>3表示体重与体长呈正异速生长;b < 3表示体重与体长呈负异速生长)。
2 结果 2.1 渔获群体组成三个航次大头鳕幼鱼的体长体重频率分布图分别如图 2、3所示。春季,大头鳕幼鱼体长范围39~ 314 mm,平均体长93.61 mm,优势体长组40~80 mm,占总尾数的81.63%,其中根据体长判断的当年生幼鱼的体长范围为39~82 mm;春季,幼鱼体重范围0.56~446.27 g,平均体重40.46 g,优势体重组0~5 g,占总尾数的83.12%。夏季,大头鳕幼鱼体长范围67~374 mm,平均体长121.48 mm,优势体长组88~132 mm,占总尾数的74.95%,其中各站位当年生幼鱼的体长范围68~162 mm;夏季,幼鱼体重范围2.71~921.43 g,平均体重38.55 g,优势体重组6~20 g,占总尾数的74.90%。秋季,大头鳕幼鱼的体长范围在110~368 mm,平均体长164.58 mm,优势体长组136~186 mm,占总尾数的73.93%,其中各站位当年生幼鱼的体长范围110~222 mm;秋季,幼鱼体重范围10.57~147.15 g,平均体重52.84 g,优势体重组18~74 g,占总尾数的72.95%(见图 2、3)。

|
图 2 大头鳕体长频率分布 Fig. 2 Body length-frequency distribution of the Pacific cod |

|
图 3 大头鳕体重频率分布 Fig. 3 Body weight-frequency distribution of the Pacific cod |
三个季节大头鳕当年生和非当年生幼鱼体长-体重关系分别如图 4、5所示,拟合的公式如下所示。由于秋季仅捕获到1条非当年生幼鱼,因此无法描述秋季非当年生幼鱼的体长-体重关系。春季,当年生和非当年生幼鱼的异速生长因子均显著小于3(t检验,p < 0.05),个体呈负异速生长,表明其体长的增长大于体重的增长。夏季捕获的当年生和非当年生幼鱼以及秋季捕获的当年生幼鱼的异速生长因子均显著大于3(t检验,p < 0.05),个体呈正异速生长,表明夏秋季,幼鱼体重的增长显著大于体长的增加。当年生幼鱼:
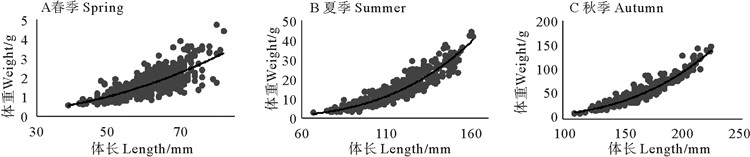
|
图 4 大头鳕当年生幼鱼体长-体重关系 Fig. 4 Body weight-length relationships of young-of-the-year Pacific cod |
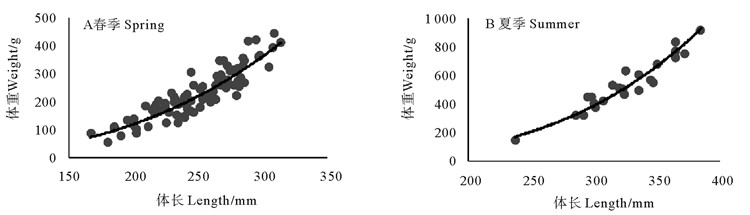
|
图 5 大头鳕非当年生幼鱼体长-体重关系 Fig. 5 Body weight-length relationships of one-year-old Pacific cod |
春季:W=10-4L2.335,R2=0.611 7(n=445);
夏季:W=10-6L3.372 6 ,R2=0.897 1(n=492);
秋季:W=10-6L3.408 ,R2=0.903 9(n=323)。
非当年生幼鱼:
春季:W=5×10-5L2.759 1,R2=0.813 4(n=89);
夏季:W=9×10-7L3.478 8,R2=0.925 2(n=23)。
2.2 CPUE分布2017年春、夏季和2016年秋季共对118个站位进行了调查,大头鳕CPUE分布如图 6所示。春季(5月)在34个站位捕获到大头鳕幼鱼,出现频率为28.81%,平均渔获量为1.49 kg/h,平均捕获深度为56.02 m。主要分布于青海渔场、海州湾渔场、石岛渔场和连青石渔场(见图 6A)。夏季在27个站位捕获到大头鳕幼鱼,出现频率为22.88%,平均渔获量为3.47 kg/h,平均捕获深度为49.93 m。主要分布在连青石渔场、石岛渔场和烟威渔场,该季节青海渔场已没有大头鳕幼鱼分布,而烟威渔场的渔获密度增大,呈现向东和向北深水区迁移的趋势。对捕获到大头鳕的站位进行经纬度方向的聚类分析结果显示:所有站位在空间分布上可划分为三部分,分布重心分别为(35.25°N,122.25°E)、(35.86°N,122.36°E)和(37.94°N,122.95°E)(见图 6B)。秋季(10月)在21个站位捕获到大头鳕幼鱼,出现频率为17.80%,平均渔获量为2.84 kg/h,平均捕获深度为59.81 m。石岛渔场渔获密度较高,连青石渔场和烟威渔场次之(见图 6C)。

|
( A.春季;B.夏季;C.秋季。图B中黑圈代表大头鳕CPUE分布重心的范围。A. Spring; B. Summer; C. Autumn. The black circles in figure B represent the gravity centres of Pacific cod CPUE. ) 图 6 大头鳕CPUE分布图 Fig. 6 CPUE of the Pacific cod in the Yellow Sea |
在三个季节的航次调查中,大头鳕幼鱼的种群密度指数如表 1所示。其中夏季渔获量最大,秋季次之,春季最小。单位时间渔获尾数和出现频率在春季最大,秋季最小。
|
|
表 1 大头鳕种群密度指数比较 Table 1 Comparison of stock density indices of the Pacific cod among of three seasons |
解释变量之间的Pearson相关性分析结果如表 2所示,经度、纬度、深度和其他因子之间的相关性显著(P<0.05),因此在后续的GAM模型构建时仅选取了月份、底温和底盐作为解释变量。GAM模型分析的结果显示,底盐、底温和采样月份三个因子单独对大头鳕CPUE的方差解释率分别为20.7%、8.69%和9.29%,当底盐单独作为解释变量时,模型的AIC最小(见表 3),因此进一步加入底温和月份进行模型构建,随机变量为底盐和月份时模型的AIC值与加入底温时模型的AIC值相近(见表 4),但是调整判定系数和方差解释率均有提高(见表 4),底盐和底温对大头鳕CPUE的影响效应图分别如图 6、7所示。本次调查捕获到的大头鳕盐度分布范围在31.40~33.92之间,集中分布于31.90~32.85之间,底盐范围为31.40~31.90和32.10~32.80范围内,大头鳕CPUE随着底盐的升高而增加,在31.90~32.10内,大头鳕的CPUE随底盐升高而降低,当盐度高于32.80时,CPUE随盐度增加呈急剧下降趋势(见图 7)。CPUE随温度变化的结果显示,大头鳕分布的温度范围为5~12 ℃,集中分布于7~9 ℃之间,CPUE在8.5 ℃达到最大,但在分布范围内,CPUE随温度的变化较小(见图 8)。
|
|
表 2 大头鳕CPUE与各因子的相关性矩阵 Table 2 The correlation matrix between CPUE of Pacific cod and various factors |
|
|
表 3 大头鳕CPUE与单个环境因子的GAM模型拟合结果 Table 3 The GAM fitting results of CPUE of Pacific cod and a single environmental factor |
|
|
表 4 大头鳕CPUE与环境因子组合的GAM模型拟合结果 Table 4 The GAM fitting results of CPUE of Pacific cod and environmental factors combination |
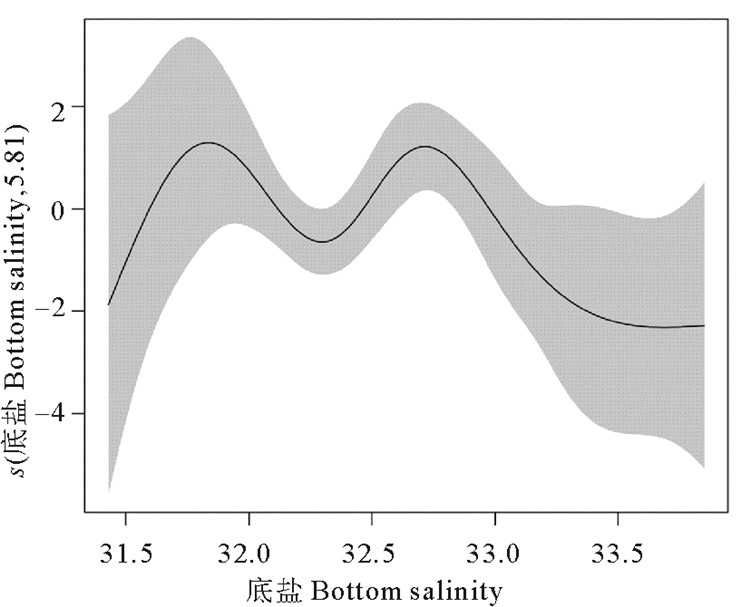
|
图 7 底盐对大头鳕CPUE的影响效应 Fig. 7 Effect of sea bottom salinity on the variation of CPUE of Pacific cod |

|
图 8 底温对大头鳕CPUE的影响效应 Fig. 8 Effect of sea bottom temperature on the variation of CPUE of Pacific cod |
各站位大头鳕当年生和非当年生幼鱼的平均体长与底温分布的结果如图 9所示:春季调查中捕获到的非当年生幼鱼(平均体长247 mm)基本分布于123°E以东水温低于10 ℃的水体中,而当年生幼鱼(平均体长60 mm)位于相对近岸的水域中(见图 9A);夏季调查中捕获到的幼鱼均位于底层水温低于10 ℃等温线以深水域,其中捕获到当年生幼鱼(体长平均值114 mm)的站位占88.5%,捕获到非当年生幼鱼(平均值314 mm)的站位占30.8%(见图 9B)。秋季仅捕获一条非当年生幼鱼,其余全部为当年生幼鱼,平均体长范围在122~191 mm之间(平均值为165 mm)。绝大部分站位位于低于10 ℃等温线以深的水域,南北主要分布于35.50°N~37.50°N之间(见图 9C)。
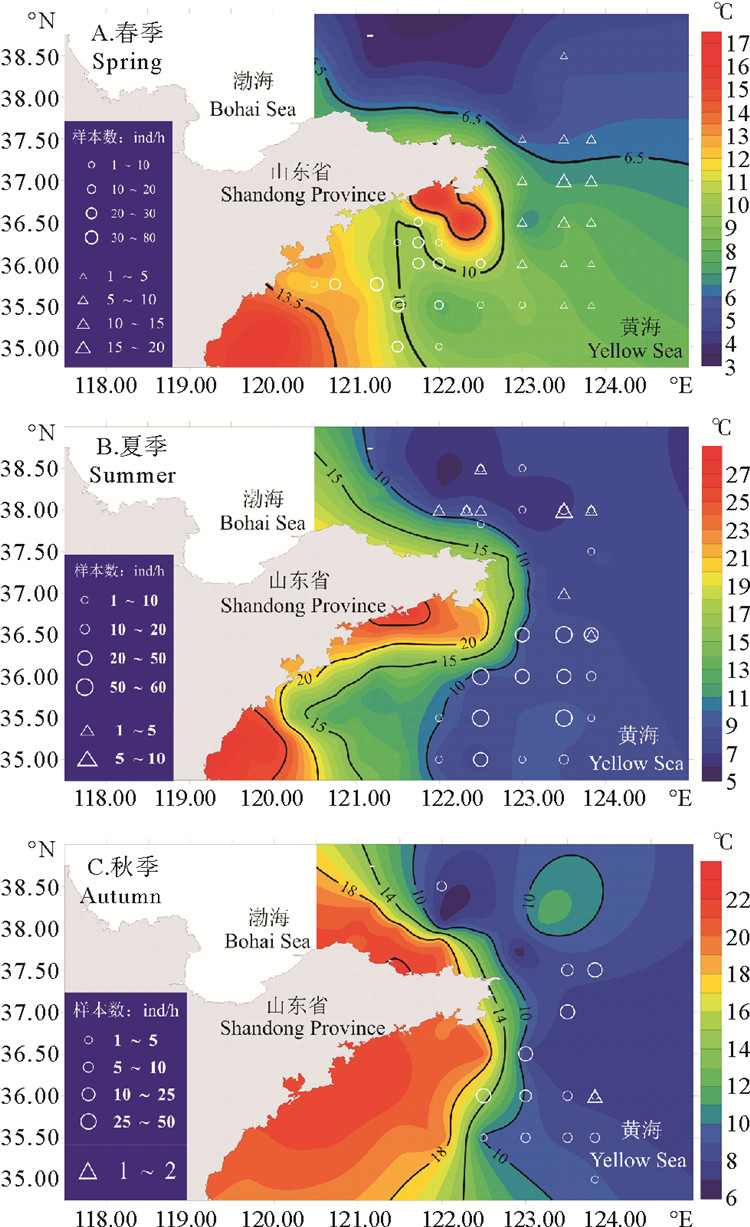
|
图 9 大头鳕当年生(○)和非当年生(△)幼鱼与底层温度分布 Fig. 9 Young-of-the-year (○) and 1-year-old (△) Pacific cod and bottom temperature |
冬季产卵期,大头鳕成鱼个体由深水区向近岸移动,优先选择粗砂或鹅卵石底质水域进行产卵[28],因此当年生幼鱼成为春季青海渔场高渔获密度的主要组成部分。黄海冷水团在每年春末基本成型,夏季达到鼎盛期,初秋开始减弱。低温中心的出现及其演变是黄海冷水团形成和发展的重要标志,在冷水团形成的过程中,有3个低温中心。夏季,大头鳕幼鱼在空间分布上可划分为三个区域,各自区域内CPUE的分布重心分别对应于黄海冷水团的三个低温中心,表明大头鳕的分布与黄海冷水团的低温中心密切相关。秋季,在调查海域内大头鳕的出现频率相较于春夏季明显减少,这可能与黄海冷水团衰退,大头鳕也随之迁移至烟威外海东部和石岛外海等较深水层有关[28]。因此黄海冷水团从春季发展、夏季强盛到秋季逐渐衰退的过程对大头鳕的分布有重要影响。
本研究中大头鳕幼鱼种群密度的两个盐度高峰为31.90和32.80附近,这主要与不同季节幼鱼分布的位置有关。春季,青海渔场附近盐度较低,该位置当年生幼鱼的渔获密度较高,夏秋季,幼鱼基本分布于底盐较高的122°E以东海域。赵传絪等人的研究结果表明,黄海冷水团的消长,直接影响着大头鳕的分布和洄游,索饵洄游的鳕鱼大多分布于黄海冷水团的边缘,底层水温6~8 ℃范围是大头鳕的密集分布区,底层水温9 ℃以上的区域鱼群分布稀少,底层水温达10 ℃以上的区域基本无鳕鱼分布[1],本研究表明,底温8.5 ℃附近大头鳕幼鱼的种群密度最高,这一结论与前人的研究结果相一致。
3.2 黄海冷水团的消长对大头鳕幼鱼生长的影响夏季是黄海冷水团最强盛的时期,表底层温差达到最大,不仅为大头鳕提供了适宜生长的温度条件,同时黄海冬季冷水沉降和黄海暖流的加入[29]以及黄海表面夏季环流[4]形成的漩涡使得中央海域有机质含量最高,有利于大头鳕的生长。个体较大的大头鳕幼鱼由摄食浮游生物转向摄食底栖生物,黄海中部夏季小型底栖动物的丰度和生物量均远高于冷水团外[7],同时夏季温跃层附近也形成了溶解氧和叶绿素最大值层[30],为大头鳕幼鱼提供了丰富的饵料资源,因此夏秋季的当年生和非当年生幼鱼体重的增长显著大于体长的增加。与张人元等[9]报道的黄海大头鳕0龄个体(3.316 1)和李忠炉[14]2007—2009年阶段实验所得的b值(3.333)进行t检验,结果均显示:夏季(p>0.05)和秋季(p>0.05)差异不显著,春季(p < 0.05)差异显著;与李忠炉[14]1999—2002年阶段的大头鳕b值(2.994)进行t检验结果显示各季节差异均显著。不同种群、性别、发育阶段、寄生虫量、胃饱满度等因素均会影响b值[25, 31-32],因此造成b值差异的原因可能是研究对象年龄以及发育阶段的不同。
4 结语本文以2016—2017年黄海冷水团存在的春、夏、秋三个季节捕获到的大头鳕为研究对象,分析了当年生和非当年生幼鱼的分布及体长-体重关系。春季,大头鳕幼鱼主要分布于青海渔场、石岛渔场和连青石渔场,其中当年生幼鱼主要集中于近岸浅海水域,非当年生幼鱼则位于水深较深的东部海域。夏季,幼鱼主要位于黄海中部122.00°E以东、底温低于10 ℃的较深海域,有少部分分布于黄海北部,近岸浅水区几乎没有幼鱼分布。大头鳕幼鱼的这种分布模式与黄海冷水团强盛时期南北位置的低温中心以及索饵场的存在有关;秋季,黄海北部大头鳕幼鱼的种群密度明显降低,仅在石岛渔场和连青石渔场的种群密度仍较高。本文结合黄海冷水团的季节变化模式,分析探明了大头鳕在黄海冷水团变动影响下的季节性分布规律。本研究为探究其近年资源变动的原因,及制定合理的渔业资源保护和管理措施提供了基础数据参考。
| [1] |
赵传絪, 刘效舜, 曾炳光.中国海洋渔业资源[M].杭州: 浙江科学技术出版社, 1990. Zhao C Y, Liu X S, Zeng B G. Marine Fishery Resources of China[M]. Hangzhou: Zhejiang Science and Technology Press, 1990. (  0) 0) |
| [2] |
А. Г卡冈诺夫斯基.上层鱼类的行动与鱼群探察[M].青岛: 黄海水产研究所, 1961. А Г Kaganovsky. Action of Upper Fish and Exploration of Fish Stocks[M]. Qingdao: Yellow Sea Fisheries Research Institute, 1961. (  0) 0) |
| [3] |
苏纪兰, 袁业立.中国近海水文[M].北京: 海洋出版社, 2005: 207-246. Su J L, Yuan L Y. Offshore hydrology of China[M]. Beijing: China Ocean Press, 2005: 207-246. (  0) 0) |
| [4] |
于非, 张志欣, 刁新源, 等. 黄海冷水团演变过程及其与邻近水团关系的分析[J]. 海洋学报(中文版), 2006(5): 26-34. Yu F, Zhang Z X, Diao X Y, et al. Analysis of evolution of the Huanghai Sea Cold Water Mass and its relationship with adjacent water masses[J]. Acta Oceanologica Sinica (Chinese version), 2006(5): 26-34. (  0) 0) |
| [5] |
朱明远, 毛兴华, 吕瑞华, 等. 黄海海区的叶绿素a和初级生产力[J]. 黄渤海海洋, 1993(3): 38-51. Zhu M Y, Mao X H, Lv R H, et al. Chlorophyll a and primary productivity in the Yellow Sea[J]. Oceanography of Huanghai & Bohai Seas, 1993(3): 38-51. (  0) 0) |
| [6] |
万瑞景, 黄大吉, 张经. 东海北部和黄海南部鳀鱼卵和仔稚幼鱼数量, 分布及其与环境条件的关系[J]. 水产学报, 2002(4): 321-330. Wan J R, Huang D J, Zhang J. Abundance and distribution of eggs and larvae of Engraulis japonicus in the northern part of Yellow Sea and its relationship with environmental conditions[J]. Journal of Fisheries of China, 2002(4): 321-330. (  0) 0) |
| [7] |
刘清河, 刘晓收, 许嫚, 等. 夏季南黄海冷水团及其周边海域小型底栖动物类群组成与分布[J]. 生态学报, 2015, 35(24): 8062-8074. Liu Q H, Liu X S, Xu M, et al. Meiofaunal assemblage and distribution in the southern Yellow Sea Cold Water Mass and its adjacent waters in summer[J]. Acta Ecologica Sinica, 2015, 35(24): 8062-8074. (  0) 0) |
| [8] |
李峣, 赵宪勇, 张涛, 等. 黄海鳀鱼越冬洄游分布及其与物理环境的关系[J]. 海洋水产研究, 2007(2): 104-112. Li Y, Zhao X Y, Zhang Tao, et al. Wintering migration and distribution of anchovy in the Yellow Sea and its relation to physical environment[J]. Marine Fisheries Research, 2007(2): 104-112. (  0) 0) |
| [9] |
张人元, 卞晓东, 单秀娟, 等. 黄海大头鳕0龄幼体分布及其与环境因子的关系[J]. 水产学报, 2018, 42(6): 870-880. Zhang R Y, Bian X D, Shan X J, et al. Distribution of the age 0 group Pacific cod (Gadus macrocephalus) in the Yellow Sea and its relationship with environmental factors[J]. Journal of Fisheries of China, 2018, 42(6): 870-880. (  0) 0) |
| [10] |
薛长湖, 宋雨, 徐杰, 等. 太平洋鳕鱼脑中硫苷脂的分离纯化和分析[J]. 中国海洋大学学报(自然科学版), 2014, 44(10): 51-56. Xue C H, Song Y, Xu J, et al. The isolation and molecular species analysis of sulfatides from Codfish brain[J]. Periodical of Ocean University of China, 2014, 44(10): 51-56. (  0) 0) |
| [11] |
王珊珊, 林海燕, 朱兰兰, 等. 太平洋鳕鱼排酶解产物的制备及其钙螯合活性研究[J]. 食品安全质量检测学报, 2018, 9(1): 7-12. Wang S S, Lin H Y, Zhu L L, et al. Preparation of Gadus macrocephalus frame hydrolysate and its calcium chelating activity[J]. Journal of Food Safety and Quality, 2018, 9(1): 7-12. (  0) 0) |
| [12] |
高天翔, 杜宁, 张义龙, 等. 大头鳕(Gadus macrocephalus Tilesius)摄食食性的初步研究[J]. 海洋湖沼通报, 2003(4): 74-78. Gao T X, Du Y, Zhang Y L, et al. Preliminary study of diet of Pacific cod, Gadus macrocephalus Tilesius[J]. Transactions of Oceanology and Limnology, 2003(4): 74-78. (  0) 0) |
| [13] |
方明烈. 黄海鳕鱼(Gadus macrocephalus Tilesius)摄食习性的初步研究[J]. 海洋湖沼通报, 1982(2): 46-54. Fang M L. Preliminary studies on the feeding habits of Cod (Gadus macrocephalus Tiilesius) in the Yellow Sea[J]. Transactions of Oceanology and Limnology, 1982(2): 46-54. (  0) 0) |
| [14] |
李忠炉, 金显仕, 张波, 等. 黄海大头鳕(Gadus macrocephalus)种群特征的年际变化[J]. 海洋与湖沼, 2012, 43(5): 924-931. Li Z L, Jin X S, Zhang B, et al. Interannual variations in the population characteristics of the pacific cod Gadus macrocephalus in the Yellow Sea[J]. Oceanologia et Limnologia Sinica, 2012, 43(5): 924-931. (  0) 0) |
| [15] |
陈大刚.渔业资源生物学[M].北京: 中国农业出版社, 1997. Chen D G. Fishery Resources Biology[M]. Beijing: China Agriculture Press, 1997. (  0) 0) |
| [16] |
张以恳, 杨玉玲. 夏季北黄海冷水团多年变化特征分析[J]. 海洋预报, 1996, 13(4): 15-21. Zhang Y K, Zhang Y L. Analyses of the variational characteristics of the north Huanghai sea cold water mass[J]. Marine Forecasts, 1996, 13(4): 15-21. (  0) 0) |
| [17] |
Dunxin Hu, Qingye Wang. Interannual variability of the southern yellow sea cold water mass[J]. Chinese Journal of Oceanology and Limnology, 2004, 22(3): 231-236.
(  0) 0) |
| [18] |
邱道立, 周诗赉, 李昌明. 应用聚类分析法划分黄海水团的初步研究[J]. 海洋学报, 1984(S1): 86-98. Qiu D L, Zhou S L, Li C M. Preliminary study of Huanghai mass applying cluster analysis[J]. Acta Oceanologica sinica, 1984(S1): 86-98. (  0) 0) |
| [19] |
任慧军, 詹杰民. 黄海冷水团的季节变化特征及其形成机制研究[J]. 水动力学研究与进展:A辑, 2005, 20(S1): 887-896. Ren H J, Zhan J M. A numerical study on the seasonal variability of the Yellow Sea cold water mass and the related dynamics[J]. Journal of Hydrodynamics(Series A), 2005, 20(S1): 887-896. (  0) 0) |
| [20] |
Zhang S W, Wang Q Y, Lü Yue, et al. Observation of the seasonal evolution of the yellow sea cold water mass in 1996-1998[J]. Continental Shelf Research, 2008, 28(3): 442-457.
(  0) 0) |
| [21] |
Lehodey Patrick, Bertignac Michel, Hampton John, et al. El niño southern oscillation and tuna in the western pacific[J]. Nature, 1997, 389(6652): 715.
(  0) 0) |
| [22] |
牛明香, 李显森, 徐玉成. 智利外海竹荚鱼中心渔场时空变动的初步研究[J]. 海洋科学, 2009, 33(11): 105-109. Niu M X, Li X S, Xu Y C. Preliminary study on spatio-temporal change of central fishing ground of Chilean jack mackerel (Trachurus murphyi) in the offshore waters of Chile[J]. Marine Sciences, 2009, 33(11): 105-109. (  0) 0) |
| [23] |
贺祥, 林振山. 基于GAM模型分析影响因素交互作用对PM2.5浓度变化的影响[J]. 环境科学, 2017, 38(1): 22-32. He X, Lin Z S. Interactive effects of the influencing factors on the changes of PM2.5 concentration based on GAM model[J]. Environmental Science, 2017, 38(1): 22-32. (  0) 0) |
| [24] |
徐国强, 朱文斌, 张洪亮, 等. 基于GAM模型分析印度洋大眼金枪鱼和黄鳍金枪鱼渔场分布与不同环境因子关系[J]. 海洋学报, 2018, 40(12): 68-80. Xu G Q, Zhu W B, Zhang H L, et al. Relationship between fishing grounds of Thunnus obesus and Thunnus albacores with environmental factors in the Indian Ocean based on generalized additive model[J]. Acta Oceanologica Sinica, 2018, 40(12): 68-80. (  0) 0) |
| [25] |
Tesch F W, Ricker W E. Methods for Assessment of Fish Production in Fresh Waters[M]. Oxford: Blackwell Scientific Publications Oxford and Edinburgh, 1971.
(  0) 0) |
| [26] |
李忠炉, 金显仕, 单秀娟, 等. 小黄鱼体长-体质量关系和肥满度的年际变化[J]. 中国水产科学, 2011, 18(3): 602-610. Li Z L, Jin X S, Shan X J, et al. Inter-annual changes on body weight-length relationship and relative fatness of small yellow croaker (Larimichthys polyactis)[J]. Journal of Fishery Sciences of China, 2011, 18(3): 602-610. (  0) 0) |
| [27] |
Pauly D, Munro J L. Once more on the comparison of growth in fish and invertebrates[J]. Fishbyte, 1984, 2(1): 1-21.
(  0) 0) |
| [28] |
唐启升, 叶懋中.山东近海渔业资源开发与保护[M].北京: 农业出版社, 1990. Tang Q S, Ye M Z. Exploitation and Protection of Coastal Fishery Resources in Shandon Province[M]. Beijing: China Agriculture Press, 1990. (  0) 0) |
| [29] |
张启龙, 翁学传, 杨玉玲. 南黄海春季水团分析[J]. 海洋与湖沼, 1996(4): 421-428. Zhang Q L, Weng X C, Yang Y L. Analysis of water masses in the south Yellow Sea in spring[J]. Oceanologia et Limnologia Sinica, 1996(4): 421-428. (  0) 0) |
| [30] |
韦钦胜, 傅明珠, 李艳, 等. 南黄海冷水团海域溶解氧和叶绿素最大值现象及营养盐累积的季节演变[J]. 海洋学报(中文版), 2013, 35(4): 142-154. Wei Q S, Fu M Z, Li Y, et al. Observation of the seasonal evolution of DO, Chlorophyll a maximum phenomena and nutrient accumulating in the southern Huanghai (Yellow) Sea Cold Water Mass area[J]. Acta Oceanologica Sinica(Chinese version), 2013, 35(4): 142-154. (  0) 0) |
| [31] |
Le Cren E D. The length-weight relationship and seasonal cycle in gonad weight and condition in the perch (Perca fluviatilis)[J]. The Journal of Animal Ecology, 1951(20): 201-219.
(  0) 0) |
| [32] |
常剑波, 孙建贻, 段中华, 等. 网湖似刺鳊鮈种群生长和死亡率研究[J]. 水生生物学报, 1994(3): 230-239. Chang J B, Xiang Y, Sun J Y, et al. Study on the population growth and mortality of Paracanthobrama Guichenoti[J]. Acta Hydrobiologica Sinica, 1994(3): 230-239. (  0) 0) |
2. Shandong Hydrobios Resources Conservation and Management Center, Yantai 264000, China
 2020, Vol. 50
2020, Vol. 50


