2. 莱州明波水产有限公司, 山东 烟台 261418
斑石鲷(Oplegnathus punctatus), 俗称斑鲷、黑嘴、黑金鼓等, 隶属鲈形目(Perciformes)石鲷科(Oplegnathidae)石鲷属(Oplegnathus), 主要分布于朝鲜、日本、中国台湾以及南海、东海、黄海等海域。在自然海域中该鱼极少形成自然群体, 没有明显的盛鱼期, 且产量很小, 是目前新兴的水产品种, 具有很高的观赏价值和经济价值。当前对斑石鲷的报道主要集中在早期发育[1]、疾病免疫[2]、染色体核型[3]和线粒体DNA[4]等方面。随着人工繁殖技术的突破和养殖规模的不断扩大, 鱼类病毒性疾病频发已经成为影响产业健康稳定发展的瓶颈之一, 而对于鱼类免疫学和病毒性疾病发病机理等研究而言, 细胞系的构建是重要的技术途径, 目前, 有关斑石鲷细胞培养的研究尚未见报道。
鱼类细胞培养研究始于1960年代, Wolf等[5]建立了第一个鱼类细胞系, 即虹鳟鱼(Oncorhynchus mykiss)生殖腺细胞系RTG-2。近年来, 为了研究鱼类病原微生物, 鱼类基因功能及调控, 越来越多鱼类细胞系被建立[6-8]。作为实验材料, 鱼类细胞系与活体鱼相比有着许多优点。首先, 可节约大量实验成本及时间, 因为细胞系作为实验材料不需大型养殖设备, 不受养殖季节性的影响; 其次, 细胞实验更易精确控制实验条件, 不受鱼类病害等影响, 更易操作[9-10]; 另外, 当某鱼类配子或胚胎不可得时, 体外培养或冷冻保存的该鱼类细胞有可能作为研究该物种的细胞核供体[11]。
鱼类细胞系现已被广泛用于生理学, 毒理学, 病毒学和基因功能研究[12-14]。同时鱼类细胞系还被用于重要免疫基因的功能研究[15]。鱼类病毒的易感性具有物种特异性, 而来自同种鱼的不同组织的细胞系对病毒易感也具有特异性, 因此来源于特定物种的细胞系也更适合于分离鱼类病毒[16-18]。Dong等[2]于2010年成功分离了斑石鲷虹彩病毒(The spotted knifejaw iridovirus, SKIV-ZJ07)并进行了病毒致病性研究; Shuang等[19]于2013年对斑石鲷虹彩病毒病毒蛋白进行了研究, 这些研究中均利用了鱼类细胞系, 而斑石鲷细胞系的成功建立将为研究斑石鲷病毒病提供更合适的工具。
本实验建立了斑石鲷细胞系, 并探究了2种细胞系培养所适合的血清浓度、温度条件, 鉴定了细胞系并成功的在该细胞系中实现外源基因转入及表达。
1 材料与方法 1.1 原代培养本实验所用斑石鲷稚鱼体长约3 cm, 均取自莱州明波水产有限公司。原代培养使用组织块移植培养的方法进行培养。首先洗净实验鱼体表面, 解剖取其肌肉组织、脑组织, 分别放于灭菌培养皿内, 使用添加了青霉素、链霉素的PBS清洗5遍。将组织取出在加入DMEM/F12培养基(DMEM/F12, Gibico)的培养皿内剪成约0.1 mm3的小块, 用培养基清洗数次, 将组织小块移植到25 cm2细胞培养瓶底部, 将培养瓶倒置平放于培养箱, 24 ℃贴壁6 h后, 加入3 mL含20%胎牛血清(FBS, Gibico)的DMEM/F12的培养基(400 U/mL青霉素、400 μg/mL链霉素, NEAA, 10 ng/mL bFGF), 于24 ℃培养箱培养。每3 d更换一次培养液, 观察并记录细胞生长状况。
1.2 传代培养观察到培养瓶中组织小块周围迁出大量细胞, 并且细胞铺满培养瓶底部约90%时, 进行传代培养。移除培养液, 加入1 mL PBS清洗贴壁的细胞, 以确保移除胎牛血清。加入0.8 mL TrypLETM Express (Gibco), 显微镜下观察, 当细胞变圆脱离培养瓶底部时, 加入2 mL FBS终止消化反应, 最后加入7.2 mL DMEM/F12培养基(400 U/mL青霉素、400 μg/mL链霉素, NEAA, 10 ng/mL bFGF)使培养体系FBS浓度为20%, 进行1:2分瓶于24 ℃培养箱继续培养。细胞传至第6代时培养体系中FBS浓度降至15%, 传至35代时培养体系中FBS浓度降为10%。
1.3 最适培养条件的确定为确定适合OPPM, OPPB细胞系生长的培养温度, 预实验中将数量为2.06×105的OPPM细胞, 数量为1.65×105的OPPB细胞分别接种于3.5 cm培养皿, 培养液中FBS浓度为10%。于18、24、30、36 ℃培养箱中培养, 发现24、30 ℃条件下OPPM, OPPB细胞增殖速度较快; 18 ℃条件下细胞增殖慢, 细胞形态正常。36 ℃条件下部分细胞短时间内可正常贴壁, 但无法增殖并逐渐死亡。为进一步确定适合2种细胞系培养的温度, 将温度梯度设置为24、26、28、30、32 ℃。将数量为1.66×105的OPPM细胞, 数量为1.95×105的OPPB细胞分别接种于3.5 cm培养皿, 培养液中FBS浓度为10%。将细胞置于相应温度培养箱中培养, 分别于12、24、36、48、60、72 h时取出, 将细胞消化脱壁并在显微镜下使用血球计数板统计细胞数目。实验重复3次, 每次实验计数重复3次。
为确定适合OPPM、OPPB细胞系生长的FBS浓度, 将数量为2.36×105的OPPM细胞, 数量为1.94×105的OPPB细胞分别接种于3.5 cm培养皿, 培养液中FBS浓度分别为5%、10%、15%、20%, 于24 ℃培养箱培养。分别于12、24、36、48、60、72 h时取出, 将细胞消化脱壁并在显微镜下使用血球计数板统计细胞数目。实验重复3次, 每次实验计数重复3次。
1.4 染色体核型分析取163代的OPPM, 第157代OPPB细胞进行核型分析。细胞传代后5 h, 在培养液中加入秋水仙素(Solarbio, China), 使培养液中秋水仙素浓度0.005%。24 ℃培养箱中培养2 h后, 3 000 r/min离心5 min, 去除上清。加入800 μL 0.075 mol/L的KCl溶液, 室温低渗40 min。加入400 μL预冷的卡诺溶液(乙醇:乙酸为3:1进行配制), 4 ℃固定20 min。3 000 r/min离心5 min, 去除上清后, 加入800 μL预冷的卡诺溶液, 重悬细胞后-20 ℃固定20 min。重复固定3次。将固定的细胞进行冷滴片, 吉姆萨染液避光染片5 min后, 用蒸馏水缓慢冲净染液, 显微镜下观察、计数。染色体制片参考王旭波等[20]的研究方法。
1.5 细胞系来源鉴定使用酚-氯仿法, 提取OPPM, OPPB细胞总DNA、斑石鲷肌肉组织总DNA, DNA提取方法参考Wang等[21]的研究。设计18S rRNA基因的特异性引物, 其序列为:18S-F(5’-GGTAACGGGGAATCAGGGT-3’)和18S-R(5’-GTGGTGCCCTTCCGTCAA-3’)。PCR体系为2.5 μL taq酶缓冲液(10×), 2 μL dNTPs(10 mol/L), 引物各0.5 μL(10 μmol/L), 1 μLDNA模板, 0.2 μL taq酶, 18.3 μL水, 总体系为25 μL, 混合后进行PCR扩增。扩增条件为94℃预变性5 min, 94℃变性30 s, 55 ℃退火30 s, 72 ℃延伸1 min, 循环30次, 72 ℃延伸10 min, 12 ℃保温。将PCR产物克隆至PMD19T载体, 转化至DH5α, 检测得到阳性单克隆菌株进行测序及比对分析。
1.6 细胞冷冻保存与复苏使用TrypLETM Express将细胞消化脱壁, 转移至离心管, 离心去除上清。DMEM/F12培养基重悬细胞, 统计细胞数目后加入到细胞冻存液中, 使细胞冻存液最终的组成成分为15% FBS, 10% DMSO, 75% DMEM/F12培养基, 冻存液中细胞密度为106/mL。经程序降温后于-80 ℃冰箱过夜保存, 后于液氮中长期保存。
取液氮冷冻保存10个月后的细胞(OPPM第63代, OPPB第58代), 将冻存管迅速放于37 ℃水浴中融化, 然后将细胞转移至细胞培养瓶中, 加入4 mL含15%FBS的培养液中, 于24 ℃培养箱中培养过夜, 次日去除培养液并更换新的培养液以去除DMSO。当液氮冻存的细胞融化时, 将冻存管中细胞吹吸均匀, 取出适量的细胞, 使用台盼蓝进行染色。显微镜统计未被染色的细胞所占比例, 染色重复3次, 每次染色计数重复3次。
1.7 细胞转染实验采用脂质体LipofectamineTM 3000(Invitrogen), pEGFP-C1质粒进行转染实验。将第128代OPPM细胞, 106代OPPB细胞接种至24孔板中, 细胞完全贴壁后, PBS清洗细胞表面, 换为每孔500 μL不含FBS和抗生素的DMEM/F12培养基。将1.5 μL LipofectamineTM 3000和500 ng pEGFP-C1质粒分别稀释于25 μL培养基(不含FBS和抗生素)中, 在稀释了的质粒中再加入1 μL P3000, 将加入P3000试剂的稀释质粒加入到稀释的LipofectamineTM 3000中, 室温孵育5 min。然后将混合物加入24孔板一个孔中, 混匀。24 h后使用荧光倒置显微镜观察细胞荧光信号。
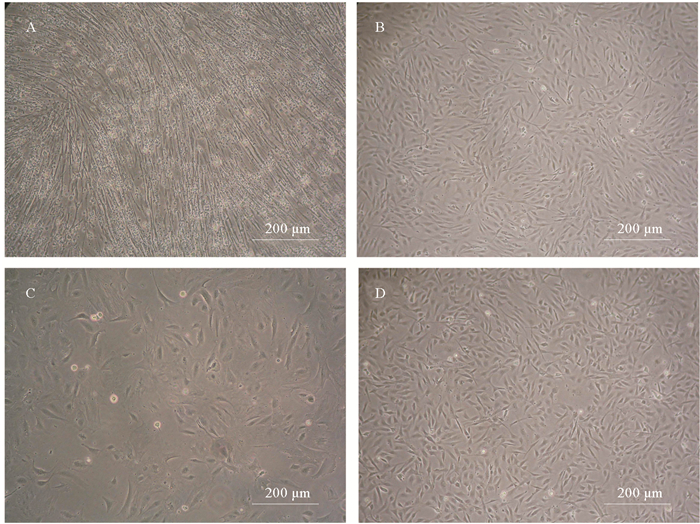
2 结果与分析 2.1 原代培养与传代培养将组织小块移植到细胞培养瓶底部, 次日显微镜观察可见少量细胞从组织小块边缘迁出。3 d更换1次培养液, 斑石鲷肌肉(OPPM)细胞原代培养8 d后, 斑石鲷脑(OPPB)细胞原代培养10 d后, 铺满细胞培养瓶底部约85%, 此时进行原瓶传代, 即按1:1进行传代。3 d后细胞铺满细胞培养瓶底部超过90%, 对其进行1:2传代。前5代培养液FBS浓度为20%, 6代后降为15%, 35代后降为10%。OPPM细胞, OPPB细胞2~3 d即可传代一次, 至今OPPM细胞已传至183代, OPPB细胞传至174代。细胞稳定增殖, 形态呈均一的成纤维样细胞, 见图 1。
|
(A.第5代OPPM细胞; B.第60代OPPM细胞; C.第5代OPPB细胞; D.第60代OPPB细胞。A.The OPPM cell line at passage 5;B.The OPPM cell line at passage 60;B.The OPPB cell line at passage 5;D.The OPPB cell line at passage 60.) 图 1 斑石鲷肌肉(OPPM)细胞, 斑石鲷脑(OPPB)细胞 Fig. 1 Morphology of OPPM and OPPB cell lines of O.punctatus |
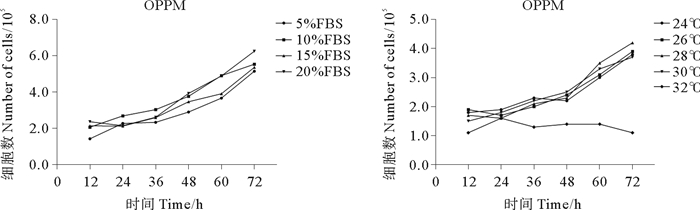
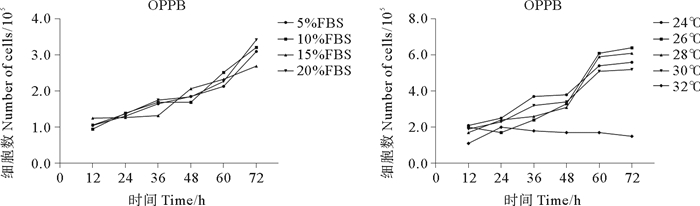
细胞接种72 h内, 5%~20% FBS浓度范围内, 不同浓度FBS对OPPM细胞的增殖速度无显著影响, 但在不添加FBS的培养基中细胞无法正常生长。28 ℃条件下OPPM细胞增殖速度最快, 为最适培养温度; 24、26、30 ℃条件下细胞增殖速度较快; 32 ℃条件下部分细胞短时间内可正常贴壁, 但无法增殖(见图 2)。细胞接种72 h内, 5%~20% FBS浓度范围内, 不同浓度FBS对OPPB细胞的增殖速度无显着影响, 但在不添加FBS的培养基中细胞无法正常生长。26 ℃条件下OPPB细胞增殖速度最快, 为最适培养温度; 24、28、30 ℃细胞增殖速度较快; 32 ℃条件下部分细胞短时间内可正常贴壁, 但无法增殖(见图 3)。
|
图 2 OPPM细胞在不同FBS浓度条件, 不同温度条件下的生长情况 Fig. 2 The growth pattern of OPPM cell line in different FBS concentration and temperature |
|
图 3 OPPB细胞在不同FBS浓度条件, 不同温度条件下的生长情况 Fig. 3 The growth pattern of OPPB cell line in different FBS concentration and temperature |
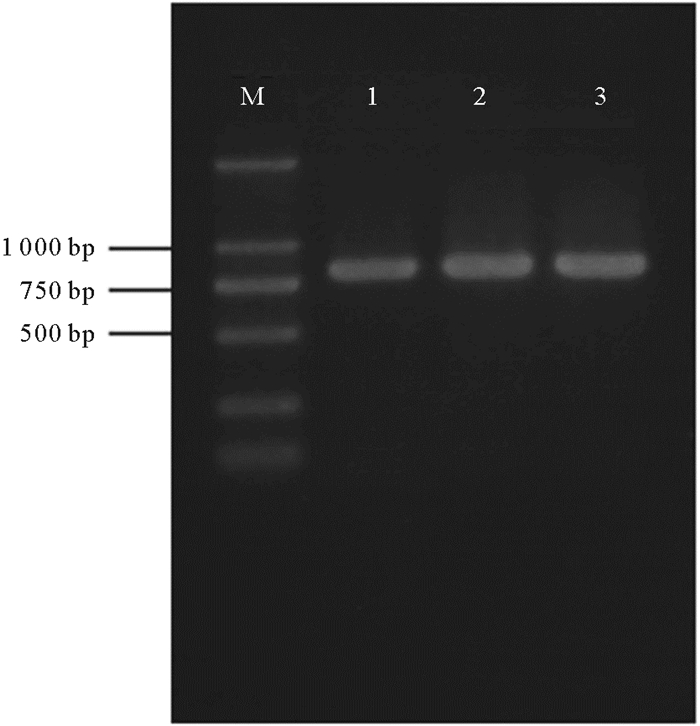
通过扩增OPPB、OPPM细胞系18S rRNA基因与斑石鲷肌肉组织18S rRNA并比较其同源性来确定细胞系来源。扩增片段长度为819 bp, 琼脂糖凝胶鉴定为单一条带(见图 4)。使用MegAlign进行DNA序列比对分析, 结果显示, OPPM、OPPB细胞系与斑石鲷18S rRNA序列相似性约为99.6%, 说明两种细胞系均来源于斑石鲷鱼。
|
(泳道1.肌肉组织; 泳道2.OPPM细胞; 泳道3.OPPB细胞; M.Marker:DL2000。Line 1.Muscle; line 2.OPPM; line 3.OPPB; M.Marker, DL2000.) 图 4 18S rRNA基因的PCR扩增结果 Fig. 4 The result of amplification 18S rRNA |
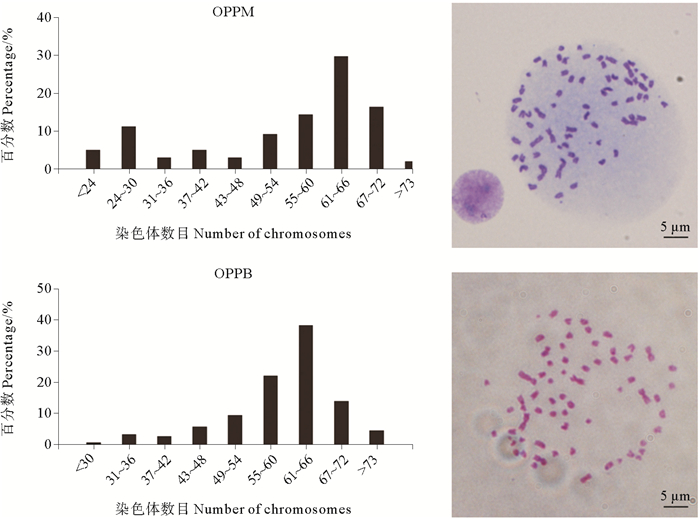
斑石鲷染色体核型为雄性2n=47, 1m+2sm+44t, 雌性2n=48, 2sm+46t[3], 而2个细胞系的染色体数目出现不同程度变异, 统计120个OPPM细胞染色体核型, 其中约60.8%的细胞染色体数目为55~72条; 统计200个OPPB细胞染色体核型, 其中约74.2%的细胞染色体数目为55~72条(见图 5)。2种细胞系染色体数目较斑石鲷二倍体核型有所增加且中部着丝粒染色体数目明显增多。OPPM细胞系中48条染色体细胞仅占3%, OPPB细胞系中48条染色体细胞仅占1.6%, 且核型全部发生了改变。
|
图 5 OPPM, OPPB细胞的核型分析 Fig. 5 The karyotype analysis of OPPM and OPPB |
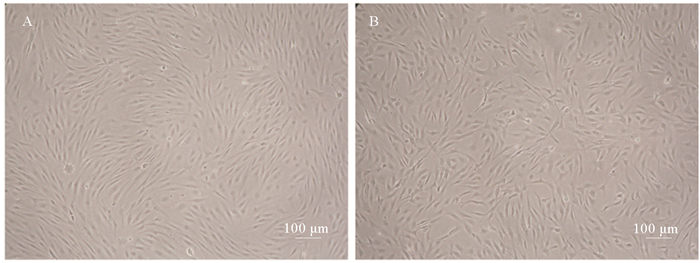
复苏冷冻保存10个月后的第63代的OPPM细胞, 经台盼蓝染色, 测的细胞存活率约为91.2%。细胞复苏后8 h内贴壁, 3 d后细胞铺满培养瓶底部, 且复苏细胞形态正常, 呈纤维样(见图 6-A), 传代后生长状态正常。复苏冻存10个月的第58代的OPPB细胞, 经台盼蓝染色, 测的细胞存活率约为86.7%。细胞复苏后8 h内贴壁, 4 d后细胞铺满培养瓶底部, 且复苏细胞形态正常, 呈纤维样(见图 6-B), 传代后生长状态正常。
|
(A.复苏3 d后的OPPM细胞; B.复苏4 d后的OPPB细胞。A.The morphology of OPPM cell line after revived 3 days; B.The morphology of OPPB cell line after revived 4 days.) 图 6 冻存10个月, 复苏后的OPPM细胞, OPPB细胞 Fig. 6 The morphology of revived OPPM and OPPB cell lines after cryostoraged 10 months |
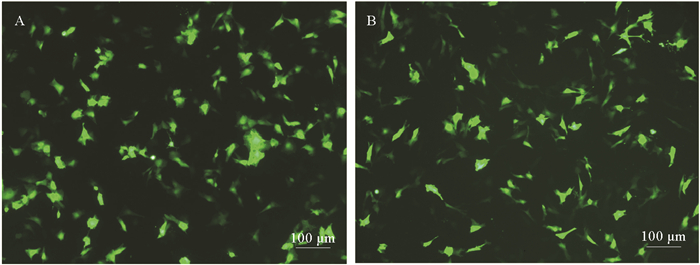
通过脂质体LipofectamineTM 3000可成功的将pEGFP-C1质粒转入OPPM、OPPB细胞。转染质粒后细胞形态未发生显著改变, 转染12 h后, 置于倒置荧光显微镜下观察, 可见部分细胞开始出现微弱的绿色荧光信号; 转染24 h可以观察到明显的绿色荧光信号; 48 h时可观察到较强的荧光信号(见图 7), 且转染效率较高。表明在OPPM和OPPB细胞系中转染pEGFP-C1后, CMV启动子成功驱动了EGFP的表达。
|
(A.OPPM细胞中EGFP的表达; B.OPPB细胞中EGFP的表达。A.The expression of EGFP in OPPM; B.The expression of EGFP in OPPB.) 图 7 转染EGFP-C1质粒后48 h, OPPM, OPPB细胞中表达EGFP Fig. 7 The expression of EGFP gene in OPPM and OPPB at 48 hours after transfecting EGFP-C1 |
本研究首次建立了斑石鲷肌肉细胞系和斑石鲷脑细胞系, 并将其分别命名为OPPM和OPPB。本实验所使用的培养基为DMEM/F12培养基, 即DMEM细胞培养基与F12细胞培养基1:1配方, 其优点为DMEM具有较高的营养物质浓度且F12培养基含有多种微量元素, 特点为促进细胞快速贴壁及生长。据LAKRA等[22]统计, 多数的鱼类细胞系培养使用了L15培养基, 而本研究选用DMEM/F12培养基成功培养斑石鲷细胞系, 说明DMEM/F12培养基也适合于鱼类细胞的原代、传代培养。
OPPM与OPPB细胞原代培养采取组织块迁出法, 实验采用体长3 cm的稚鱼, 具有生长速度快细胞分裂旺盛等特点。因此将其肌肉组织, 脑组织机械破碎至0.1 mm的组织小块后, 细胞在较短时间内迁出组织块, 在组织块周围形成单层贴壁的细胞。
OPPM细胞已传至183代, OPPB细胞已传至174代。原代细胞形态多样, 经多次传代筛选, 一些类型的细胞更适应培养环境, 增殖较快, 生命力较强, 逐渐淘汰其他类型细胞, 使细胞形态趋于均一和稳定, 主要由成纤维样细胞与上皮样细胞组成。本实验中, 采用液氮保存细胞复苏效率较高, 经台盼蓝染色计数, 细胞存活率均达到85%以上, 液氮保存超过10个月的细胞复苏后状态良好, 3~4 d即可正常传代。细胞系可以被稳定的保存, 为其作为良好的实验工具提供了保证。
OPPM和OPPB细胞在24~30 ℃条件下增殖速度较快, 其中OPPM细胞最适培养温度为28 ℃, OPPB细胞最适培养温度为26、32 ℃时细胞均无法正常增殖。斑石鲷养殖平均水温为25.3 ℃(20.3~29.6 ℃), 本文所建立的两种细胞系所适应的温度条件与斑石鲷鱼相符, 说明细胞培养所适应的环境温度与活体鱼所适宜的温度密切相关。在建立鱼类细胞系时, 应参考该种鱼所适宜的培养温度进行培养。OPPM, OPPB细胞原代培养体系中加入20% PBS, 而后续的传代培养中FBS浓度逐渐降至10%, 在此浓度时细胞可快速增殖。FBS浓度实验中, 不添加FBS的培养体系中, 细胞无法正常贴壁、生长。5%、10%、15%和20%浓度FBS下OPPM, OPPB细胞72 h内增殖速度无明显的差异, 而在日常传代中, 发现当PBS浓度小于10%, 3~4次传代后可能出现细胞生长, 增殖速度显著降低且无法正常传代的情况, 说明FBS中的活性蛋白及因子为此细胞系生长所必须。
染色体核型分析是鉴定细胞系的重要标准, Sood等[23]的研究结果表明, 体外培养第64代纹鳢(Channa striatus)胸腺细胞模式染色体数目及形态与纹鳢二倍体核型基本一致。Swaminathan等[24]的研究中鉴定了第15代及第35代锦鲤鳍细胞染色体, 结果表明其模式染色体数目与二倍体锦鲤一致。这些研究中, 鱼类细胞早期传代培养中, 染色体并未发生显著变化。在本研究中, 经历超过150次的传代, OPPM, OPPB细胞系染色体数目较斑石鲷染色体数目均有所增加, 并且染色体结构也出现显著变化, 中部着丝粒染色体数目显著增加, 说明在经历长期体外培养和多次的传代培养后, 细胞的染色体可能发生了加倍、断裂、重组融合等现象, 导致染色体数目的增加、染色体的重排和丢失等, 导致细胞成为异倍体, 这些变异可能继续发展, 需要进一步的追踪和研究。这一结果与王旭波等[20]对传代296次的牙鲆鳃细胞系染色体分析结果相类似, 在多次的传代培养后, 细胞系染色体数目增加且形态发生明显改变。
细胞转染实验可以实现目的基因的过表达及抑制表达, 从而在体外水平研究基因的功能。Sun等[25]的研究中在半滑舌鳎精巢细胞系中转染pEGFP-N3质粒, 细胞成功表达EGFP; Ku等[26]的研究中在真鲷背鳍细胞系中转染pEGFP-C3后, 可观察到绿色荧光信号; 在本研究中通过转染pEGFP-C1质粒在斑石鲷细胞系中成功表达EGFP蛋白, 上述3种质粒都含有CMV启动子, 说明CMV启动子在鱼类细胞系中可以广泛的成功启动外源基因的表达。OPPM、OPPB细胞系可以高效表达由CMV启动子启动的EGFP的表达, 预示着OPPM和OPPB可作为研究斑石鲷功能基因的体外操作平台, 为斑石鲷基因功能研究创造条件。
| [1] |
王雨福, 肖志忠, 刘清华, 等. 斑石鲷早期发育的异速生长模式[J]. 海洋科学, 2016, 40(5): 43-48. Wang Y F, Xiao Z Z, Liu Q H, et al. Spotted knifejaw (Oplegnathus punctatus) early ontogeny functional organs allometry[J]. Marine Sciences, 2016, 40(5): 43-48. DOI:10.11759//hykx20141216005 (  0) 0) |
| [2] |
Dong C, Weng S, Luo Y, et al. A new marine megalocytivirus from spotted knifejaw, Oplegnathus punctatus, and its pathogenicity to freshwater mandarinfish, Siniperca chuatsi[J]. Virus Research, 2010, 147(1): 98-106. DOI:10.1016/j.virusres.2009.10.016
(  0) 0) |
| [3] |
薛蕊, 安皓, 刘清华, 等. 斑石鲷(Oplegnathus punctatus)雌、雄鱼核型及Ag-NORs带型分析[J]. 海洋与湖沼, 2016, 47(3): 626-632. Xue R, An H, Liu Q H, et al. Karyotype and Ag-NORs in male and female of Oplegnathus punctatus[J]. Oceanologia et Limnologia Sinica, 2016, 47(3): 626-632. (  0) 0) |
| [4] |
肖志忠, 肖永双, 马道远, 等. 基于线粒体DNA部分片段探讨条石鲷与斑石鲷的亲缘关系[J]. 海洋学报(中文版), 2011, 33(5): 115-123. Xiao Z Z, Xiao Y S, Ma D Y, et al. Relationship between Oplegnathus fasciatus and O.punctatus revealed by mtDNA sequence characteristics[J]. Acta Oceanologica Sinica, 2011, 33(5): 115-123. (  0) 0) |
| [5] |
Wolf K, Quimby M. Established eurythermic line of fish cells in vitro[J]. Science, 1962, 135(3508): 1065-1066. DOI:10.1126/science.135.3508.1065
(  0) 0) |
| [6] |
Gignac S J, Vo N T, Mikhaeil M S, et al. Derivation of a continuous myogenic cell culture from an embryo of common killifish, Fundulus heteroclitus[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2014, 175(9): 15-27.
(  0) 0) |
| [7] |
Higaki S, Shimada M, Koyama Y, et al. Development and characterization of an embryonic cell line from endangered endemic cyprinid Honmoroko Gnathopogon caerulescens (Sauvage, 1883)[J]. In Vitro Cellular & Developmental Biology-Animal, 2015, 51(8): 763-768.
(  0) 0) |
| [8] |
Wang N, wang X L, Sha Z X, et al. Establishment, characterization and virus susceptibility of a kidney-derived cell line from southern flounder, Paralichthys lethostigma Jordan & Gilbert[J]. Journal of Fish Diseases, 2011, 34(1): 81-85. DOI:10.1111/jfd.2010.34.issue-1
(  0) 0) |
| [9] |
Wang Y C, Chaung R H, Tung L C. Comparison of the cytotoxicity induced by different exposure to sodium arsenite in two fish cell lines[J]. Aquatic Toxicology, 2004, 69(1): 67-79. DOI:10.1016/j.aquatox.2004.04.007
(  0) 0) |
| [10] |
Shuilleabhain S N, Mothersill C, Sheehan D, et al. In vitro cytotoxicity testing of three zinc metal salts using established fish cell lines[J]. Toxicology in Vitro, 2004, 18(3): 365-376. DOI:10.1016/j.tiv.2003.10.006
(  0) 0) |
| [11] |
Han J E, Choresca C H, Koo O J, et al. Establishment of glass catfish (Kryptopterus bicirrhis) fin-derived cells[J]. Cell biology International Reports, 2011, 18(1): 1-5. DOI:10.1042/CBR20110002
(  0) 0) |
| [12] |
Fent K. Fish cell lines as versatile tools in ecotoxicology:assessment of cytotoxicity, cytochrome P4501A induction potential and estrogenic activity of chemicals and environmental samples[J]. Toxicology in Vitro, 2001, 15(4): 477-488.
(  0) 0) |
| [13] |
Rode M, Berg T, Gjøen T. Effect of temperature on endocytosis and intracellular transport in the cell line SHK-1 derived from salmon head kidney[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1997, 117(4): 531-537. DOI:10.1016/S0300-9629(96)00414-8
(  0) 0) |
| [14] |
Pham P, Huang Y, Mosser D, et al. Use of cell lines and primary cultures to explore the capacity of rainbow trout to be a host for frog virus 3 (FV3)[J]. In Vitro Cellular & Developmental Biology-Animal, 2015, 51(9): 894-904.
(  0) 0) |
| [15] |
Xie J, Belosevic M. Functional characterization of receptor-interacting serine/threonine kinase 2 (RIP2) of the goldfish (Carassius auratus L.)[J]. Developmental & Comparative Immunology, 2015, 48(1): 76-85.
(  0) 0) |
| [16] |
Lai Y S, Murali S, Ju H Y, et al. Two iridovirus-susceptible cell lines established from kidney and liver of grouper, epinephelus awoara (temminck & schlegel), and partial characterization of grouper iridovirus[J]. Journal of Fish Diseases, 2000, 23(6): 379-388. DOI:10.1046/j.1365-2761.2000.00247.x
(  0) 0) |
| [17] |
Dewitte-Orr S, Lepic K, Bryson S, et al. Development of a continuous cell line, PBLE, from an American eel peripheral blood leukocyte preparation[J]. In Vitro Cellular & Developmental Biology-Animal, 2006, 42(8-9): 263-372.
(  0) 0) |
| [18] |
Swaminathan T R, Lakra W S, Gopalakrishnan A, et al. Development and characterization of a new epithelial cell line PSF from caudal fin of Green chromide, Etroplus suratensis (Bloch, 1790)[J]. In Vitro Cellular & Developmental Biology-Animal, 2010, 46(8): 647-656.
(  0) 0) |
| [19] |
Shuang F, Luo Y, Xiong X P, et al. Virions proteins of an RSIV-type megalocytivirus from spotted knifejaw Oplegnathus punctatus (SKIV-ZJ07)[J]. Virology, 2013, 437(2): 89-99. DOI:10.1016/j.virol.2012.12.017
(  0) 0) |
| [20] |
王旭波, 张全启, 齐洁, 等. 牙鲆鳃细胞系染色体组型的变异分析[J]. 中国水产科学, 2008, 15(3): 483-487. Wang X B, Zhang Q Q, Qi J, et al. Variation analysis of karyotypes of flounder Paralichthys olivaceus gill cell line[J]. Journal of Fishery Sciences of China, 2008, 15(3): 483-487. (  0) 0) |
| [21] |
Wang G, Lapatra S, Zeng L, et al. Establishment, growth, cryopreservation and species of origin identification of three cell lines from white sturgeon, Acipenser transmontanus[J]. Methods in Cell Science, 2004, 25(3-4): 211-220. DOI:10.1007/s11022-004-9120-x
(  0) 0) |
| [22] |
Lakra W, Swaminathan T R, Joy K. Development, characterization, conservation and storage of fish cell lines:A review[J]. Fish Physiology and Biochemistry, 2011, 37(1): 1-20. DOI:10.1007/s10695-010-9411-x
(  0) 0) |
| [23] |
Sood N, Chaudhary D, Pradhan P, et al. Establishment and characterization of a continuous cell line from thymus of striped snakehead, Channa striatus (Bloch 1793)[J]. In Vitro Cellular & Developmental Biology-Animal, 2015, 51(8): 787-796.
(  0) 0) |
| [24] |
Swaminathan T R, Basheer V, Kumar R, et al. Establishment and characterization of fin-derived cell line from ornamental carp, Cyprinus carpio koi, for virus isolation in India[J]. In Vitro Cellular & Developmental Biology-Animal, 2015, 51(7): 705-713.
(  0) 0) |
| [25] |
Sun A, Chen S L, Gao F T, et al. Establishment and characterization of a gonad cell line from half-smooth tongue sole Cynoglossus semilaevis pseudomale[J]. Fish Physiology and Biochemistry, 2015, 41(3): 673-683. DOI:10.1007/s10695-015-0037-x
(  0) 0) |
| [26] |
Ku C C, Lu C H, Wang C S. Establishment and characterization of a fibroblast cell line derived from the dorsal fin of red sea bream, Pagrus major (Temminck & Schlegel)[J]. Journal of Fish Diseases, 2010, 33(3): 187-196. DOI:10.1111/jfd.2010.33.issue-3
(  0) 0) |
2. Laizhou Mingbo Aquatic CO.Ltd., Yantai 261418, China
 2018, Vol. 48
2018, Vol. 48


