2. 江苏海洋大学 江苏省海洋生物资源与环境重点实验室, 江苏 连云港 222005;
3. 江苏海洋大学 江苏省海洋生物产业技术协同创新中心, 江苏 连云港 222005;
4. 江苏海洋大学 江苏省海洋生物技术重点实验室, 江苏 连云港 222005
龙须菜(Gracilariopsis lemaneiformis)是红藻门(Rhodophyta)江蓠科(Gracilariaceae)的一类重要的产琼胶海藻,据不完全统计,2015年世界琼胶产量的91%来自龙须菜/江蓠属海藻等[1]。龙须菜富含蛋白质、膳食纤维、微量元素、矿物质等,并且脂肪含量相对较低,因此可以作为一种理想的绿色食物,其所含藻胆蛋白、多糖具有增强免疫力和抗肿瘤的功效[2-3]。另外,新鲜的龙须菜还富含牛磺酸和谷氨酸,广泛用作鲍鱼的饵料[4-5]。根据栽培面积数据,以龙须菜为代表的江蓠栽培已成为中国第二大海藻栽培产业。
龙须菜生长迅速,在增殖过程中吸收大量氮磷等营养元素,因此其不仅具有重要的社会经济效益,还具有重要的生态效益,能有效改善水域环境,可用于构建海洋牧场和水体多营养层次综合养殖等生态系统。本文对龙须菜栽培产业现状、琼胶合成途径和诱变育种进行了综述,对产业存在的问题和未来发展前景进行了展望。
1 龙须菜栽培 1.1 技术进步历史龙须菜/江蓠在中国的人工栽培从无至有发展迅速,最早可追溯至1950年代,1970年代探索出的江蓠半人工育苗和网帘夹苗栽培技术,1980年代成功应用的“全浮筏式”栽培技术,是极大促进江蓠栽培发展的关键技术进步[6]。
为提升龙须菜栽培效率,栽培模式的优化至关重要。Yang等[7]在青岛胶州湾比较研究了水平挂养和垂直挂养两种栽培方式及栽培水层对龙须菜生长的影响,发现水平挂养较好,垂直挂养中龙须菜生长受水层影响较为明显。目前龙须菜主要采取营养繁殖,通过藻段夹苗、水平挂养、“全浮筏式”栽培。营养繁殖是直接利用收获藻体的一部分作为苗种的栽培方式,虽可以节省和减少育苗的时间、空间、设施等投入与需求,但也存在很大弊端[8-9]。近年来,基于有性生殖,通过采孢子育苗进行龙须菜栽培的方式已获得小规模试验成功[8-9]。新的栽培模式及其成熟将进一步提升栽培效率。
野生型龙须菜的适温范围是12~23 ℃,龙须菜栽培的适宜温度是12~26 ℃[10]。因此在北方较为适宜的栽培时间为5月中下旬到11月中旬,在南方是11月中旬至次年5月中旬,中国南北方适宜栽培时间恰好覆盖全年。龙须菜南移栽培思路的施行[10],形成了“南用北调”、“北用南调”的南北互调种苗的格局,实现了全国范围内的全年栽培,促进了龙须菜栽培产业的发展。
1.2 栽培产业分布与规模2003年,江蓠栽培的规模及年产量数据被收录至《中国渔业统计年鉴》(农业部渔业局,2004—2019)[11],统计表明(见图 1):江蓠栽培面积和产量在2003年是40 km2和5万t干品,到2018年分别达到90 km2和30万t干品;2010年以后,累计栽培面积及产量分别为1 126.67 km2和2 856 465 t;自2013年后中国江蓠年产量突破20万t,值得注意的是栽培面积自2016年接近100 km2后不再增长。这些变化情况说明:从2003—2018年全国江蓠栽培产量呈整体上升趋势,栽培规模除在少数年份,如2007、2017年呈现明显下滑外,均是不断增长的趋势;2010年以后线性上升趋势更为明显,龙须菜栽培产业前景看好。而栽培面积变化趋势也暗示了栽培面积的饱和。
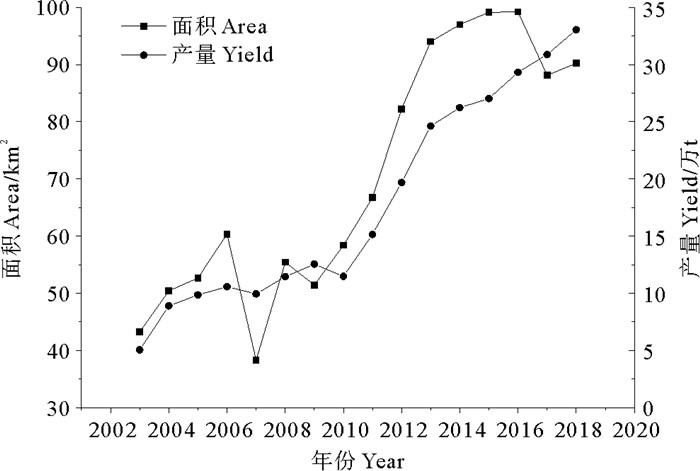
|
((作图数据引自《中国渔业统计年鉴》2004—2019[11]。Data quoted from "China Fishery Statistics Yearbook 2004—2019"[11].) ) 图 1 2003—2018年中国江蓠栽培规模及产量变化趋势 Fig. 1 Trends of the cultivated scale and yield of Gracilariaceae species in China from 2003 to 2018 |
《中国渔业统计年鉴》[11]数据显示(见图 2):栽培规模较大的省份是福建、广东和海南,福建省江蓠栽培规模发展迅速,呈逐年上升的趋势,且增幅显著,海南省与广东省江蓠栽培面积多年来保持在较为平稳的水平。近年来,随着栽培面积的扩大,“北苗南用”的栽培需要,自2013年山东省江蓠栽培也开始占有较大份额,成为江蓠栽培大省。2003年全国江蓠的产量以广东和海南省为主,两省栽培产量占全国87%;福建省自2004年开始大面积栽培江蓠,产量逐年提高,至2018年产量突破22万t,是2003年全国江蓠总产量的4倍(见图 3)。
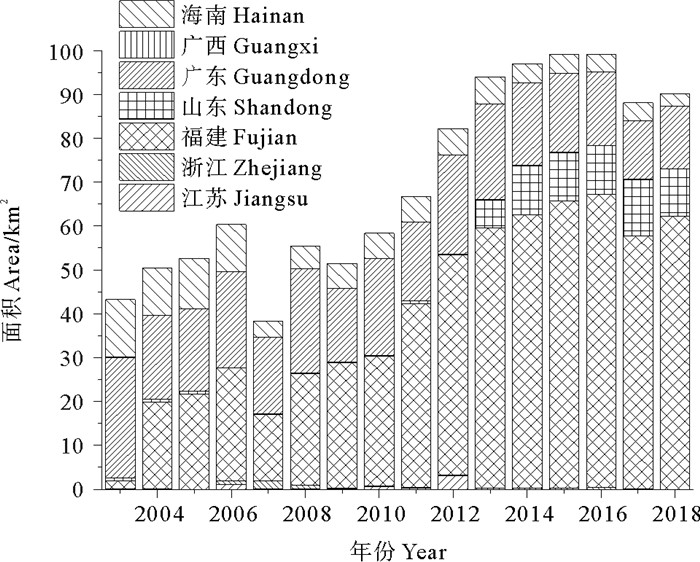
|
((作图数据引自《中国渔业统计年鉴》2004—2019[11]。Data quoted from "China Fishery Statistics Yearbook"2004—2019[11].) ) 图 2 2003—2018年中国江蓠栽培规模各省份分布情况 Fig. 2 The provincial distribution of the cultivated scale of Gracilariaceae species in China from 2003 to 2018 |
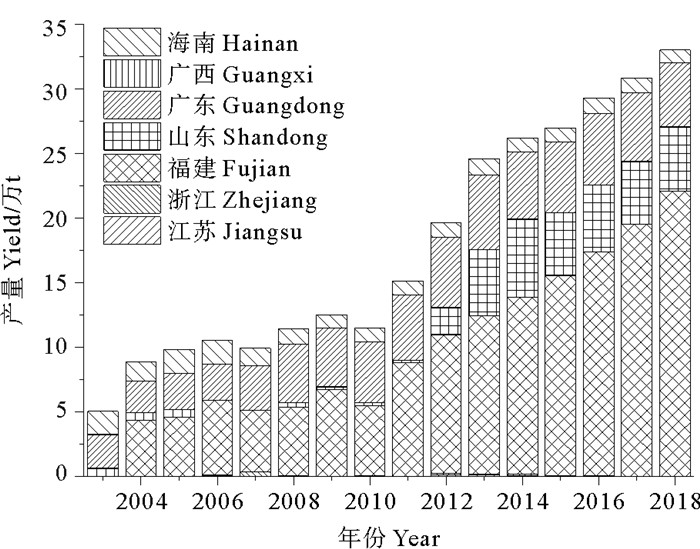
|
((作图数据引自《中国渔业统计年鉴》2004—2019[11]。Data quoted from "China Fishery Statistics Yearbook" 2004—2019[11].) ) 图 3 2003—2019年中国江蓠栽培产量各省份分布情况 Fig. 3 The provincial distribution of the cultivated yield of Gracilariaceae species in China from 2003 to 2019 |
从栽培规模和产量来看,中国江蓠的人工栽培主要集中在南方,北方相对较少,从2018年开始江蓠栽培分布在福建、山东、广东和海南四省,沿中国海岸线,栽培分布具有明显不均衡性(见图 2、3)。
1.3 栽培对生态环境的影响研究显示,每产出3.5 t干重海藻,将利用1.27 t碳(C)、0.22 t氮(N)和0.03 t磷(P),具有良好的生态环境效益。郑兵研究了龙须菜养殖与广东深澳湾环境因子的变化特征,结果显示龙须菜养殖能够有效的吸收海水中的氨态氮和无机磷[12]。研究发现龙须菜对赤潮藻的生长具有明显的抑制作用,可以有效降低赤潮藻物种的丰度[13-14]。龙须菜在生长过程中可以吸收周围水体的C、N、P等,防止海水的富营养化,对海水的净化与生物修复有着不可替代的作用[15-18]。
Zhou等[14]建立了龙须菜与黑鮶(Sebastodes fuscescens)共养体系,对5组处理体系中营养盐的变化进行定时检测,数据显示藻体生长吸收大量营养盐,生物量的变化与营养盐之间存在相关性。Wei等[19]报道了在盐田湾进行的龙须菜与牡蛎混养的“生物提取”效果,显示了混养体系在硫抽取与降低富营养状况方面的重要价值。马来西亚学者也研究了江蓠G. edulis和G. changii对养虾废水的净化效应[20]。龙须菜养殖越来越显示其生态友好的特性而应用于与动物的混养和缓解海区富营养状况的实践中。
1.4 新品种培育与特性栽培龙须菜已初步实现良种化。迄今为止,中国成功选育的龙须菜国家级水产品种已有3个,分别为:1998年审定通过的龙须菜“981”,2014年审定通过的龙须菜“2007”和2015年审定通过的龙须菜“鲁龙1号”。三个品种均是以DNA序列的非定向改变为基础,并通过人工选育,筛选出的性状优良且遗传稳定的四分孢子体,因其在生长、抗逆等经济性状上的优良表现,成为规模化栽培的首选[10, 21-24]。
“981”龙须菜,具有耐高温、抗逆速生、琼胶含量高、质量好等特点[10, 25],在很长一段时间内是唯一在应用的良种。“2007”是以“981”为出发材料经诱变选育的良种,在耐受高温、琼胶含量和品质等方面均比出发材料有提升[21, 26]。而随着栽培海域的拓展与产业的发展,对新品种提出了更多要求。“鲁龙1号”弹性大,抗风浪能力强,尤其是生长优势明显,产量比传统栽培品种提高15%~30%,蛋白含量比传统品种增加约12%[22, 24]。值得注意的是全国江蓠栽培面积自2016年接近100 km2后不再增长,而产量并不减少,同样栽培面积从2014年起增长缓慢,而产量的增长速度远超栽培面积增长(见图 2、3),这个节点与新品种“鲁龙1号”的应用高度吻合。良种的推广应用极大提高了产量和品质,惠及广大养殖群体。
2 龙须菜遗传育种 2.1 琼胶合成途径解析琼胶是一种重要的工业和食用原料,是龙须菜/江蓠的重要代谢产物。因此对琼胶代谢途径的研究是龙须菜经济性状解析的重要方面。在红藻中红藻淀粉和琼胶均位于代谢通路的末端,因此二者都是碳的储存形式。并且在红藻淀粉和琼胶的合成的代谢通路上,二者对底物UDP-葡萄糖具有一定的竞争性。琼胶合成后不分解,是一种稳定的碳储存物质,但红藻淀粉又可以分解为Glucose-1-P和Glucose-6-P,用来合成新一轮的淀粉和琼胶。许多学者根据同位素示踪技术构建了红藻琼胶和淀粉的代谢通路[27-29](见图 4)。

|
((1.甘露糖磷酸异构酶;2. GTP-甘露糖-1-磷酸鸟嘌呤基转移酶;3. GDP-D-甘露糖-表异构酶;4.葡萄糖磷酸变位酶;5. UDP-葡萄糖焦磷酸化酶;6.半乳糖-1-磷酸尿苷酰转移酶;7.淀粉合酶1. Mannose-6-phosphate isomerase, pmi; 2. Mannose-1-phosphate guanylyltransferase, mpg; 3. GDP-mannose- 3′, 5′-epimerase, gme; 4. Phosphoglucomutase, pgm; 5. UDP-glucose pyrophosphorylase, glup; 6. Galactose-1-phosphate uridylyltransferase, galt; 7. Starch synthase, fss.) ) 图 4 预测的红藻淀粉和琼胶在红藻中的代谢途径[27-29] Fig. 4 Hypothetical metabolic pathway of floridean starch and agar in red algae[27-29] |
在龙须菜中是否也存在这一琼胶代谢通路呢?一系列研究报道了龙须菜中上述代谢通路中基于单基因表达量与琼胶、淀粉含量的相关性研究。Li等[30]报道了半乳糖-1-磷酸尿苷酰转移酶(galactose-1-phosphate uridylyltransferase, galt)基因的克隆,galt基因的相对表达量与藻体的琼胶含量一定程度的相关性,推测galt基因是琼胶合成途径中的一种重要酶。张扬等[31]获得UDP-葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase, glup)基因的全长序列,并发现其表达与不同野生藻株藻体琼胶含量很强的相关性。Chang等[32]进一步发现该基因表达与不同盐度培养、P限制条件培养和四个不同栽培品系龙须菜中琼胶含量明显的正相关关系。他们的研究结果显示了参与龙须菜琼胶代谢通路同一路径酶系反应活性的一致性。
杜青伟[33]进一步对3, 6-內醚-L型半乳糖合成途径的三种酶:6-磷酸甘露糖异构酶(pmi)、甘露糖-1-磷酸鸟嘌呤基转移酶(mpg)、GDP-甘露糖-3,5-表型异构酶(gme)与淀粉合成途径末端酶:淀粉合酶(fss)的基因进行了克隆与表达调控的研究,揭示了龙须菜琼胶代谢途径不同路径的时间转换规律,也提出了琼胶含量的指示基因[33-34]。
他们的研究表明龙须菜中存在红藻中普遍类型的琼胶与淀粉代谢通路,且多个基因的表达与终产物-琼胶或淀粉含量相关。
龙须菜琼胶代谢途径和其他江蓠中基本一致。Siow等[35]通过高通量测序获得了张氏江蓠(Gracilaria changii)中GDP-mannose-3′, 5′-epimerase (gme)基因的全长序列,并证明gme基因表达量与三个江蓠物种中琼胶含量的正相关关系。Lim等[36]进一步报道了张氏江蓠琼胶含量和强度相关性标记的开发,提出可用于快速筛选高琼胶含量和高琼胶强度株系。
对于龙须菜育种而言,琼胶含量与强度是重要的产业相关性状,快速、稳定的性状关联分子标记的开发和使用可以提高遗传育种筛选的准确性,同时加速育种进程,将成为经济性状筛选的重要技术手段。
2.2 诱变育种技术基于多种分子标记与技术:核糖体RNA及其间隔区、微卫星DNA (SSR)、扩增片段长度多态性(AFLP)及限制性位点扩增多态性(RSAP),对龙须菜种群和家系内部、不同地理群体的遗传多样性分析,发现龙须菜种群/群体个体间遗传多样性较低,遗传相似系数较高的特点[37-40]。这一方面反映出龙须菜比较特殊的生存策略,另一方面则提示龙须菜种质保存应侧重更广泛的地理群体个体,而更重要的是这表明常用的选择育种方案在龙须菜遗传育种过程中可以发挥的作用有限,从而为龙须菜育种策略的选择提供了指向。
对于较低遗传多样性的物种,诱变育种无疑是快捷方便的方式。诱变育种技术根据不同作用机理,主要分为物理诱变和化学诱变。龙须菜中常用的是化学诱变。用MNNG和EMS处理龙须菜获得了多种色素突变体[41-42],成为解析龙须菜藻体颜色控制的基础材料,龙须菜良种“981”和“2007”的培育也经历了MNNG诱变处理[21, 25]。
考虑到龙须菜藻体有较厚的细胞壁,影响某些物理诱变方法的处理效果,付峰[43-44]对龙须菜缺乏厚壁的四分孢子和果孢子进行紫外线辐照诱变,来筛选抗逆速生突变体,建立了龙须菜四分孢子和果孢子的紫外诱变技术方法,及耐高温藻株的筛选方案;并获得了性状突出的株系。
魏惠惠等[45]则提供了一套采用X射线进行诱变的龙须菜诱变筛选技术方案,获得了耐高温突变株和低磷速生突变株,为下一步遗传研究和生产应用提供了材料。Jiang等[46]研究确认了低磷突变株系的生长优势,及其可能的磷代谢调控机理。
目前已有多种诱变技术在龙须菜中进行了成功的尝试和应用,提供了较为可行的技术方案,筛选的品系也具有更多类型的产业预期性状。
3 产业发展挑战与展望龙须菜栽培产业仍面临着一些需要突破的问题。在很长时期内,龙须菜主要栽培品种只有几个,且品种培育针对的性状比较单一,因此需要根据海域水文环境特征和产业下游处理和加工特点,选育海域适应性、多元化的海藻品种,以保证和促进区域化、针对性生产的需要。同时,借助现代生物技术对龙须菜进行遗传育种势在必行。建立全面稳定的龙须菜/江蓠经济性状评估技术体系,实现基于全基因组信息的聚合良种选育和重要经济性状的精细定位和鉴定具有重要意义。随着第二代与单分子测序技术的发展,越来越多的藻类完成全基因组测序,全基因组选择育种在藻类中的实现并不遥远。
基因编辑技术的出现则使分子育种技术实现飞跃性提升,如ZFN、TALEN等,尤其是CRISPR/Cas9技术[47-48],它具有其它基因编辑技术无可比拟的优势,在一些微藻中已经实现基于该技术体系的基因编辑[49-51],表明在藻类中该技术的可行性,虽然目前在大型海藻中还没有成功的报道,但考虑到该技术的高效性和应用前景,在龙须菜等大型海藻中建立这项突破性技术也是未来的发展趋势。
当前,中国龙须菜栽培仍以营养繁殖的方式,通过藻段夹苗进行育苗栽培,这种方法简单易操作,无需经过复杂的培训即可被用于生产,为广大的海藻养殖户所接受。但龙须菜栽培所需苗种直接取自浮筏架上采收的藻体,长期以来形成“南用北调”、“北用南调”的格局,也成为栽培成本与生产不可控因素之一。
鉴于营养繁殖栽培方式的缺陷,积极探索龙须菜苗种繁育的新方法,建立在龙须菜有性生殖与孢子繁育的基础之上的苗种制备,可有效地解决:栽培所需苗种来源;龙须菜渡夏室内保存问题;育苗的重复性、稳定性与可调控性;有效降低因“南用北调”、“北用南调”所产生的费用及人力、物力消耗;可大量繁育出不同遗传背景的种苗,亦可针对不同海区育苗等[8-9]。此外,完善和推广新的生态栽培模式,如与动物混养,实现改善养殖生态环境的同时,提高养殖效率。因此包括栽培方式在内的设施、技术的深入探索和研发是保障产业持续发展的关键问题之一。
另外,当前江蓠栽培仍是看天吃饭,因此充分了解龙须菜栽培产量、质量的影响因素至关重要,这需要对不同栽培海区在不同栽培季节栽培状况的持续调查观测,以为龙须菜栽培提供指导性建议和应对措施。
致谢: 感谢中国海洋大学潘克厚教授和宁波大学徐年军教授对本文提出的建设性意见和建议。
| [1] |
Porse H, Rudolph B. The seaweed hydrocolloid industry: 2016 updates, requirements, and outlook[J]. Journal of Applied Phycology, 2017, 29: 2187-2200. DOI:10.1007/s10811-017-1144-0
(  0) 0) |
| [2] |
Kang Y, Wang Z, Xie D, et al. Characterization and antitumor activity of polysaccharide from Gracilariopsis lemaneiformis[J]. Marine Drugs, 2017, 15(4): 100. DOI:10.3390/md15040100
(  0) 0) |
| [3] |
Wang X, Zhang Z, Sun X, et al. Synthesized sulfated and acetylated derivatives of polysaccharide extracted from Gracilariopsis lemaneiformis and their potential antioxidant and immunological activity[J]. International Journal of Biological Macromolecules, 2019, 124: 568-572. DOI:10.1016/j.ijbiomac.2018.11.244
(  0) 0) |
| [4] |
Qi Z, Liu H, Li B, et al. Suitability of two seaweeds, Gracilaria lemaneiformis and Sargassum pallidum, as feed for the abalone Haliotis discus hannai Ino[J]. Aquaculture, 2010, 300(1): 189-193.
(  0) 0) |
| [5] |
Xuan X, Wen X, Li S, et al. Potential use of macro-algae Gracilaria lemaneiformis in diets for the black sea bream, Acanthopagrus schlegelii, juvenile[J]. Aquaculture, 2013, 412: 167-172.
(  0) 0) |
| [6] |
车轼. 海带 裙带菜 紫菜 江蓠—海水安全优质养殖技术丛书[M]. 山东: 山东科学技术出版社, 2009. Che S. Laminaria, Undaria, Porphyra, Gracilaria-Series Book on the Safe and High Quality Mariculture Techniques[M]. Shandong: Press of Shandong Scientific Technology, 2009. (  0) 0) |
| [7] |
Yang Y F, Fei X G, Song J M, et al. Growth of Gracilaria lemaneiformis under different cultivation conditions and its effects on nutrient removal in Chinese coastal waters[J]. Aquaculture, 2006, 254(1-4): 248-255. DOI:10.1016/j.aquaculture.2005.08.029
(  0) 0) |
| [8] |
周伟.龙须菜优良种质筛选及其固碳效能与分子生物学的基础研究[D].青岛: 中国海洋大学, 2014. Zhou W. Strain Selection, Carbon Sequestration Efficiency and Basic Research in Molecular Biology of Gracilariopsis/Gracilaria lemaneiformis[D]. Qingdao: Ocean University of China, 2014. (  0) 0) |
| [9] |
Zhou W, Sui Z, Wang J, et al. Mass cultivation of economically important red alga Gracilariopsis lemaneiformis (Gracilariaceae, Rhodophyta) from tetraspores and carpospores[J]. Aquaculture, 2016, 460: 25-31. DOI:10.1016/j.aquaculture.2016.03.052
(  0) 0) |
| [10] |
张学成, 费修绠. 全国水产原良种审定委员会审定品种——981龙须菜及其栽培技术介绍[J]. 科学养鱼, 2008(6): 21-22. Zhang X C, Fei X G. Approved cultivar by national aquaculture commission for original and improved varieties-981 Gracilariopsis lemaneiformis and its cultivation techniques[J]. Scientific Fish Farming, 2008(6): 21-22. (  0) 0) |
| [11] |
农业部渔业局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2004. Department of Fisheries, Ministry of Agriculture. China Fishery Statistics Yearbook[M]. Beijing: China Agriculture Press, 2004. (  0) 0) |
| [12] |
郑兵.深澳湾环境因子的变化特征与龙须菜养殖的生态效应[D].汕头: 汕头大学, 2009. Zheng B. Variation Characteristics of Environmental Factors and Ecological Effects of Gracilaria lemaneiformis in Shen'ao Bay, Eastern Coast of Guangdong[D]. Shantou: Shantou University, 2009. (  0) 0) |
| [13] |
Wang Y, Yu Z, Song X, et al. Effects of macroalgae Ulva pertusa (Chlorophyta) and Gracilaria lemaneiformis (Rhodophyta) on growth of four species of bloom-forming dinoflagellates[J]. Aquatic Botany, 2007, 86(2): 139-147. DOI:10.1016/j.aquabot.2006.09.013
(  0) 0) |
| [14] |
Zhou Y, Yang H, Hu H, et al. Bioremediation potential of the macroalga Gracilaria lemaneiformis (Rhodophyta) integrated into fed fish culture in coastal waters of north China[J]. Aquaculture, 2006, 252(2): 264-276.
(  0) 0) |
| [15] |
Han T, Jiang Z, Fang J, et al. Carbon dioxide fixation by the seaweed Gracilaria lemaneiformis in integrated multi-trophic aquaculture with the scallop Chlamys farreri in Sanggou Bay, China[J]. Aquaculture International, 2013, 21(5): 1035-1043. DOI:10.1007/s10499-012-9610-9
(  0) 0) |
| [16] |
Yang Y F, Fei X G, Song J M, et al. Growth of Gracilaria lemaneiformis under different cultivation conditions and its effects on nutrient removal in Chinese coastal waters[J]. Aquaculture, 2006, 254(1): 248-255.
(  0) 0) |
| [17] |
林贞贤, 汝少国, 杨宇峰. 大型海藻对富营养化海湾生物修复的研究进展[J]. 海洋湖沼通报, 2007, 4: 128-134. Lin Z X, Ru S G, Yang Y F. Prospect for bioremediation of large-sized seaweed cultivation in eutrophic bays[J]. Transactions of Oceanology and Limnology, 2007, 4: 128-134. (  0) 0) |
| [18] |
毛玉泽, 杨红生, 周毅, 等. 龙须菜(Gracilaria lemaneiformis)的生长、光合作用及其对扇贝排泄氮磷的吸收[J]. 生态学报, 2006, 26(10): 3225-3231. Mao Y Z, Yang H S, Zhou Y, et al. Studies on growth and photosynthesis characteristics of Gracilaria lemaneiformis and its capacity to uptake ammonium and phosphorus from scallop excretion[J]. Acta Ecologica Sinica, 2006, 26(10): 3225-3231. DOI:10.3321/j.issn:1000-0933.2006.10.009 (  0) 0) |
| [19] |
Wei Z L, Huo Y L Z, Liu Q, et al. A field scale evaluation of Gracilaria lemaneiformis co-cultured with Crassostrea gigas as a nutrient bioextraction strategy in Yantian Bay, China[J]. Algal Research, 2019, 38: 101407. DOI:10.1016/j.algal.2019.101407
(  0) 0) |
| [20] |
Mawi S, Krishnan S, Fadhil Md D M, et al. Bioremediation potential of macroalgae Gracilaria edulis and Gracilaria changii co-cultured with shrimp wastewater in an outdoor water recirculation system[J]. Environmental Technology & Innovation, 2020, 17: 100571.
(  0) 0) |
| [21] |
孟琳, 徐涤, 陈伟洲, 等. 龙须菜新品系07-2的筛选及性状分析[J]. 中国海洋大学学报(自然科学版), 2009, 39(S1): 94-98. Meng L, Xu D, Chen W Z, et al. Selection and characterization of a new strain of Gracilaria lemaneiformis[J]. Periodical of Ocean University of China, 2009, 39(S1): 94-98. (  0) 0) |
| [22] |
王津果, 隋正红, 周伟, 等. 龙须菜新品系ZC的生长和生理生化参数的测定及其SCAR标记的开发[J]. 中国海洋大学学报(自然科学版), 2014, 44(11): 37-44. Wang J G, Sui Z H, Zhou W, et al. The determination of growth, physiological, biochemical parameters and the development of SCAR marker of the new strain ZC of Gracilariopsis lemaneiformis (Rhodophyta)[J]. Periodical of Ocean University of China, 2014, 44(11): 37-44. (  0) 0) |
| [23] |
于喆. 龙须菜"2007"[J]. 中国水产, 2014(12): 59-60. Yu J. Gracilaria lemaneiformis "2007"[J]. Chinese Aquaculture, 2014(12): 59-60. (  0) 0) |
| [24] |
周伟, 隋正红. 龙须菜"鲁龙1号"[J]. 中国水产, 2016(3): 56-57. Zhou W, Sui Z H. Gracilariopsis lemaneiformis "Lulong No.1"[J]. Chinese Aquaculture, 2016(3): 56-57. DOI:10.3969/j.issn.1002-6681.2016.03.026 (  0) 0) |
| [25] |
张学成, 费修绠, 王广策, 等. 江蓠属海藻龙须菜的基础研究与大规模栽培[J]. 中国海洋大学学报(自然科学版), 2009, 39(5): 947-954. Zhang X C, Fei X G, Wang G C, et al. Genetic studies and large scale cultivation of Gracilaria lemaneiformis[J]. Fournal of Ocean University of China, 2009, 39(5): 947-954. (  0) 0) |
| [26] |
陈伟洲, 徐涤, 王亮根, 等. 两个龙须菜新品系经济性状及琼胶特性的初步研究[J]. 中国海洋大学学报(自然科学版), 2009, 39(3): 437-442. Chen W Z, Xu D, Wang G L, et al. Preliminary study on economic characteristics and agar characteristics of two new strains of Gracilaria lemaneiformis[J]. Periodical of Ocean University of China, 2009, 39(3): 437-442. (  0) 0) |
| [27] |
Barbier Guillaume, Oesterhelt Christine, Larson M D, et al. Comparative genomics of two closely related unicellular thermo-acidophilic red algae, Galdieria sulphuraria and Cyanidioschyzon merolae, reveals the molecular basis of the metabolic flexibility of Galdieria sulphuraria and significant differences in carbohydrate metabolism of both algae[J]. Plant Physiology, 2005, 137: 460-474. DOI:10.1104/pp.104.051169
(  0) 0) |
| [28] |
Viola Roberto, Nyvall Pi, Pedersen Marianne. The unique features of starch metabolism in red algae[J]. Proceedings of The Royal Society B-Biological Sciences, 2001, 268: 1417-1422. DOI:10.1098/rspb.2001.1644
(  0) 0) |
| [29] |
Yu S K. Enzymes of Floridean Starch and Floridoside Degradation in Red Algae[D]. Sweden: Uppsala University, 1992.
(  0) 0) |
| [30] |
Li M, Sui Z, Kang K, et al. Cloning and analysis of the galactose-1-phosphate uridylyltransferase (galt) gene of Gracilariopsis lemaneiformis (Rhodophyta) and correlation between gene expression and agar synthesis[J]. Journal of Applied Phycology, 2010, 22(2): 157-164. DOI:10.1007/s10811-009-9435-8
(  0) 0) |
| [31] |
张杨, 隋正红, 丁弘叶, 等. 龙须菜UDP-葡萄糖焦磷酸化酶的克隆及其表达与琼胶产量的关系[J]. 中国海洋大学学报(自然科学版), 2011, 41(1/2): 80-86. Zhang Y, Sui Z H, Ding H Y, et al. Cloning and analysis of the UDP-glucose pyrophosphorylase (UGPase) gene of Gracilaria leimaneiformis (Rhodophyta) and correlation between gene expression and agar synthesis[J]. Periodical of Ocean University of China, 2011, 41(1/2): 80-86. (  0) 0) |
| [32] |
Chang L, Sui Z, Fu F, et al. Relationship between gene expression of UDP-glucose pyrophosphorylase and agar yield in Gracilariopsis lemaneiformis (Rhodophyta)[J]. Journal of Applied Phycology, 2014, 26(6): 2435-2441. DOI:10.1007/s10811-014-0277-7
(  0) 0) |
| [33] |
杜青伟.龙须菜质体基因组进化分析及红藻琼胶和淀粉合成途径相关基因的克隆及其表达调控的研究[D].青岛: 中国海洋大学, 2016. Du Q. Evolutionary Analysis of Chloroplast Genome and Studies on the Gene Cloning and Expressions Regulations Involving in the Pathway of Agar and Floridean Starch Synthesis of Gracilariopsis lemaneiformis (Rhodophyta)[D]. Qingdao: Ocean University of China, 2016. (  0) 0) |
| [34] |
Hu Y, Du Q, Mi P, et al. Gene cloning and expression regulation in the pathway of agar and floridean starch synthesis of Gracilariopsis lemaneiformis (Rhodophyta)[J]. Journal of Applied Phycology, 2019, 31(3): 1889-1896. DOI:10.1007/s10811-018-1690-0
(  0) 0) |
| [35] |
Siow R S, Teoh S, Teo S S, et al. Molecular cloning and characterization of GDP-mannose-3′, 5′-epimerase from Gracilaria changii[J]. Journal of Applied Phycology, 2013, 25(5): 1309-1318. DOI:10.1007/s10811-013-9987-5
(  0) 0) |
| [36] |
Lim Y Y, Lee W K, Lim P E, et al. Expression analysis of potential transcript and protein markers that are related to agar yield and gel strength in Gracilaria changii (Rhodophyta)[J]. Algal Research, 2019, 41: 101532. DOI:10.1016/j.algal.2019.101532
(  0) 0) |
| [37] |
李敏, 隋正红, 易恒, 等. 龙须菜5.8S rRNA和ITS区的克隆与系统学分析[J]. 中国海洋大学学报(自然科学版), 2009, 39(1): 77-83. Li M, Sui Z H, Yi H, et al. Cloning and sequence analysis of 5. 8S rRNA and ITS region between 18S and 28S rRNA of Gracilaria lemaneiformis (Rhodophyta)[J]. Periodical of Ocean University of China, 2009, 39(1): 77-83. (  0) 0) |
| [38] |
Pang Q Q, Sui Z H, Kang K H, et al. Application of SSR and AFLP to the analysis of genetic diversity in Gracilariopsis lemaneiformis (Rhodophyta)[J]. Journal of Applied Phycology, 2010, 22(5): 607-612. DOI:10.1007/s10811-009-9500-3
(  0) 0) |
| [39] |
郭伟华, 隋正红, 胡依依, 等. 基于SSR和RSAP的龙须菜作图群体多态性标记开发与亲本间遗传距离的估计与比较[J]. 水产学报, 2015, 39(1): 24-30. Guo W H, Sui Z H, Hu Y Y, et al. Development of polymorphic markers and estimation and comparison of genetic distances among parents of mapping population of Gracilariopsis lemaneiformis (Rhodophyta) based on SSR and RSAP analysis[J]. Journal of Fisheries of China, 2015, 39(1): 24-30. (  0) 0) |
| [40] |
Hu Y, Sui Z, Zhou W, et al. Development of genomic simple sequence repeat markers and genetic diversity analysis of Gracilariopsis lemaneiformis (Rhodophyta)[J]. Journal of Applied Phycology, 2018, 30: 707-716. DOI:10.1007/s10811-017-1237-9
(  0) 0) |
| [41] |
Zhang X C, van der Meer J P. A genetic study on Gracilaria sjoestedtii[J]. Canadian Journal of Botany, 1988, 66: 2022-2026. DOI:10.1139/b88-276
(  0) 0) |
| [42] |
张学成, 张锦东, 隋正红, 等. 江蓠属藻胆蛋白的研究Ⅰ诱变、突变体筛选及藻胆蛋白的光谱特性[J]. 青岛海洋大学学报, 1996, 26(3): 318-326. Zhang X C, Zhang J D, Sui Z H, et al. Studies on phycobiliprotein of Gracilaria Ⅰ mutagnesis, screening of mutant and spectrum characters of phycobiliprotein[J]. Journal of Qingdao Ocean University, 1996, 26(3): 318-326. (  0) 0) |
| [43] |
付峰.龙须菜紫外诱变育种及抗逆速生优良品系的选育[D].青岛: 中国海洋大学, 2013. Fu F. The Ultraviolet Mutagenesis Breeding and Selection Of Stress Tolerance and Fast Growth Strains of Gracilariopsis lemaneiformis[D]. Qingdao: Ocean University of China, 2013. (  0) 0) |
| [44] |
Fu F, Sui Z, Zhou W, et al. UV-irradiation mutation of tetraspores of Gracilariopsis lemaneiformis and screening of thermotolerant strains[J]. Journal of Applied Phycology, 2014, 26(1): 647-656. DOI:10.1007/s10811-013-0087-3
(  0) 0) |
| [45] |
魏惠惠, 隋正红, 王津果, 等. 龙须菜果孢子的X射线诱变及优势突变体的筛选[J]. 中国海洋大学学报(自然科学版), 2016, 46(9): 50-58. Wei H H, Sui Z H, Wang J G, et al. X-ray-irradiation mutation on carpospores of Gracilariopsis lemaneiformis and screening of mutants with superiority traits[J]. Periodical of Ocean University of China, 2016, 46(9): 50-58. (  0) 0) |
| [46] |
Jiang M, Wei H, Chen H, et al. Expression analysis of three phosphate transporter genes in the fast-growing mutants of Gracilariopsis lemaneiformis (Rhodophyta) under low phosphorus condition[J]. Journal of Applied Phycology, 2019, 31(3): 1907-1919. DOI:10.1007/s10811-018-1679-8
(  0) 0) |
| [47] |
Ishino Y, Shinagawa H, Makino K, et al. Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product[J]. Journal of Bacteriology, 1987, 169(12): 5429-5433. DOI:10.1128/JB.169.12.5429-5433.1987
(  0) 0) |
| [48] |
Wiedenheft B, Sternberg S H, Doudna J A. RNA-guided genetic silencing systems in bacteria and archaea[J]. Nature, 2012, 482(7385): 331-338. DOI:10.1038/nature10886
(  0) 0) |
| [49] |
Chen H L, Li S S, Huang R, et al. Conditional production of a functional fish growth hormone in the transgenic line of Nannochloropsis oculata (Eustigmatophyceae) 1[J]. Journal of Phycology, 2008, 44(3): 768-776. DOI:10.1111/j.1529-8817.2008.00508.x
(  0) 0) |
| [50] |
Wang Q, Lu Y, Xin Y, et al. Genome editing of model oleaginous microalgae Nannochloropsis spp. by CRISPR/Cas9[J]. The Plant Journal, 2016, 88(6): 1071-1081. DOI:10.1111/tpj.13307
(  0) 0) |
| [51] |
Nymark M, Sharma A K, Sparstad T, et al. A CRISPR/Cas9 system adapted for gene editing in marine algae[J]. Scientific Reports, 2016, 6: 24951. DOI:10.1038/srep24951
(  0) 0) |
2. Jiangsu Key Laboratory of Marine Bioresources and Environment, Jiangsu Ocean University, Lianyungang 222005, China;
3. Co-Innovation Center of Jiangsu Marine Bio-industry Technology, Lianyungang 222005, China;
4. Jiangsu Key Laboratory of Marine Biotechnology, Jiangsu Ocean University, Lianyungang 222005, China
 2020, Vol. 50
2020, Vol. 50

