莱茵衣藻(Chlamydomonas reinhardtii)是实验室研究中最常用的模式生物[1]。这种单细胞真核绿藻,因其培养条件简单、生长周期短、生长速度快、光合效率高而被称为“光合酵母”[2]。迄今为止,已经实现了对莱茵衣藻核基因组、叶绿体基因组和线粒体基因组的遗传转化[3-5]。Su等[6]首次利用别藻蓝蛋白基因(apcA和apcB)构建莱茵衣藻叶绿体表达载体,并实现2个基因在莱茵衣藻叶绿体中的正确表达。表明在莱茵衣藻中表达藻胆蛋白具有可行性。
藻胆体(Phycobilisome, PBS)是位于蓝藻和红藻类囊体膜基质侧表面的大型水溶性捕光复合体[7]。藻胆体能吸收较宽范围波长(490~650 nm)的光能,将能量传递给光合作用的反应中心,继而驱动光合电子传递[8-10]。而位于藻胆体核心的别藻蓝蛋白,包括α和β亚基,由其组成的三聚体(αβ)3是藻胆体核心的主要成分,别藻蓝蛋白核心直接与类囊体膜上的光合反应核心相接触[11],因此能够将藻红蛋白和藻蓝蛋白吸收的光能传递给类囊体膜上的反应中心。
近年来,藻胆蛋白的异源重组表达的有关报道并不少见。Zhao等[12]在大肠杆菌中表达了共价结合藻胆素的别藻蓝蛋白α和β亚基,Arciero等[13]在大肠杆菌中共表达脱辅基藻胆蛋白α和β亚基,并且在没有藻胆素的情况下形成单体。而且,越来越多的研究表明藻胆蛋白可以与异源光系统间进行能量传递,在容寿榆[14]等的研究中,就发现藻胆体与菠菜光系统Ⅱ可以进行能量传递。李文军等[15]和尚孟慧[16]的研究结果证实,重组藻胆蛋白与天然藻胆蛋白一样可以提高植物类囊体的光吸收能力。
包括陆生高等植物在内的以叶绿素为主要捕光色素的绿色光合生物捕光光谱极窄,仅能捕获利用极小波长范围内的可见光。而以藻胆体为捕光结构的光合藻类能高效捕获并利用500~650 nm区域内的可见光,能弥补叶绿素a (最大吸收为440和670 nm)吸收光谱中的部分空白[17]。因此,为探索拓宽真核绿藻的吸收光谱,提高其光能利用效率的方法,本研究首次在莱茵衣藻中尝试表达有光学活性的别藻蓝蛋白β亚基,探究其对莱茵衣藻光系统的光能传递和生长状况的影响。值得注意的是,由于别藻蓝蛋白生物合成中的一个重要步骤是发色团通过硫醚键共价结合于载脂别藻蓝蛋白中特定半胱氨酸(Cys)残基[18]。发色团藻蓝胆素的生物合成是血红素相继在血红素氧化酶(Ho)和铁氧还蛋白氧化还原酶(PcyA)催化的还原和异构作用中产生[19]。因此,本研究中同时表达了血红素氧化酶基因(ho)和铁氧还蛋白氧化还原酶基因(pcyA),以生成藻蓝胆素使别藻蓝蛋白具有光学活性。本研究将为探究别藻蓝蛋白与类囊体膜光系统之间的光能传递规律提供新的途径,为利用重组别藻蓝蛋白提高异源类囊体膜光系统的光合作用进行新探索。
1 材料与方法 1.1 实验材料和培养条件莱茵衣藻细胞壁缺失突变株(Chlamydomonas reinhardtii CC-849),获自衣藻资源中心(University of Minnesota)。藻株在Tris-醋酸盐-磷酸盐(TAP)培养基(pH为6.8~7.0)中混合营养培养,培养温度为23 ℃,以100 r/min的转速振荡培养。
节旋藻(Arthrospira platensis)保存于中国海洋大学藻类遗传育种与生物技术实验室。藻株在Zarrouk培养基中培养,培养温度为25 ℃。
莱茵衣藻转化载体的构建基于载体pHyg3,该载体购于明尼苏达大学(University of Minnesota)的衣藻资源中心,其含有莱茵衣藻β-2微管蛋白启动子,莱茵衣藻rbcS2基因3′非翻译区以及赋予载体潮霉素B抗性的吸水链霉菌氨基糖苷磷酸转移酶基因(aph7)[20]。
针对转化藻株的光合系统的测定和生长影响的实验,分别设置: 低光照强度(25 μmol·m-2 ·s-1)和高光照强度(50 μmol·m-2·s-1);白光(380~780 nm)和绿光(500~560 nm)。
1.2 载体构建莱茵衣藻转化载体pHyg3-apcB-ho-pcyA的构建基于pHyg3,首先实验室前期工作已经通过克隆分别得到ho和pcyA,而后分别将其与莱茵衣藻β-2微管蛋白启动子和莱茵衣藻rbcS2基因3′非翻译区连接构建各自的表达框架,通过酶切连接到转化载体pHyg3,得到pHyg3-ho-pcyA[21]。与此同时,通过PCR扩增得到将钝顶节旋藻(Arthrospira platensis)的别藻蓝蛋白β亚基基因(apcB),引入KpnI和BssHⅡ两个酶切位点。与上述步骤相同的是,将apcB与莱茵衣藻β-2微管蛋白启动子和莱茵衣藻rbcS2基因3′非翻译区连接组成表达框,并利用KpnⅠ和BssHⅡ位点与质粒pHyg3-ho-pcyA相连接。最终得到莱茵衣藻转化载体pHyg3-apcB-ho-pcyA。
1.3 莱茵衣藻核转化及阳性克隆的筛选莱茵衣藻转化过程基于Kindle所描述的方法[22]。将细胞培养至指数生长期。在20 ℃,经离心后浓缩藻细胞至108个细胞/mL。将其同5 μg转化质粒和400 μg灭菌玻璃珠(直径425~600 μm)一起涡旋振荡15 s进行转化。转化后的混合液以新鲜的三羟甲基氨基甲烷醋酸盐(TAP)培养基重悬后接种于1.5%琼脂平板(含10 μg/mL的潮霉素B的TAP培养基)。将平板在50 μmol·m-2·s-1的光照下于23 ℃环境中倒置培养10~15 d,长出单藻落,从平板上挑取单克隆,培养3 d后以之为模板,根据钝顶节旋藻别藻蓝蛋白β亚基基因、血红素氧化酶基因和铁氧还蛋白氧化还原酶基因设计引物,进行PCR筛选阳性藻株。分别将含有质粒pHyg3-apcB-ho-pcyA的藻株命名为Cr-ApcBHP,而将未经基因转化的对照藻株CC-849简称为cc849。
1.4 Southern印记分析使用植物基因组DNA提取试剂盒(TAKARA)提取转化藻株与对照藻株的基因组DNA,用限制酶SalⅠ/BglⅡ和XhoⅠ/ HindⅢ酶切3 h以进行β亚基(apcB)和铁氧还蛋白氧化还原酶基因(pcyA)的Southern Blot验证,而用HindⅢ/MluⅠ和KpnⅠ/ HindⅢ酶切以进行血红素氧化酶基因(ho)的Southern Blot验证。apcB、ho和pcyA经扩增并纯化后用于制备Dig标记的探针。然后使用DIG High Prime DNA Labeling and Detection Starter KitⅠ(Roche)完成Southern印迹(Southern blot)分析。
1.5 实时定量PCR(qRT-PCR)分析使用E.Z.N.A.TM酵母RNA试剂盒(Omega)提取低光与高光环境,绿光与白光环境下的培养藻液的总RNA。使用PrimeScriptTM RT Master Mix(TaKaRa)将RNA反转录为cDNA。以反转录得到cDNA为模板,根据apcB、ho和pcyA以及源自莱茵衣藻的内参蛋白基因RACK1设计引物用于qRT-PCR分析。RACK1作为内参基因。每个藻株有3个生物学重复,进行3次技术重复。按照Livak等的ΔΔCT法分析处理数据[23]。
1.6 蛋白免疫印迹分析离心收获培养至对数中期的莱茵衣藻。经超声破碎、煮沸变性,获得蛋白样品进行SDS-PAGE(其中含有15%的分离胶和5%的浓缩胶)。然后根据钝顶节旋藻别藻蓝蛋白β亚基肽链部分序列制备一抗,并使用山羊抗兔IgG过氧化物酶结合物作为二抗。通过蛋白免疫印迹(Western Blot)检测别藻蓝蛋白β亚基的表达。
1.7 叶绿素含量的测定按照Porra等[24]的公式:
| $ \begin{gathered} \operatorname{Chl}(\mu \mathrm{g} / \mathrm{mL})=17.76\left(\mathrm{OD}_{647}-\mathrm{OD}_{750}\right)+ \\ 7.34\left(\mathrm{OD}_{664}-\mathrm{OD}_{750}\right) 。\end{gathered} $ |
用80%的丙酮提取莱茵衣藻培养物的总色素。用分光光度计测量OD647、OD664和OD750以计算总叶绿素浓度(μg/mL),每个藻株有3个生物学重复。
1.8 低温(77K)荧光发射光谱测定20 ℃,3 000 g离心20 min浓缩细胞,并重悬于新鲜TAP培养基,使所有样品总叶绿素浓度统一为50 μg/mL,根据Akio的方法[25],将细胞重悬于含有15%的PEG4000的新鲜TAP培养基中。样品暗适应15 min后, 测量77 K下650~800 nm的荧光发射光谱,其中狭缝宽度为5 nm,激发波长为435(对于叶绿素a)和620 nm(对于别藻蓝蛋白),每个样品有3个生物学重复。
1.9 莱茵衣藻光合作用参数测定莱茵衣藻光系统Ⅰ(PSⅠ)和光系统Ⅱ(PSⅡ)的光能电子传递效率(ETR)通过Dual-PAM-100系统(Heinz Walz GmbH,Effeltrich,德国)进行测定[26]。所有藻株培养到第4天,首先20 ℃,3 000 g离心20 min浓缩细胞,并重悬于新鲜TAP培养基,使所有样品总叶绿素浓度统一为50 μg/mL并使其暗适应3 min后,测定样品的快速光响应曲线,每个藻株有3个生物学重复。
1.10 生长曲线测定对在不同培养环境下培养的莱茵衣藻转化藻株与对照藻株的生长速率和生物量积累进行测量。将新鲜的已活化的莱茵衣藻接种到不含潮霉素B的300 mL TAP培养基中。初始细胞浓度为5×105个细胞/mL。每天通过分光光度计测量所有藻株在750 nm处的吸光值,以绘制实验中的生长曲线,每个样品有3个生物学重复。
2 结果 2.1 莱茵衣藻转化载体pHyg3-apcB-ho-pcyA的构建经过KpnI和BssHⅡ酶切连接后,构建了pHyg3-apcB-ho-pcyA基因表达载体(见图 1),通过玻璃珠转化法转化入莱茵衣藻中,从平板上筛选阳性菌落,分别用apcB、ho和pcyA的引物进行PCR以验证其阳性。凝胶电泳结果表明(见图 2),在cc849的泳道中未发现外源基因条带。藻株Cr-ApcBHP的泳道中清楚地显示了apcB表达框、ho表达框和pcyA表达框大小分别为1 823、1 912和1 605 bp的条带,每个表达框中皆包含β-2微管蛋白启动子、目标基因以及rbcS2基因3′非翻译区终止子。初步表明质粒pHyg3-apcB-ho-pcyA成功转化到莱茵衣藻中。
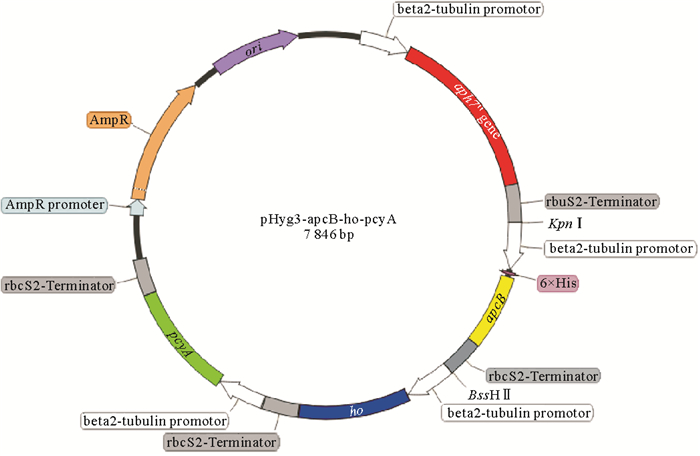
|
(beta2-tubulin promotor:莱茵衣藻β-2微管蛋白启动子;rbcS2-Terminator:莱茵衣藻rbcS2基因3′非翻译区;aph7″:潮霉素B抗性的吸水链霉菌氨基糖苷磷酸转移酶基因;apcB:别藻蓝蛋白β亚基基因;ho:血红素氧化酶基因;pcyA:铁氧还蛋白氧化还原酶基因。beta2-tubulin promotor: Chlamydomonas reinhardtii β-2 tubulin promoter; rbcS2-Terminator: The 3′ untranslated region of rbcS2 gene in Chlamydomonas reinhardtii; aph7″: The aminoglycoside phosphotransferase gene of Streptomyces absorbent resistant to hygromycin B; apcB: β-subunit geneof allophycyanin; ho: Heme oxygenase gene; pcyA: Ferridoxin oxidoreductase gene. ) 图 1 莱茵衣藻转化载体pHyg3-apcB-ho-pcyA Fig. 1 Transformation vector pHyg3-apcB-ho-pcyA of Chlamydomonas reinhardtii |
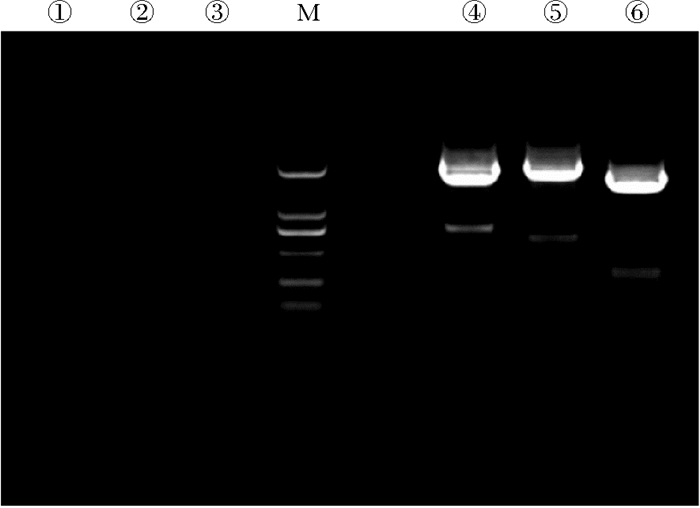
|
(泳道1~3为以cc849为模板,分别用apcB,ho和pcyA的引物进行的PCR。第4~6泳道分别为以Cr-ApcBHP为模板,分别用apcB,ho和pcyA的引物进行的PCR。泳道M是DNA标准品(100~2 000 bp)。Lanes 1~3 are PCR with primers of apcB, ho and pcyA using cc849 as template. Lanes 4~6 are PCR with primers apcB, ho and pcyA using Cr-ApcBHP as template. Lane M is Marker (100~2 000 bp).) 图 2 cc849和Cr-ApcBHP的转化基因PCR结果 Fig. 2 PCR results of transformed genes of cc849 and Cr-ApcBHP |
为了确定apcB、ho和pcyA基因已整合到转化子基因组中,从Cr-ApcBHP中提取基因组DNA并进行Southern印迹(Southern blot)分析。通过高保真DNA聚合酶扩增完整的apcB、ho和pcyA序列以用于探针制备。
结果如图 3所示,当用XhoⅠ/ HindⅢ酶切时,对于apcB和pcyA,Cr-ApcBHP都有一个条带,当用SalI/BglⅡ酶切时,apcB基因检测结果有2个条带,而pcyA基因检测结果有一个条带,未转化藻株cc849中没有杂交条带。用HindⅢ/MluⅠ和KpnⅠ/HindⅢ酶切基因组DNA检测ho基因时,各有一条不同于未转化的对照藻株cc849的条带。这表明外源基因apcB、pcyA和ho已成功整合到转基因藻株Cr-ApcBHP的基因组中。
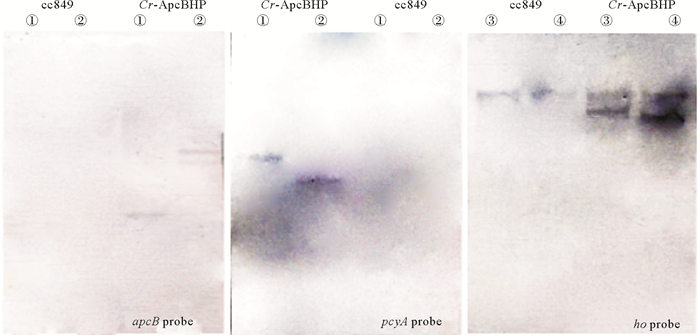
|
(分别使用apcB、pcyA和ho的探针进行。泳道①~④分别表示样品被限制性内切酶XhoⅠHindⅢ、SalⅠ/BglⅡ、HindⅢ/MluⅠ、KpnⅠ/HindⅢ酶切。This was done using probes for apcB, pcyA and ho, respectively. Lanes ①~④ indicated that the samples were digested by XhoⅠHindⅢ, SalⅠ/BglⅡ, HindⅢ/MluⅠ, KpnⅠ/HindⅢ, respectively.) 图 3 cc849和Cr-ApcBHP的Southern印迹 Fig. 3 Southern blot of cc849 and Cr-ApcBHP |
为了研究别藻蓝蛋白β亚基基因在转基因藻株中的表达,将转化藻株Cr-ApcBHP和对照藻株cc849进行蛋白免疫印迹(Western blot)分析。
如图 4所示,在样品Cr-ApcBHP所在的第2泳道中,有1个大小约为51 kDa的印迹和一条在17 kD的杂交条带,对照cc849所在的泳道①上没有相应大小蛋白条带。该结果表明别藻蓝蛋白β亚基已在莱茵衣藻中成功表达。根据条带大小,推测别藻蓝蛋白β亚基在藻株Cr-ApcBHP中可能更多的是作为三聚体存在。

|
(对照cc849位于泳道1,Cr-ApcBHP位于泳道2。The control cc849 is located in lane 1 and Cr-ApcBHP in lane 2. ①别藻蓝蛋白β亚基多聚Allophy cocyanin β submit polymer; ②别藻蓝蛋白β亚基Allophy cocyanin β submit.) 图 4 Cr-ApcBHP和cc849的蛋白免疫印迹 Fig. 4 Western blot of Cr-ApcBHP and cc849 |
在培养过程中提取转基因和对照莱茵衣藻的RNA用于分析apcB、ho和pcyA的转录水平。
结果显示在图 5中。转录水平以内参蛋白基因荧光定量值作为参考计算,所得值再与对照未转化藻株中相应基因的荧光定量值相比较。在低光实验和高光实验中,Cr-ApcBHP中apcB、ho和pcyA均成功地转录,相比之下,在高光条件下,别藻蓝蛋白β亚基在转基因莱茵衣藻转录水平更高。
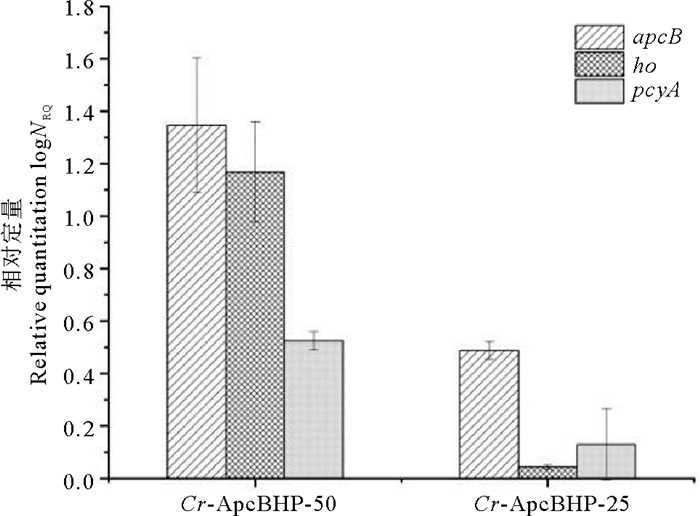
|
(apcB:别藻蓝蛋白基因的β亚基基因;ho:血红素氧化酶基因;pcyA:铁氧还蛋白氧化还原酶基因;Cr-ApcBHP-50:高光条件下Cr-ApcBHP藻株;Cr-ApcBHP-25:低光条件下Cr-ApcBHP藻株。apcB: β-subunit gene of allophycyanin gene; ho: Heme oxygenase gene; pcyA: Ferridoxin oxidoreductase gene; Cr-ApcBHP-50: Cr-ApcBHP strain under high light condition; Cr-ApcBHP-25: Cr-ApcBHP strain under low light condition.) 图 5 高光和低光条件转基因莱茵衣藻中apcB、ho和pcyA的转录水平分析 Fig. 5 Analysis of transcript levels of apcB, ho and pcyA in transgenic Chlamydomonas reinhardtii under high and low light conditions |
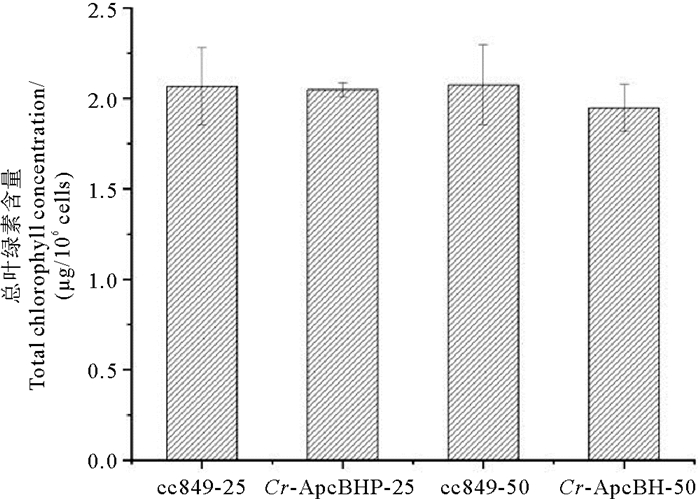
细胞内叶绿素水平是光合作用的重要生理指标[27]。别藻蓝蛋白中的藻蓝胆素和叶绿素都是光合色素, 而两者的生物合成都源自原卟啉Ⅸ,则藻蓝胆素的合成与叶绿素竞争原卟啉Ⅸ,故转基因藻株中叶绿素的生物合成可能受到限制。而叶绿素是绿藻光合作用核心天线的唯一组成色素和外围天线的重要组成色素[28],其含量对莱茵衣藻的光合作用与生长不可或缺。为了研究别藻蓝蛋白β亚基基因的表达是否影响叶绿素含量,本论文研究了每个藻株中总叶绿素的含量(见图 6)。
|
(cc849:对照藻株cc849;Cr-ApcBHP:转化藻株Cr-ApcBHP;-25:低光条件(25 μmol·m-2·s-1);-50:高光条件(50 μmol·m-2·s-1)。cc849: Control algae strain cc849; Cr-ApcBHP: Transformed algae strain Cr-ApcBHP; -25: Low light condition (25 μmol·m-2·s-1); -50: High light condition(50 μmol·m-2·s-1).) 图 6 高光和低光条件下cc849,Cr-ApcBHP中的总叶绿素含量(/106个细胞) Fig. 6 Total chlorophyll content in cc849 and Cr-ApcBHP under high and low light conditions (/106 cells) |
将藻株cc849,Cr-ApcBHP中的总叶绿素含量分别命名为TChlcc849,TChlCr-ApcBHP。在低光实验中,TChlCr-ApcBHP略低于TChlcc849(p=0.914 699)。在高光实验中,TChlCr-ApcBHP略低于TChlcc849(p=0.553 386),但是差异均不显著。因此可以推测Cr-ApcBHP中叶绿素含量的降低是由于Ho和PcyA的共同催化下合成的藻蓝胆素与叶绿素竞争前体物质,导致叶绿素含量降低,藻蓝胆素使得别藻蓝蛋白β亚基产物具有光学活性。而相对来说,高光条件下,转化藻株与对照cc849二者间的叶绿素含量差异更大,由此说明,高光条件下,ho基因和pcyA基因的表达水平更高,这同转录水平分析结果中高光条件下各基因的表达水平更高而导致更多前体物质被合成藻蓝胆素相符合。但是总体说来,转基因藻株的叶绿素的含量变化并不显著。
2.4.3 重组别藻蓝蛋白β亚基的表达对莱茵衣藻77 K低温荧光发射光谱的影响将藻株Cr-ApcBHP和对照cc849在低光(25 μmol·m-2·s-1)和高光(50 μmol·m-2·s-1)环境中培养,在波长为435(叶绿素a的特征激发波长)和620 nm(别藻蓝蛋白的特征激发波长)的激发光中激发,并测量低温荧光发射光谱,以确定重组别藻蓝蛋白β亚基对莱茵衣藻光系统的影响。
如图 7A所示,在435 nm激发后,低光照实验组中,Cr-ApcBHP在690和715 nm处(代表PSⅡ和PSⅠ的荧光发射峰)的峰值远远高于对照cc849(p=1.201 921×10-10,p=1.257 201×10-6),而前者差别更加显著。高光实验组中,Cr-ApcBHP在690 nm处的峰值与cc849相差不显著(p=0.708 700),在715 nm处的峰值低于对照cc849(p=0.011 842)。结果表明,低光条件下Cr-ApcBHP中的重组别藻蓝蛋白β亚基对莱茵衣藻的光合系统具有更积极的促进作用。
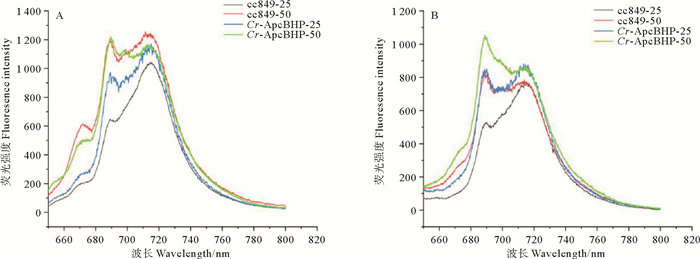
|
(A: 435 nm激发后的荧光发射光谱; B: 620 nm激发后的荧光发射光谱。cc849:对照藻株cc849;Cr-ApcBHP:转化藻株Cr-ApcBHP;-25:低光条件(25 μmol·m-2·s-1);-50:高光条件(50 μmol·m-2·s-1)。A: Fluorescence emission spectra after excitation at 435 nm; B: Fluorescence emission spectra after excitation at 620 nm. cc849: Control algae strain cc849; Cr-ApcBHP: Transformed algae strain Cr-ApcBHP; -25: Low light condition (25 μmol·m-2·s-1); -50: High light condition(50 μmol·m-2·s-1).) 图 7 cc849,Cr-ApcBHP藻株的低温荧光发射光谱 Fig. 7 Low temperature fluorescence emission spectra of algal strain cc849 and Cr-ApcBHP |
在620 nm激发后(见图 7B),在别藻蓝蛋白的特征峰(660 nm)的位置,荧光值有所提升。无论是低光照还是高光实验组中,Cr-ApcBHP在690和715 nm处(代表PSⅡ和PSⅠ的荧光发射峰)峰值皆显著高于对照cc849(PS Ⅱ:pCr-ApcBHP-25=5.022 835 6×10-12,pCr-ApcBHP-50=8.457 434×10-10;PS I:pCr-ApcBHP-25=4.492 505×10-7,pCr-ApcBHP-50=6.166 577×10-8)。2种培养条件下,相较于对照cc849,PSⅡ处的荧光发射峰值比PS Ⅰ提高更加显著。
2.4.4 重组别藻蓝蛋白β亚基的表达对莱茵衣藻光合作用影响的分析对于培养至第4天的转基因和对照莱茵衣藻的样品,测量并记录了其PS Ⅰ和PS Ⅱ的表观电子传递速率(ETRPSⅠ和ETRPSⅡ)。对于ETRPSⅡ,无论在低光还是高光实验中,Cr-ApcBHP的ETRPSⅡ值均显著高于cc849(低光下p=0.049 576 1,高光下p=0.014 351)(见图 8A)。对于ETRPS I(见图 8B),低光实验中,Cr-ApcBHP的ETRPSⅠ值与cc849的相似(p=0.815 269),但略高于对照cc849的ETRPSⅠ。高光环境下,Cr-ApcBHP的ETRPSⅠ和cc849几乎相同(p=0.999 666)。以上结果表明,重组别藻蓝蛋白β亚基的表达对莱茵衣藻光合作用系统的电子传递速率有一定影响,特别是对PSⅡ。而只有在低光下ETRPSⅠ才稍有波动,差异不显著。结合低温荧光发射图谱结果来看,在一定程度上说明了低光照条件下,重组别藻蓝蛋白对莱茵衣藻转化藻株的光合作用的影响比高光照更显著。两个结果分别从光学变化和电子传递上证明重组别藻蓝蛋白β亚基对PSⅡ的促进作用更加显著。
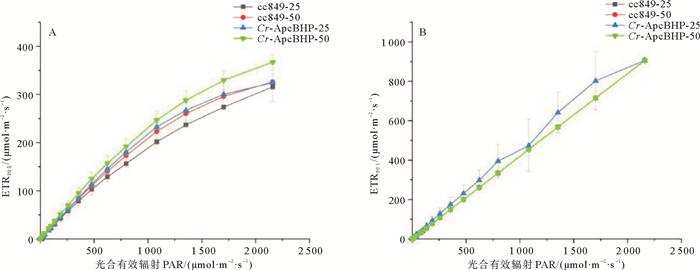
|
(A: PSⅡ的表观电子传递速率(ETRPSⅡ);B: PSⅠ的表观电子传递速率(ETRPSⅠ)。cc849:对照藻株cc849;Cr-ApcBHP:转化藻株Cr-ApcBHP;-25:低光条件(25 μmol·m-2·s-1);-50:高光条件(50 μmol·m-2·s-1)。A: Apparent electron transfer rate of PSⅡ (ETRPSⅡ); B: Apparent electron transfer rate of PSⅠ(ETRPSⅠ). cc849: Control algae strain cc849; Cr-ApcBHP: Transformed algae strain Cr-ApcBHP; -25: Low light condition (25 μmol·m-2·s-1); -50: High light condition(50 μmol·m-2·s-1).) 图 8 高光与低光实验中PS Ⅰ和PS Ⅱ的表观电子传递速率 Fig. 8 Apparent electron transfer rates of PSⅠ and PSⅡ in high light and low light experiments |
如图 9所示,低光实验中Cr-ApcBHP在前8天与cc849几乎相同(p=0.945 499),但第8天以后Cr-ApcBHP仍保持稳定,而cc849仍略有上升。在高光实验中,Cr-ApcBHP和cc849生长速率显著高于低光条件,Cr-ApcBHP的生长速率较cc849略低,在第3天进入稳定期后,Cr-ApcBHP的细胞密度比cc849低,但差别不大(p=0.647 538)。第7天以后,cc849的细胞密度仍处于增长的状态,Cr-ApcBHP的细胞密度开始略有下降,二者的差距越来越大,但差异不显著(高光照p=0.076 616,低光照p=0.186 147)。
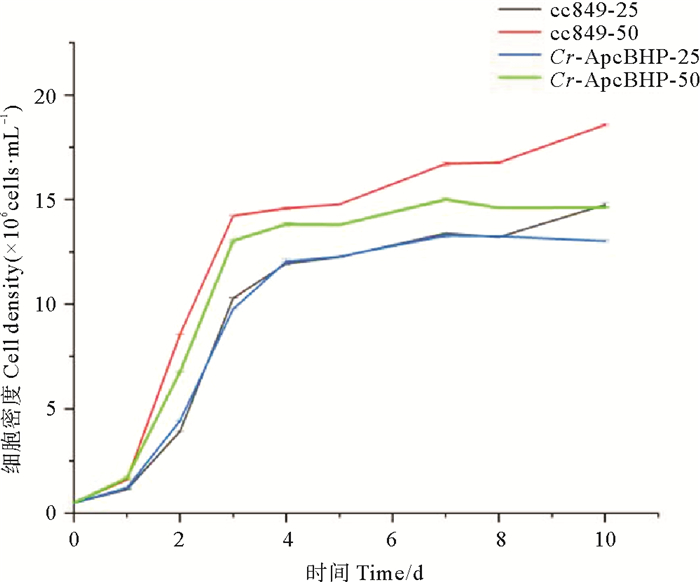
|
(cc849:对照藻株cc849;Cr-ApcBHP:转化藻株Cr-ApcBHP;-25:低光条件(25 μmol·m-2·s-1);-50:高光条件(50 μmol·m-2·s-1)。cc849: Control algae strain cc849; Cr-ApcBHP: Transformed algae strain Cr-ApcBHP; -25: Low light condition (25 μmol·m-2·s-1); -50: High light condition(50 μmol·m-2·s-1).) 图 9 高光和低光条件下莱茵衣藻藻株的生长曲线 Fig. 9 Growth curves of Chlamydomonas reinhardtii strain under high and low light conditions |
叶绿素a的最大吸收峰位于420和663 nm,不能有效吸收利用绿光(500~560 nm),绿光培养下莱茵衣藻的光合作用受到限制。但别藻蓝蛋白的最大吸收峰位于650 nm,相比于叶绿素a更偏向于绿色光,为了研究转入别藻蓝蛋白是否可以弥补其吸收光谱中绿色光部分的空缺,因此通过设置绿光条件来探究重组别藻蓝蛋白β亚基对宿主藻株的光能利用率和生长的影响。
2.5.1 实时定量PCR(qRT-PCR)分析别藻蓝蛋白β亚基的转录情况提取绿光和白光培养下转基因和对照莱茵衣藻的RNA用于转录水平分析。Cr-ApcBHP中apcB、ho和pcyA均成功地转录。相比之下,在白光条件下,别藻蓝蛋白β亚基在转基因莱茵衣藻转录水平更高(见图 10)。
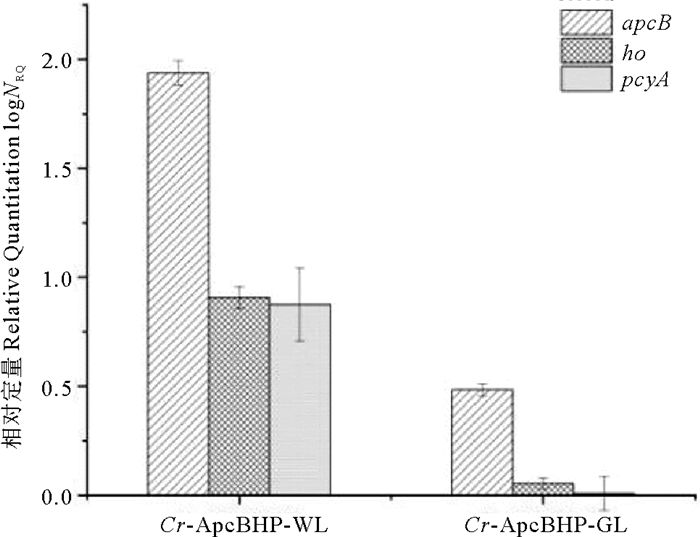
|
(apcB:别藻蓝蛋白基因的β亚基基因;ho:血红素氧化酶基因;pcyA:铁氧还蛋白氧化还原酶基因;Cr-ApcBHP-WL:白光条件下Cr-ApcBHP藻株;Cr-ApcBHP-GL:绿光条件下Cr-ApcBHP藻株。apcB: β-subunit gene of allophycyanin gene; ho: heme oxygenase gene; pcyA: Ferridoxin oxidoreductase gene; Cr-ApcBHP-WL: Cr-ApcBHP strain under white light condition; Cr-ApcBHP-GL: Cr-ApcBHP strain under green light condition.) 图 10 转基因莱茵衣藻的转录水平分析 Fig. 10 Transcript level analysis of transgenic Chlamydomonas reinhardtii |
每个藻株中总叶绿素含量随时间的变化趋势如图 11所示。在绿光实验中,TChlCr-ApcBHP始终低于TChlcc849。在白光实验中,TChlCr-ApcBHP低于TChlcc849。可见藻蓝蛋白的表达对叶绿素的前体物原卟啉Ⅸ的争夺影响了叶绿素的含量。绿光培养叶绿素总量显著低于白光,可见单一绿光培养对莱茵衣藻的叶绿素限制很大,别藻蓝蛋白的表达,进一步限制了叶绿素的含量。
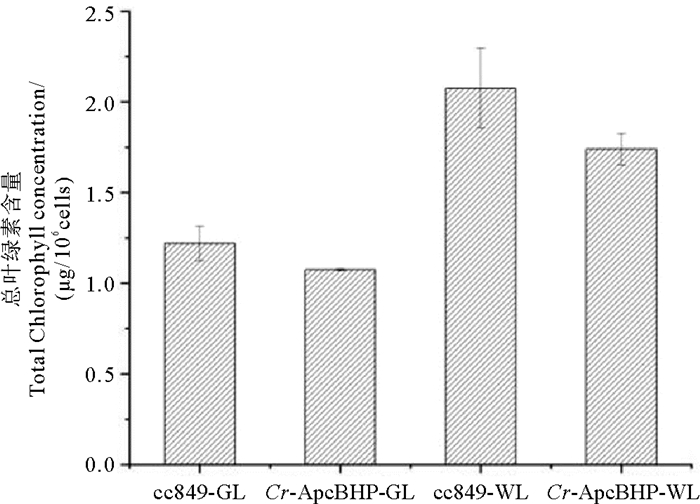
|
(cc849:对照藻株cc849;Cr-ApcBHP:转化藻株Cr-ApcBHP;-WL:白光条件;-GL:绿光条件。cc849: Control algae strain cc849; Cr-ApcBHP: Transformed algae strain Cr-ApcBHP; -WL: white light condition; -GL: green light condition. ) 图 11 白光和绿光条件下cc849,Cr-ApcBHP中的总叶绿素含量(/106个细胞) Fig. 11 Total chlorophyll content in cc849, Cr-ApcBHP under white and green light conditions (/106 cells) |
将藻株Cr-ApcBHP和对照cc849在白光和绿光环境中培养,在波长为435 nm(叶绿素a的特征激发波长)和620 nm(别藻蓝蛋白的特征激发波长)的激发光中激发并检测低温荧光发射光谱以确定重组别藻蓝蛋白β亚基对莱茵衣藻光系统的影响。如图 12A所示,在435 nm激发后,在白光实验中,Cr-ApcBHP在690 nm处(代表PSⅡ的荧光发射峰)和在715 nm处(代表PSⅠ的荧光发射峰)的峰值的显著高于对照cc849(PSⅡ:pCr-ApcBHP=1.009 852×10-23;PSⅠ:pCr-ApcBHP=1.353 437×10-10)。同样,在绿光环境中,Cr-ApcBHP在690 nm处和在715 nm处的峰值均高于对照cc849,差异性更加显著。(PSⅡ:pCr-ApcBHP=6.947 937×10-28;PSⅠ:pCr-ApcBHP=2.238 862×10-14)。
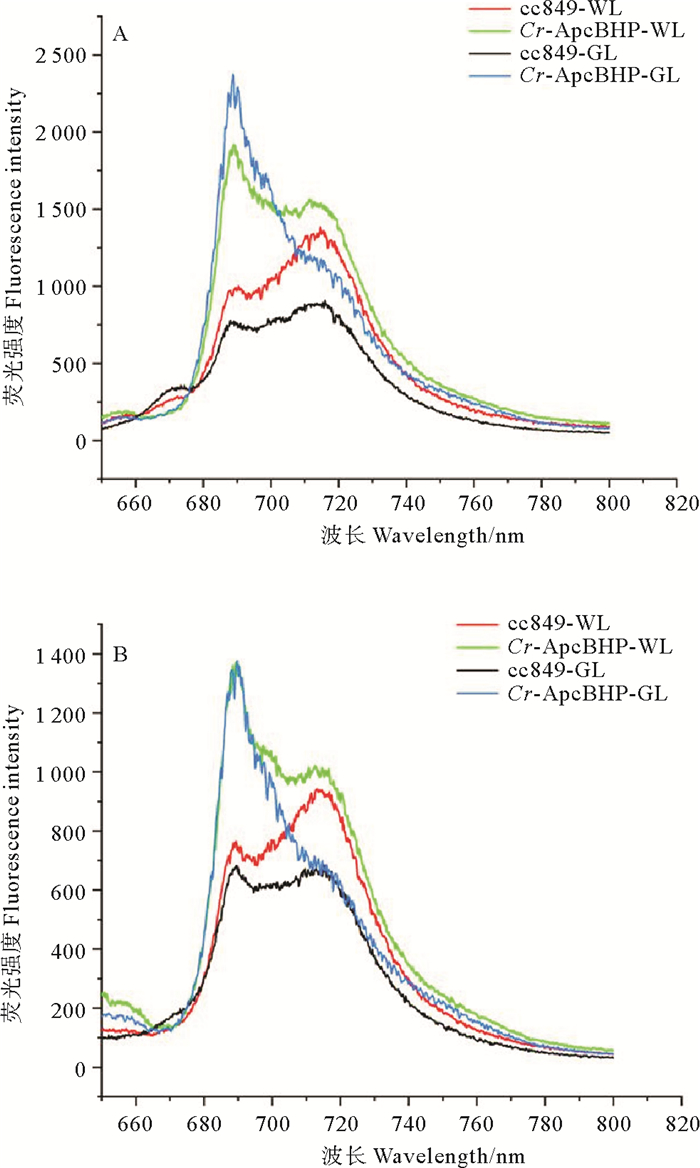
|
(A: 435 nm激发后的荧光发射光谱; B: 620 nm激发后的荧光发射光谱。cc849:对照藻株cc849;Cr-ApcBHP:转化藻株Cr-ApcBHP;-WL:白光条件;-GL绿光条件A. Fluorescence emission spectra after 435 nm excitation; B. Fluorescence emission spectra after 620 nm excitation.cc849: Control algae strain cc849; Cr-ApcBHP: Transformed algae strain Cr-ApcBHP; -WL: white light condition; -GL: green light condition. ) 图 12 白光和绿光实验中cc849,Cr-ApcBHP藻株的低温荧光发射光谱 Fig. 12 Low temperature fluorescence emission spectra of cc849 and Cr-ApcBHP algal strain in white and green light experiments |
在620 nm激发后(见图 12B),在别藻蓝蛋白的特征峰(660 nm)的位置,Cr-ApcBHP具有较小的荧光发射峰。在白光实验以及绿光实验中,Cr-ApcBHP在690 nm处(代表PSⅡ的荧光发射峰)和715 nm处(代表PSⅠ的荧光发射峰)的峰值都显著高于对照cc849(PSⅡ:pCr-ApcBHP-WL=4.725 355×10-19,pCr-ApcBHP-GL=2.557 763×10-24;PSⅠ:pCr-ApcBHP-WL=1.608 576×10-7,pCr-ApcBHP-GL=0.004 209)。
结果显示绿光条件和白光条件下,两个光系统的荧光发射峰值皆有不同程度增长,但是绿光条件下的荧光强度增长更加显著,说明转化藻株Cr-ApcBHP中,外源基因成功表达并在光能传递中发挥作用,弥补了莱茵衣藻自身叶绿素利用绿光效率低的不足。每个培养条件下的转化藻株中,PSⅡ比PSⅠ提升得更加显著,表明具有光学活性的别藻蓝β亚基可能更倾向于将捕获的光能传递给PSⅡ。
2.5.4 重组藻蓝蛋白β亚基的表达对莱茵衣藻光合作用影响的分析对于培养至第4天的转基因和对照莱茵衣藻的样品,测量并记录了其PS Ⅰ和PS Ⅱ的表观电子传递速率(ETRPSⅠ和ETRPSⅡ)。对于ETRPSⅡ(见图 13A),无论在绿光还是白光实验中,Cr-ApcBHP的ETRPSⅡ值与cc849的无显著差异(绿光中p=0.151 093,白光中p=0.125 383)。对于ETRPSⅠ(见图 13B),绿光实验中,Cr-ApcBHP的ETRPSⅠ值与cc849的相似(p=0.788 893),但略高于对照cc849。白光环境下,Cr-ApcBHP和cc849二者的ETRPSⅠ几乎相同(p=0.999 666)。总体来说,不论是绿光还是白光,PSⅡ受影响较大,而PSⅠ在不同条件下相对比较稳定,藻株Cr-ApcBHP在绿光下PSⅠ受到的影响略大。

|
(A: PSⅡ的表观电子传递速率(ETRPSⅡ);B: PSⅠ的表观电子传递速率(ETRPSⅠ)。cc849:对照藻株cc849;Cr-ApcBHP:转化藻株Cr-ApcBHP;-WL:白光条件;-GL绿光条件。A. Apparent electron transfer rate of PSⅡ (ETRPSⅡ). A: Apparent electron transfer rate of PSⅡ (ETRPSⅡ); B: Apparent electron transfer rate of PSⅠ(ETRPSⅠ). cc849: Control algae strain cc849; Cr-ApcBHP: Transformed algae strain Cr-ApcBHP; -WL: white light condition; -GL: green light condition.) 图 13 绿光与白光实验中PSⅠ和PSⅡ的表观电子传递速率 Fig. 13 Apparent electron transfer rates of PS Ⅰ and PS Ⅱ in the green light and white light experiments |
连续10 d测量转基因藻株和对照藻株二者的OD750nm并记录莱茵衣藻的生物量,绘制了一条生长曲线。如图 14所示,绿光实验中Cr-ApcBHP的细胞密度始终高于cc849,这种差异在培养的第3天最显著(p=0.000 117)。第4天以后,两者的细胞密度差别不大(p=0.614 040)。转化藻株Cr-ApcBHP在第3天即达到稳定期,而cc849第4天才达到稳定期,由此分析在绿光下外源基因在转化藻株中发挥作用从而在更短时间内捕获到最大生长速率所需光能,从而促进绿光中莱茵衣藻的生长。除此以外,转化藻株与对照藻株都在进入稳定期后细胞密度有所下降,推测可能是随着细胞的生长,培养基中碳源、氮源等逐渐消耗,单一色光不足以提供细胞生长的能量,故而限制细胞的生长。在白光实验中,转化藻株Cr-ApcBHP生长与对照藻株cc849生长几乎相同(p=0.942 318)。
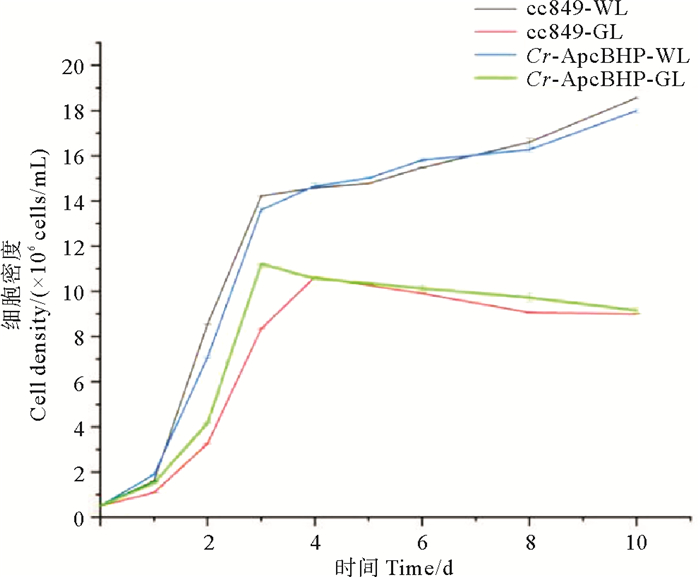
|
(cc849:对照藻株cc849;Cr-ApcBHP:转化藻株Cr-ApcBHP;-WL:白光条件;-GL:绿光条件。cc849: Control algae strain cc849; Cr-ApcBHP: Transformed algae strain Cr-ApcBHP; -WL: White light condition; -GL: Green light condition.) 图 14 白光和绿光条件下莱茵衣藻藻株的生长曲线 Fig. 14 Growth curves of Chlamydomonas reinhardtii strain under white and green light conditions |
可能由于绿光为单一色光,导致莱茵衣藻生长速率低于白光,但显而易见的是,在绿光条件下转化藻株比cc849有更高的生长速率,因此别藻蓝蛋白β亚基表达的重组外源蛋白对绿光下莱茵衣藻的生长有一定促进作用。
3 讨论以叶绿素为主要捕光色素的绿色光合生物捕光光谱极窄,而藻胆蛋白的可见光吸收范围几乎覆盖整个可见光区[29],由此人们设想如果可以将藻胆蛋白与高等植物类囊体膜组合,或许能弥补其吸收光谱的部分空缺,为此人们进行了一些尝试,发现纯化的藻胆蛋白可以将捕获的光能传递给绿色植物的类囊体膜[30-31]。并且许多研究表明,在异源宿主中表达具有光学活性的藻胆蛋白是可以实现的。藻蓝蛋白(PC)的holo-α亚基的合成途径首先由Tooley等[32]在大肠杆菌中重建,开创性地使用双质粒系统进行藻蓝胆素(PCB)生物合成并使用各种裂解酶连接到脱脂藻胆蛋白亚基,并确定了在异源宿主中生产全藻胆蛋白的可行性[33]。Zhao等[34]在大肠杆菌中表达了共价结合胆色素的APC α和β亚基(ApcA和ApcB)。但多数研究主要是以原核生物为转化材料,却鲜少有藻胆蛋白在绿色光合生物中异源重组表达的报道,更缺少绿色光合生物中重组表达藻胆蛋白对其光合作用影响的研究。
本研究利用玻璃珠转化法首次将钝顶节旋藻的别藻蓝蛋白β亚基、血红素氧化酶和铁氧还蛋白氧化还原酶基因导入莱茵衣藻中,并分别置于高光和低光环境、白光和绿光环境中培养,最终分别于基因水平、转录水平和蛋白质水平检测出别藻蓝蛋白β亚基在莱茵衣藻中成功表达。
别藻蓝蛋白中的藻蓝胆素和叶绿素的生物合成均源自于原卟啉Ⅸ,因此两者的生物合成存在竞争关系。总叶绿素含量结果显示,在两种培养条件下,转化株的叶绿素含量低于对照cc849,由此分析,由于细胞内叶绿素含量的劣势,转基因莱茵衣藻通过自身捕光系统获取的光能应当比对照cc849更少。而77 K低温荧光发射光谱的结果显示,转化藻株Cr-ApcBHP在高光与低光环境下,PSⅡ与PSⅠ的特征发射峰较对照基本都有不同程度地提高;相类似的,绿光条件和白光条件下,最突出的是690 nm处的峰值皆有大幅度增长。这表明转基因莱茵衣藻中可能发生了自重组别藻蓝蛋白β亚基到光系统核心的能量传递,捕获的光能并没有受到叶绿素含量降低而降低。而且由于别藻蓝蛋白位于藻胆体核心,在藻胆体核心中,主要存在3种三聚体,APC(αβ)3、(αβ)2(αBβ)和(αβ)2(LCMβ18)。异质(αβ)2(LCMβ18) 三聚体被认为是整个PBS复合体的末端能量受体,在能量收集和随后转移到PSⅡ中起关键作用[35]。位置上的优势使得转化藻株的重组别藻蓝蛋白β亚基能将捕获的光能更直接地向PSⅡ传递,因而使得PSⅡ处的荧光峰提升更加显著。对两种条件下培养的藻株进行的电子传递速率分析进一步印证了这一结论,在转基因藻株中,ETRPSⅡ显著上调,ETRPSⅠ在低光(绿光)条件下也有所变化。转基因莱茵衣藻虽然胞内叶绿素含量较低,但是其光能电子传递水平并没有低于藻株cc849,其更活跃的电子传递速率可能是胞内别藻蓝蛋白β亚基的表达促进了其光能传递,同样这种促进作用对于光系统Ⅱ(PSⅡ)更显著。
从各藻株细胞的生长曲线来看,各培养条件中的转基因藻株与对照藻株的生长曲线非常相似,都会在指数期细胞密度迅速增长。绿光条件下,转基因藻株的细胞密度在对数生长期时略高于对照;其他各光照条件下,转基因藻株都比对照要低一些,这一方面可能是外源蛋白表达给细胞生长带来了能量上的负荷[36],如转化藻株中藻蓝胆素的合成造成的总叶绿素含量的降低可能会对莱茵衣藻的生长造成影响。另一方面,徐前照[37]的研究表明,藻胆体将捕获的光能依次通过别藻蓝蛋白和核膜连接蛋白转移至光合作用反应中心。连接蛋白LCM(ApcE) 被假定为藻胆体末端能量受体(TEA) 的主要成分,将激发能量从藻胆体转移到光系统Ⅱ。在本研究的重组表达体系中,没有共表达连接蛋白,连接蛋白的缺失可能使得别藻蓝蛋白的能量传递效率不高,因此没有达到促进藻株生长的作用。而绿光条件的特殊在于对照藻株自身光合捕光系统可利用的光能较少,重组别藻蓝蛋白β亚基能够捕获更多的光能,一定程度上促进了转基因藻株对光能的利用,弥补藻蓝蛋白表达给藻株带来的能量负荷,从而在生长上表现出一定的促进作用。
本研究成功实现了别藻蓝蛋白β亚基在莱茵衣藻中的表达,在转基因莱茵衣藻中发生了自别藻蓝蛋白β亚基到PSⅡ的光能传递,不仅为探究别藻蓝蛋白与类囊体膜光系统之间的光能传递规律提供了新途径,而且为利用蓝藻藻胆蛋白构建新的光合系统,进而提高绿色植物光合效率提供了新尝试。
| [1] |
Harris E H. Chlamydomonas as a model organism[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 2001, 52(1): 363-406. DOI:10.1146/annurev.arplant.52.1.363 (  0) 0) |
| [2] |
Rochaix J D. Chlamydomonas reinhardtii as the photosynthetic yeast[J]. Annual Review of Genetics, 1995, 29: 209-230. DOI:10.1146/annurev.ge.29.120195.001233 (  0) 0) |
| [3] |
Kindle K L, Sodeinde O A. Sodeinde nuclear and chloroplast transformation in Chlamydomonas reinhardtii: Strategies for genetic manipulation and gene expression[J]. Journal of Applied Phycology, 1994, 69(2): 231-238. (  0) 0) |
| [4] |
Rochaix J D. The three genomes of Chlamydomonas[J]. Photosynthesis Research, 2002, 73(1-3): 285-293. (  0) 0) |
| [5] |
Remacle C, Cardol P, Coosemans N, et al. High-efficiency biolistic transformation of Chlamydomonas mitochondria can be used to insert mutations in complex Ⅰ genes[J]. Proceedings of the National Academy of Sciences, USA, 2006, 103(12): 4771-4776. DOI:10.1073/pnas.0509501103 (  0) 0) |
| [6] |
Su Z L, Qian K X, Tan C P, et al. Recombination and heterologous expression of allophycocyanin gene in the chloroplast of Chlamydomonas reinhardtii[J]. Acta Biochimica et Biophysica Sinica, 2005, 37(10): 709-712. DOI:10.1111/j.1745-7270.2005.00092.x (  0) 0) |
| [7] |
MacColl R. Cyanobacterial phycobilisomes[J]. Journal of Structural Biology, 1998, 124(2-3): 311-334. DOI:10.1006/jsbi.1998.4062 (  0) 0) |
| [8] |
Watanabe M, Ikeuchi M. Phycobilisome: Architecture of a light-harvesting supercomplex[J]. Photosynthesis Research, 2013, 116(2-3): 265-276. DOI:10.1007/s11120-013-9905-3 (  0) 0) |
| [9] |
Saer R G, Robert E, Blankenship E R. Light harvesting in phototrophic bacteria: Structure and function[J]. The Biochemical Journal, 2017, 474(13): 2107-2131. DOI:10.1042/BCJ20160753 (  0) 0) |
| [10] |
Mullineaux C W. Phycobilisome-reaction centre interaction in cyanobacteria[J]. Photosynthesis Research, 2008, 95(2-3): 175-182. DOI:10.1007/s11120-007-9249-y (  0) 0) |
| [11] |
Glazer A N, Melis A. Photochemical reaction centers: Structure, organization, and function[J]. Annual Review of Plant Physiology, 1987, 38(1): 11-45. DOI:10.1146/annurev.pp.38.060187.000303 (  0) 0) |
| [12] |
Zhao K H, Su P, Tu J M, et al. Phycobilin: Cystein-84 biliprotein lyase, a near-universal lyase for cysteine-84-binding sites in cyanobacterial phycobiliproteins[J]. Proceedings of the National Academy of Sciences, USA, 2007, 104(36): 14300-14305. DOI:10.1073/pnas.0706209104 (  0) 0) |
| [13] |
Arciero D M, Bryant D A, Glazer A N. In vitro attachment of bilins to apophycocyanin. Ⅰ. Specific covalent adduct formation at cysteinyl residues involved in phycocyanobilin binding in C-phycocyanin[J]. Journal of Biological Chemistry, 1988, 263(34): 18343-18349. DOI:10.1016/S0021-9258(19)81365-0 (  0) 0) |
| [14] |
容寿榆, 俞国强, 单晓亮, 等. 蓝藻藻胆体与菠菜光系统Ⅱ颗粒之间的能量传递[J]. 植物学报, 1998, 40(7): 622-626. Rong S Y, Yu G Q, Shan X L, et al. Energy transfer from cyanobacterial phycobilisomes to spinach photosystem Ⅱ particles[J]. Acta Botanica Sinica, 1998, 40(7): 622-626. (  0) 0) |
| [15] |
李文军, 蒲洋, 牛壮, 等. 重组别藻蓝蛋白三聚体结构与功能[J]. 科学通报, 2017, 62(16): 1699-1713. Li W J, Pu Y, Niu Z, et al. Structural and functional investigation of allophycocyanin trimer[J]. Chinese Science Bulletin, 2017, 62(16): 1699-1713. (  0) 0) |
| [16] |
尚孟慧, 臧晓南, 林娇娇, 等. 重组藻胆蛋白与高等植物类囊体膜之间能量传递的研究[J]. 中国海洋大学学报(自然科学版), 2021, 51(5): 49-56. Shang M H, Zang X N, Lin J J, et al. Study on energy transfer between recombinant phycobiliprotein and thylakoid membrane[J]. Periodical of Ocean University of China, 2021, 51(5): 49-56. (  0) 0) |
| [17] |
Saer R G, Blankenship R E. Light harvesting in phototrophic bacteria: Structure and function[J]. Biochemical Journal, 2017, 474(13): 2107-2131. DOI:10.1042/BCJ20160753 (  0) 0) |
| [18] |
Sun D, Zang X, Guo Y, et al. Cloning of pcB and pcA gene from Gracilariopsis lemaneiformis and expression of a fluorescent phycocyanin in heterologous host[J]. Genes (Basel), 2019, 10(5): 322. DOI:10.3390/genes10050322 (  0) 0) |
| [19] |
Frankenberg N, Mukougawa K, Kohchi T, et al. Functional genomic analysis of the HY2 family of ferredoxin-dependent bilin reductases from oxygenic photosynthetic organisms[J]. Plant Cell, 2001, 13(4): 965-978. DOI:10.1105/tpc.13.4.965 (  0) 0) |
| [20] |
Berthold P, Schmitt R, Mages W. An engineered Streptomyces hygroscopicus aph 7″ gene mediates dominant resistance against hygromycin B in Chlamydomonas reinhardtii[J]. Protist, 2002, 153(4): 401-412. DOI:10.1078/14344610260450136 (  0) 0) |
| [21] |
章峰. 重组藻蓝蛋白对莱茵衣藻光合系统影响的初步探讨[D]. 青岛: 中国海洋大学, 2020. Zhang F. Preliminary Study on the Effects of Recombinant Phycocyanin on the Photosynthetic System of Chlamydomonas reinhardtii[D]. Qingdao: Ocean University of China, 2020. (  0) 0) |
| [22] |
Kindle K L. High-frequency nuclear transformation of Chlamydomonas reinhardtii[J]. Proceedings of the National Academy of Sciences, USA, 1990, 87(3): 1228-1232. DOI:10.1073/pnas.87.3.1228 (  0) 0) |
| [23] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT Method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 (  0) 0) |
| [24] |
Porra R J, Thompson W A, Kriedemann P E. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: Verification of the concentration of chlorophyll standards by atomic absorption spectroscopy[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1989, 975(3): 384-394. DOI:10.1016/S0005-2728(89)80347-0 (  0) 0) |
| [25] |
Murakami A. Quantitative analysis of 77 K fluorescence emission spectra in Synechocystis sp. PCC 6714 and Chlamydomonas reinhardtii with variable PSⅠ/PSⅡ stoichiometries[J]. Photosynthesis Research, 1997, 53(2-3): 141-148. (  0) 0) |
| [26] |
Zivcak M, Brestic M, Kunderlikova K, et al. Repetitive light pulse-induced photoinhibition of photosystem Ⅰ severely affects CO2 assimilation and photoprotection in wheat leaves[J]. Photosynthesis Research, 2015, 126(2-3): 449-463. DOI:10.1007/s11120-015-0121-1 (  0) 0) |
| [27] |
Zhou W, Sui Z, Wang J, et al. Effects of sodium bicarbonate concentration on growth, photosynthesis, and carbonic anhydrase activity of macroalgae Gracilariopsis lemaneiformis, Gracilaria vermiculophylla and Gracilaria chouae (Gracilariales, Rhodophyta)[J]. Photosynthesis Research, 2016, 128(3): 259-270. DOI:10.1007/s11120-016-0240-3 (  0) 0) |
| [28] |
Sandrine B, Natsumi K, Fabrice R, et al. Functional accumulation of antenna proteins in chlorophyll b-less mutants of Chlamydomonas reinhardtiii[J]. Molecular Plant, 2017, 10(1): 115-130. DOI:10.1016/j.molp.2016.10.001 (  0) 0) |
| [29] |
Mullineaux C W. Phycobilisome-reaction centre interaction in cyanobacteria[J]. Photosynthesis Research, 2008, 95(2-3): 175-182. DOI:10.1007/s11120-007-9249-y (  0) 0) |
| [30] |
Zhu B H, Wang G C, Tseng C K. Interaction between phycobilisomes from Porphyridium cruentum and thylakoid membranes from Gymnodinium sp. or Spinach[J]. Russian Journal of Plant Physiology, 2005, 52(3): 288-293. DOI:10.1007/s11183-005-0043-4 (  0) 0) |
| [31] |
冯小亭, 臧晓南, 张学成, 等. 藻胆体与类囊体膜之间的能量传递研究进展[J]. 科技资讯, 2015, 13(27): 245-251. Feng X T, Zang X N, Zhang X C, et al. Advances in energy transfer between phycobilisomes and thylakoid membrane[J]. Science and Technology Information, 2015, 13(27): 245-251. (  0) 0) |
| [32] |
Tooley A J, Glazer A N. Biosynthesis of the cyanobacterial light-harvesting polypeptide phycoerythrocyanin holo-α subunit in a heterologous host[J]. Bacteriology, 2002, 184(17): 4666-4671. DOI:10.1128/JB.184.17.4666-4671.2002 (  0) 0) |
| [33] |
Liu S, Chen Y, Lu Y, Chen H, et al. Biosynthesis of fluorescent cyanobacterial allophycocyanin trimer in Escherichia coli[J]. Photosynthesis Research, 2010, 105(2): 135-142. DOI:10.1007/s11120-010-9574-4 (  0) 0) |
| [34] |
Zhao K H, Su P, Tu J M, et al. Phycobilin: Cystein-84 biliprotein lyase, a near-universal lyase for cysteine-84-binding sites in cyanobacterial phycobiliproteins[J]. Proceedings of the National Academy of Sciences, 2007, 104(36): 14300-14305. (  0) 0) |
| [35] |
Liu L N, Chen X L, Zhang Y Z, et al. Characterization, structure and function of linker polypeptides in phycobilisomes of cyanobacteria and red algae: An overview[J]. Biochimica et Biophysica Acta, 2005, 1708(2): 133-142. (  0) 0) |
| [36] |
Dejtisakdi W, Miller S M. Overexpression of Calvin cycle enzyme fructose 1, 6-bisphosphatase in Chlamydomonas reinhardtii has a detrimental effect on growth[J]. Algal Research, 2016, 14(2): 116-126. (  0) 0) |
| [37] |
徐前照. 蓝细菌别藻蓝蛋白亚基光谱性质及光敏色素结构的研究[D]. 武汉: 华中农业大学, 2020. Xu Q Z, Study on the Spectral Properties of Allophycocyanin and the Structureofa Cyanobacteriochrome[D]. Wuhan: Huazhong Agricultural University, 2020. (  0) 0) |
 2023, Vol. 53
2023, Vol. 53


