2. 青岛海泊河污水处理厂,山东 青岛 266005
很多行业生产过程中会产生高盐含氮废水,如海产品加工业、食品加工业、皮革工业和印染工业等。在废水生物处理系统中高盐浓度会对微生物产生高渗透压,导致细胞死亡,进而降低有机物、氮等污染物的去除效能[1-2]。但近年来有研究表明,通过驯化作用微生物能够逐步适应高盐条件,例如利用序批式生物膜反应器、序批式反应器和膜生物反应器等处理高盐含氮废水实现了同步短程硝化反硝化(Simultaneous Partial Nitrification and Denitrification,SPND),且取得良好氮去除效果[3-5]。
进水pH值是影响废水生物处理系统脱氮效果和微生物群落组成的重要因素。一些高盐含氮废水呈酸性且pH波动较大,会对生物处理产生不利影响[6-7]。研究发现,在弱碱性条件下,活性污泥在污水处理系统中具有更好的有机物和氮去除效果,而酸性环境不利于微生物的生存,且破坏了系统的运行稳定性[8-9]。Huesemann[10]和Yin[11]等的研究均发现,污水pH值从8逐步降低到6,硝化作用呈线性下降趋势,在pH值6.5时下降90%以上,导致很低的氮去除率(<7%)。但另有研究显示,反应器经过长期运行,微生物通过逐步驯化可以扩大pH耐受范围,有效应对pH冲击作用[12]。Zhou等[13]研究了pH由7.5降低至3.0的冲击作用,发现COD去除率先下降然后逐渐上升至90%以上。Cai等[14]在膜生物反应器中利用同步硝化反硝化工艺处理pH为5.5的船舶污水,实现了较高的TN和COD去除效率。在酸性环境中,一些不适应酸性条件的菌属丰度降低,可能会被洗脱出系统,而耐酸菌成为优势菌,这为酸性污水的生物处理提供了生物学基础。例如,Sphingobacterium和Stenotrophomonas在进水pH从7.5降低为3.0时明显富集,成为优势菌属[13];而Meganema和Acinetobacter随pH由中性降低至5.5丰度降低[12]。
迄今为止,虽然已有研究探讨了pH对污水生物脱氮的影响,但尚未见有关高盐条件下pH对短程硝化反硝化过程和微生物群落影响的报道。本研究利用复合序批式生物膜反应器(HSBBR) 处理高盐含氮废水,考察了进水pH变化对同步短程硝化反硝化性能的影响,利用高通量测序技术从门和属水平分析了pH改变对悬浮污泥和生物膜中微生物群落结构的影响,特别是脱氮功能菌的演变,从微生物角度阐析了进水pH对氮转化过程的作用。
1 实验方法 1.1 实验装置和运行条件本实验采用1个圆柱形HSBBR,直径19 cm、有效容积7.0 L,反应器内部悬挂两片组合纤维填料,每个填料的直径为14 cm、间距10 cm,填料比表面积为1 236 m2·m-3。反应器每个运行周期历时8 h,包括进水15 min、前段缺氧120 min、好氧240 min、后段缺氧30 min、静置60 min和出水15 min六个阶段,每个周期进水和排水量为3.5 L,换容比为50%,水力停留时间为16 h。在好氧阶段用电磁空气泵将空气引入反应器底部的多孔砂头扩散器,进行供氧,用转子流量计控制供气量,使好氧阶段液相溶解氧(DO) 浓度保持在1.0 mg·L-1以上。在好氧和缺氧阶段均采用机械搅拌装置进行混合搅拌。反应器内液相温度控制在(25±1) ℃。
1.2 实验用水本研究开始前,反应器在3.2盐度、pH为7.8左右、温度为25 ℃条件下运行了345天,实现了稳定的同步短程硝化反硝化脱氮过程,取得了高效的有机物和氮去除。本实验进水为人工配制的高盐废水,每升水中投加32 g海水晶控制盐度为3.2%,每10 g海水晶中主要物质含量为:5.3 g Cl-,3.3 g Na+,0.62 g SO42-,0.3 g Mg2+,0.1 g K+和0.09 g Ca2+。进水COD、NH4+-N和总磷(TP) 浓度为400、40和8 mg·L-1(分别由乙酸钠、氯化铵、磷酸二氢钾提供)。本实验分为4个时期,第1、2、3和4时期的进水pH分别保持在7.8、6.0、5.0和7.8,第2和3时期是考察进水pH值由7.8降为6.0和5.0对反应器性能的影响,第4时期是考察pH值由5.0恢复至7.8以后处理性能的恢复情况。
1.3 分析方法 1.3.1 水质测定每两天取反应器进出水水样,按照国家标准方法检测COD、NH4+-N、NO2--N和NO3--N浓度[15],总无机氮(TIN) 为NH4+-N、NO2--N和NO3--N浓度之和。pH及溶解氧分别用便携式pH计(PHB-4,雷磁,中国)和溶解氧仪(Oxi330i,WTW,德国)测定。为了深入分析周期内反应期间氮的转化过程,每个条件下反应器性能达到稳定时,在一个周期内不同时间取液相样品,测定各种形态无机氮的浓度,并计算曝气阶段同步硝化反硝化效率,见公式(1)。
| $ E_{\mathrm{SND}}=\left[1-\left(\mathrm{NO}_{\mathrm{x}, \mathrm{e}}^{-}-\mathrm{NO}_{\mathrm{x}, \mathrm{i}}^{-}\right) /\left(\mathrm{NH}_{4, \mathrm{i}}^{+}-\mathrm{NH}_{4, \mathrm{e}}^{+}\right)\right] \times 100 \% 。$ | (1) |
式中:ESND是同步硝化反硝化效率;NOx,e- (mg·L-1) 是曝气阶段结束时反应器中NO3--N和NO2--N总浓度;NOx,i- (mg·L-1) 是曝气阶段开始时反应器中NO3--N和NO2--N总浓度;NH4,i+ (mg·L-1) 是曝气阶段开始时反应器中NH4+-N浓度;NH4,e+ (mg·L-1) 是曝气阶段结束时反应器中NH4+-N浓度。
1.3.2 微生物群落分析为了探究进水pH改变对微生物群落结构和脱氮功能菌的影响,在阶段3和4结束时取悬浮污泥和生物膜样品,使用PowerSoil DNA试剂盒(MoBio Laboratories,Carlsbad,CA,美国)提取DNA。利用引物515F (5′-GTGCCAGCAGCCGCGGTAA-3′)和907R (5′- CCGTCAATTCCTTTGAGTTT-3′) 对细菌16S rDNA的高变区V4-V5进行聚合链式反应(PCR) 扩增。通过Novogene (中国北京) 的Illumina MiSeq平台进行高通量测序。
2 结果与讨论 2.1 反应器性能本实验各时期污染物去除效果如图 1所示。不同进水pH值条件下COD均保持较高且稳定的去除率,第1~4时期平均去除率分别为97.14%、96.93%、96.75%和96.98%,表明降解有机物的异养菌对pH的变化具有较强的适应能力。当进水pH由6.0降为5.0时,最初NH4+-N去除率明显降低,由100%降为92.55%,但很快恢复至100%;其他时期NH4+-N去除率保持在97%以上;说明进水pH的变化对NH4+-N去除没有明显影响(见图 1(B)),推测某些耐酸的氨氧化菌能够在低pH条件下生存并发挥了转化氨氮的作用,这方面内容有必要进行更深入的研究。Yue等[16]的研究观察到,氨氧化菌(AOB)在较宽的进水pH值范围内(6.5~8.3)表现出良好的活性。当进水pH降为6.0和5.0时,TIN去除率在初期3~5天均下降,最低分别降到88.59%和82.77%,随后2天很快恢复到93.58%和94.38%,之后继续升高至96%和98%左右(见图 1(C));pH为6.0和5.0条件下TIN平均去除率分别为93.98%和95.80%,略高于第1时期的91.04%;第4时期进水pH值恢复至7.8后,TIN去除率初期下降,随后逐步回升,平均去除率为95.11%。这一结果表明,本研究TIN去除对进水pH变化具有较强的抗击能力,原因可能有三个方面,一是HSBBR中生物膜的存在缓解了pH的不利影响,生物膜具有复杂的微生物群落结构,适应冲击负荷变化能力强,在应对pH冲击时通常比活性污泥表现出更高的缓冲能力[11, 13];二是在本研究的序批式反应器中上一周期结束时混合液较高的pH对低pH进水起到了中和作用(如2.2节的分析);三是低pH进水条件下反应期内较高丰度的氨氧化菌和反硝化菌为氮的有效去除提供了生物学保障(见2.3.2节的分析)。前人在处理盐度为1.0%的废水时发现进水pH从7.4降为6.0和5.0使出水COD和TIN浓度分别由50和1.59 mg·L-1明显升高至154和13.64 mg·L-1,COD和TIN去除率降低是由于微生物降解作用受到强烈抑制,这与本研究结果不同,可能是因为本研究采用的HSBBR中活性污泥与生物膜共存,对pH冲击有一定的缓冲作用。而采用膜生物反应器污泥浓度较低(1 000 mg·L-1),不足以应对pH冲击,但他们的研究也观察到当进水pH重新恢复至7.4时,COD和TIN去除率恢复至原来水平[17]。
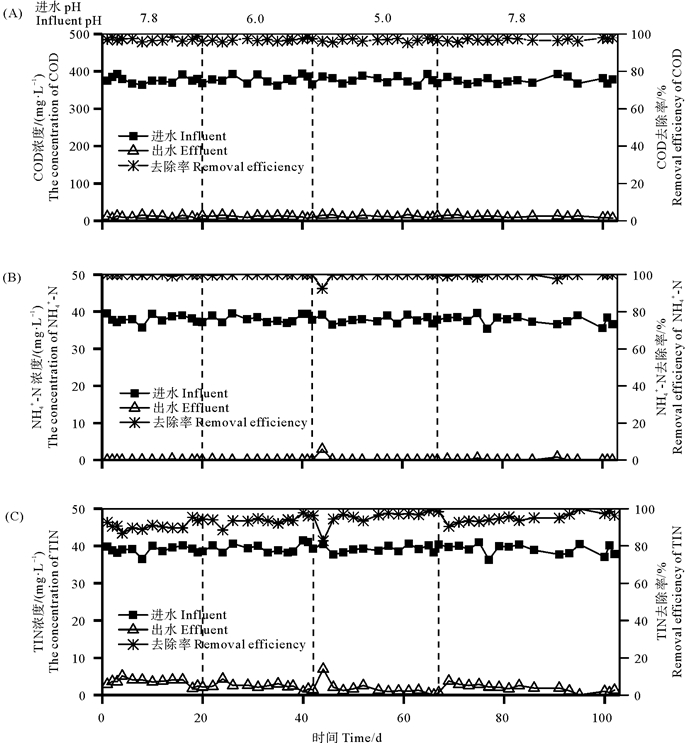
|
图 1 HSBBR反应器运行性能 Fig. 1 The performance of the HSBBR |
为了深入探究pH对氮转化的影响,在每个实验时期结束时,分析了一个周期内各种形态无机氮和pH的变化,结果见图 2。4个时期在前缺氧阶段(15~135 min)NH4+-N和TIN浓度均同步降低,分别由17.41~19.73 mg·L-1和17.88~20.86 mg·L-1降至12.44~18.33 mg·L-1和12.47~18.47 mg·L-1,且没有NO3--N和NO2--N的积累。据4个实验时期周期内DO测定结果,前缺氧阶段DO浓度均较低,在0.00~0.63 mg·L-1范围内,有研究表明0.3~2.5 mg·L-1的溶解氧范围可以进行短程硝化,即氨氮可被氧化为亚硝态氮[18];此外,结合2.3.2节微生物群落结构分析可知,本研究反应器中亚硝酸盐氧化菌相对丰度很低,远低于氨氧化菌相对丰度,说明亚硝酸盐氧化过程受到抑制;因此可以推断,本研究中前缺氧阶段NH4+-N浓度降低主要是短程硝化的结果;结合该阶段TIN浓度的同步降低,说明存在同步短程硝化反硝化作用。值得注意的是,在前缺氧阶段pH值总体上随反应时间的增加而升高,特别是进水pH值较低的第2和3时期(进水pH值为6.0和5.0),pH值分别由6.61和5.79升高至7.41和6.79,原因是该阶段COD浓度较高(见图 3),特别是前期(15~30 min)碳源很充足(COD/TIN为5.8~9.8),有利于前一个周期中残留的NO2--N(0.14~2.87 mg·L-1)及进水中的NO3--N(0.17~1.00 mg·L-1)进行反硝化反应而释放碱度,使pH值升高。大部分COD在前缺氧阶段被去除,COD浓度由175~187 mg·L-1降至28 mg·L-1以下。
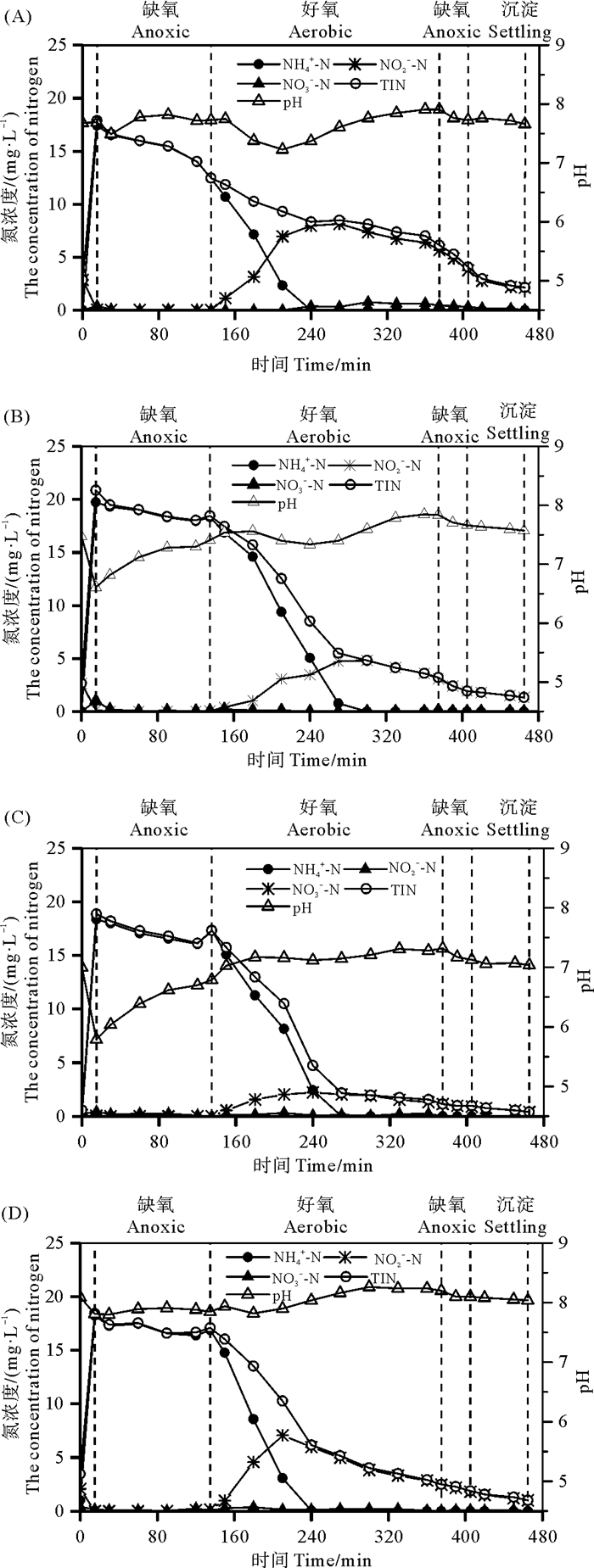
|
图 2 周期内氮浓度和pH变化:A、B、C和D图分别代表第1、2、3和4时期 Fig. 2 Profiles of nitrogen and pH during a cycle at various periods: (A) 1, (B) 2, (C) 3, (D) 4 |
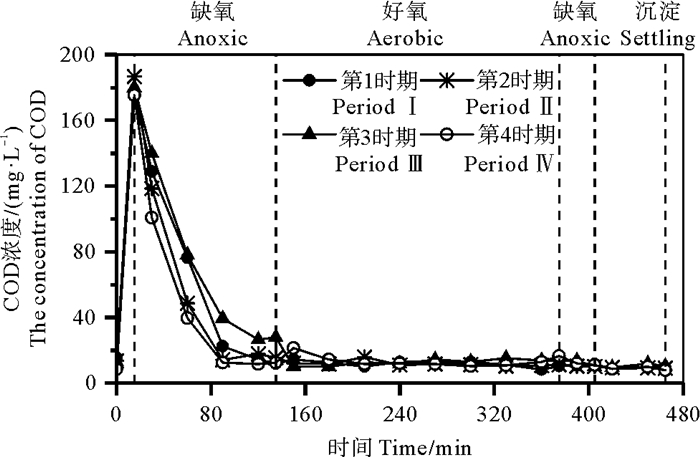
|
图 3 不同时期周期内COD浓度变化 Fig. 3 Profiles of COD during a cycle at various periods |
在好氧曝气阶段,前期(135~270 min)NH4+-N浓度迅速下降,由12.44~18.33 mg·L-1降至0.00~0.76 mg·L-1,第1~4时期氨氧化率分别为8.1、7.8、8.5和9.6 mg·(L·h)-1,各pH进水条件下均取得良好的氨氧化效果。好氧阶段前期,由于硝化作用消耗碱度,pH下降,并在氨氮降解基本完成时到达谷底,随后pH回升,此阶段pH保持在6.79~8.24水平,属于氨氧化菌适宜生长的pH范围;值得注意的是,在较低pH进水条件下(6.0和5.0),pH经历前缺氧阶段较快提升后,在好氧阶段总体趋势是继续升高,基本维持在适宜氨氧化菌生长的范围(6.79~7.85),这是保证低pH进水时期仍能获得高NH4+-N去除率的关键。在好氧阶段前期伴随着氨氮氧化,NO2--N浓度逐步上升,在氨氮氧化基本完成时达到峰值,特别是进水pH值为7.8的两个时期(第1和4时期),NO2--N积累峰值分别达到8.15和7.07 mg·L-1;进水pH值为6.0和5.0条件下,NO2--N最大积累浓度分别为4.81和2.23 mg·L-1,明显低于进水pH为7.8条件;好氧阶段后期,反硝化作用使NO2--N浓度逐步降低。结合四个时期好氧阶段无NO3--N明显积累现象(0.0~0.76 mg·L-1),可以得到结论:pH为7.8时期较高的NO2--N积累是NO2--N还原作用较弱导致的,而非NO3--N还原为NO2--N造成;进水pH降低至6.0和5.0对短程反硝化产生了影响,促进了短程反硝化过程。这与相关研究一致,Qian等[19]指出,相对于pH值为5.0的进水,高pH值(7.0和9.0)有利于反硝化过程中亚硝酸盐的积累,对亚硝酸盐的进一步还原产生抑制作用。本研究四个实验时期在好氧阶段TIN浓度均持续下降,特别是在好氧阶段前期伴随着氨氮的快速氧化TIN浓度迅速降低,说明存在高效同步短程硝化反硝化作用,第1~4时期好氧阶段的同步硝化反硝化效率(ESND)分别达到50.80%、83.25%、93.48%和86.43%,可知pH降低没有对同步硝化反硝化效率产生不利影响。依据上述实验结果,可以得出结论,本研究条件下,进水pH由7.8降低为6.0和5.0没有对同步短程硝化反硝化过程产生负面影响。由于COD在前缺氧阶段大部分被去除,在好氧阶段COD浓度较低,且变化较小,浓度为8~28 mg·L-1。在pH为5.0条件下好氧阶段后期(270~375 min)COD/TIN比值较高(6.6~11.9),除此之外,好氧阶段COD/TIN比值均较低(基本在4.0以下),对反硝化脱氮有一定影响。本研究在好氧阶段能保持较好TIN去除效果的原因,有待进一步研究。
在后缺氧阶段和沉淀阶段,NO2--N和TIN浓度均随反应时间延长不断下降,说明此两阶段存在短程反硝化反应。与好氧阶段类似,在后缺氧阶段和沉淀阶段COD浓度变化很小,结合后缺氧阶段起始时刻反应器内COD/TIN比(1.70~11.87)可知,此两阶段主要发生异养短程反硝化反应。
2.3 进水pH对微生物群落的影响 2.3.1 微生物丰富度和多样性第3和4时期实验结束时取反应器内悬浮污泥和生物膜样品,分析了pH为5.0和7.8两种条件下微生物群落的丰富度和多样性,结果见表 1。根据微生物存在的形态和进水pH值,将4个样品命名为SS5.0、BF5.0、SS7.8和BF7.8(SS代表悬浮污泥,BF代表生物膜)。4个样品的高覆盖率(>0.999)表明测序结果能够合理地解释微生物群落的丰富度和多样性。进水pH从5.0提高到7.8,悬浮污泥和生物膜的Shannon和Simpson指数均降低,说明微生物群落多样性减少。随pH升高,悬浮污泥的Chao 1和ACE指数下降,而生物膜的Chao 1指数升高、ACE指数基本不变,说明较低pH条件下悬浮污泥中微生物丰富度更高,而生物膜中微生物丰富度更低。
|
|
表 1 微生物群落多样性和丰富度指数 Table 1 The diversity and richness indices of microbial community |
4个样品中共检测到16个菌门,优势菌门(相对丰度≥1%)的相对丰度如图 4所示。本研究检测出的优势菌门为Proteobacteria(变形菌,49.9%~75.2%)、Bacteroidetes(拟杆菌,10.4%~31.9%)、Spirochaetes(2.7%~9.0%)和Chloroflexi(绿弯菌,2.3%~6.8%)。变形菌和拟杆菌门丰度最高,多种硝化菌和反硝化菌属于这两个菌门,它们在水体氮循环中发挥重要作用[20];研究报道0.0~3.0%盐度胁迫下这两个菌门占主导地位,在高盐条件下表现出更高的丰度[21]。变形菌对pH值变化较敏感,进水pH从5.0升高至7.8,悬浮污泥和生物膜中相对丰度均降低,分别由75.2%和70.9%降低到71.6%和49.9%。变形菌是含盐废水处理系统中的主要耐盐菌[22]。悬浮污泥中拟杆菌相对丰度随进水pH升高变化不大,但生物膜中拟杆菌丰度明显增大,由13.8%提升到31.9%。有研究表明拟杆菌适宜在较高pH条件下生长,碱性条件有利于拟杆菌的富集[12];拟杆菌具有很强的蛋白质分解能力[23]。随pH升高,Spirochaetes相对丰度在悬浮污泥中显著增加(从3.0%增至9.0%),但在生物膜中略微降低,说明该菌门更适合在弱碱性条件下生长,Lee等[24]的研究得到类似结果。绿弯菌在生物膜中的相对丰度较悬浮污泥中高,且随进水pH的升高变化较大,由4.3%提高到6.8%;绿弯菌常出现在自养脱氮反应器中,可以利用自养氨氧化菌和厌氧氨氧化菌释放的可溶性微生物产物(SMP) 和胞外聚合物(EPS) 作为营养物质[25];此外,绿弯菌可以降解碳水化合物并促进絮凝体的形成[26-27],具有良好的耐盐性[28]。
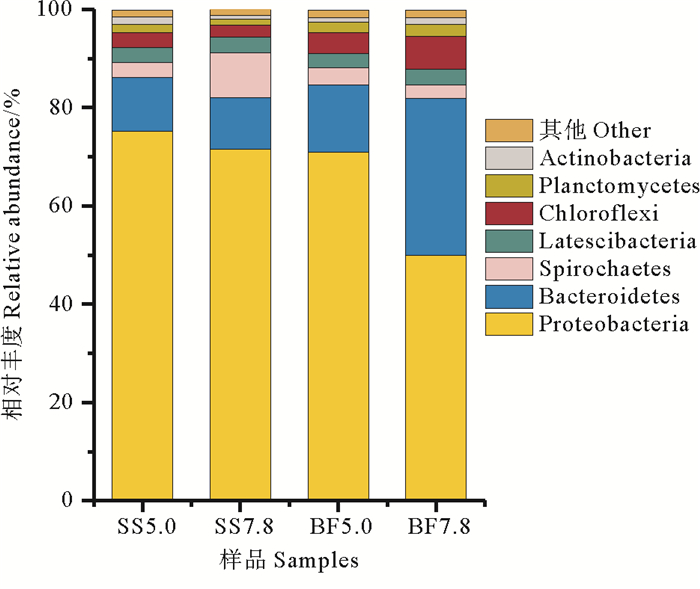
|
图 4 进水pH 5.0和7.8条件下各菌门的相对丰度 Fig. 4 The relative abundance of phylum under influent pH 5.0 and 7.8 |
本研究检测到19种主要菌属,见图 5。进水pH为5.0条件下,悬浮污泥或生物膜中丰度大于2.0%的优势菌属是Defluviicoccus(14.7%~27.3%)、Candidatus_Competibacter(22.7%~26.0%)、Candidatus_Accumulibacter(11.8%~17.8%)、Nitrosomonas(3.3%~3.8%)和unidentified_Spirochaetaceae (2.9%~3.3%);pH值提高至7.8时,相对丰度大于2.0%的优势菌属演变为Candidatus_Accumulibacter(7.6%~40.5%)、Candidatus_Competibacter (21.3%~26.2%)、unidentified_Spirochaetaceae(2.5%~8.7%)、Candidatus_Thiobios(0.8%~3.8%)、Phaeodactylibacter(0.3%~3.3%)、Defluviicoccus(1.6%~2.1%)和Maritimimonas(0.5%~2.1%)。进水pH=5.0条件下悬浮污泥和生物膜中丰度最高的菌属分别是Defluviicoccus(27.3%)和Candidatus_Competibacter(26.0%),这两种菌经常在短程硝化反硝化系统中检测到,是参与反硝化反应的主要功能菌[29-30];进水pH提升至7.8后,悬浮污泥和生物膜中丰度最高的菌属分别是聚磷菌Candidatus_Accumulibacter(40.5%)和反硝化菌Candidatus_Competibacter(26.2%)。在复合序批式反应器中也观察到盐度为1.0%和2.0%时,Candidatus_Competibacter是悬浮污泥中丰度最高的菌属[21]。
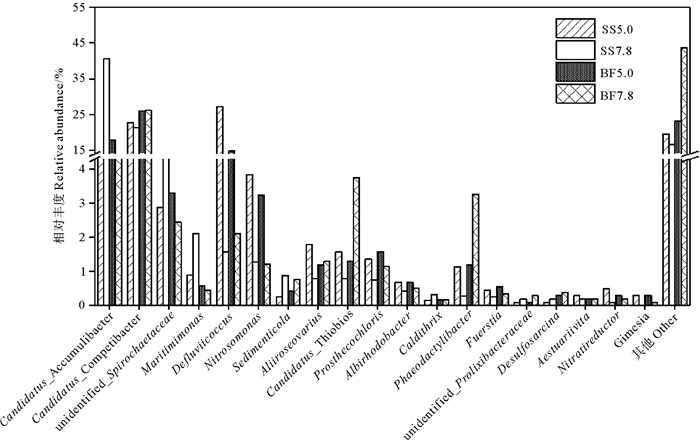
|
图 5 悬浮污泥和生物膜中各菌属的相对丰度 Fig. 5 Microbial composition of suspend sludge and biofilm at genus level |
4个样品中共检测到15种耐盐菌属,总丰度为18.4%~47.0%,耐盐菌的高丰度有利于反应器在盐胁迫下的稳定运行。优势菌属Candidatus_Accumulibacter、Candidatus_Thiobios、Nitrosomonas、Phaeodactylibacter和Maritimimonas都具有耐盐性。王旭的研究也观察到Candidatus_Accumulibacter在3%盐度条件下是优势菌属。Candidatus_Thiobios通常存在于盐水或海洋环境中,相比无盐环境,在3.0%盐度下丰度更高,成为耐盐优势属,表现出对3.0%盐度的适应性[21]。据报道Phaeodactylibacter的相对丰度在6%盐度时达到最大值,具有良好的耐盐性[31]。本研究检测到的其他耐盐菌属有Sedimenticola(0.3%~0.9%)、Albirhodobacter(0.4%~0.7%)、Nitratireductor(0.1%~0.5%)、Caldithrix(0.2%~0.3%)、Gimesia(0.0%~0.3%)。
Nitrosomonas是本研究检测到的唯一氨氧化菌属,适宜在淡水环境中生存,但能耐受4%高盐度,在处理高盐含氮废水的生物反应器中经常检测到,在含盐废水处理系统中往往是优势AOB[31];其丰度在进水pH为5.0条件下(3.3%~3.8%)明显高于pH为7.8时(1.2%~1.3%),这可以解释低进水pH时期HSBBR仍能保持高NH4+-N去除率的现象。Guo等[32]的研究也观察到,进水pH为5条件下氨氧化菌的总丰度高于pH=6和8,Nitrosomonas在酸性条件下活性较高。本研究HSBBR系统中检测到一种亚硝酸盐氧化菌(NOB) Sediminispirochaeta,且丰度很低(0.0%~0.1%),导致NO2--N积累,这为反应器内NO2--N浓度明显高于NO3--N提供了微生物的解释。
本研究共检测到12种反硝化菌属(DNB),相对丰度如图 6所示。Defluviicoccus和Candidatus_Competibacter为异养反硝化菌,在反硝化菌中占绝对优势,合计相对丰度占反硝化菌总丰度比例达到92.0%~95.1%(悬浮污泥中)和85.5%~93.6%(生物膜中),因此这两个菌属对反硝化过程起到了决定作用。值得注意的是,Defluviicoccus在进水pH为5.0时的相对丰度大大高于pH为7.8时的值,前者是后者的7~17倍,说明该菌属适宜在较低pH条件下生长;Pronk等[33]在以醋酸盐为唯一碳源的好氧颗粒污泥反应器中观察到,Defluviicoccus可以分泌酸性的胞外聚合物,以保护细胞免受外界条件的影响。pH的改变对Candidatus_Competibacter丰度几乎没有影响,相对丰度在两种pH条件下相近,该菌属可以产生胞外多糖,有利于提高活性污泥的生物絮凝和沉降性能[34]。本研究中检测到一些特殊功能的反硝化菌属,如自养反硝化菌Sedimenticola和具有好氧反硝化功能的Gimesia和Acinetobacter,虽然这三种菌属的相对丰度较低(分别为0.3%~0.9%、0.1%~0.3%和0%~0.1%),但它们的存在说明HSBBR系统中反硝化过程是通过多种途径实现的。进水pH为5.0时反硝化菌总相对丰度在悬浮污泥和生物膜中分别为52.6%和43.5%,明显高于pH为7.8时的值(24.9%和33.1%);进水pH为5.0条件下反硝化菌的高丰度保证了低进水pH阶段(阶段3)的反硝化效果和有效的总氮去除。
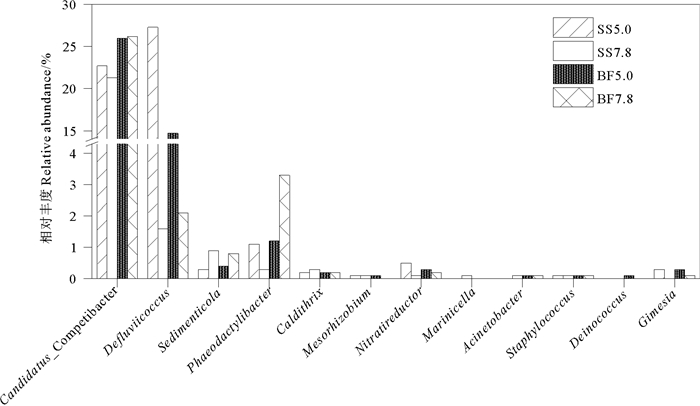
|
图 6 反硝化菌属相对丰度 Fig. 6 The relative abundance of genus with function of denitrification |
本研究采用HSBBR研究了进水pH对高盐含氮废水中有机物和氮去除效果的影响,结果表明:
(1) 进水pH从7.8降为6.0和5.0以及从5.0恢复至7.8不会对HSBBR的有机物和氮去除产生显著影响。稳定状态下,COD、NH4+-N和TIN去除率均保持在90%以上。
(2) 进水pH值为6.0和5.0时,在前缺氧阶段pH明显升高,保证了较低pH进水条件下反应器内仍能保持有利于硝化和反硝化的pH范围。进水pH值为6.0和5.0条件下,NO2--N积累峰值低于进水pH为7.8条件,表现出较好的短程反硝化效果。
(3) 进水pH为5.0时,反应器内相对丰度前三位的菌属为Defluviicoccus、Candidatus_Competibacter及Candidatus_Accumulibacter;pH提升至7.8时,丰度前三位的菌属是Candidatus_Accumulibacter、Candidatus_Competibacter和unidentified_Spirochaetaceae。进水pH为5.0条件下,反硝化菌属总丰度达43.5%~52.6%,为有效反硝化和总氮去除提供了微生物保障。
致谢: 本研究得到中国海洋大学海洋环境与生态教育部重点实验室支持,作者对此表示诚挚谢意。
| [1] |
Bassin J P, Kleerebezem R, Muyzer G, et al. Effect of different salt adaptation strategies on the microbial diversity, activity, and settling of nitrifying sludge in sequencing batch reactors[J]. Applied Microbiology and Biotechnology, 2012, 93(3): 1281-1294. DOI:10.1007/s00253-011-3428-7 (  0) 0) |
| [2] |
Castillo-Carvajal L C, Sanz-Martín J L, Barragán-Huerta B E. Biodegradation of organic pollutants in saline wastewater by halophilic microorganisms: A review[J]. Environmental Science and Pollution Research, 2014, 21(16): 9578-9588. DOI:10.1007/s11356-014-3036-z (  0) 0) |
| [3] |
Huang W Y, She Z L, Gao M C, et al. Effect of anaerobic/aerobic duration on nitrogen removal and microbial community in a simultaneous partial nitrification and denitrification system under low salinity[J]. Science of the Total Environment, 2019, 651: 859-870. DOI:10.1016/j.scitotenv.2018.09.218 (  0) 0) |
| [4] |
She Z L, Zhao L T, Zhang X L, et al. Partial nitrification and denitrification in a sequencing batch reactor treating high-salinity wastewater[J]. Chemical Engineering Journal, 2016, 288: 207-215. DOI:10.1016/j.cej.2015.11.102 (  0) 0) |
| [5] |
Wang Z, Luo G, Li J, et al. Response of performance and ammonia oxidizing bacteria community to high salinity stress in membrane bioreactor with elevated ammonia loading[J]. Bioresource Technology, 2016, 216: 714-721. DOI:10.1016/j.biortech.2016.05.123 (  0) 0) |
| [6] |
Adham S, Hussain A, Minier-Matar J, et al. Membrane applications and opportunities for water management in the oil & gas industry[J]. Desalination, 2018, 440: 2-17. DOI:10.1016/j.desal.2018.01.030 (  0) 0) |
| [7] |
Ahmad N N R, Ang W L, Leo C P, et al. Current advances in membrane technologies for saline wastewater treatment: A comprehensive review[J]. Desalination, 2021, 517: 115170. DOI:10.1016/j.desal.2021.115170 (  0) 0) |
| [8] |
Zheng S, Sun J, Han H. Effect of dissolved oxygen changes on activated sludge fungal bulking during lab-scale treatment of acidic industrial wastewater[J]. Environmental Science & Technology, 2011, 45(20): 8928-8934. (  0) 0) |
| [9] |
Jaramillo F, Orchard M, Muñoz C, et al. Advanced strategies to improve nitrification process in sequencing batch reactors - A review[J]. Journal of Environmental Management, 2018, 218: 154-164. (  0) 0) |
| [10] |
Huesemann M H, Skillman A D, Crecelius E A. The inhibition of marine nitrification by ocean disposal of carbon dioxide[J]. Marine Pollution Bulletin, 2002, 44(2): 142-148. DOI:10.1016/S0025-326X(01)00194-1 (  0) 0) |
| [11] |
Yin Z, Santos C E D D, Vilaplana J G, et al. Importance of the combined effects of dissolved oxygen and pH on optimization of nitrogen removal in anammox-enriched granular sludge[J]. Process Biochemistry, 2016, 51(9): 1274-1282. DOI:10.1016/j.procbio.2016.05.025 (  0) 0) |
| [12] |
Jiang Y, Yang K, Shang Y, et al. Response and recovery of aerobic granular sludge to pH shock for simultaneous removal of aniline and nitrogen[J]. Chemosphere, 2019, 221: 366-374. DOI:10.1016/j.chemosphere.2018.12.207 (  0) 0) |
| [13] |
Zhou H, Wang G C, Wu M H, et al. Phenol removal performance and microbial community shift during pH shock in a moving bed biofilm reactor (MBBR)[J]. Journal of Hazardous Materials, 2018, 351: 71-79. DOI:10.1016/j.jhazmat.2018.02.055 (  0) 0) |
| [14] |
Cai Y H, Ben T, Zaidi A A, et al. Nitrogen removal augmentation of ship sewage by an innovative aerobic-anaerobic micro-sludge MBR technology[J]. Process Biochemistry, 2019, 82: 123-134. DOI:10.1016/j.procbio.2019.04.020 (  0) 0) |
| [15] |
APHA. Standard Methods for the Examination of Water and Wastewater[M]. [s. l. ]: American Public Health Association(APHA), 2005.
(  0) 0) |
| [16] |
Yue X, Yu G P, Liu Z H, et al. Fast start-up of the CANON process with a SABF and the effects of pH and temperature on nitrogen removal and microbial activity[J]. Bioresource Technology, 2018, 254: 157-165. DOI:10.1016/j.biortech.2018.01.019 (  0) 0) |
| [17] |
Cai Y, Ben T, Zaidi A A, et al. Effect of pH on pollutants removal of ship sewage treatment in an innovative aerobic-anaerobic micro-sludge MBR system[J]. Water, Air, & Soil Pollution, 2019, 230(7): 163. (  0) 0) |
| [18] |
Zhu G, Peng Y, Li B, et al. Biological removal of nitrogen from wastewater[M]. Reviews of Environmental Contamination and Toxicology, New York: Springer New York, 2008: 159-195.
(  0) 0) |
| [19] |
Qian W T, Ma B, Li X Y, et al. Long-term effect of pH on denitrification: High pH benefits achieving partial-denitrification[J]. Bioresource Technology, 2019, 278: 444-449. DOI:10.1016/j.biortech.2019.01.105 (  0) 0) |
| [20] |
He S L, Niu Q G, Li Y Y, et al. Factors associated with the diversification of the microbial communities within different natural and artificial saline environments[J]. Ecological Engineering, 2015, 83: 476-484. DOI:10.1016/j.ecoleng.2015.06.029 (  0) 0) |
| [21] |
Li T, Guo Z X, She Z L, et al. Comparison of the effects of salinity on microbial community structures and functions in sequencing batch reactors with and without carriers[J]. Bioprocess and Biosystems Engineering, 2020, 43(12): 2175-2188. DOI:10.1007/s00449-020-02403-8 (  0) 0) |
| [22] |
He Q, Wang H, Chen L, et al. Robustness of an aerobic granular sludge sequencing batch reactor for low strength and salinity wastewater treatment at ambient to winter temperatures[J]. Journal of Hazardous Materials, 2020, 384: 121454. DOI:10.1016/j.jhazmat.2019.121454 (  0) 0) |
| [23] |
Yan P, Wang J, Chen Y P, et al. Investigation of microbial community structure in an advanced activated sludge side-stream reactor process with alkaline treatment[J]. International Biodeterioration & Biodegradation, 2015, 104: 356-362. (  0) 0) |
| [24] |
Lee S H, Park J H, Kang H J, et al. Distribution and abundance of Spirochaetes in full-scale anaerobic digesters[J]. Bioresource Technology, 2013, 145: 25-32. DOI:10.1016/j.biortech.2013.02.070 (  0) 0) |
| [25] |
Zhang C S, Zhang S Q, Zhang L Q, et al. Effects of constant pH and unsteady pH at different free ammonia concentrations on shortcut nitrification for landfill leachate treatment[J]. Applied Microbiology and Biotechnology, 2015, 99(8): 3707-3713. DOI:10.1007/s00253-014-6340-0 (  0) 0) |
| [26] |
Niu T H, Zhou Z, Shen X L, et al. Effects of dissolved oxygen on performance and microbial community structure in a micro-aerobic hydrolysis sludge in situ reduction process[J]. Water Research, 2016, 90: 369-377. DOI:10.1016/j.watres.2015.12.050 (  0) 0) |
| [27] |
Zhao L M, Zhang C C, Bao M T, et al. Advanced treatment for actual hydrolyzed polyacrylamide-containing wastewater in a biofilm/activated sludge membrane bioreactor system: Biodegradation and interception[J]. Biochemical Engineering Journal, 2019, 141: 120-130. DOI:10.1016/j.bej.2018.10.020 (  0) 0) |
| [28] |
Wang Q, Ding J, Xie H, et al. Phosphorus removal performance of microbial-enhanced constructed wetlands that treat saline wastewater[J]. Journal of Cleaner Production, 2021, 288: 125119. DOI:10.1016/j.jclepro.2020.125119 (  0) 0) |
| [29] |
Hossain M I, Cheng L, Cord-Ruwisch R. Energy efficient COD and N-removal from high-strength wastewater by a passively aerated GAO dominated biofilm[J]. Bioresource Technology, 2019, 283: 148-158. DOI:10.1016/j.biortech.2019.03.056 (  0) 0) |
| [30] |
韩亚琳, 王福浩, 王群, 等. HSBBR运行模式对同步短程硝化反硝化脱氮及微生物群落特征的影响[J]. 环境工程, 2021, 39(1): 51-57. Han Y L, Wang F H, Wang Q, et al. Effect of operational mode on nitrogen removal and microbial community in the process of simultaneous partial nitrification and denitrification[J]. Environmental Engineering, 2021, 39(1): 51-57. (  0) 0) |
| [31] |
王旭, 王福浩, 吴澜, 等. 超高盐度对耐盐活性污泥脱氮、微生物活性和群落结构的影响[J]. 中国海洋大学学报(自然科学版), 2021, 51(S1): 50-59. Wang X, Wang F H, Wu L, et al. Effects of ultra-high salinity on denitrification, microbial activity and community structure of salt-tolerant activated sludge[J]. Journal of Ocean University of China(Natural Science), 2021, 51(S1): 50-59. (  0) 0) |
| [32] |
Guo J B, Cong Q W, Zhang J, et al. Nitrous oxide emission in a laboratory anoxic-oxic process at different influent pHs: Generation pathways and the composition and function of bacterial community[J]. Bioresource Technology, 2021, 328: 124844. DOI:10.1016/j.biortech.2021.124844 (  0) 0) |
| [33] |
Pronk M, Neu T R, van Loosdrecht M C M, et al. The acid soluble extracellular polymeric substance of aerobic granular sludge dominated by Defluviicoccus sp.[J]. Water Research, 2017, 122: 148-158. DOI:10.1016/j.watres.2017.05.068 (  0) 0) |
| [34] |
Seviour T W, Lambert L K, Pijuan M, et al. Selectively inducing the synthesis of a key structural exopolysaccharide in aerobic granules by enriching for Candidatus "Competibacter phosphatis"[J]. Applied Microbiology and Biotechnology, 2011, 92(6): 1297-1305. DOI:10.1007/s00253-011-3385-1 (  0) 0) |
2. Qingdao Haibohe Sewage Treatment Plant, Qingdao 266005, China
 2023, Vol. 53
2023, Vol. 53


