2. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室,山东 青岛 266237;
3. 华东师范大学河口海岸学国家重点实验室,上海 200241
氮元素与海洋浮游植物的生长情况密切相关。在易受人类活动影响的近海,无机氮营养盐的排放导致了近岸海域富营养化及赤潮的爆发。而氮脱除过程则与微生物活动密切相关。反硝化过程曾被认为是海洋氮去除的主要途径[1-2],然而仅凭反硝化过程并不能解释海洋中氮收支不平衡的状况[3]。近几十年来,厌氧氨氧化(Anammox)过程的发现为海洋脱氮途径进行了补充,也为海洋氮收支平衡添加了重要的模块。厌氧氨氧化反应是指在厌氧环境下NH4+和NO2-反应生成N2的过程。厌氧氨氧化反应首次在污水处理厂中被证实存在[4],随后在多种不同环境的海域中被发现[5-8]。已有研究证实,厌氧氨氧化反应在海洋的缺氧区及氧最小值区(Oxygen Minimum Zones,OMZs)中至关重要[9],甚至能优先于反硝化作用成为缺氧区氮脱除的最主要途径[10-12]。
沿海区域是氮元素海洋地球化学循环的重要场所,同时也被认为是厌氧氨氧化作用的重要地区[13-14]。尤其是在较易受人类活动影响的海湾区域,沿海人口增加及土地利用扩张导致的营养盐荷载输入增加为厌氧氨氧化活动提供了充足的反应底物;同时,营养盐增加会引发赤潮和绿潮等生态灾害,可能导致水体低氧区域增多,为厌氧氨氧化反应提供重要的环境条件。目前厌氧氨氧化作用主要的分析方法有生物标志物法、同位素标记法和分子信息学。在边缘海区域,前人主要使用氮同位素标记法和分子信息学方法对厌氧氨氧化活动进行研究。如Song等[15]通过同位素标记法发现长江口有13%~50%的固定氮流失来源于厌氧氨氧化反应,Hou等[16]使用生物信息学方法发现随盐度的增加,长江口沉积物中厌氧氨氧化种群结构由Candidatus Brocadia为主转变为Candidatus Scalindua为主。以上两种方法主要用于研究正在进行的厌氧氨氧化活动,而使用生物标志物法可以区分厌氧氨氧化菌的来源并获得较长时间尺度的厌氧氨氧化活动记录。
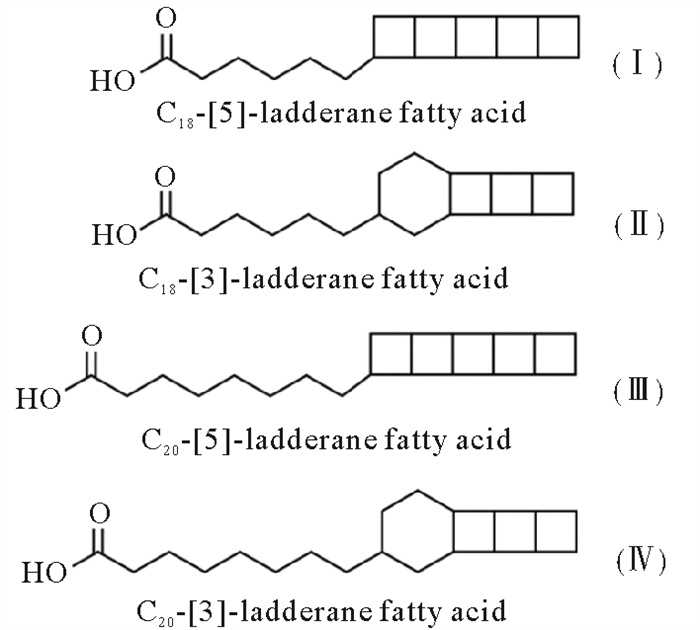
梯烷脂是厌氧氨氧化菌产生的特征生物标志物,可以指示海洋水体及沉积物中的厌氧氨氧化活动。梯烷脂主要存在于厌氧氨氧化菌中的厌氧氨氧化体(Anammoxosome)上,核心结构为3~5个链接起来的环丁烷基团(见图 1)。这种膜脂结构特殊,为厌氧氨氧化菌特有,且在自然条件下较为稳定,易于辨识,指示性专一。通过对海洋沉积梯烷脂进行分析,能有效地指示该区域厌氧氨氧化活动的发生和相关菌种的来源,并进行氮循环历史记录的回溯[17-22]。国内对梯烷脂的研究主要集中在河口的典型缺氧区域,Hu等[21]通过对长江口水体颗粒物的分析,指出梯烷脂主要来自于水体原位产生;Zhao等[17]对长江口沉积柱的研究发现梯烷脂能较好地在百年尺度上重建长江口-东海区域的缺氧及富营养化历史。但目前鲜有在与人类活动密切相关的海湾的梯烷脂研究。
|
图 1 核心梯烷脂结构示意图 Fig. 1 The structure of ladderane fatty acids |
胶州湾位于中国山东半岛南部黄海之滨,形成于全新世时期黄海对山东半岛的海侵运动,是典型的半封闭-封闭型海湾。其海域面积367.4 km2,但湾口入黄海最窄处仅有3.3 km。胶州湾除了与黄海进行物质交换,还受到陆源输入和人类活动排放的强烈影响。海湾西部有大沽河、洋河,东部有墨水河、白沙河、李村河等河流汇入,河流入湾总径流量约9×108 m3[23]。胶州湾周围设置了数十个污水排放口,主要集中在东岸。海湾内水文状况主要受潮流和余流的影响,加之河流径流的输入,导致海湾水文状况较复杂,整体易受人类活动排放的影响。胶州湾被中国北部沿海的大型城市青岛所环绕,其海域状况与青岛市海洋经济发展水平、污水排放及城市化程度密切相关。已有的研究表明,胶州湾水质状况从20世纪末呈明显的恶化趋势,但在21世纪初随着海洋国家自然保护区的划定有所改善。营养盐浓度在2002年左右呈中度营养和富营养化水平,随后海水富营养化有所缓解[24]。溶解氧浓度从1998年的9 mg/L迅速下降至2002年的5 mg/L,随着随后十年中水质的改善,溶解氧浓度得以上升[25]。本研究使用生物标志物法,运用梯烷脂从有机碳循环的角度研究胶州湾的厌氧氨氧化活动。本文主要通过生物标志物和总有机质指标(TOC, TOC/TN,δ13C)来研究沉积物中陆海源有机碳的贡献,通过梯烷脂的分布来讨论厌氧氨氧化活动的来源,并探讨厌氧氨氧化活动对海洋环境因素的响应与指示作用。
1 研究区域及方法 1.1 样品采集本研究所使用的表层沉积物于2019年8月在胶州湾采集,共30个站位(见图 2)。表层沉积物用箱式采样器采集,取0~2 cm,立即存放入-20 ℃的冰柜中。底层水盐度、温度、pH由WTW便携式多参数水文测定仪当场测定,溶解氧浓度使用采水器采取原位海水后使用自动电位滴定仪(848 Titrino plus,Metrohm,Swizterland)测定。溶解态氮营养盐采用营养盐连续流动分析仪(QuAAtro,Seal,Germany)测定,总溶解无机氮(DIN)含硝酸氮(NO3--N),亚硝酸氮(NO2--N)和氨氮(NH4+-N):硝酸氮测定采用铜镉还原-重氮偶氮法,亚硝酸氮测定采用重氮-偶氮法,氨氮测定采用苯酚法。
|
( 蓝色圆点为采样站位。Blue points represent sampling sites ) 图 2 研究区域及采样站位 Fig. 2 Map of study area and sampling sites |
有机质会附着在沉积颗粒表面,使沉积颗粒的粒径增加,为保证绝大多数有机质能被去除,又不至于高温破坏颗粒结构,将冻干沉积物样品置于马弗炉350 ℃高温去除有机碳(12 h)。降至室温后加入分散剂(六偏磷酸钠溶液,1 mol/L),随后使用粒度自动测定仪(Mastersizer 3000)进行测定,测定结果取平均粒度进行分析。
称取1 g左右冻干沉积物并研磨均匀,使用4 mol/L的盐酸除去沉积物样品中的无机碳组分后将样品在55 ℃的烘箱中烘干,平衡24 h后, 使用CHN元素分析仪(Thermo Flash EA2000)测定TOC和TN。得出原始数据后进行校正以避免酸洗过程中的损失对TOC和TN的影响。校正方法如下:
酸洗前称量冻干沉积物总质量m1,酸洗后称量冻干沉积物总质量m2,酸洗后实测样品TOC含量为a。求得校正后的样品TOC含量为TOC=a×m2/m1;TN校正方法同TOC。
TOC和TN的标准品为Atropina Standard(TOC=70.56%)和Low Organic Content Soil Standard OAS(TOC=(1.61±0.09)%),TOC与TN标准偏差使用标准Low Organic Content Soil Standard OAS测得,分别为0.02% (n=6)及0.002% (n=6)。
上述预处理沉积物使用稳定同位素比质谱仪(Elemental Analyzer-Isotope Ratio Mass Spectrometer, EA-IRMS)在连续流模式下进行有机碳的δ13C测定,使用稳定同位素比质谱仪测定δ13C的标准品为USGS-40(δ13C =-26.39‰), IAEA-600(δ13C =-27.77‰)和IAEA-CH3(δ13C =-24.72‰), 标准偏差使用标准USGS-40(δ13C =-26.39‰)测得为0.6‰(n=6)。
标准偏差公式如下:
| $ \alpha {\rm{ = }}\sqrt {\frac{{\sum\limits_{i = 1}^n {{{\left( {{X_i} - X} \right)}^2}} }}{{n - 1}}} 。$ |
式中:Xi为标准品实测值;X为测定均值;n=6。
1.3 生物标志物分析本研究计算陆源有机质贡献指标所使用的类脂生物标志物主要包括正构烷烃、甾醇和支链甘油二烷基甘油四醚(br-GDGTs),使用萃取分离法进行富集。将冻干并研磨均匀的沉积物样品加入内标(C19-醇, C24-氘烷和C46-GDGT),使用二氯甲烷∶甲醇(3∶1)溶剂进行超声萃取。萃取后混合液使用氮吹富集,并用6%氢氧化钾-甲醇溶液水解。水解12 h后使用正己烷萃取,先使用正己烷洗脱正构烷烃组分,再使用二氯甲烷∶甲醇(95∶5)洗脱甾醇和GDGTs组分。正构烷烃和甾醇组分使用气相色谱仪(FID-GC,Agilent 7890N,色谱柱为HP-1毛细管柱)进行测定,GDGTs组分使用高效液相色谱-质谱联用仪(HPLC-MS,Agilent1200/Waters-Quattro Ultima Pt mass,色谱柱为Prevail Cyano正相色谱柱)进行测定。
本研究使用梯烷脂作为厌氧氨氧化的标志物,使用萃取分离法进行富集。冻干并研磨均匀的沉积物样品加入二氯甲烷∶甲醇(2∶1)溶剂进行萃取,然后使用活化铜粉除去残余的硫,氮吹富集后用6%氢氧化钾-甲醇溶液水解。水解12 h后使用正己烷萃取4次,合并萃取液获得中性组分。在剩余的混合液中加入6 mol/L盐酸调节pH,继续用正己烷萃取,得到的萃取液经无水硫酸钠脱水后加入三氟化硼-甲醇溶液甲基化处理。甲基化后的脂肪酸甲酯(FAMEs)经过正己烷的萃取后加入内标2-羟基-4-甲氧基二苯丙酮,使用高效液相色谱-质谱联用仪(HPLC-MS,Agilent1200/Waters-Quattro Ultima Pt mass,色谱柱为Zorbax Eclipse XDB-C8反相键合色谱柱)进行测定。
1.4 TMBR、BIT和NL5的计算相对陆源指标TMBR[28]和BIT[29]的计算公式分别如下:
| $ {\rm{TMBR = }}\frac{{\sum {\left( {{\rm{C27 + C29 + C3}}1\ n - {\rm{alkanes}}} \right)} }}{{\sum {\left( {{\rm{C27 + C29 + C3}}1\ n - {\rm{alkanes}}} \right) + \sum {\left( {{\rm{B + D}}} \right)} } }}。$ |
式中:∑(C27 + C29 + C31 n-alkanes)为陆地高等植物生物标志物长直链烷烃含量;∑(B + D)为海洋浮游植物生物标志物;B代表菜子甾醇含量;D代表甲藻甾醇含量。
| $ {\rm{BIT}} = \frac{{\left( {{\rm{{\rm I}a + {\rm I}{\rm I}a + {\rm I}{\rm I}{\rm I}a}}} \right)}}{{\left( {{\rm{{\rm I}a + {\rm I}{\rm I}a + {\rm I}{\rm I}{\rm I}a}}} \right) + {\rm{{\rm I}V}}}}。$ |
式中:Ⅰa + Ⅱa + Ⅲa代表不同的支链甘油二烷基甘油四醚:br-GDGT-Ⅰ、br-GDGT-Ⅱ、br-GDGT-Ⅲ含量之和,Ⅳ代表海洋中泉古菌醇含量。
梯烷脂的NL5指标与厌氧氨氧化菌所生活的温度相关[30],公式如下:
| $ {\rm{NL5 = }}\frac{{{\rm{ladderaneI}}}}{{{\rm{ladderaneI + ladderaneⅢ }}}}。$ |
| $ {\rm{NL5 = 0}}{\rm{.2 + }}\frac{{{\rm{0}}{\rm{.7}}}}{{{\rm{1 + }}{{\rm{e}}^{ - {\rm{(}}\frac{{{\rm{Temp - 16}}{\rm{.3}}}}{{{\rm{1}}{\rm{.5}}}}{\rm{)}}}}}}。$ |
式中:ladderane Ⅰ代表甲酯化处理后的梯烷脂C18-[5]-ladderane FAME(Ⅰ)含量;ladderane Ⅲ代表甲酯化处理后的梯烷脂C20-[5]-ladderane FAME(Ⅲ) 含量。
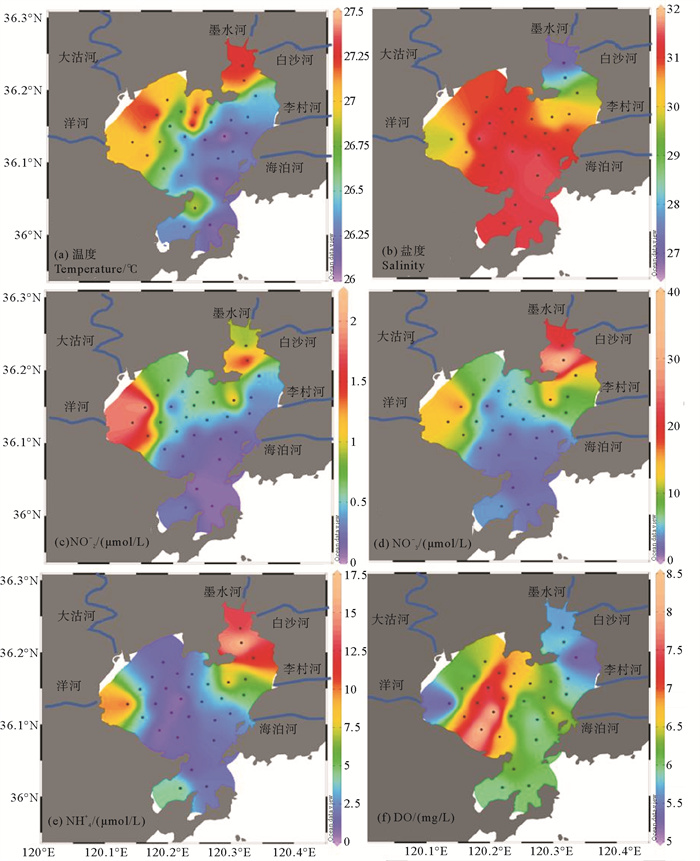
2 结果 2.1 胶州湾水体及沉积物的环境参数胶州湾夏季底层水体温度差异较小,为26.0~27.5 ℃,平均26.7 ℃,胶州湾东北角及西部海域水温较高(见图 3(a)),是由于这些区域水深较浅,底层水易受太阳辐射影响。底层水盐度为26.9~31.6,平均为30.8,胶州湾东北角及洋河河口附近盐度较低,其余站位盐度均为31.0附近(见图 3(b))。胶州湾底层水三种无机氮盐(亚硝氮、硝氮、氨氮)空间分布上较为类似,主要的高值区出现在湾东北部及西部河口区域(见图 3(c),3(d),3(e))。底层水体溶解氧含量为5.2~8.3 mg/L,平均6.3 mg/L,低值区同样集中于胶州湾东北角及西部近岸河口区域(见图 3(f))。
|
( (a)胶州湾底层水体温度(℃);(b)胶州湾底层水体盐度;(c)胶州湾底层水体NO2-含量(μmol/L);(d)胶州湾底层水体NO3-含量(μmol/L);(e)胶州湾底层水体NH4+含量(μmol/L);(f)胶州湾底层水体溶解氧含量(mg/L)。(a)Bottom sea water temperature (℃) of Jiaozhou Bay; (b)Bottom sea water salinity (psu) of Jiaozhou Bay; (c)Bottom NO2- content (μmol/L) of Jiaozhou Bay; (d)Bottom NO3- content (μmol/L) of Jiaozhou Bay; (e)Bottom NH4+ content (μmol/L) of Jiaozhou Bay; (f)Bottom DO content (mg/L) of Jiaozhou Bay. ) 图 3 胶州湾海底水体参数 Fig. 3 Bottom sea water parameters in Jiaozhou Bay |
胶州湾表层沉积物中的TOC含量为0.06%~0.94%,平均0.48%,高值区集中在胶州湾东部近岸处(见图 4(a))。表层沉积物总有机质δ13C值为-22.4‰~-19.7‰,δ13C值普遍偏高且极差较小,但是空间分布上呈较明显的西高东低的趋势,最低值出现在胶州湾东北角及湾南部出口处(见图 4(b))。表层沉积物的碳氮比TOC/TN为3.7~12.3,平均8.4,碳氮比普遍偏低,空间上呈西低东高的趋势(见图 4(c))。
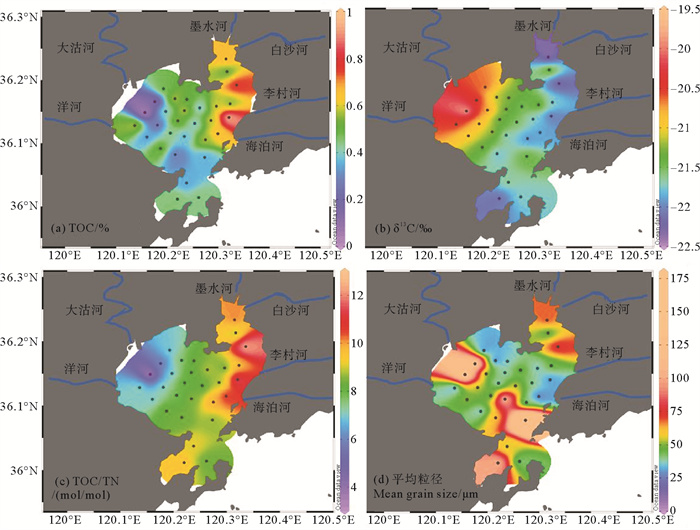
|
( (a) 沉积物TOC含量(%);(b) 沉积物TOC的δ13C值(‰);(c) 沉积物碳氮比(mol/mol);(d) 沉积物平均粒径(μm)。(a) TOC of sediments (%); (b) TOC-δ13C value of sediments (‰); (c) TOC/TN ratio of sediments (mol/mol); (d) mean grain size of sediments (μm). ) 图 4 胶州湾沉积物总有机质参数及平均粒径 Fig. 4 Bulk organic matter and mean grain sizes of sediment samples |
表层沉积物的平均粒径为24~187 μm,大部分底泥为粉砂质(Silt),而粒径较高的砂质(Sand)区集中在三个区域,分别是海湾东北角,西部大沽河/洋河河口,及胶州湾南部湾口处(见图 4(d))。
2.3 生物标志物和比值指标胶州湾表层沉积物生物标志物的空间分布上,指示陆源有机质贡献的指标TMBR和BIT都在胶州湾东北部及西部比值较高(见图 5(a),图 5(b))),TMBR比值指标为0.23~0.69,平均为0.46,BIT比值指标为0.10~0.29,平均0.17。

|
( (a) 沉积物有机质TBMR指标,数值由长链烷烃及甾醇含量比值得出,代表陆源有机质的贡献比例;(b)沉积物有机质BIT指标,数值由不同GDGT及泉古菌醇含量比值得出,代表陆源有机质的贡献比例。(a) Distribution of TMBR index, which is calculated by contents of long chain n-alkanes, brassicasterol and dinosterol; (b) Distribution of BIT index, which is calculated by contents of br-GDGTs and crenachaeol. ) 图 5 胶州湾沉积有机质陆源贡献指标 Fig. 5 Distribution of terrestrial OC contribution indices |
胶州湾所有站位的表层沉积物中都检出了梯烷脂,含量为4~574 μg/g OC,平均含量为163 μg/g OC。在胶州湾西部含量较低,高值站位主要分布胶州湾东部120.3°E附近及湾口处(见图 6(a))。本研究聚焦四种梯烷核心脂,C18-[5]-ladderane FAME(Ⅰ),C18-[3]-ladderane FAME(Ⅱ),C20-[5]-ladderane FAME(Ⅲ)和C20-[3]-ladderane FAME(Ⅳ)。胶州湾表层沉积物中C20-[5]-ladderane FAME(Ⅲ)和C20-[3]-ladderane FAME(Ⅳ)为主要组分,分别占同站位总梯烷脂含量的23%~66%(平均38%)和24%~77%(平均56%),且不同组分梯烷脂的空间分布和总梯烷脂空间分布状况基本一致。
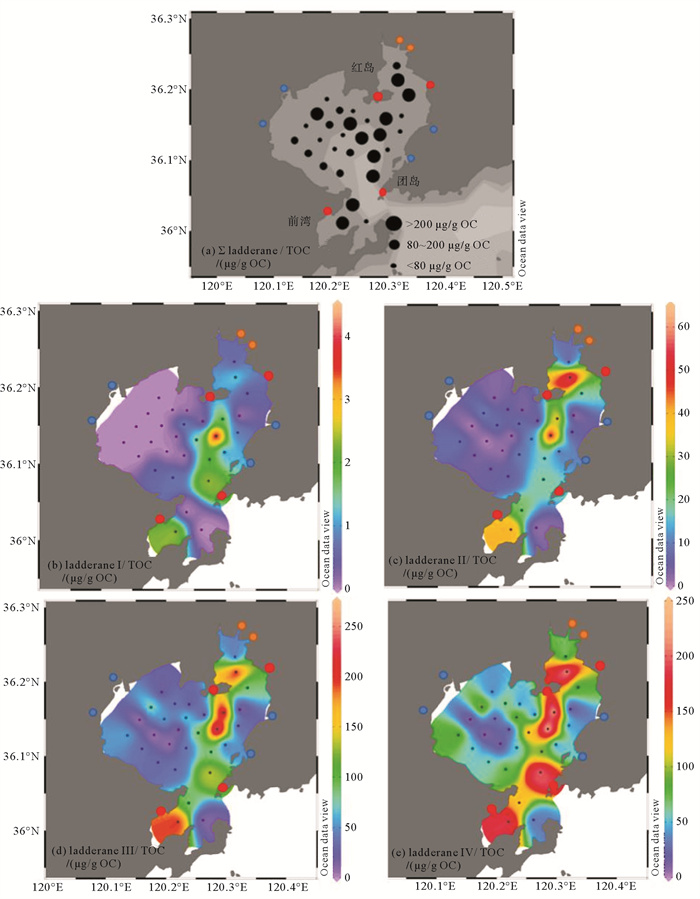
|
( 根据山东省生态环境厅发布的省控重点污染源排放监控数据库,红点代表胶州湾周围污水主要输入;蓝点代表胶州湾沿岸河流主要输入;橙点代表河流-污水混合输入。(a) ∑ ladderane/TOC含量区间分布图(μg/g OC);(b) ladderane Ⅰ/TOC含量分布图(μg/g OC);(c) ladderane Ⅱ/TOC含量分布图(μg/g OC);(d) ladderane Ⅲ/TOC含量分布图(μg/g OC);(e) ladderane Ⅳ/TOC含量分布图(μg/g OC)。Red dots represent main sewage input, according to the emission monitoring database of key pollution sources released by Shandong Provincial Department of Ecology and Environment. Blue dots represent main river water input of Jiaozhou Bay. Orange dots represent mixing inputs of sewage and river water. Red dots represent main sewage input around Jiaozhou Bay. (a) Distribution of summed TOC-normalized ladderane contents (μg/g OC); (b) Distribution of TOC-normalized ladderane Ⅰ contents (μg/g OC); (c) Distribution of ladderane Ⅱ contents (μg/g OC); (d) Distribution of TOC-normalized ladderane Ⅲ contents (μg/g OC); (e) Distribution of TOC-normalized ladderane Ⅳ contents (μg/g OC). ) 图 6 胶州湾沉积物梯烷脂含量分布图 Fig. 6 The spatial distribution of different ladderane FAMEs contentsin sediments |
利用梯烷脂研究海湾厌氧氨氧化活动的关键是厘清梯烷脂是由海洋产生还是来自于陆源输入,因此首先对胶州湾沉积物中有机质的来源进行判断与讨论,并后续建立有机碳与梯烷脂的相关关系,进一步对梯烷脂的来源及响应进行分析。
总有机质参数碳氮比值TOC/TN及稳定碳同位素δ13C能从总有机碳角度对有机质的来源进行分析。胶州湾沉积物有机质TOC/TN值与δ13C值存在良好的相关关系(r2 = 0.82)(见图 7(b)),表明在胶州湾沉积有机质中有机质来源的影响因素相似,可以通过两者来有效判断有机质来源。碳氮比高值区(TOC/TN>9,mol/mol)和δ13C低值区(δ13C<-21‰)明显集中于海湾东部沿岸区域,表明与西北部区域相比,东部沿岸区域沉积物中陆源有机质的贡献更多。一般海源浮游植物碳氮比约为5~7(mol/mol),接近Redfield比值6.6(mol/mol),而陆地高等植被的碳氮比高达15~1 000(mol/mol)[31]。海源浮游植物δ13C值一般在-23‰~-12‰[32],陆地高等植物的δ13C值则更低,为-33‰~-23‰[32]。胶州湾沉积物中碳氮比值平均为8.4(mol/mol),δ13C值平均为-21.4‰。总的来说,胶州湾沉积物有机质TOC/TN值较低、δ13C值较高,表明在胶州湾沉积有机质中海源初级生产力可能占主导,原因可能为近年来胶州湾附近各河流中下游设置较多的拦水坝,使得陆源物质如高等植物碎屑较难直接输入到海湾中。TOC-TN的拟合直线显示两者相关性良好,斜率为8.38(高于Redfield比值),且回归线落在TN轴的正截距上(见图 7(a)),表现出沉积物对无机氮的吸附作用[33],可能与胶州湾陆源输入较多的无机氮盐相关。胶州湾西北大沽河口区域δ13C值较高(见图 4(b)),可能受沿海河口区域C4植物(δ13C值-16‰~-9‰)的影响[34],另外,土壤来源有机质及农肥也可能是导致海湾地区δ13C值偏高的原因[35-36]。综合而言,总有机质参数表明胶州湾沉积有机质以海源为主导。
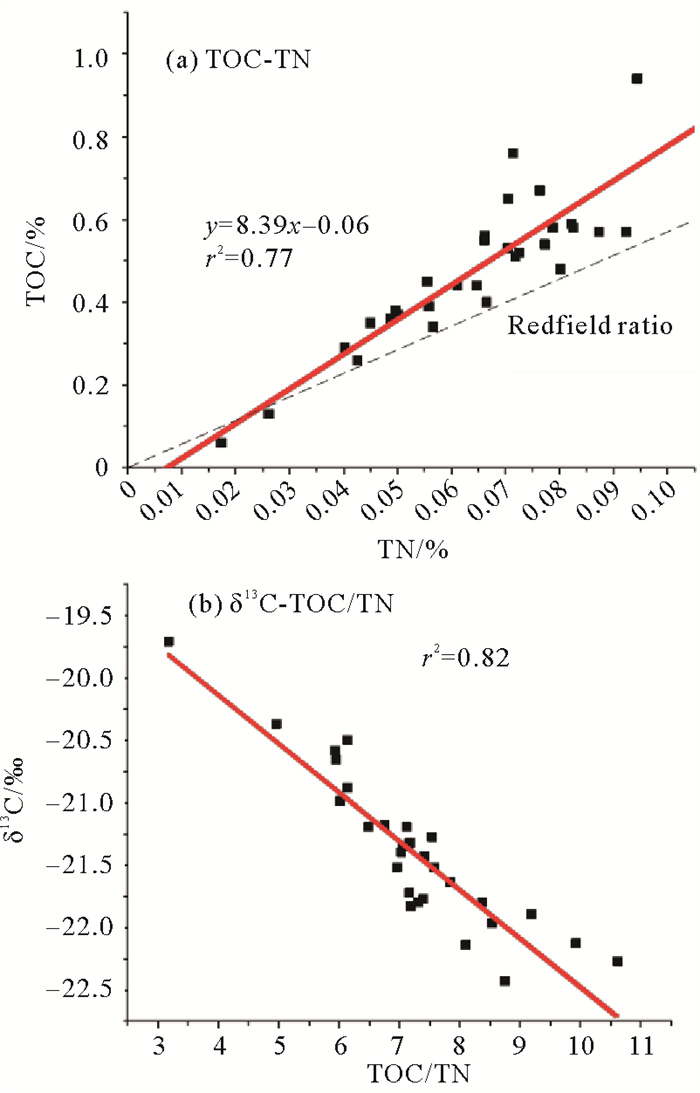
|
( (a) 沉积物TOC和TN线性关系图;(b) 沉积物总有机质的δ13C和TOC/TN线性关系图。(a) Plot of sediment TOC and TN; (b) Plot of sediment TOC-δ13C and TOC/TN. ) 图 7 胶州湾沉积物总有机质参数线性关系图 Fig. 7 Plot of sediment OC parameters |
考虑到胶州湾总有机质参数难以精确指示不同来源有机质贡献程度,因此使用生物标志物指标对不同来源有机质贡献进行进一步解析。为了避免沉积物本身性质(如粒度等)对有机质保存的影响,可使用相对陆源指标TMBR和BIT衡量湾底沉积物中海/陆源有机质的贡献比例。整体来说,TMBR(平均值0.46)和BIT值(平均值0.17)都表明胶州湾沉积物中海源有机质占主要地位,其贡献约为54%(TMBR得出)和83%(BIT得出)。TMBR指标和BIT指标所指示陆源相对贡献的空间分布类似,陆源贡献较高的区域位于海湾东北部和西部,主要受河流输入的影响。湾东北部区域陆源贡献指标尤其高,虽然此处附近的河流流量较小,仅占胶州湾整体河流入海通量的不到20%[23],但陆源贡献指标明显高于西部河口区域(见图 5(a),图 5(b)5(b))。原因可能是海湾东北部区域较小且较狭窄,不同于西部河口直接面向开阔海域,海湾东北部多条河流输入的陆源有机质能较多的聚集于此区域。在本文研究区域,BIT值普遍低于TMBR值,这可能是由于TMBR所使用的生标(长链烷烃)与BIT使用的生标(br-GDGTs)在传输机制及存在方式上有所不同。BIT指标使用的br-GDGTs主要由土壤细菌产生,只能指示河流输入土壤对海湾沉积有机质的贡献;同时br-GDGTs在河口区域的降解也可能是BIT值偏低的原因[37];而TMBR指标使用的长链烷烃存在于高等植物碎屑中,除了随河流输入海湾,还可以通过大气沉降输送入海[38]。
3.2 胶州湾梯烷脂的成分与来源胶州湾表层沉积物中普遍检出梯烷脂。由于胶州湾沉积物平均粒径的空间分布存在较大差异,为了部分排除粒径对有机质保存产生的影响,因此在讨论梯烷脂的空间分布时使用总有机碳均一化后的梯烷脂含量(ladderane/TOC)来分析。前人研究指出沉积物中的梯烷脂主要来自于活体的厌氧氨氧化细菌,也可能来自于已经凋亡或失活的厌氧氨氧化细菌[39]。与其他研究方式不同,沉积物中的梯烷脂不仅能代表正在进行的厌氧氨氧化活动,还能记录曾经进行的厌氧氨氧化活动。通过追溯沉积物中梯烷脂的来源并分析其成分,可以推断梯烷脂是由外部(包括河流和污水口)输入海湾还是由海洋原位的厌氧氨氧化活动产生。因此,运用梯烷脂能更好地对胶州湾脱氮的潜力及贡献进行评估。
胶州湾沉积梯烷脂空间分布不均匀,海湾西部梯烷脂含量普遍偏低,高值区主要位于胶州湾东北角,北岸的红岛附近,以及团岛和前湾港附近的站位(见图 6(a))。对胶州湾沉积梯烷脂与陆源有机质贡献指标进行相关性比对,结果表明梯烷脂与陆源贡献指标均无显著线性关系(见图 8)。这说明沉积物中的梯烷脂不单受陆源或海源主导,需要考虑不同方式的混合对梯烷脂分布的影响。
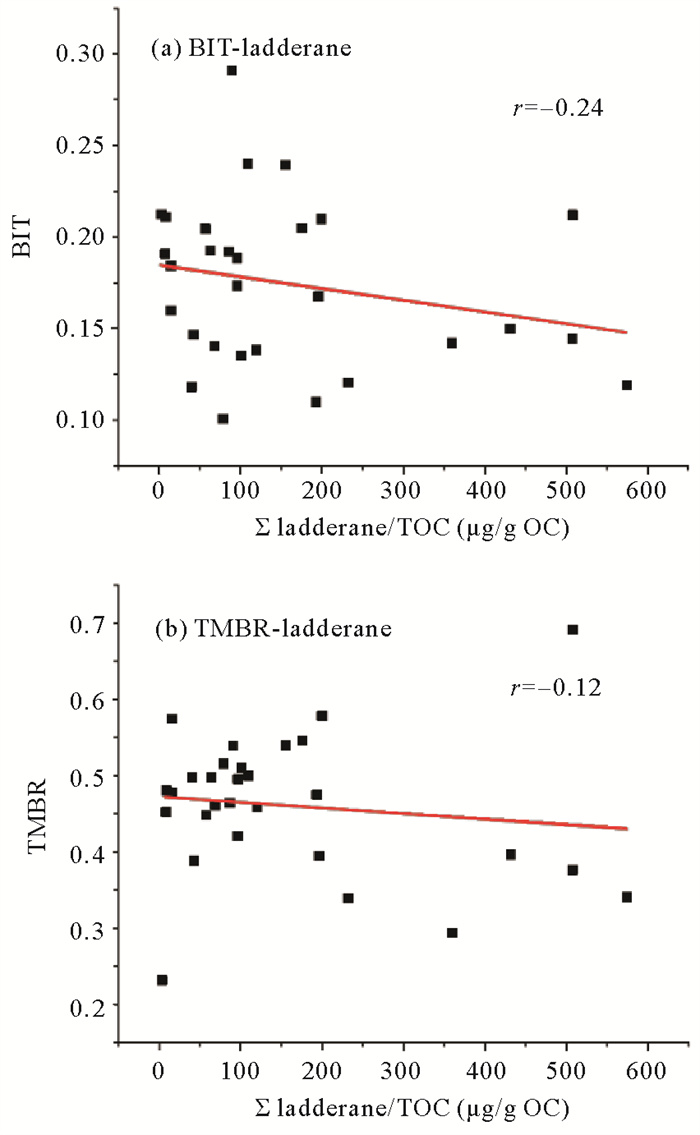
|
( (a)沉积物BIT指标与总梯烷脂含量线性关系;(b) 沉积物TMBR指标与总梯烷脂含量线性关系。(a) Plot of BIT index and TOC-normalized ladderane contents; (b) Plot of TMBR index and TOC-normalized ladderane contents. ) 图 8 胶州湾沉积物有机质陆源贡献指标与总梯烷脂含量线性关系图 Fig. 8 Plot of terrestrial OC contribution indices versus summed TOC-normalized ladderane contents |
研究表明,在不同温度下,厌氧氨氧化菌会通过改变合成的梯烷脂链长来保持细胞膜的流动性[30],一般来说厌氧氨氧化菌所处环境温度越高,膜脂上所合成的链长较长的ladderane Ⅲ含量占比会增加,链长较短的ladderane Ⅰ则减少,而基于ladderane Ⅲ和ladderane Ⅰ比值的温度指标NL5值越大。根据NL5-T经验公式的函数性质,NL5值反演梯烷脂合成温度的最适区间为12~20 ℃[19],反演温度的NL5最大值为0.9,对应的温度约为25 ℃。胶州湾所有站位表层沉积物中梯烷脂NL5值均大于0.9,无法进行具体温度反演计算,可能是较高的合成温度使得厌氧氨氧化菌膜脂上所合成的ladderane Ⅲ含量远高于ladderane Ⅰ。根据胶州湾沉积物NL5的数值,定性上可以判断梯烷脂合成的环境温度高于25 ℃,与胶州湾夏季平均水温26.7 ℃较为相符。同样,祝孟玲等[54]和Zhao等[17]分别对珠江口和东海陆架沉积物中的梯烷脂来源进行了分析,并通过NL5值反演温度推断沉积物中梯烷脂可能主要来自于上层水体颗粒物沉降。另外,虽然海洋沉积物中存在厌氧氨氧化活动[27, 39, 49],但胶州湾沉积物夏季温度约为21 ℃[51],明显低于夏季水体温度,与梯烷脂较高的NL5值不符,且夏季表层沉积物间隙水并未明显缺氧(平均4.5 mg/L)[27],因此胶州湾沉积物中的梯烷脂可能主要来自于夏季水体颗粒物的沉降。但由于NL5-T经验公式的温度最佳适用范围有限(12~20 ℃),并不能据此完全排除胶州湾沉积物原位产生梯烷脂的可能性。
厌氧氨氧化菌在海洋水体中主要附着于颗粒物上进行厌氧氨氧化活动[21]。厌氧氨氧化菌主要有五种不同属,分别为Candidatus brocadia、Candidatus scalindua、Candidatus kuenenia、Candidatus jettenia、Candidatus anammoxoglobus不同属厌氧氨氧化菌种有不同的生理性质及形态特征,会产生不同种类的梯烷脂,因此可以分析各成分梯烷脂的含量及比例来探究胶州湾沉积物中梯烷脂的不同来源。近海及河流环境中主要发现的菌群为Candidatus scalindua,Candidatus brocadia和Candidatus kuenenia[26-27, 40]。其中Scalindua为高盐种,最常见于大洋环境;而Brocadia及Kuenenia为低盐种,主要存在于污水处理反应器及河流/河口区域[41]。培养试验的结果显示,菌种Scalindua的梯烷膜脂中ladderane Ⅳ为单独主导,ladderane Ⅲ/ladderane Ⅳ约为0.6;菌种Brocadia和Kuenenia中ladderane Ⅲ和Ⅳ共同主导,ladderane Ⅲ/ladderane Ⅳ均为1.0左右[42]。胶州湾中各站位梯烷脂含量差异较大且空间分布不均匀,因此将梯烷脂高值站位(>200 μg/g OC)与低值站位的ladderane Ⅲ/ladderane Ⅳ进行双样本t检验,以分辨不同站位中梯烷脂的来源。在排除异常值后,高值站位与低值站位ladderane Ⅲ/ladderane Ⅳ存在显著性差异(p=0.001)。具体来说,梯烷脂高值站位中的ladderane Ⅲ/ladderane Ⅳ较高(见图 9(a)),平均达到了0.9(见图 9(c)),比例更接近淡水菌种Brocadia和Kuenenia;而低值站位中ladderane Ⅲ/ladderane Ⅳ平均值为0.7,排除异常值后平均值为0.6(见图 9(c)),比例更接近高盐种厌氧氨氧化菌Scalindua。需要注意的是,梯烷脂高值站位也能检出Scalindua的特有膜脂ladderane Ⅱ[42],因此这些站位可能同样存在Scalindua菌种。以上结果表明,在梯烷脂低值站位,高盐种厌氧氨氧化菌Scalindua可能是梯烷脂的主要贡献者,即梯烷脂主要由海水原位产生;而在梯烷脂高值站位,除了Scalindua的贡献之外,还可能有较多来自于淡水排放菌种Brocadia和Kuenenia的贡献,即梯烷脂主要来自于河流/污水输送的颗粒物。空间分布上,高值站位也集中位于胶州湾沿岸的污水处理厂附近(见图 6(a))。而湾西部的河流(大沽河、洋河)虽然能贡献胶州湾80%以上的河流入海流量及70%以上的泥沙入海通量[23],但相比于人口密集的东岸,西部河流流域受人类排放的影响较少[48],且沉积物平均粒径较高不利于生物标志物的保存,因此梯烷脂在湾西部无明显的高值站位。未来在典型区域的端元(如污水端,河流淡水端及现场生产悬浮颗粒物)以及不同季节对梯烷脂进行进一步的结构及分布研究能更好的校验梯烷脂对海湾区域厌氧氨氧化活动的指示意义。
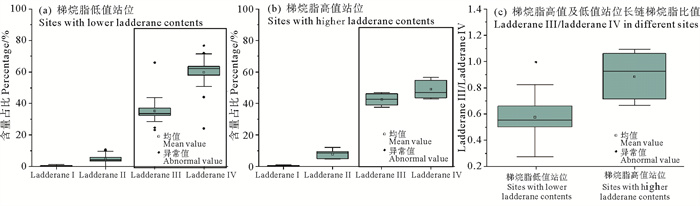
|
( (a) 梯烷脂低值站位中(< 200 μg/g OC)的不同组分含量占比;(b) 梯烷脂高值站位中(> 200 μg/g OC)的不同组分含量占比;(c) 梯烷脂低值及高值站位ladderane Ⅲ与ladderane Ⅳ比值。(a) Compositions of ladderane FAMEs in sites with lower ladderane contents(< 200 μg/g OC); (b) Compositions of ladderane FAMEs in sites with higher ladderane contents(> 200 μg/g OC); (c). ladderane Ⅲ/ladderane Ⅳ ratio in sites with lower ladderane contents and sites with higher ladderane contents. ) 图 9 不同站位梯烷脂不同组分含量占比箱式图 Fig. 9 Box plot of ladderane FAMEs in different sites |
目前,厌氧氨氧化活动已经在不同环境中被广泛发现,包括大洋、近海、淡水、河口和污水等。根据青岛市海洋环境公报,青岛市夏季(8月)海水水质状况为一年中最佳,主要表现在无机氮盐平均浓度较低,富营养化海域面积较小且主要集中在东部沿岸,与本次采样数据相吻合。若使用分子信息学方法研究沉积物的厌氧氨氧化活动,由于采样时间和季节的不同,沉积物中存在凋亡或非活性态的厌氧氨氧化菌,可能因此引入误差,错估了研究海域中厌氧氨氧化对氮脱除的贡献。胶州湾沉积物沉积速率为0.28~0.64 cm/a [45],因此本研究采集的表层沉积物(0~2 cm)反映的是近几年的沉积状况。梯烷脂作为百年尺度上稳定的生物标志物,在确定其来源后,能够反映研究海域的厌氧氨氧化活动状况(包括已经进行的和正在进行的;河流/人为排放的和海水中原位合成的),从而更好地对氮循环及脱氮过程进行评价,并综合指示海洋中的厌氧氨氧化状况。
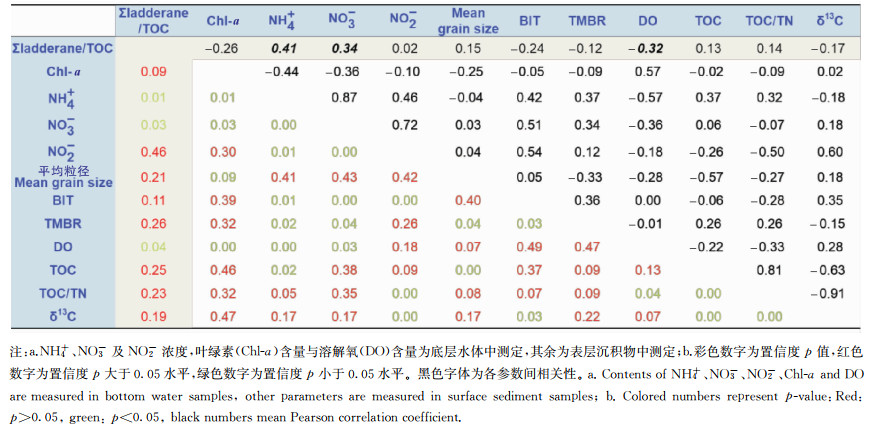
胶州湾表层沉积物中普遍检出了梯烷脂,根据3.2中的讨论,胶州湾表层沉积物中的梯烷脂主要来自夏季温暖的水体颗粒物的沉降,且梯烷脂高值区域有污水排放的贡献。根据青岛市海洋健康公报数据,2010年以来胶州湾夏季海水环境质量状况较为类似,主要营养盐高值区都集中于海湾东北角与西部的河口区,因此本文所测定的夏季水体营养盐数据可以用于分析胶州湾沉积物中梯烷脂的影响因素。从营养盐角度考虑,厌氧氨氧化反应的反应底物是NH4+和NO2-,且与NO3-的反硝化作用有复杂的耦合关系。因此环境中的营养盐含量,尤其是底物浓度可能直接影响厌氧氨氧化活动,进而影响到梯烷脂的含量。对大洋水体的研究发现,梯烷脂含量与水体营养盐浓度高值分布均存在较好的一致性[11, 43-44]。对厌氧氨氧化菌的研究发现,不同环境中厌氧氨氧化菌分布和活性可能受不同营养盐影响[5, 16, 26-27]。对胶州湾沉积梯烷脂和底层水体营养盐参数进行皮尔斯相关性分析发现,本区域中沉积梯烷脂与水体NH4+及NO3-呈正相关关系(见表 1,r=0.41, p < 0.05;r=0.34, p < 0.05),但与NO2-无显著相关(见表 1,p>0.1)。在胶州湾,底层水体中NH4+浓度普遍高于NO2-浓度,NO2-/NH4+较低(平均0.26),远低于厌氧氨氧化反应底物之比(NO2-/NH4+=1.32∶1)。虽然此种环境下NO2-更可能成为厌氧氨氧化反应的限制条件,但在胶州湾内,NO2-与沉积梯烷脂相关关系不显著,因此没有证据显示NO2-为厌氧氨氧化活动的限制性底物。这可能由两个原因造成:一是厌氧氨氧化作用与反硝化作用的耦合较为复杂,海湾环境的脱氮过程中反硝化作用占主导,因此厌氧氨氧化所需的NO2-可能直接来自于硝酸盐的还原过程;二是海洋沉积梯烷脂并非都在原位产生,也可能来自于营养盐含量迥异的淡水水体。NH4+和NO3-两者与梯烷脂呈较显著的相关关系,这是因为胶州湾海水中这两种无机氮盐主要来自于河流排放及地下水的输入,受人类活动排放的影响较大,尤其是NO3-作为胶州湾水体中的主要营养盐,主要来自于人类活动排放,这与前文分析一致,即梯烷脂的高值可能是受污水排放所导致。本研究发现梯烷脂含量与NH4+呈显著正相关关系(见表 1)。虽然NH4+为厌氧氨氧化反应的底物,但前人研究很少在海洋中发现其含量会对厌氧氨氧化过程产生影响,因为海洋环境中NH4+部分来自于有机质的矿化,其与矿化过程中的电子受体主要促进反硝化作用,从而抑制了海洋中的厌氧氨氧化活动[7]。胶州湾水体中的NH4+主要来自于陆源排放,能被厌氧氨氧化菌充分应用,因此胶州湾海域梯烷脂与反应底物NH4+存在显著相关关系。
|
|
表 1 胶州湾海底环境各参数皮尔森相关关系ab Table 1 Pearson correlations of different parameters in Jiaozhou Bay bottom environment |
考虑到胶州湾作为受人类活动影响剧烈的海湾,水文环境复杂,影响海域水体健康状况的变量较多,因此对表层沉积物样品的各有机质参数和环境参数进行主成分分析,探究梯烷脂是否具有指示复杂状况下水体环境质量的潜力。主成分分析中所有变量公因子方差都大于0.7,即都被良好表达。提取主成分1(PC1)和主成分2(PC2)做各因子的二维载荷图(见图 10(a))并研究各个变量在主成分轴上的投影。主要营养盐(NO3-、NH4+)、溶解氧和叶绿素含量在横坐标主成分1的投影绝对值较大,这些变量都是评价胶州湾水体环境质量的指标,因此我们将主成分1认为是胶州湾水体环境质量;δ13C、TOC/TN和TOC在纵坐标主成分2的投影绝对值较大,这些参数是沉积物有机质本身的性质,因此将主成分2认为是胶州湾沉积物有机质来源性质指标。通过总梯烷脂变量向量与其他变量向量的位置关系,以及总梯烷脂变量向量在主成分上的投影,可以对其影响因素进行区分。投影显示,梯烷脂向量近似平行于PC1横轴,且在横轴上的投影绝对值较大,因此推断梯烷脂能较好表达胶州湾水体环境质量,如海湾富营养化状态,污水排放状态等。进一步对各站位主成分得分图(见图 10(b))进行分析,发现胶州湾沉积物梯烷脂含量较高的站位大部分聚集于主成分1的正轴附近且在横轴的投影值较高。3.2中讨论得出高值的沉积物梯烷脂可能受陆源污水排放影响,这也与对主成分1代表胶州湾水体环境质量的判断相一致。梯烷脂向量与主要营养盐向量,尤其是铵盐NH4+接近平行且方向相同(正相关),而与溶解氧和叶绿素含量向量接近中心对称,方向相反(负相关),这与梯烷脂与NH4+及溶解氧的皮尔森相关系数一致(见表 1,lad-NH4+,r=0.41,p < 0.05;lad-DO,r=-0.32,p < 0.05)。虽然有研究表明在沉积物中梯烷脂含量与溶解氧含量有较好的负相关关系[7, 44],但是厌氧氨氧化菌并非需要严格缺氧的环境才能生存[40, 49]。胶州湾底层海水溶解氧含量较高(5.2~8.3 mg/L),在此环境沉积物中发现普遍存在的厌氧氨氧化活动指示物可能有以下原因:第一,厌氧氨氧化活动可在有氧环境中进行,Hamersley等[10]和Kuypers等[11]都在非显著缺氧环境中(DO>2 mg/L)检出一定含量的厌氧氨氧化菌,虽然在这些海域中梯烷脂含量并非最高,但能证明厌氧氨氧化菌能存在于氧化性水体中;Liu等[52]对厌氧氨氧化菌耐氧性的研究显示,厌氧氨氧化菌可以在含氧污水(DO最高达8 mg/L)中存在并保持活性进行脱氮作用,这可能与其他微生物对厌氧氨氧化菌的保护作用有关;Zhang等[53]对黄河悬浮颗粒厌氧氨氧化作用的研究显示在DO普遍大于8 mg/L的水体环境中存在厌氧氨氧化菌。第二,厌氧氨氧化菌细胞颗粒能与来自于水体的颗粒物相结合,故胶州湾沉积物中的梯烷脂可能反映了有机质碎屑在沉降过程中降解所造成的微缺氧环境,如南太平洋的陆架区域的厌氧氨氧化活动便与海洋雪状况密切相关[50]。第三,海湾中的沉积梯烷脂还可能来自于低溶解氧河流水体中颗粒物的搬运,并非在海洋低氧环境中原位生产。需要指出的是,梯烷脂能够稳定保存在沉积物中并记录厌氧氨氧化活动,如Zhao等在长江口海域的百年尺度沉积柱中检测到了梯烷脂的存在,并通过与海域营养状况历史记录的对比证明梯烷脂能较好指示人类活动对水体溶解氧的影响[17]。因此,表层沉积物中梯烷脂对人类活动影响下的海湾水体质量状况的有效指示,能为百年尺度沉积记录的研究奠定基础,这为指示海湾环境、乃至其他边缘海环境中的人类活动提供了新的思路。
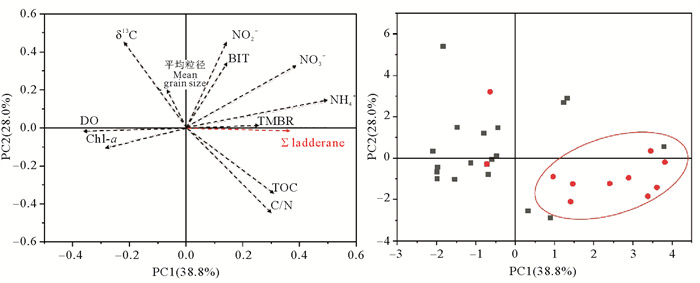
|
( (a)主成分分析载荷图;(b)主成分分析得分图,其中红色圆点代表梯烷脂高值站位,黑色方点代表梯烷脂低值站位。(a) Loadings plot from principle component analysis; (b) Scores plot from principle component analysis, red dots represent higher ladderane contents sites and black squares represent lower ladderane contents sites. ) 图 10 胶州湾沉积物梯烷脂及其他参数的主成分载荷图及得分图 Fig. 10 Loadings plot and scores plot from principle component analysis (PCA) containing ladderanes and other parameters |
(1) 胶州湾表层沉积物有机质中海源贡献普遍大于陆源贡献,部分区域的高陆源有机质贡献可能受河流输入的影响。
(2) 沉积物中梯烷脂含量的空间分布及其各组分的比例表明,胶州湾区域存在广泛的厌氧氨氧化活动,且主要夏季水体颗粒物的沉降而非在沉积物中产生。大部分站位沉积梯烷脂主要来自于海水水体中高盐种Candidatus scalindua,在梯烷脂高值站位也有菌种Candidatus brocadia和Candidatus kuenenia的贡献,主要来源于河流/污水输入的颗粒物。
(3) 海湾中沉积梯烷脂含量与多种环境因子存在相关关系,与NH4+及NO3-呈正相关,与溶解氧呈负相关。沉积物中的梯烷脂可以指示较长时间海湾厌氧氨氧化活动的情况。主成分分析表明梯烷脂作为生物标志物,能较好地反映海水环境质量,尤其是受人类活动影响较大的海湾的水体环境质量。
致谢: 本文相关样品的采集由马海力、朋鹏和丁杨提供协助,样品总有机质参数的测定由张海龙和金贵娥给予帮助,作者对以上人员表示诚挚谢意。
| [1] |
Codispoti L A, Brandes J A, Christensen J P, et al. The oceanic fixed nitrogen and nitrous oxide budgets: Moving targets as we enter the Anthropocene?[J]. Scientia Marina, 2001, 65(2): 85-105.
(  0) 0) |
| [2] |
Galloway J N, Dentener F J, Capone D J, et al. Nitrogen cycles: past, present, and future[J]. Biogeochemistry, 2004, 70(2): 153-226. DOI:10.1007/s10533-004-0370-0
(  0) 0) |
| [3] |
Naqvi S W A, Voss M, Montoya J P. Recent advances in the biogeochemistry of nitrogen in the ocean[J]. Biogeosciences, 2008, 5(4): 1033-1041. DOI:10.5194/bg-5-1033-2008
(  0) 0) |
| [4] |
Mulder A, Graaf A A, Robertson L A, et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor[J]. FEMS Microbiology Ecology, 2006, 16(3): 177-184.
(  0) 0) |
| [5] |
Trimmer M, Nicholls J C, Deflandre B. Anaerobic ammonium oxidation measured in sediments along the Thames Estuary, United Kingdom[J]. Applied and Environmental Microbiology, 2003, 69(11): 6447-6454. DOI:10.1128/AEM.69.11.6447-6454.2003
(  0) 0) |
| [6] |
Rysgaard S, Glud R N. Anaerobic N2 production in Arctic sea ice[J]. Limnology and Oceanography, 2004, 49(1): 86-94. DOI:10.4319/lo.2004.49.1.0086
(  0) 0) |
| [7] |
Engström P, Dalsgaard T, Hulth S, et al. Anaerobic ammonium oxidation by nitrite (anammox): Implications for N2 production in coastal marine sediments[J]. Geochimica et Cosmochimica Acta, 2005, 69(8): 2057-2065. DOI:10.1016/j.gca.2004.09.032
(  0) 0) |
| [8] |
Schubert C J, Durisch-Kaiser E, Wehrli B, et al. Anaerobic ammonium oxidation in a tropical freshwater system (Lake Tanganyika)[J]. Environmental Microbiology, 2006, 8(10): 1857-1863. DOI:10.1111/j.1462-2920.2006.01074.x
(  0) 0) |
| [9] |
Thamdrup B, Dalsgaard T. Production of N2 through anaerobic ammonium oxidation coupled to nitrate reduction in marine sediments[J]. Applied and Environmental Microbiology, 2002, 68(3): 1312-1318. DOI:10.1128/AEM.68.3.1312-1318.2002
(  0) 0) |
| [10] |
Hamersley M R, Lavik G, Woebken D, et al. Anaerobic ammonium oxidation in the Peruvian oxygen minimum zone[J]. Limnology and Oceanography, 2007, 52(3): 923-933. DOI:10.4319/lo.2007.52.3.0923
(  0) 0) |
| [11] |
Kuypers M M M, Lavik G, Woebken D, et al. Massive nitrogen loss from the Benguela upwelling system through anaerobic ammonium oxidation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(18): 6478-6483. DOI:10.1073/pnas.0502088102
(  0) 0) |
| [12] |
Dalsgaard T, Thamdrup B, Farías L, et al. Anammox and denitrification in the oxygen minimum zone of the eastern South Pacific[J]. Limnology and Oceanography, 2012, 57(5): 1331-1346. DOI:10.4319/lo.2012.57.5.1331
(  0) 0) |
| [13] |
Paulmier A, Ruiz-Pino D. Oxygen minimum zones (OMZs) in the modern ocean[J]. Progress in Oceanography, 2009, 80(3-4): 113-128. DOI:10.1016/j.pocean.2008.08.001
(  0) 0) |
| [14] |
Zhang X, Zhang Q, Yang A, et al. Incorporation of microbial functional traits in biogeochemistry models provides better estimations of benthic denitrification and anammox rates in coastal oceans[J]. Journal of Geophysical Research: Biogeosciences, 2018, 123(10): 3331-3352. DOI:10.1029/2018JG004682
(  0) 0) |
| [15] |
Song G D, Liu S M, Marchant H, et al. Anammox, denitrification and dissimilatory nitrate reduction to ammonium in the East China Sea sediment[J]. Biogeosciences, 2013, 10(11): 6851-6864. DOI:10.5194/bg-10-6851-2013
(  0) 0) |
| [16] |
Hou L, Zheng Y, Liu M, et al. Anaerobic ammonium oxidation (anammox) bacterial diversity, abundance, and activity in marsh sediments of the Yangtze Estuary[J]. Journal of Geophysical Research: Biogeosciences, 2013, 118(3): 1237-1246. DOI:10.1002/jgrg.20108
(  0) 0) |
| [17] |
Zhao Z, Cao Y, Fan Y, et al. Ladderane records over the last century in the East China sea: Proxies for anammox and eutrophication changes[J]. Water Research, 2019, 156: 297-304. DOI:10.1016/j.watres.2019.03.046
(  0) 0) |
| [18] |
Jaeschke A. Present and Past Contribution of Anaerobic Ammonium Oxidation to Nitrogen Cycling as Revealed by Ladderane Lipids[M]. Utrecht: Geologica Ultraiectina, 2009.
(  0) 0) |
| [19] |
Rattray J. Ladderane Lipids in Anammox Bacteria: Occurence, Biosynthesis and Application as Environmental Markers[M]. Utrecht: Geologica Ultraiectina, 2008.
(  0) 0) |
| [20] |
Rush D, Wakeham S G, Hopmans E C, et al. Biomarker evidence for anammox in the oxygen minimum zone of the Eastern Tropical North Pacific[J]. Organic Geochemistry, 2012, 53: 80-87. DOI:10.1016/j.orggeochem.2012.02.005
(  0) 0) |
| [21] |
Hu J W, Zhang H L, LI L, et al. Seasonal changes of organic matter origins and anammox activity in the Changjiang Estuary deduced from multi-biomarkers in suspended particulates[J]. Science China Earth Sciences, 2016, 59(7): 1339-1352. DOI:10.1007/s11430-016-5286-8
(  0) 0) |
| [22] |
Rush D, Talbot H M, Van Der Meer M T J, et al. Biomarker evidence for the occurrence of anaerobic ammonium oxidation in the eastern Mediterranean Sea during Quaternary and Pliocene sapropel formation[J]. Biogeosciences, 2019, 16(12): 2467-2479. DOI:10.5194/bg-16-2467-2019
(  0) 0) |
| [23] |
Deng B, Zhang J, Zhang G, et al. Enhanced anthropogenic heavy metal dispersal from tidal disturbance in the Jiaozhou Bay, North China[J]. Environmental Monitoring and Assessment, 2010, 161(1-4): 349-358. DOI:10.1007/s10661-009-0751-x
(  0) 0) |
| [24] |
姚云, 郑世清, 沈志良. 胶州湾营养盐及富营养化特征[J]. 海洋通报, 2007(4): 91-98. Yao Y, Zheng S Q, Shen Z L. Study on the mechanism of eutrophication in the Jiaozhou Bay[J]. Marine Science Bulletin, 2007(4): 91-98. DOI:10.3969/j.issn.1001-6392.2007.04.013 (  0) 0) |
| [25] |
吴在兴. 我国典型海域富营养化特征、评价方法及其应用[D]. 青岛: 中国科学院海洋研究所, 2013. Wu Z X. The Eutrophication Characteristics of Typical Chinese Coastal Areas and Applications of an Integrated Methodology for Eutrophication Assessment in These Areas[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2013. (  0) 0) |
| [26] |
Wu J, Hong Y, Ye J, et al. Diversity of anammox bacteria and contribution to the nitrogen loss in surface sediment[J]. International Biodeterioration and Biodegradation, 2019, 142: 227-234. DOI:10.1016/j.ibiod.2019.05.018
(  0) 0) |
| [27] |
Dang H, Chen R, Wang L, et al. Environmental factors shape sediment anammox bacterial communities in hypernutrified Jiaozhou Bay, China[J]. Applied and Environmental Microbiology, 2010, 76(21): 7036-7047. DOI:10.1128/AEM.01264-10
(  0) 0) |
| [28] |
Xing L, Zhang H, Yuan Z, et al. Terrestrial and marine biomarker estimates of organic matter sources and distributions in surface sediments from the East China Sea shelf[J]. Continental Shelf Research, 2011, 31(10): 1106-1115. DOI:10.1016/j.csr.2011.04.003
(  0) 0) |
| [29] |
Hopmans E C, Weijers J W H, Schefuβ E, et al. A novel proxy for terrestrial organic matter in sediments based on branched and isoprenoid tetraether lipids[J]. Earth and Planetary Science Letters, 2004, 224(1-2): 107-116. DOI:10.1016/j.epsl.2004.05.012
(  0) 0) |
| [30] |
Rattray J E, Van Vossenberg J De, Jaeschke A, et al. Impact of temperature on ladderane lipid distribution in anammox bacteria[J]. Applied and Environmental Microbiology, 2010, 76(5): 1596-1603. DOI:10.1128/AEM.01796-09
(  0) 0) |
| [31] |
Meyers P A. Organic geochemical proxies of paleoceanographic[J]. Organic Geochemistry, 1997, 27(5): 213-250.
(  0) 0) |
| [32] |
Fry B, Sherr E B. δ13C measurements as indicators of carbon flow in marine and freshwater ecosystems[J]. Contributions in Marine Science, 1984, 68: 13-47.
(  0) 0) |
| [33] |
Hu L, Guo Z, Feng J, et al. Distributions and sources of bulk organic matter and aliphatic hydrocarbons in surface sediments of the Bohai Sea, China[J]. Marine Chemistry, 2009, 113(3-4): 197-211. DOI:10.1016/j.marchem.2009.02.001
(  0) 0) |
| [34] |
Pancost R D, Boot C S. The palaeoclimatic utility of terrestrial biomarkers in marine sediments[J]. Marine Chemistry, 2004, 92(1-4): 239-261. DOI:10.1016/j.marchem.2004.06.029
(  0) 0) |
| [35] |
Hedges J I, Oades J M. Comparative organic geochemistries of soils and marine sediments[J]. Organic Geochemistry, 1997, 27(7-8): 319-361. DOI:10.1016/S0146-6380(97)00056-9
(  0) 0) |
| [36] |
OLeary M H. Carbon isotope fractionation in plants[J]. Phytochemistry, 1981, 20(4): 553-567. DOI:10.1016/0031-9422(81)85134-5
(  0) 0) |
| [37] |
Zhu C, Weijers J W H, Wagner T, et al. Sources and distributions of tetraether lipids in surface sediments across a large river-dominated continental margin[J]. Organic Geochemistry, 2011, 42(4): 376-386. DOI:10.1016/j.orggeochem.2011.02.002
(  0) 0) |
| [38] |
Xing L, Zhao M, Gao W, et al. Multiple proxy estimates of source and spatial variation in organic matter in surface sediments from the southern Yellow Sea[J]. Organic Geochemistry, 2014, 76: 72-81. DOI:10.1016/j.orggeochem.2014.07.005
(  0) 0) |
| [39] |
Jaeschke A, Rooks C, Trimmer M, et al. Comparison of ladderane phospholipid and core lipids as indicators for anaerobic ammonium oxidation (anammox) in marine sediments[J]. Geochimica et Cosmochimica Acta, 2009, 73(7): 2077-2088. DOI:10.1016/j.gca.2009.01.013
(  0) 0) |
| [40] |
Zhang X, Hélène Agogué, Dupuy C, et al. Relative abundance of ammonia oxidizers, denitrifiers, and anammox bacteria in sediments of hyper-nutrified estuarine tidal flats and in relation to environmental conditions[J]. Clean Soil Air Water, 2014, 42(6): 815-823. DOI:10.1002/clen.201300013
(  0) 0) |
| [41] |
Kuenen J G. Anammox bacteria: From discovery to application[J]. Nature Reviews Microbiology, 2008, 6(4): 320-326. DOI:10.1038/nrmicro1857
(  0) 0) |
| [42] |
Rattray J E, Vossenberg J, Hopmans E C, et al. Ladderane lipid distribution in four genera of anammox bacteria[J]. Archives of Microbiology, 2008, 190(1): 51-66. DOI:10.1007/s00203-008-0364-8
(  0) 0) |
| [43] |
Kuypers M M M, Silekers A O, Lavik G, et al. Anaerobic ammonium oxidation by anammox bacteria in the Black Sea[J]. Nature, 2003, 422(6932): 608-611. DOI:10.1038/nature01472
(  0) 0) |
| [44] |
Jaeschke A, Hopmans E C, Wakeham S G, et al. The presence of ladderane lipids in the oxygen minimum zone of the Arabian Sea indicates nitrogen loss through anammox[J]. Limnology and Oceanography, 2007, 52(2): 780-786. DOI:10.4319/lo.2007.52.2.0780
(  0) 0) |
| [45] |
Kang X, Song J, Yuan H, et al. The sources and composition of organic matter in sediments of the Jiaozhou Bay: implications for environmental changes on a centennial time scale[J]. Acta Oceanologica Sinica, 2017, 36(11): 68-78. DOI:10.1007/s13131-017-1076-1
(  0) 0) |
| [46] |
Strous M, Heijnen J J, Kuenen J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J]. Applied Microbiology and Biotechnology, 1998, 50(5): 589-596. DOI:10.1007/s002530051340
(  0) 0) |
| [47] |
Rich J J, Dale O R, Song B, et al. Anaerobic ammonium oxidation (anammox) in Chesapeake Bay sediments[J]. Microbial Ecology, 2008, 55(2): 311-320. DOI:10.1007/s00248-007-9277-3
(  0) 0) |
| [48] |
Yao P, Yu Z, Deng C, et al. Spatial-temporal distribution of phytoplankton pigments in relation to nutrient status in Jiaozhou Bay, China[J]. Estuarine Coastal and Shelf Science, 2010, 89(3): 234-244. DOI:10.1016/j.ecss.2010.07.003
(  0) 0) |
| [49] |
Cai Y, Zhang X, Li G, et al. Spatiotemporal distributions and environmental drivers of diversity and community structure of nosZ-type denitrifiers and anammox bacteria in sediments of the Bohai Sea and North Yellow Sea, China[J]. Journal of Oceanology and Limnology, 2019, 37(4): 1211-1228. DOI:10.1007/s00343-019-8200-3
(  0) 0) |
| [50] |
Kalvelage T, Lavik G, Lam P, et al. Nitrogen cycling driven by organic matter export in the South Pacific oxygen minimum zone[J]. Nature Geoscience, 2013, 6(3): 228-234. DOI:10.1038/ngeo1739
(  0) 0) |
| [51] |
纪莹璐. 胶州湾西北部海域小型底栖动物生态学和自由生活海洋线虫群落结构研究[D]. 青岛: 中国海洋大学, 2015. Ji Y L. Studies of Meiobenthic Ecology and Community Structure of Free Living Marine Nematode in the Northwest Jiaozhou Bay[D]. Qingdao: Ocean University of China, 2015. (  0) 0) |
| [52] |
Liu S, Yang F, Xue Y, et al. Evaluation of oxygen adaptation and identification of functional bacteria composition for anammox consortium in non-woven biological rotating contactor[J]. Bioresource Technology, 2008, 99(17): 8273-8279. DOI:10.1016/j.biortech.2008.03.006
(  0) 0) |
| [53] |
Zhang S, Xia X, Liu T, et al. Potential roles of anaerobic ammonium oxidation (anammox) in overlying water of rivers with suspended sediments[J]. Biogeochemistry, 2017, 132(3): 237-249. DOI:10.1007/s10533-017-0297-x
(  0) 0) |
| [54] |
祝孟玲. 利用生物标志物梯烷脂研究珠江口厌氧氨氧化活动的时空分布特征[D]. 青岛: 中国海洋大学, 2014. Zhu M L. The Study on the Spatial and Temporal Distribution of Anammox in the Pearl River Estuary by Ladderane Lipids[D]. Qingdao: Ocean University of China, 2014. (  0) 0) |
2. Laboratory for MarineEeology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai 200241, China
 2021, Vol. 51
2021, Vol. 51