2. 中国海洋大学海洋生物多样性与进化研究所,山东 青岛 266003
台湾小孔蛸(Cistopus taiwanicus Liao & Lu, 2009)隶属于软体动物门(Mollusca)头足纲(Cephalopoda)八腕目(Octopoda)蛸科(Octopodidae)小孔蛸属(Cistopus),主要分布在中国东海、台湾海峡和南海,是一种中大型底栖蛸类[1]。本属主要特征是各腕基部间近口处具黏液囊结构,属内种间差别主要体现在成熟雄性腕上扩大吸盘的位置和数量,本文研究对象——台湾小孔蛸的成熟雄性的第一、二腕具2~4个扩大吸盘[2]。
丛集球虫属(Aggregata Frenzel, 1885)是感染野生和饲养头足类消化道的一类常见寄生虫[3-4]。丛集球虫生活史复杂,其生命周期包括无性生殖阶段和有性生殖阶段,为异源性寄生虫,需要两个宿主完成其生命周期:无性生殖阶段(分生孢子期)在中间宿主——甲壳类动物的肠道内发育,有性生殖阶段(配子生殖阶段和孢子生殖阶段)在终宿主——头足类动物的肠道内发育[5-6]。丛集球虫通过食物链传播,会对头足类动物的胃和肠道造成严重的组织病理学和功能损伤。组织病理学损伤主要包括结缔组织的周围性反应、血细胞浸润和感染组织肿胀,而功能损伤包括吸收不良综合征[7-10]。
传统上,丛集球虫鉴定依赖于孢子生殖阶段的形态特征,包括孢子囊的结构特征(大小、形状、孢子囊壁的厚度和结构)、每个孢子囊内的子孢子数量和子孢子大小及寄主特异性[11-12]。随着分子生物学的发展,分子标记技术为丛集球虫的鉴定和诊断提供了新手段,成为分类学的重要补充。Kopečná等[13]首次扩增出寄生于真蛸(Octopus vulgaris)的A. octopiana以及乌贼(Sepia officinalis)的A. eberthi的18S rRNA序列,随后Castellanos-Martínez等[14]和Tedesco等[15]对A. octopiana和A. eberthi的18S rRNA基因进行测序,并结合表型特征评估了它们的分类和系统发育状况。迄今为止,在世界范围内,丛集球虫共发现并命名了13种,分别寄生于14种头足类(10种章鱼、2种鱿鱼和2种乌贼),主要分布在太平洋东北部、大西洋东北部、印度洋西北部、大西洋西南部、地中海西部等海域。中国有关丛集球虫的记录有限,仅见于多刺丛集球虫(A. octaculeata)和中华丛集球虫(A. sinensis),其中中华丛集球虫是目前第一个也是唯一一个被报道的双宿主寄生的丛集球虫[16-17]。本文在台湾小孔蛸中发现了丛集球虫又一新种,这是对丛集球虫属生物学资料的补充,并且为台湾小孔蛸的疾病诊断和组织学病理研究提供参考。
1 材料与方法 1.1 样本采集分别从浙江南麂岛(121.00°E, 27.29°N)、福建东山(117.43°E, 23.71°N)、广东阳江(111.98°E, 21.86°N)和海南三亚(109.51°E, 18.25°N)的出海渔民处获得野生台湾小孔蛸鲜活样品,冷冻保存并运送到中国海洋大学贝类遗传育种实验室进行处理。对所有个体的消化系统(包括嗉囊、食道、胃、盲囊、肠道)进行解剖,发现被感染个体共计31只,详细的采样地、日期等信息如表 1所示。
|
|
表 1 台湾小孔蛸样品信息 Table 1 Sampling information of Cistopus taiwanicus |
从新鲜台湾小孔蛸肠道中分离出卵囊置于载玻片上,用盖玻片压片,在光学显微镜(Olympus BX53)下观察拍照,直接测量丛集球虫孢子生殖阶段成熟卵囊、孢子囊和子孢子各项形态特征数据(单位μm),并计算平均值和标准偏差。为进行组织学观察,将感染严重个体的盲囊和肠组织用波恩氏液固定24 h, 在70%酒精中洗涤多余固定液,随后用乙醇梯度脱水,石蜡包埋和切片(Leica RM2016), 切片厚度为5 μm, 最后苏木精和伊红染色[18]以制成永久玻片标本,对孢子囊中的孢子进行观察、拍照和计数。
电镜样品制备参考Gestal等[19],从台湾小孔蛸中分离出新鲜卵囊,固定在2.5%戊二醛缓冲液中(4 ℃, 4 h)。分别用扫描电子显微镜(SEM-VEGA3)和透射电子显微镜(JEM1200)进行超显微观察和拍照。
1.3 分子生物学鉴定从感染台湾小孔蛸的消化道中分离出丛集球虫卵囊,提取总DNA。取大约50 mg卵囊悬浮于600 μL提取缓冲液中,使用超声波破碎仪破碎(5循环,40 W, 50 s), 加入蛋白酶K消化过夜,参照苯酚-氯仿法[20]提取DNA, 质量合格的DNA母液储存在-20 ℃下备用。
使用为Aggregata spp.设计的保守引物,扩增基因组DNA的18S rRNA小亚基。PCR反应体系及程序参考Castellanos-Martínez等[21],1.5%琼脂糖凝胶电泳检测扩增产物, 上海生工生物工程技术公司(Sangon Biotech)进行双向测序。
用DNASTAR软件包中的SeqMan v.7.2对测序结果进行排列校对,通过Blast对18S rRNA基因序列进行比对。从GenBank下载26个顶复亚门近缘物种序列构建系统发育树,具体序列如下:A. octopiana RV1(KC188342), A. octopiana (DQ096837), A. eberthi RV2(KC188343), A. eberthi(DQ096838), Cryptosporidium meleagridis (AF112574), C. parvum(AF115377), C. wrairi(U11440), C. felis(AF112575), C. canis (AF112576), Adelina bambarooniae(AF494059), Ad.dimidiate(DQ096835), Ad. grylli(DQ096836), Hepatozoon canis(EF622096), H.catesbianae(AF130361), E.arnyi(AY613853), E.bovis(U77084), A. sinensis JS.1(MN275009), A. sinensis JS.2(MN275010), A. sinensis JS.3(MN275012), A. sinensis SD.1(MN275011), A. sinensis TW.1(MN275013), A. octaculeata 1(MW577122), A. octaculeata 2(MW577123), A. octaculeata 3(MW577124), A. octaculeata 4(MW577125), A. octaculeata 5(MW577126)。选用E. arnyi (AY613853)和E. bovis (U77084)作为外群,使用MEGA 6.0[22]将全部序列进行多重比对分析,去除模糊对齐的区域,保留gap区域。构建系统发育树之前,根据贝叶斯信息准则(AIC)使用jModelTest 2.1软件[23]选择最合适的DNA进化模型,筛选出最优模型为GTR+G。系统发育分析采用最大似然法(Maximum likelihood, ML)和贝叶斯法(Bayesian inference, BI),分别使用软件MEGA 6.0和MrBayes 3.2[24]构建系统发育树。使用FigTree 1.4.2软件[25]编辑系统发育树。
2 结果与分析 2.1 疣丛集球虫(Aggregata verrucosa sp. nov.)终宿主:台湾小孔蛸(Cistopus taiwanicus Liao & Lu, 2009)。
寄生部位:胃盲囊、肠。
采集地点:浙江南麂岛(121.00°E, 27.29°N)、福建东山(117.43°E, 23.71°N)、广东阳江(111.98°E, 21.86°N)和海南三亚(109.51°E, 18.25°N)。
词源:拉丁文,verrucosa=warty(有疣的),是以该种丛集球虫具有疣状突起的特征命名。
模式标本存放处:中国海洋大学水产学院标本馆,OUC-LSGB-HE-C0001。
2.2 形态描述在被感染的31只台湾小孔蛸样本中,雌雄比14∶17(见表 1)。丛集球虫分布在肠组织内部,偶见于盲囊,识别出肉眼可见的白色点状卵囊(见图 1)。
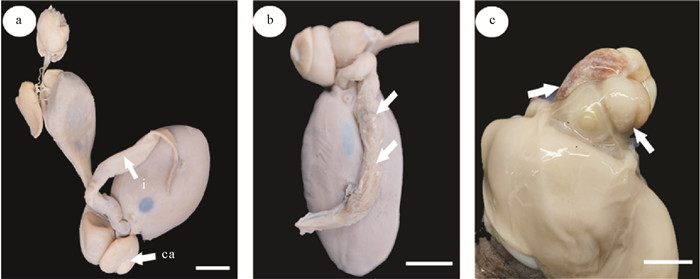
|
( a: 台湾小孔蛸消化系统;b: 疣丛集球虫在肠内的分布;c: 疣丛集球虫在盲囊内的分布。标尺=1 cm。ca: 盲囊;i: 肠。a: The digestive system of Cistopus taiwanicus; b: Aggregata verrucosa distributed in the intestinal; c: Aggregata verrucosa distributed in the caecum. Bar=1 cm. ca: Caecum; i: Intestine. ) 图 1 疣丛集球虫的寄生部位 Fig. 1 Parasitic site of Aggregata verrucosa |
丛集球虫成熟的卵囊(n=10)呈球形,长径范围936.96~1 563.31 μm,平均长径(1 305.62±197.04) μm;短径范围860.13~1 227.85 μm,平均短径(1 073.45±121.06) μm(见图 2a)。孢子囊(n=30)为卵圆形或近球形,长径范围12.87~14.24 μm,平均长径(13.53±0.33) μm;短径范围12.39~13.70 μm,平均短径(12.87±0.30) μm(见图 2b)。子孢子(n=15)卷曲在孢子囊中,通过挤压从孢子囊中分离出子孢子(见图 2c),呈螺旋状,长径范围12.18~16.01 μm,平均长径(14.43±1.11) μm;短径范围2.06~2.62 μm,平均短径(2.27±0.19) μm(见图 2d)。
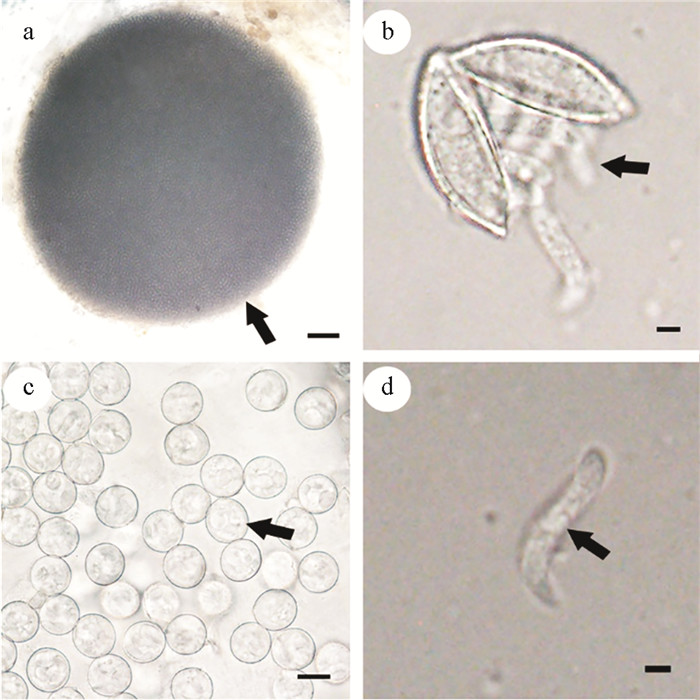
|
( a: 卵囊,标尺=100 μm;b: 孢子囊,标尺=10 μm;c—d: 子孢子,标尺=2 μm。a: Oocyst, bar=100 μm; b: Sporocysts, bar=10 μm; c—d: Sporozoites, bar=2 μm. ) 图 2 疣丛集球虫的形态特征 Fig. 2 Morphological character of Aggregata verrucosa |
组织学观察显示,感染严重的台湾小孔蛸肠组织中存在大量丛集球虫卵囊(见图 3a)。丛集球虫感染由配子生殖阶段开始,裂殖子不均等分裂形成大配子(♀)和小配子(♂),大配子(见图 3b)为圆形或卵圆形,与小配子结合受精产生受精膜,受精膜能形成卵囊,受精后产生合子。此后,孢子生殖阶段开始,卵囊中的合子经反复核分裂后成为孢子虫(见图 3c),鉴别特征是细胞质表面有众多细胞核排列,最后分裂为球形单核孢子母细胞,并转化为孢子囊(见图 3d—j),成熟的孢子囊中含有4~10个子孢子(见图 3i, j)。
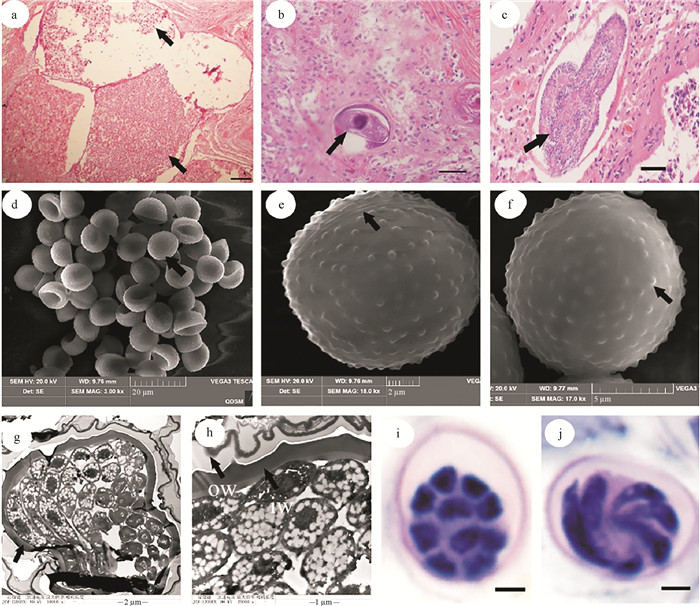
|
( a: 被疣丛集球虫卵囊感染的肠道组织,标尺=100 μm;b—c: 配子生殖阶段的大配子和孢子生殖阶段的产孢体,标尺=50 μm;d: 扫描电镜下的孢子囊形态,标尺=20 μm;e: 孢子囊的裂缝线,标尺=2 μm;f: 孢子囊的表面具疣状突起,标尺=5 μm;g: 透射电镜下的孢子囊形态,标尺=2 μm;h: 双层的孢子囊壁,ow:外层壁,iw:内层壁,标尺=1 μm;i—j: 孢子囊的横切与纵切切片,标尺=2 μm。a: Intestinal tissue infected with oocysts of A. verrucosa, bar=100 μm; b—c: Macrogamete in the gamogonial stage and sporont in the sporogonial stage, bar=50 μm; d: Morphology of sporocyst under SEM, bar=20 μm; e: The dehiscence suture of sporocyst, bar=2 μm; f: The warty projection on the surface of sporocyst, bar=5 μm; g: Morphology of sporocyst under TEM, bar=2 μm; h: A double layered wall of sporocyst, ow: the outer layer, iw: the inner layer, bar=1 μm; i—j: The transverse and longitudinal sections of sporocyst, bar= 2 μm. ) 图 3 组织切片下的疣丛集球虫形态和电镜下的孢子囊形态 Fig. 3 Morphology of Aggregata verrucosa under histological section and morphology of sporocysts under scanning electron microscopy and transmission electron microscopy |
超微结构显示,每个卵囊内有多个细胞核(见图 3g),孢子囊为卵圆形或近球形(见图 3d—f),由两个半球形的瓣膜形成,紧密地连接在一起,且有明显的裂缝线(见图 3e)。孢子囊壁(见图 3h)为双层,外层为规则、光滑的覆盖物,内层较厚且有许多疣状突起(见图 3f, h),突起长度范围0.18~0.25 μm,平均长度(0.21±0.03) μm。
2.3 系统发育关系基于最大似然法(ML)和贝叶斯法(BI)构建的系统发育树均具有很高的支持度,拓扑结构显示Aggregatidae,Cryptosporidiidae,Haemogregarinidae和Adeleidae先后聚成一支(后验概率(PP)=1,自举值(BS)=100,见图 4)。在这个支系中,A. verrucosa(从台湾小孔蛸扩增的序列1和2)可视为一个新种(PP=1,BS=100,见图 4),与中华丛集球虫A. sinensis亲缘关系最近,并与A. octopiana和A. eberthi形成姐妹群,最后与多刺丛集球虫A. octaculeata构成一个支系。系统发育分析表明,Aggregatidae科和Cryptosporidiidae科为一个具有高节点支持的姐妹群(PP=1,BS=100,见图 4),Adelina属作为Hepatozoon属的姐妹群,与Eimeria属聚在一起构成一个支系,与之前的研究结果[14]一致。此外,Aggregata物种在进化上更接近Adelina属,与之前的丛集球虫的研究结果[21]一致。
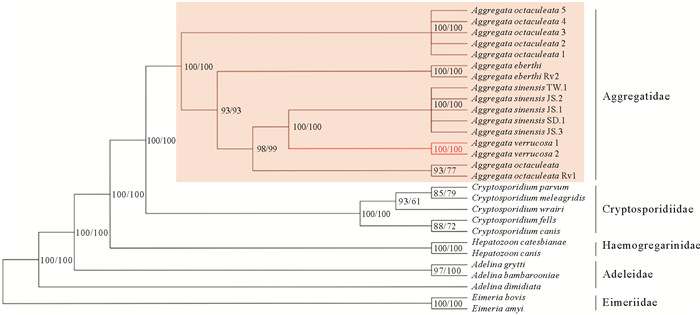
|
( 基于GTR+G构建的进化模型, 左为贝叶斯法(节点数为后验概率),右为最大似然法(节点数为自举值)。An evolutionary model based on GTR+G, the left is Bayesian method (number of nodes is the posterior probability) and the right is maximum likelihood method (number of nodes is the bootstrap value). ) 图 4 疣丛集球虫与顶复亚门物种系统发育关系 Fig. 4 Phylogenetic relationships among Aggregata verrucosa and Apicomplexa species |
截至目前,已报道寄生于14种头足类的13种丛集球虫[26-29]。本研究根据形态学数据和18S rRNA基因序列,从台湾小孔蛸体内鉴定出一种丛集球虫新种,并命名为疣丛集球虫Aggregata verrucosa sp. nov.。根据Gestallanos等[21]形态学鉴定方法,发现A. verrucosa卵囊大小为1 305.62 μm×1 073.45 μm, 显著区别于其他13个种,是A. octopiana卵囊大小(612 μm×402 μm)的4倍多(见表 2),是丛集球虫属中最大的。孢子囊大小为13.53 μm×12.87 μm,子孢子个数为4~10个,与真蛸体内A. octopiana的孢子囊长径(11~15 μm)和子孢子个数(8个)接近。子孢子长径为14.43 μm,仅大于A. sagittata的子孢子[30]。在超微结构水平上,Aggregata的孢子囊壁有两种模式:光滑和多刺[12]。A. verrucosa属于后者,其孢子囊壁外层光滑,内层具疣状突起,但与多刺丛集球虫A. octaculeata和中华丛集球虫A. sinensis相比,突起比较光滑[16-17]。
|
|
表 2 丛集球虫属内各物种孢子生殖阶段主要特征的比较 Table 2 Comparison in morphology of the sporogonic stages for species of Aggregata |
在头足类动物中,有各种病原体,包括病毒、细菌、真菌、原生动物和后生动物寄生虫[31],丛集球虫感染不是头足类动物的致命疾病,但它削弱了宿主的先天免疫能力,使其易受继发感染。因此,丛集球虫属被认为是对头足类健康最危险的寄生虫[8, 32]。头足类动物感染丛集球虫后,无性生殖阶段的裂殖子不均等分裂形成大配子和小配子,大配子呈圆形或卵圆形,可感染头足类动物的整个消化道(主要是盲囊和肠道)和组织的上皮细胞。感染严重时头足类动物鳃中的结缔组织、胴体部、腕、内脏团和肠系膜上有明显白色点状卵囊,此时称作肠外球虫病[33-34]。本研究的疣丛集球虫(A. verrucosa)主要感染台湾小孔蛸的肠组织(见图 1),偶见于盲囊中,并未在其他组织部位中发现,这可能因为该种丛集球虫对寄生部位具有严格选择性。同时,丛集球虫入侵导致感染细胞肥大,使得宿主组织产生明显的血细胞浸润或丛集球虫替换宿主组织[35]。根据本研究的组织病理学检查,感染严重的台湾小孔蛸肠道组织已被疣丛集球虫的卵囊所代替(见图 3a),这与之前描述的其他丛集球虫种感染情况一致[7, 36]。此外,丛集球虫感染会导致上皮细胞脱落和结缔组织破裂,造成头足类动物消化道黏膜萎缩和溃疡,黏膜酸化从而影响消化酶的稳定性,进而阻碍其对营养物质的吸收作用,产生吸收不良的症状[33]。
基于18S rRNA基因构建的系统发育树将疣丛集球虫(A. verrucose)归为丛集球虫科(Aggregatidae)的单一分支,进一步证实该物种隶属于丛集球虫属,与中华丛集球虫A. sinensis和A. octopiana的亲缘关系密切,这与它们的宿主台湾小孔蛸、真蛸、长蛸(Octopus minor)和短蛸(Amphioctopus fangsiao)的系统发育结果一致[37]。此外,真蛸和中华蛸(Octopus sinensis)的亲缘关系很近[38],但本研究的系统发育结果表明,寄生于中华蛸的多刺丛集球虫(A. octaculeata)在丛集球虫属的基部,并未与寄生于真蛸的A. octopiana聚在一起,也与其他丛集球虫种关系较远,该种的系统发育位置有待进一步研究和验证。传统上,丛集球虫寄生虫被认为在其最终宿主头足类动物中具有宿主特异性[3]。本研究发现疣丛集球虫寄生于台湾小孔蛸,但不能证实其有宿主特异性,有必要在中国小孔蛸(Cistopus chinensis)等近缘种和该海域其他头足类动物中开展相关研究。
识别和描述目前感染头足类动物的丛集球虫种类,对于了解丛集球虫属的生态作用和感染头足类的影响非常重要。本研究鉴定出的丛集球虫新种是对丛集球虫属生物学资料的补充,同时为台湾小孔蛸疾病诊断和组织学病理研究提供参考。
致谢: 澳大利亚维多利亚博物馆卢重成教授对文章撰写提供了宝贵意见;中国海洋大学贝类遗传育种研究室唐艳博士提供了实验帮助,硕士研究生刘朝阳、卢在庆和黄俊杭提供了实验样品,谨致谢忱。
| [1] |
Norman M D, Finn J K, Hochberg F G. Cephalopods of the World[M]. Rome: Food and Agriculture Organization of the United Nations, 2014: 113-114.
(  0) 0) |
| [2] |
Liao J X, Lu C C. A new species of Cistopus (Cephalopoda: Octopodidae) from Taiwan and morphology of mucous pouches[J]. Journal of Molluscan Studies, 2009, 75: 269-278. DOI:10.1093/mollus/eyp023 (  0) 0) |
| [3] |
Hochberg F G. Diseases of mollusca: Cephalopoda[J]. Diseases Caused by Protistans and Metazoans, 1990, 16(2): 47-227. (  0) 0) |
| [4] |
Berto B P, McIntosh D, Lopes C W G. Studies on coccidian oocysts (Apicomplexa: Eucoccidiorida)[J]. Revista Brasileira de Parasitologia Veterinária, 2014, 23(4): 1-15. (  0) 0) |
| [5] |
Dobell C. The life-history and chromosome cycle of Aggregata eberthi (Protozoa: Sporozoa: Coccidia)[J]. Parasitology, 1925, 17(1): 1-136. DOI:10.1017/S0031182000082184 (  0) 0) |
| [6] |
Gestal C, Guerra A, Pascual S, et al. On the life cycle of Aggregata eberthi and observations on Aggregata octopiana (Apicomplexa, Aggregatidae) from Galicia (NE Atlantic)[J]. European Journal of Protistology, 2002, 37(4): 427-435. DOI:10.1078/0932-4739-00817 (  0) 0) |
| [7] |
Gestal C, Páez de la Cadena M, Pascual S. Malabsorption syndrome observed in the common octopus Octopus vulgaris infected with Aggregata octopiana (Protista: Apicomplexa)[J]. Diseases of Aquatic Organisms, 2002, 51(1): 61-65. (  0) 0) |
| [8] |
Gestal C, Guerra A, Pascual S. Aggregata octopiana (Protista: Apicomplexa): A dangerous pathogen during commercial Octopus vulgaris ongrowing[J]. ICES Journal of Marine Science, 2007, 64(9): 1743-1748. DOI:10.1093/icesjms/fsm154 (  0) 0) |
| [9] |
Pascual S, González A F, Guerra A. Unusual sites of Aggregata octopiana infection in octopus cultured in floating cages[J]. Aquaculture, 2006, 254(1-4): 21-23. DOI:10.1016/j.aquaculture.2005.10.014 (  0) 0) |
| [10] |
Castellanos-Martínez S, Gestal C, Pascual S, et al. Protist (Coccidia) and related diseases[J]. Handbook of Pathogens and Diseases in Cephalopods, 2019, 31(4): 143-152. (  0) 0) |
| [11] |
Gestal C, Nigmatullin C M, Hochberg F G, et al. Aggregata andresi n. sp. (Apicomplexa: Aggregatidae) from the ommastrephid squid Martialia hyadesi in the SW Atlantic Ocean and some general remarks on Aggregata spp. in cephalopod hosts[J]. Systematic Parasitology, 2005, 60(6): 65-73. (  0) 0) |
| [12] |
Gestal C, Pascual S, Hochberg F. Aggregata bathytherma sp. nov. (Apicomplexa: Aggregatidae), a new coccidian parasite associated with a deep-sea hydrothermal vent octopus[J]. Diseases of Aquatic Organisms, 2010, 91(3): 237-242. DOI:10.3354/dao02264 (  0) 0) |
| [13] |
Kopečná J, Jirků M, Oborník M, et al. Phylogenetic analysis of coccidian parasites from invertebrates: Search for missing links[J]. Protist, 2006, 157(2): 173-183. DOI:10.1016/j.protis.2006.02.005 (  0) 0) |
| [14] |
Castellanos-Martínez S, Diz A P, Álvarez C P, et al. Proteomic characterization of the hemolymph of Octopus vulgaris infected by the protozoan parasite Aggregata octopiana[J]. Journal of Proteomics, 2014, 105(8): 151-163. (  0) 0) |
| [15] |
Tedesco P, Gestal C, Begić K, et al. Morphological and molecular characterization of Aggregata spp. frenzel 1885 (Apicomplexa: Aggregatidae) in Octopus vulgaris cuvier 1797 (Mollusca: Cephalopoda) from central mediterranean[J]. Protist, 2017, 168(5): 636-648. DOI:10.1016/j.protis.2017.08.002 (  0) 0) |
| [16] |
任静, 何卫彤, 王丽华, 等. 中华蛸寄生丛集球虫(顶复亚门: 丛集球虫科)新种的形态学与分子生物学研究[J]. 海洋与湖沼, 2021, 52(5): 1323-1331. Ren J, He W T, Wang L H, et al. Morphological and molecular characterization of a new species of Aggregata (Apicomplexa: Aggregatidae) infecting Octopus sinensis[J]. Oceanologia et Limnologia Sinica, 2021, 52(5): 1323-1331. (  0) 0) |
| [17] |
Ren J, Zheng X D. Aggregata sinensis n. sp. (Apicomplexa: Aggregatidae), a new coccidian parasite from Amphioctopus fangsiao and Octopus minor (Mollusca: Octopodidae) in the Western Pacific Ocean[J]. Parasitology Research, 2022, 121(1): 373-381. DOI:10.1007/s00436-021-07389-0 (  0) 0) |
| [18] |
Culling C F A, Allison R T, Barr W T. Cellular Pathology Technique[M]. London: Butterworth, 1985: 1-336.
(  0) 0) |
| [19] |
Gestal C, Pascual S, Corral L, et al. Ultrastructural aspects of the sporogony of Aggregata octopiana (Apicomplexa, Aggregatidae), a coccidian parasite of Octopus vulgaris (Mollusca, Cephalopoda) from NE Atlantic coast[J]. European Journal of Protistology, 1999, 35(4): 417-425. DOI:10.1016/S0932-4739(99)80051-0 (  0) 0) |
| [20] |
Sambrook J, Fritsch E F, Maniatis T. Molecular Cloning: A Laboratory Manual[M]. Cold Spring Harbor: Cold Spring Harbor Laboratory, 1989: 211-218.
(  0) 0) |
| [21] |
Castellanos-Martínez S, Pérez L M, Gestal C. Molecular phylogenetic analysis of the coccidian cephalopod parasites Aggregata octopiana and Aggregata eberthi (Apicomplexa: Aggregatidae) from the NE Atlantic coast using 18S rRNA sequences[J]. European Journal of Protistology, 2013, 49(3): 373-380. DOI:10.1016/j.ejop.2012.11.005 (  0) 0) |
| [22] |
Tamura K, Stecher G, Peterson D, et al. MEGA6: Molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013, 30(12): 2725-2729. DOI:10.1093/molbev/mst197 (  0) 0) |
| [23] |
Darriba D, Taboada G L, Doallo R, et al. jModelTest 2: More models, new heuristics and parallel computing[J]. Nature Methods, 2012, 9(8): 772-772. (  0) 0) |
| [24] |
Ronquist F, Teslenko M, van der Mark P, et al. MrBayes 3.2: Efficient Bayesian phylogenetic inference and model choice across a large model space[J]. Systematic Biology, 2012, 61(3): 539-542. DOI:10.1093/sysbio/sys029 (  0) 0) |
| [25] |
Rambaut A, Drummond A. FigTree: Tree figure drawing tool, version 1.2.2[J]. Institute of Evolutionary Biology, University of Edinburgh, 2008, 29(1): 142-150. (  0) 0) |
| [26] |
Schneider A. Note sur la psorospermie oviforme du poulpe[J]. Archires de Zoologie Expérimentale at Génerale, 1875, 4(2): 4045-4045. (  0) 0) |
| [27] |
Labbé A. Sur le noyau et la division nucléaire chez les Benedenia[J]. Comptes Rendus de Académie des Sciences Paris, 1895, 120(6): 381-383. (  0) 0) |
| [28] |
Poynton S L, Reimschuessel R, Stoskopf M K. Aggregata dobelli n. sp. and Aggregata millerorum n. sp. (Apicomplexa: Aggregatidae) from two species of octopus (Mollusca: Octopodidae) from the eastern North Pacific Ocean[J]. The Journal of Protozoology, 1992, 39(1): 248-256. DOI:10.1111/j.1550-7408.1992.tb01309.x (  0) 0) |
| [29] |
Sardella N H, Ré M E, Timi J T. Two new Aggregata species (Apicomplexa: Aggregatidae) infecting Octopus tehuelchus and Enteroctopus megalocyathus (Mollusca: Octopodidae) in Patagonia, Argentina[J]. Journal of Parasitology, 2000, 86(5): 1107-1113. DOI:10.1645/0022-3395(2000)086[1107:TNASAA]2.0.CO;2 (  0) 0) |
| [30] |
Gestal C, Guerra A, Abollo E, et al. Aggregata sagittata n. sp. (Apicomplexa: Aggregatidae), a coccidian parasite from the European flying squid Todarodes sagittatus (Mollusca: Cephalopoda)[J]. Systematic Parasitology, 2000, 47(3): 203-206. DOI:10.1023/A:1006400619047 (  0) 0) |
| [31] |
Castellanos-Martínez S, Gestal C. Pathogens and immune response of cephalopods[J]. Journal of Experimental Marine Biology and Ecology, 2013, 447(1): 14-22. (  0) 0) |
| [32] |
Estévez J, Pascual S, Gestal C, et al. Aggregata octopiana (Apicomplexa: Aggregatidae) from Octopus vulgaris off NW Spain[J]. Diseases of Aquatic Organisms, 1996, 27(6): 227-231. (  0) 0) |
| [33] |
Gestal C, Abollo E, Pascual S. Observations on associated histopathology with Aggregata octopiana infection (Protista: Apicomplexa) in Octopus vulgaris[J]. Diseases of Aquatic Organisms, 2002, 50(1): 45-49. (  0) 0) |
| [34] |
Sykes A V, Gestal C. Welfare and diseases under culture conditions[J]. Cephalopod Culture, 2014(3): 97-112. (  0) 0) |
| [35] |
Mladineo I, Bočina I. Extraintestinal gamogony of Aggregata octopiana in the reared common octopus (Octopus vulgaris)(Cephalopoda: Octopodidae)[J]. Journal of Invertebrate Pathology, 2007, 96(3): 261-264. (  0) 0) |
| [36] |
Baldascino E, Di Cristina G, Tedesco P, et al. The gastric ganglion of Octopus vulgaris: Preliminary characterization of gene- and putative neurochemical-complexity, and the effect of Aggregata octopiana digestive tract infection on gene expression[J]. Frontiers in Physiology, 2017, 8(7): 1001-1001. (  0) 0) |
| [37] |
Cheng R, Zheng X D, Ma Y Y, et al. The complete mitochondrial genomes of two octopods Cistopus chinensis and Cistopus taiwanicus: Revealing the phylogenetic position of the genus Cistopus within the order Octopoda[J]. PLoS One, 2013, 8(12): e84216. (  0) 0) |
| [38] |
Gleadall I G. Octopus sinensis d'Orbigny, 1841 (Cephalopoda: Octopodidae): Valid species name for the commercially valuable East Asian common octopus[J]. Species Diversity, 2016, 21(1): 31-42. (  0) 0) |
2. Institute of Evolution and Marine Biodiversity, Ocean University of China, Qingdao 266003, China
 2024, Vol. 54
2024, Vol. 54


