2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室,山东 青岛 266237;
3. 中国海洋大学环境科学与工程学院,山东 青岛 266100
海底地下水排放是一种在不考虑水流组成和驱动力的情况下,通过海陆界面由海底排放进入近岸海域的尺度在几米至千米的地下水流[1-2]。它既包括陆源淡水的排放,也包括再循环海水的排放,再循环海水的排放主要是由潮汐作用驱动的。越来越多的研究表明,海底地下水排放是地下水及其溶解化合物(如营养物质、金属化合物等)向海洋交换的最重要途径之一,该过程可能对沿海生态系统造成巨大影响[2-3],即使在潮汐作用下通过砂质沉积物的再循环海水同样能给近海地区贡献可观的物质通量[4-6],因此潮汐作用在沿海生物地球化学过程和水文循环中扮演着重要角色。
滨海地区作为海陆生态系统重要的过渡地带,受潮汐作用显著,使得滨海地区的物质含量变化复杂,生物地球化学过程活跃,导致微生物生物代谢旺盛,种类及数量相对于其他生态系统具有很大的差异[7-8]。对美国马萨诸塞州的科德角地区滨海湿地地下水生态系统的研究发现,由于地下淡水与海水混合,可能引起硝化与反硝化微生物生态位的重叠[9]。Edmonds等[10]对美国佐治亚州奥尔塔马霍河滨海地区的研究发现,海水对滨海湿地的入侵,导致被入侵地区微生物代谢途径的改变,对微生物群落结构及功能造成一定影响。
微生物是生态系统的重要组成部分,由其介导的生物地球化学过程在碳、氮、磷、硫等生源要素循环中起关键作用[11]。沿海地区污水排放进入地下水系统,被污染的地下水进入滨海地区导致硝酸盐污染[12-13]。由于滨海地区受潮汐作用影响,好氧、厌氧环境周期性交替,为生态系统的氮素循环提供了良好的环境条件,氮素迁移转化活跃[14-15]。已有研究表明,微生物群落在滨海地区生态系统的氮素循环中具有重要作用,特别是在盐碱地区[16]。
目前,潮汐作用对地下水微生物群落结构影响的研究未见报道。青岛金沙滩位于山东半岛南端,该地区没有明显的入海河流,其潮周期是正规的半日潮,潮汐作用对滨海浅层地下水影响显著。因此,研究金沙滩浅层地下水微生物群落受潮汐作用的影响具有重要的科学意义。
本研究在青岛金沙滩进行一个潮汐周期内的浅层地下水中微生物连续采样,分析其群落特征与环境影响因子,为探讨滨海地下水中微生物群落动态变化规律提供依据。
1 材料与方法 1.1 金沙滩浅层地下水样品采集及保存2016年11月13日在青岛市黄岛区金沙滩海水浴场采集地下水中细菌样品。选取的采样地点(35.96°N, 120.25°E)位于金沙滩潮上带,离海距离约100 m,潮汐作用对该采样点影响明显且高潮时不会淹没。在采样地点采用铁锹挖掘出一个约2 m深的坑,每隔2 h用采水器采集2.0 L水样(见表 1)。用200目筛绢对水样进行初步过滤以去除大颗粒悬浮物,再通过0.22 μm的聚碳酸酯膜过滤,将滤膜折叠放入冻存管中,于液氮中保存用于后续DNA分析。
|
|
表 1 样品信息 Table 1 The information of samples |
本研究的潮汐信息获取于中国潮汐网,涨潮时间为10:00—16:00,16:00开始落潮。其中,10:00为最低潮时间,16:00为最高潮时间。
1.2 浅层地下水中理化参数测定采用Mettler Toledo多参数手持测定仪(Seven2Go)对各采样时间的水样的盐度进行现场测定;采用HACH多参数手持测定仪(HQ30D)对各采样时间的水样的pH进行现场测定。采集各时间点水样1.0 L后,立即用0.45 μm醋酸纤维滤膜过滤水样,过滤完样品分装到2个100 mL聚乙烯瓶中。一份保存至车载冰箱中(-20 ℃),用于NO2--N、NO3--N、NH4+-N、PO43--P的测定;另一份滴入两滴氯仿,常温保存,用于SiO32--Si的测定。对水样中的NO2--N、NO3--N、NH4+-N、PO43--P、SiO32--Si五项营养盐均采用营养盐自动分析仪(BRAN+LUEBBE)进行测定。
1.3 浅层地下水中细菌基因组DNA提取从液氮中取出滤膜,用已灭菌的剪刀剪碎滤膜后置于离心管中,使用Powersoil® DNA Isolation Kit(MOBIO, USA)进行细菌总DNA提取,得到的DNA保存于-80℃冰箱中用于后续实验。
1.4 金沙滩浅层地下水中细菌丰度分析细菌16S rRNA基因qPCR检测使用FastStart Universal SYBR Green Master (ROX)试剂盒(罗氏,德国),利用引物338F(5′-ACTCCTACGGGAGGCAGCA)和806R(5′-GGACTACHVGGGTWTCTAAT)对细菌16S rRNA基因进行扩增。扩增条件为:50 ℃ UNG酶激活2 min;95 ℃预变性10 min,95 ℃变性15 s,58 ℃退火2 min,40个循环。每个地下水样品设置3个平行样,并在每个体系中设置1个阴性对照。为保证DNA扩增的特异性,对每个地下水样品的DNA模板进行熔解曲线分析。
1.5 金沙滩浅层地下水中细菌群落结构及多样性分析 1.5.1 Illumina高通量测序使用细菌16S rRNA基因V3-V4可变区引物341F(5′-CCTAYGGGRBGCASCAG)和806R(5′-GGA CTA CNN GGG TAT CTA AT)对细菌DNA进行PCR扩增。PCR反应条件为:94 ℃预变性10 min;94 ℃变性30 s,58 ℃退火45 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。细菌DNA扩增产物长度约为420 bp,产物通过2%琼脂糖凝胶电泳进行检测,纯化目的条带,制备测序文库,质检合格的测序文库使用Hiseq2500 PE250平台进行测序。
1.5.2 数据分析及处理对原始测序数据进行质量筛选,去除引物、错配碱基数大于1的序列以及质量分数小于20的序列以获得优质序列[17],并对序列数量及长度进行统计。对上述获得的优质16S rRNA基因序列以97%的相似水平作为OTU的划分依据进行聚类。在QIIME9.0软件http://qiime.org)(中选用BLAST的方法将代表序列与SILVA (http://www.arb-silva.de/)的SSU rRNA数据库进行比对,获得每一个OTU在各分类阶元的物种信息。物种注释后,在各分类水平上对物种进行群落结构的统计分析[18]。使用QIIME9.0软件对每个样本在相同测序深度下分别计算Chao1、Shannon等Alpha多样性指数,并绘制稀释曲线。使用Canoco for Windows 5软件对微生物群落结构与获得的环境数据进行分析,获得群落结构与环境因子之间的相关性。
1.6 序列登录号将获得的细菌16S rRNA基因原始数据上传到NCBISRA(Sequence Read Archive)数据库中,登录号为SRP133872。
2 结果与分析 2.1 浅层地下水中理化参数分析将采集到的地下水样品进行理化参数测定(见表 2)。盐度随着时间推移表现出先降低后升高的趋势。NO2-和NH4+表现先降低再升高的趋势,其中最大值出现在涨潮开始阶段。SiO32-则表现先升高再降低的趋势,其最大值出现在涨潮后期,最小值出现在涨潮初期。
|
|
表 2 青岛金沙滩不同采样时间地下水理化参数 Table 2 Environment parameters of shallow groundwater at different times in the Golden Beach |
通过对金沙滩浅层地下水中的细菌qPCR分析,细菌16S rRNA基因的熔解曲线为单峰,表明荧光定量PCR反应过程无引物二聚体产生及非特异扩增发生。通过对各样品中的细菌进行定量,每毫升水样中含有的细菌16S rRNA基因的拷贝数介于7.55×104~2.94×105 copies/mL。由图 1可知,细菌的丰度随着采样时间的推移表现出先下降后上升再下降的趋势。通过分析发现,在涨潮前期,细菌丰度较高,而随着涨潮时间的推移,细菌丰度降低,在涨潮中期细菌丰度达到较低水平。在涨潮后期及高潮阶段,细菌丰度持续增加,到达退潮阶段丰度又发生了明显的降低。由于受到涨潮作用的影响,金沙滩滨海地下水中微生物群落丰度可能由于稀释作用而迅速降低。由于存在地下水回流现象,导致细菌丰度在退潮阶段出现明显降低的趋势。
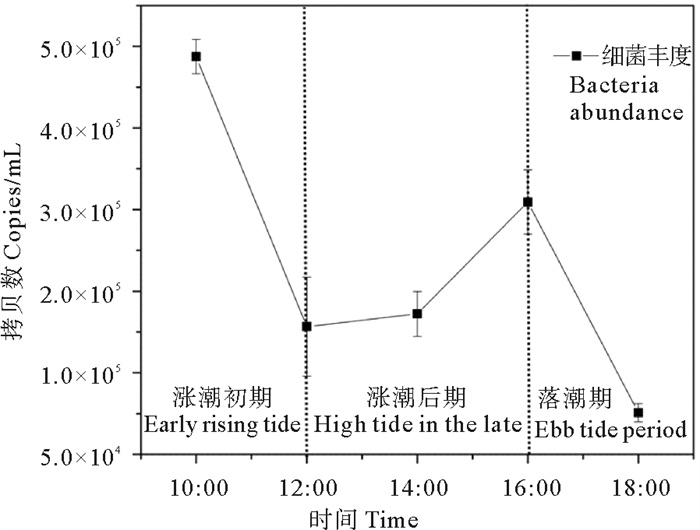
|
图 1 青岛金沙滩浅层地下水细菌丰度图 Fig. 1 Bacterial abundance in shallow groundwater from Golden Beach |
对采集的地下水样品进行细菌16S rRNA基因Illumina高通量测序发现,5个浅层地下水样品共获得164 587条高质量序列。每个样品的序列条数介于29 618~41 418条之间。序列相似度按97%进行归并和OTU划分,5个样品共获得3 276个OTUs,每个样品的OTUs数介于2 185与2 551之间。通过对样品中细菌α多样性(见表 3)分析发现,JS5.1的物种丰富度高于其他样品,而JS4.1的多样性高于其他样品。5个样品的覆盖度均高于98%,说明得到的高质量序列数能够有效覆盖样品中绝大多数物种。
|
|
表 3 青岛金沙滩浅层地下水细菌群落多样性指数 Table 3 The diversity index of bacterial community in shallow groundwater from Golden Beach |
OTU聚类注释后,对各个样品所得结果进行统计分析。5个样品共检测到45个门、81个纲、154个目、266个科、417个属、166个种。
通过对纲分类水平研究,共检测到12个优势菌群(见图 2)。其中变形菌门中的α-变形菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、δ-变形菌纲(Deltaproteobacteria)、β-变形菌纲(Betaproteobacteria)、ε-变形菌纲(Epsilonproteobacteria)在各样品中均属于优势菌,说明变形菌门是该研究区域地下水的优势菌。SAR202_clade、梭状芽胞杆菌(Clostridia)、Cytophagia、芽孢杆菌纲(Bacilli)、Flavobacteriia、Bacteroidia等也是各样品中的优势菌群。对优势菌群研究发现,α-变形菌纲在JS1.1及JS2.1中占据最优势地位,所占比重介于18.83%与35.98%,γ-变形菌纲在JS3.1、JS4.1及JS5.1中占据最优势地位,所占比重介于22.51%与26.92%之间。γ-变形菌纲在涨潮阶段,随着时间推移其所占比重逐渐上升,在JS4.1样品中所占的比重达到最大值。
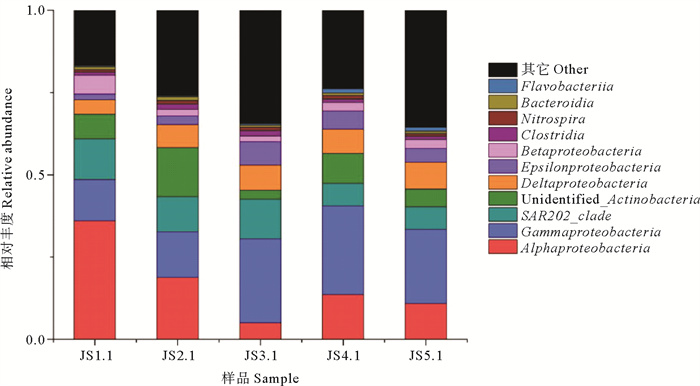
|
图 2 浅层地下水中纲分类水平上细菌的相对丰度 Fig. 2 The relative abundance of bacteria at class level in shallow groundwater |
通过对细菌属分类水平的统计发现(见图 3),不同样本的细菌群落结构具有较高的多样性及差异性,且每个站位均有60%以上的菌属不能确定分类地位,大量未知的微生物资源有待深入研究。Shewanella、Nocardioides、Pseudomonas、Caulobacter、Arcobacter、Oceaniserpentilla、Novosphingobium相对丰度较高,为本研究浅层地下水中的优势类群。对优势属的研究发现,Shewanella、Pseudomonas、Arcobacter在涨潮阶段,随着时间推移其所占比重逐渐上升,在退潮阶段相对丰度逐渐降低。
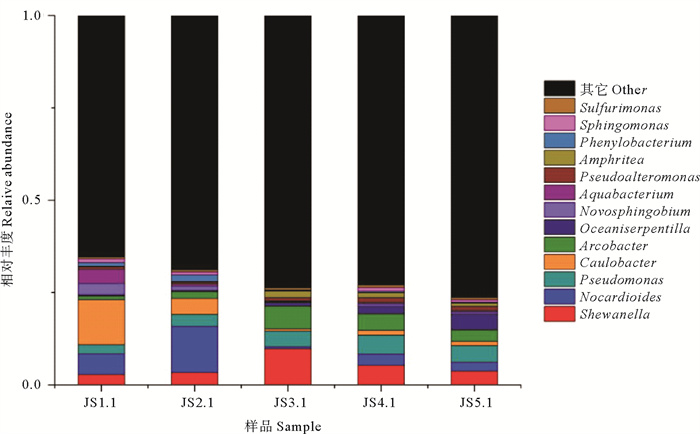
|
图 3 浅层地下水中属分类水平上细菌的相对丰度 Fig. 3 The relative abundance of bacteria at genus level in shallow groundwater |
对5个样品进行OTU分布统计发现(见图 4),5个样品的核心OTUs共有948个,约占总数的28.9%。核心OTUs在各个样品中所占比重普遍较高,相对丰度均高于84.28%,其中在JS1.1样品中的相对丰度高达94.9%。通过对核心OTUs在各样品中的比重分析发现,随着时间的推移,核心OTUs所占的比重逐渐减少,在JS5.1减少到84.3%。对每个样品特有的OTU进行统计发现,各站位所特有的OTUs在72到148个不等,其中特有的OTUs绝大多数在各个样品中的相对丰度小于0.01%,且其丰度之和在各个样品中的比重均小于1%,所占的比重对金沙滩浅层地下水中细菌群落结构的影响较小。
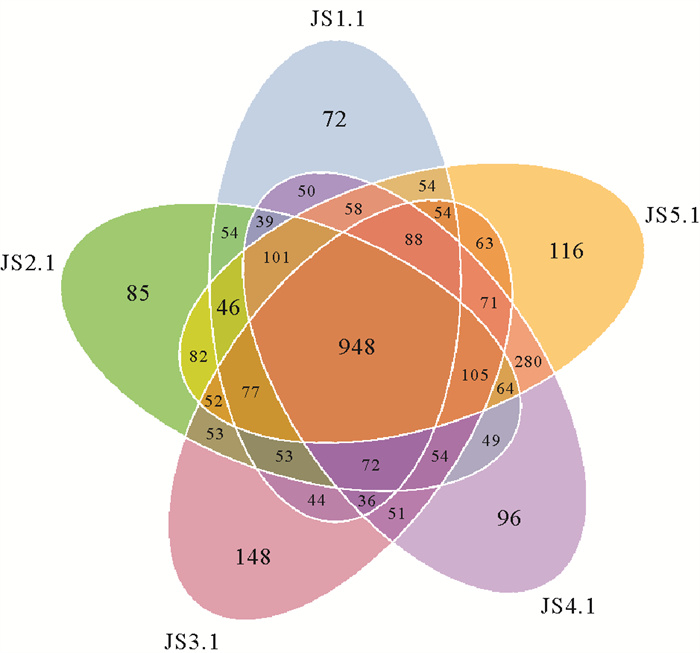
|
图 4 浅层地下水中细菌群落OTU分布Venn图 Fig. 4 The Venn diagram showing distribution of OTUs in shallow groundwater |
由于核心OTUs在各个样品中所占有的相对丰度均在80%以上,其对各样品中的细菌群落结构具有支配地位。核心OTUs在各样品之间的丰度差异是引起不同样品间细菌群落结构差异的主要因素。随着涨潮时间的推移,核心OTUs在样品中比重逐渐降低,非核心OTUs在样品中的比重逐渐升高。
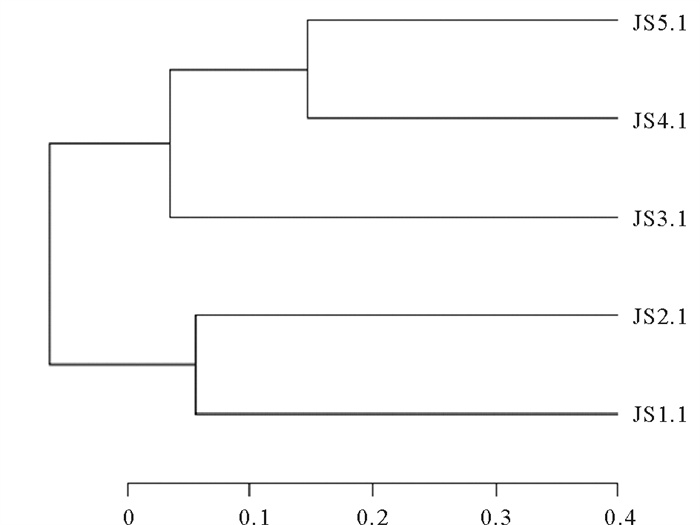
2.3.4 浅层地下水中细菌样本聚类分析通过聚类分析对地下水中的细菌群落构建聚类树发现,所有样品共分为两个分支,其中JS1.1、JS2.1两个样品聚为一个分支,JS3.1、JS4.1及JS5.1聚为另一个分支(见图 5)。
|
图 5 浅层地下水中细菌聚类图 Fig. 5 The cluster of bacterial community in shallow groundwater |
通过分析金沙滩的潮周信息,结合聚类树分析发现处于涨潮前期的JS1.1、JS2.1样品与处于退潮阶段的JS4.1、JS5.1样品之间存在较大的差异性。
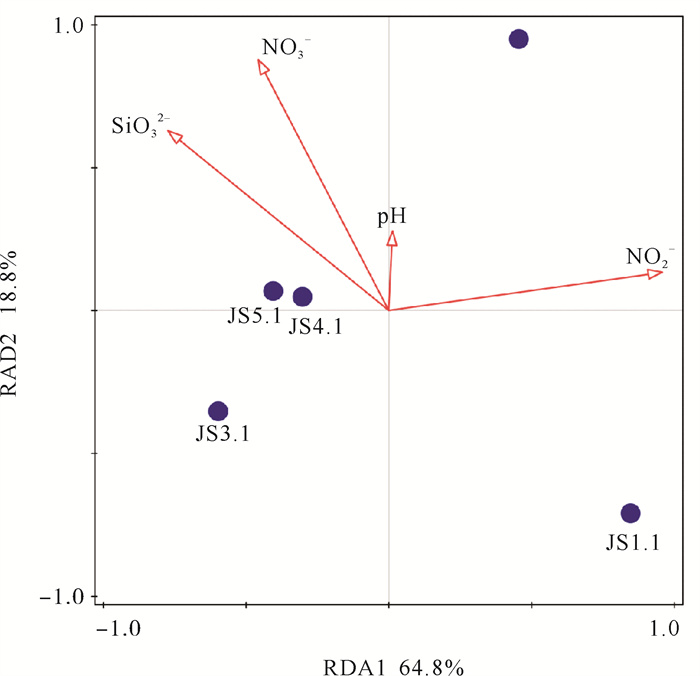
2.4 浅层地下水中细菌群落与环境因子的相关性分析在OTU水平上对金沙滩浅层地下水中细菌群落结构与环境因子的相关性进行分析(见图 6)。经BIOENV对本研究获取的所有环境因子进行筛选,得到NO2-(Nitri.)、SiO32-(DSi)、pH、NO3-(Nitra.)为影响细菌群落结构的最佳环境因子组合。通过去趋势对应分析进行判定,冗余分析更适合本研究水体中细菌群落结构与环境因子的相关性分析。结果表明,在第一、第二排序轴上的环境因子可以解释物种与环境因子间83.6%的累积变量。Nitri.、DSi、Nitra.是解释本研究中细菌群落结构变化的主要环境因子。蒙特卡洛检验表明,Nitri.、DSi对金沙滩浅层地下水中的细菌群落结构具有显著影响(P<0.05)。
|
图 6 浅层地下水中细菌群落及环境因子的RDA分析图 Fig. 6 The redundancy analysis of bacterial community and environmental parameters in shallow groundwater |
本研究中的金沙滩为沙质海滩,渗透能力较强,海水与地下水交换作用显著,潮汐作用对地下水中微生物群落影响具有重要影响。
3.1 滨海浅层地下水中微生物群落多样性在纲分类水平上对优势菌群的研究发现,α-变形菌纲在涨潮前期样品中占据最优势地位,而γ-变形菌纲在涨潮后期及退潮样品中占据最优势地位。涨潮前后样品中微生物群落变化明显,整体来看,α-变形菌纲在样品中的比重随着时间推移其所占的比重逐渐降低,具有典型海洋特征的γ-变形菌纲[19]在群落中的比重显著增高。说明受潮汐作用影响,海水入侵地下水,导致γ-变形菌纲等海洋细菌在群落中的比重逐渐增高。在属分类水平上对地下水中细菌群落的研究发现,浅层地下水中含有大量海洋菌群,其中相对丰度较高的主要有Oceaniserpentilla(0.31%~4.27%)、假交替单胞菌属(0.53%~1.30%)、赤杆菌属(0.13%~0.62%)、弧菌属(0.08%~0.58%)、海细菌属(0.07%~0.28%)、海洋杆菌属(0.10%~0.22%)、NS3a_ma-rine_group(0.06%~0.17%)、假螺菌属(0.05%~0.16%)、海洋球菌属(Oceanococcus)(0.03%~0.15%)、盐单胞菌(0.03%~0.14%)、Oceanisphaera(0.05%~0.13%)等[20-24],其可能与海洋水体交换有关。因此,潮汐作用可能会导致滨海浅层地下水中细菌群落组成发生明显变化。
通过对细菌群落结构进行分析发现,受到涨潮作用的影响,样品中核心OTUs的比重逐渐降低,而非核心OTUs在样品中的比重逐渐升高,这可能与海洋相关的微生物群落在地下水中的比例逐渐增大有关。目前已有研究表明,海水侵入地下水会导致地下水中微生物群落结构发生明显变化[25]。因此,潮汐作用对滨海浅层地下水中微生物群落结构有巨大影响。
通过对各细菌样本的聚类分析发现,涨潮前期的样品之间、退潮阶段的样品之间的相似性较高,而涨潮高潮阶段的样品(JS3.1)与涨潮前期、退潮阶段的样品的差异性较大,涨潮前期与退潮阶段的样品之间差异性也较大。这可能是由于金沙滩为沙质海滩且采样点位于高潮线附近,地下水与海水交换滞后效应较小,受到潮汐的影响明显。涨潮前期受到海水入侵作用引起地下水中微生物群落变化较小,在高潮期海水对地下水的入侵作用较为剧烈,因而引起地下水中微生物群落结构与涨潮前期微生物群落差异性较大。退潮阶段样品微生物群落结构相似性较高,可能是由于海水退却及地下水回流,海洋作用对微生物群落的影响减弱。海水与地下水的双重作用,可能是导致高潮阶段样品与退潮阶段样品微生物群落组成差异性较大的主要原因。
由于采样站位距海较近,且沙质海滩水渗透性好,潮汐作用的滞后效应小,海洋作用显著,细菌丰度变化剧烈[25]。一个潮周期内地下水样品中的细菌丰度变化规律能够基本反映出潮汐作用的影响。对金沙滩滨海浅层地下水中细菌群落丰度的研究发现,细菌的丰度变化趋势在涨潮前期及中期表现出先降低后上升的趋势,在退潮阶段又出现了下降趋势。Trick等[26]研究发现,地下水的高传递性能够产生明显的水剪切力,导致沉积物中的微生物发生吸附解析。细菌的丰度在涨潮前期呈现下降趋势,可能是受涨潮作用影响,海水对地下水中微生物群落丰度产生稀释作用。在高潮期,细菌丰度有一定程度的升高,可能是由于潮汐对地下水层的冲刷能力较强,沉积物中的微生物发生解析进入地下水中,进而导致细菌丰度有一定程度的升高。退潮阶段,地下水中的一部分微生物发生吸附进入沉积物中,导致地下水中细菌丰度降低。因此,潮汐作用会导致滨海浅层地下水中细菌丰度发生明显变化。
3.2 滨海浅层地下水中微生物群落生态功能微生物群落作为生态系统中的重要组成部分,其在生源要素的生物地球化学循环中扮演了重要的角色。受到潮汐作用影响,浅层地下水中具有与其他陆地系统不同的微生物群落组成。已有研究发现,好氧、厌氧周期性交替的环境,利于氮素的生物地球化学循环[14-15]。
对金沙滩浅层地下水中细菌生态功能研究发现,样品中存在大量与氮代谢相关的细菌群落。参与氮元素的生物地球化学循环的菌属在金沙滩浅层地下水中的相对丰度较高(4.31%~7.67%),其中包括可进行固氮作用的固氮螺菌属(Azospirillum),可进行氨化作用的分支杆菌属(Mycobacterium),进行反硝化作用的假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)及进行硝化作用的亚硝化球菌属(Nitrosococcus)等。这与图 6所得结果一致,水体中的NO2-浓度对细菌群落结构具有显著影响(P<0.05)。因此,受潮汐作用的影响,金沙滩浅层地下水中的氮循环过程比较活跃。
金沙滩浅层地下水样品中与硫代谢相关的细菌所占的相对丰度在1.29%~1.80%之间,其中包括可进行硫酸盐还原的脱硫弧菌属(Desulfovibrio),可进行硫氧化过程的Sulfurimonas、硫微螺菌属(Thiomicrospira)、Sulfurovum、亚硫酸杆菌(Sulfitobacter)等细菌群落。地下水中微生物的硫代谢活动相对较弱,可能是由于该地区没有河流输入,缺乏硫酸盐等营养物质的输入。
4 结语本研究基于分子生态学方法探讨潮汐作用对浅层地下水中细菌群落结构、多样性及丰度的影响。结果表明,潮汐作用明显改变了地下水中细菌群落组成、结构及丰度。受潮汐作用影响,浅层地下水中与氮循环相关的细菌相对丰度较高、氮代谢活动旺盛。潮汐作用对地下水中微生物群落的影响不容忽视。
| [1] |
Burnett W C, Bokuniewicz H J, Huettel M, et al. Groundwater and pore water inputs to the coastal zone[J]. Biogeochemistry, 2003, 66(1): 3-33.
(  0) 0) |
| [2] |
Moore W S. The effect of submarine groundwater discharge on the ocean[J]. Annual Review of Marine Science, 2010, 2(1): 59-88. DOI:10.1146/annurev-marine-120308-081019
(  0) 0) |
| [3] |
Burnett W C, Aggarwal P K, Aureli A, et al. Quantifying submarine groundwater discharge in the coastal zone via multiple methods[J]. Science of the Total Environment, 2006, 367(2): 498-543.
(  0) 0) |
| [4] |
Gibbes B, Robinson C, Li L, et al. Tidally driven pore water exchange within offshore intertidal sandbanks: Part Ⅱ numerical simulations[J]. Estuarine Coastal and Shelf Science, 2008, 80(4): 472-482. DOI:10.1016/j.ecss.2008.08.021
(  0) 0) |
| [5] |
Anschutz P, Smith T, Mouret A, et al. Tidal sands as biogeochemical reactors[J]. Estuarine, Coastal and Shelf Science, 2009, 84(1): 84-90. DOI:10.1016/j.ecss.2009.06.015
(  0) 0) |
| [6] |
Santos I R, Eyre B D, Huettel M. The driving forces of porewater and groundwater flow in permeable coastal sediments: A review[J]. Estuarine Coastal and Shelf Science, 2012, 98: 1-15. DOI:10.1016/j.ecss.2011.10.024
(  0) 0) |
| [7] |
刘陆. 黄河口潮间带泥滩环境微生物群落特征研究[D]. 青岛: 中国海洋大学, 2014. Liu L. The Study on the Characteristics of Microbial Community in Intertidal Mudflat of the Yellow River Estuary[D]. Qingdao: Ocean University of China, 2014. (  0) 0) |
| [8] |
刘志媛. 黄河河口过程中碳的行为变化[D]. 青岛: 中国海洋大学, 2011. Liu Z Y. The Changing Behavior of Carbon From Estuarine Dynamic in Yellow River Estuary[D]. Qingdao: Ocean University of China, 2011. (  0) 0) |
| [9] |
Rogers D R, Casciotti K L. Abundance and diversity of archaeal ammonia oxidizers in a coastal groundwater system[J]. Applied and Environmental Microbiology, 2010, 76(24): 7938-7948. DOI:10.1128/AEM.02056-09
(  0) 0) |
| [10] |
Edmonds J W, Weston N B, Joye S B, et al. Microbial community response to seawater amendment in low-salinity tidal sediments[J]. Microbial Ecology, 2009, 58(3): 558-568. DOI:10.1007/s00248-009-9556-2
(  0) 0) |
| [11] |
Falkowski P G, Fenchel T, Delong E F. The microbial engines that drive Earth's biogeochemical cycles[J]. Science, 2008, 320(5879): 1034-1039. DOI:10.1126/science.1153213
(  0) 0) |
| [12] |
Chen J, Taniguchi M, Liu G, et al. Nitrate pollution of groundwater in the Yellow River Delta, China[J]. Hydrogeology Journal, 2007, 15(8): 1605-1614. DOI:10.1007/s10040-007-0196-7
(  0) 0) |
| [13] |
Moran S B, Stachelhaus S L, Kelly R P, et al. Submarine groundwater discharge as a source of dissolved inorganic nitrogen and phosphorus to coastal ponds of Southern Rhode Island[J]. Estuaries and Coasts, 2014, 37(1): 104-118. DOI:10.1007/s12237-013-9663-7
(  0) 0) |
| [14] |
Zheng Y, Hou L, Liu M, et al. Tidal pumping facilitates dissimilatory nitrate reduction in intertidal marshes[J]. Scientific Reports, 2016, 6(1): 1-12. DOI:10.1038/s41598-016-0001-8
(  0) 0) |
| [15] |
侯贯云, 翟水晶, 乐晓青, 等. 潮汐对闽江口感潮湿地孔隙水及土壤中硅, 氮浓度的影响[J]. 应用生态学报, 2017, 28(1): 337-344. Hou G Y, Zhai S J, Le X Q, et al. Influences of tide on silicon and nitrogen contents in soil and porewater in the Minjiang River estuary, Southeast China[J]. Chinese Journal of Applied Ecology, 2017, 28(1): 337-344. (  0) 0) |
| [16] |
Cao D, Shi F, Koike T, et al. Halophyte plant communities affecting enzyme activity and microbes in saline soils of the Yellow River Delta in China[J]. Clean-Soil Air Water, 2014, 42(10): 1433-1440. DOI:10.1002/clen.201300007
(  0) 0) |
| [17] |
Caporaso J G, Kuczynski J, Stombaugh J, et al. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303
(  0) 0) |
| [18] |
Bokulich N A, Subramanian S, Faith J J, et al. Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing[J]. Nature Methods, 2013, 10(1): 57-59. DOI:10.1038/nmeth.2276
(  0) 0) |
| [19] |
DeLong E F, Preston C M, Mincer T, et al. Community genomics among stratified microbial assemblages in the ocean's interior[J]. Science, 2006, 311(5760): 496-503. DOI:10.1126/science.1120250
(  0) 0) |
| [20] |
Novikova O D, Khomenko V A, Frolova G M, et al. Porins from marine bacteria of the genus Pseudoalteromonas (Gammaproteobacteria: Pseudoalteromonadaceae)[J]. Russian Journal of Marine Biology, 2013, 39(1): 58-64. DOI:10.1134/S1063074013010057
(  0) 0) |
| [21] |
Yada S, Wang Y, Zou Y, et al. Isolation and characterization of two groups of novel marine bacteria producing violacein[J]. Marine Biotechnology, 2008, 10(2): 128-132. DOI:10.1007/s10126-007-9046-9
(  0) 0) |
| [22] |
Gärtner A, Wiese J, Imhoff J F. Amphritea atlantica gen. nov. sp. nov., a gammaproteobacterium from the Logatchev hydrothermal vent field[J]. International Journal of Systematic and Evolutionary Microbiology, 2008, 58(1): 34-39. DOI:10.1099/ijs.0.65234-0
(  0) 0) |
| [23] |
Su J, Zhou Y, Lai Q, et al. Sinobacterium caligoides gen. nov. sp. nov., a new member of the family Oceanospirillaceae isolated from the South China Sea, and emended description of Amphritea japonica[J]. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(6): 2095-2100.
(  0) 0) |
| [24] |
Green R T, Todd J D, Johnston A W B. Manganese uptake in marine bacteria; the novel MntX transporter is widespread in Roseobacters, Vibrios, Alteromonadales and the SAR11 and SAR116 clades[J]. The ISME Journal, 2013, 7(3): 581-591. DOI:10.1038/ismej.2012.140
(  0) 0) |
| [25] |
Guasto J S, Rusconi R, Stocker R. Fluid mechanics of planktonic microorganisms[J]. Annual Review of Fluid Mechanics, 2012, 44: 373-400. DOI:10.1146/annurev-fluid-120710-101156
(  0) 0) |
| [26] |
Trick T, Custodio E. Hydrodynamic characteristics of the western Doñana region (area of El Abalario), Huelva, Spain[J]. Hydrogeology Journal, 2004, 12(3): 321-335.
(  0) 0) |
2. The Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingao), Qingdao 266237, China;
3. College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China
 2021, Vol. 51
2021, Vol. 51


