2. 中国海洋大学海洋化学理论与工程技术教育部重点实验室 海洋高等研究院, 山东 青岛 266100;
3. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学实验室, 山东 青岛 266237
磷(P)是水体富营养化最为常见的限制性营养盐,水体中较高的磷含量会直接导致藻华的爆发[1]。沉积物是水环境中磷循环的载体与重要的储存库,其组成和其表面的理化性质影响着磷在沉积物—水界面上的迁移行为[2],同时共存的生物藻类以及溶解氧(DO)等环境因素也在很大程度上影响着沉积物对P的吸附或释放作用[3],进而影响着水体的生态环境质量。
已有的研究表明,藻类对沉积物磷的迁移有着直接或间接的影响[4-6]:藻类对P的吸收使上覆水中的P浓度下降,致使沉积物间隙水与上覆水之间存在P浓度梯度,进而促使沉积物中的P向上覆水中扩散,而由沉积物释出的P进一步为藻类的生长繁殖提供营养源,因此沉积物释磷行为与藻类生长往往是互相促进的。Tuominen等[7]研究发现,硅藻属细胞分解后释放出的硅还可通过与P抢占铁、铝氧化物表面的吸附位点而致使沉积物上P吸附量下降。同时,由于藻类可通过光合作用产生O2,而呼吸作用及死亡后的藻体经微生物分解则会消耗DO,从而导致藻类对水体中DO水平有着重要影响,而作为影响沉积物中磷的迁移行为的环境因素之一,DO则可通过影响铁锰氧化物和硫的氧化还原以及微生物新陈代谢等过程来实现对沉积物-水界面上磷迁移行为的影响[8]:富氧环境下,O2作为有机质降解过程中的主要电子接受体为其有氧呼吸供能;贫氧条件下,MnO2和FeOOH等就会作为理想的电子受体而被有机质的降解所利用,此时容易发生Fe3+-Fe2+的还原反应,使原本与铁、锰氧化物结合的那部分磷溶解释放至上覆水中[9],且铁结合态磷(Fe-P)是沉积物向水体释放P的主要形态[10]。
在微电极技术发展以前,传统定量水体中的溶解氧浓度多采用化学滴定方法或是借助其它仪器分析手段,存在耗时较长且难以实现在线监测的缺点。微电极优势在于能实现较高的空间分辨率并能在短时间内获得大量的数据[11]。金汞伏安微电极最初是由George W. Luther III的研究团队研制所得,制成的Au/Hg微电极应用于沉积物中DO、S2-、Mn2+和Fe2+等氧化还原成分的现场测定[12-14]。Xu等[15]利用微电极体系对Fe、Mn等金属离子的测量,揭示了海洋环境中微生物影响金属腐蚀的一般机制;并将该微电极技术应用于厦门西港沉积物中氧化还原成分浓度梯度的测量中[16]。本文采用金汞伏安微电极技术,通过对藻-沉积物共存体系中溶解氧含量的实时监测,结合体系中磷的消耗情况及沉积物中磷的形态分布等,探讨藻类生长活动对沉积物-水界面上磷的迁移转化的影响。
1 材料与方法 1.1 沉积物样品及藻的培养实验所用沉积物样品于2018年3月采自长江口,采集后在-20 ℃下冷冻保存。使用前室温解冻,自然风干,研磨后过尼龙筛,取120~200目(120~75 μm)组分备用。
实验选取的中肋骨条藻(Skeletonema costatum)是我国海域尤其是长江口水域优势的赤潮藻种[17],藻种由中国科学院海洋研究所提供。取一定量指数生长期的藻细胞接入盛有100 mL f/2培养基的250 mL的三角瓶中,然后将其置于温度为(25±0.5)℃,光照为3 000 lx,光暗比(L/D)为12 h:12 h的培养箱中进行藻种的培养。
实验所用玻璃器皿全部在10% HCl溶液中浸泡24 h,用高纯水冲洗3遍后121 ℃高压湿热灭菌30 min。培养液选用f/2营养盐配方。培养用海水为陈化一月以上的天然灭菌海水:pH为7.9±0.1,盐度为30±1,经孔径为0.45 μm的醋酸纤维滤膜过滤后121 ℃高压湿热灭菌30 min冷却后备用。
1.2 藻类/沉积物对磷的吸收/吸附实验取一定量对数生长期的中肋骨条藻(Skeletonema costatum)藻种,3 000 r/min离心4 min,倾去上清液,用灭菌海水洗涤3次后接入500 mL灭菌海水中,置于与培养实验条件相同的培养箱中饥饿24 h,待其中的营养盐消耗殆尽,取适量藻样固定后采用平板计数法于显微镜下进行细胞计数,计算实验初始藻密度。研究表明,当水体中骨条藻密度>5×103 cells/mL时即形成赤潮[18-19],为使实验水体在动力学实验48 h内保证为藻华发生阶段,故实验设定了三种不同初始藻密度:1.0×104、5.0×104和1.0×105 cells/mL。
采用批量法测定藻-沉积物共存体系中磷的消耗速率。称取或量取一系列沉积物((0.500 0±0.000 1) g)或藻种样品于100 mL锥形瓶中,然后加入40 mL 32 μmol·L-1的磷溶液(由KH2PO4和灭菌海水配制),并按照f/2培养基的配比添加其他营养盐,处理组编号信息见表 1。样品置于(25±1) ℃恒温水浴振荡器中,50 r·min-1条件下振荡,振荡器上方加光照,光照强度约(2 200±100) lx,定时取样,离心分离。悬浮的藻液经0.45 μm的醋酸纤维滤膜过滤分离,用磷钼蓝分光光度法[20]测定上清液中磷的浓度,据初始磷浓度和上清液磷浓度之差求得磷在t时间段内的消耗量,以时间t为横坐标,绘制动力学曲线;沉积物残渣转移至50 mL离心管中,烘干待做磷形态分析。其中,每个样品设置2个平行样,实验处理组设计如表 1所示。
|
|
表 1 藻-沉积物共存体系设计及编号 Table 1 Details of the experimental design |
金汞伏安微电极的制作方法参照Luther和Madison[21]进行,截取直径为0.1 mm的Au丝(纯度>99.99%)焊接到电缆线上,并利用环氧树脂封装在毛细玻璃管中,固化后进行打磨与抛光,然后置于溶解有0.01 mol·L-1Hg(NO3)2的0.1 mol·L-1HNO3电解液中进行阴极化电沉积生成汞膜。
Ag/AgCl电极(参比电极)和固态Pt电极(辅助电极)的制作方法同金电极的制作,所用材料为直径为1.0 mm的银丝和直径为0.5 mm的Pt丝。Ag电极的卤化:将焊接好的Ag电极置于0.5 mol·L-1的NaCl溶液(或天然海水)中进行阳极极化使其表面生成AgCl薄膜。
1.4 溶解氧的测定运用三电极体系(Au/Hg微电极为工作电极,Ag/AgCl电极为参比电极,Pt电极为辅助电极),利用瑞士万通Autolab恒电位电流仪,采用循环伏安法(Cyclic Volta-mmetry)在-0.1~-1.8 V电势范围内进行扫描,定时获得样品溶液体系的溶解氧含量[21],以时间t为横坐标,溶解氧浓度为纵坐标绘制动力学溶解氧变化曲线。每一时刻溶解氧的测定均在电极稳定后扫描5次,以保证其重现性与精确性。
1.5 沉积物中的磷形态分布分析[22-24]对沉积物原样及以上实验过程后的沉积物样品分别用MgCl2溶液和柠檬酸钠-连二亚硫酸钠-碳酸氢钠混合溶液(CDB溶液)逐级分离提取其中的弱吸附态磷(Ex-P)和铁结合态磷(Fe-P)。另外,将沉积物用盐酸提取测定其中无机磷(IP)、将沉积物在550 ℃下灰化后用盐酸提取测定其总磷(TP),两者相减获得有机磷含量(OP)。上述提取液中各形态磷的测定均采用磷钼蓝分光光度法[20]。
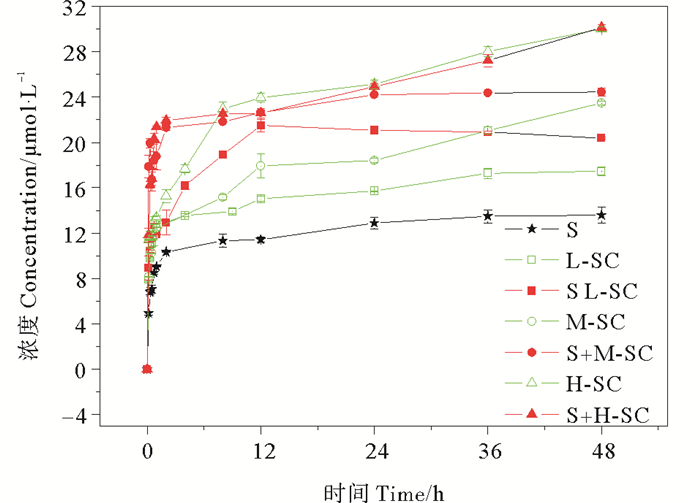
2 结果与讨论 2.1 中肋骨条藻和沉积物对磷的吸收/吸附作用的相互影响 2.1.1 初始藻密度对磷消耗的影响为了解藻密度对沉积物-水体系中磷消耗的影响,首先测试不同初始藻密度的藻体对磷的吸收动力学曲线及藻与沉积物共存时对磷的消耗动力学曲线,如图 1所示。
|
图 1 不同初始藻密度下沉积物-藻共存体系中磷的消耗情况 Fig. 1 Phosphorus consumption at different initial algal densities |
显然,藻的存在明显加大了体系中磷浓度的降低幅度,同样条件下,藻密度较高的体系中,磷浓度的降低率也是较高的。在无藻类存在的情况下,沉积物对无机磷的吸附平衡时间以48 h计,吸附平衡后沉积物对介质中无机磷的吸附百分比为42.5%。仅藻类存在条件下,不同初始藻密度的藻对磷的吸收情况差异明显,48 h后低、中、高藻密度组由32 μmol·L-1的初始磷浓度分别下降至14.5、8.5和2.0 μmol·L-1,消耗磷的百分比分别为54.7%,73.4%,93.8%。当藻体与沉积物共存时,24 h后低、中藻密度处理组对磷的消耗几乎趋于稳定,而高藻密度处理组在24 h后对磷的消耗依然较为剧烈,且中、高藻密度处理组12 h前对磷的吸收趋势相近,12 h后差异增大,至48 h三种初始藻密度处理组中磷浓度减少量分别为20.4、24.4和30.1 μmol·L-1,相较零时刻的下降百分比分别为63.8%,76.3%及94.1%。
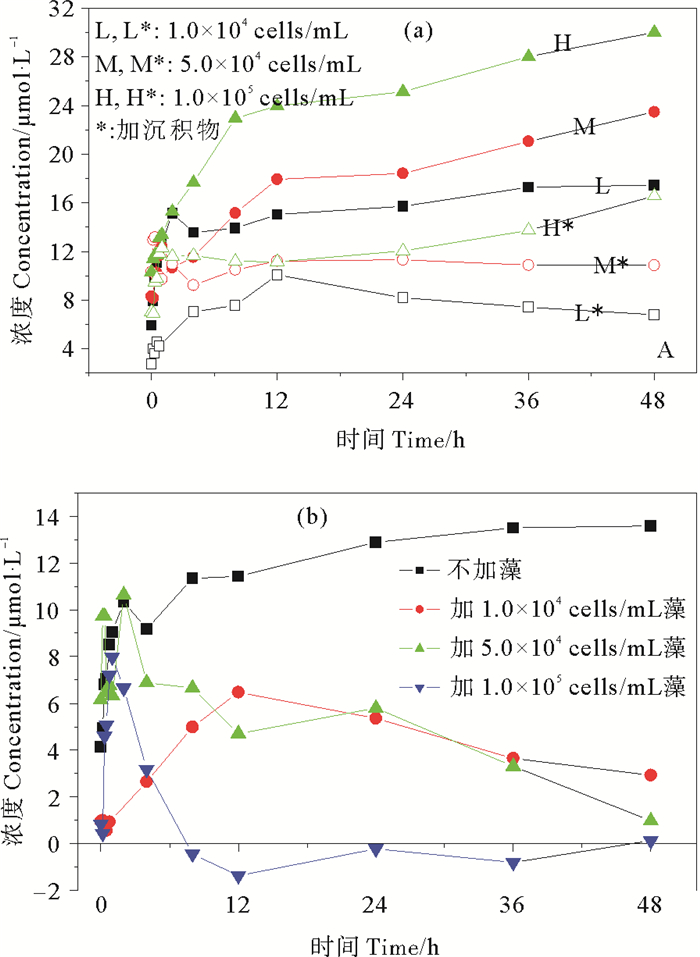
2.1.2 中肋骨条藻与沉积物共存条件下二者的相互影响为进一步探究藻类与沉积物共存条件下二者的相互影响,分别将实际藻吸收磷动力学曲线与共存体系中扣除沉积物吸附所获得的藻吸收磷动力学曲线(见图 2(a)),以及实际沉积物吸附磷动力学曲线与共存体系中扣除相应藻吸收所获得的沉积物吸附磷动力学曲线(见图 2(b))进行了对比分析。
|
图 2 藻类-沉积物共存对藻吸收磷动力学(a)和沉积物吸附磷动力学(b)的影响 Fig. 2 The absorption/adsorption kinetic curves of algal (a)and sediment (b) in coexistence systems |
结果表明,加入沉积物实验组中的藻类对磷的吸收明显低于单一藻类实验组,共存体系下的低、中、高藻密度藻体48 h后对磷的吸收百分比仅分别为21.3%,34.1%及51.9%,与单一藻类条件下相比各下降了33.4%,39.3%及41.9%。同时,藻类的存在亦显著影响了沉积物对磷的吸附行为;添加藻类体系中的沉积物虽在短时间内对磷的吸附呈上升趋势,但低、中、高藻密度组中的沉积物分别在12、2及1 h时刻对磷的吸附不增反降,1.0×105 cells/mL藻密度条件下的沉积物8 h后甚至出现磷释放现象,48 h后低、中、高藻密度存在条件下的沉积物对磷吸附的百分比仅分别为9.1%,2.8%和0.3%,与单一沉积物对磷的吸附情况相比分别下降了33.4%,39.7%及42.2%,即藻密度越大该影响越明显。藻类对磷的持续吸收导致水体中磷浓度不断降低,从而使得沉积物上磷的吸附量逐渐降低,如果水体中磷浓度低于吸附解吸临界磷平衡浓度,还将会导致沉积物中磷的析出。该结果与许多研究认为的藻类生长与繁殖会促进沉积物释磷现象[25-26]的观点不谋而合。
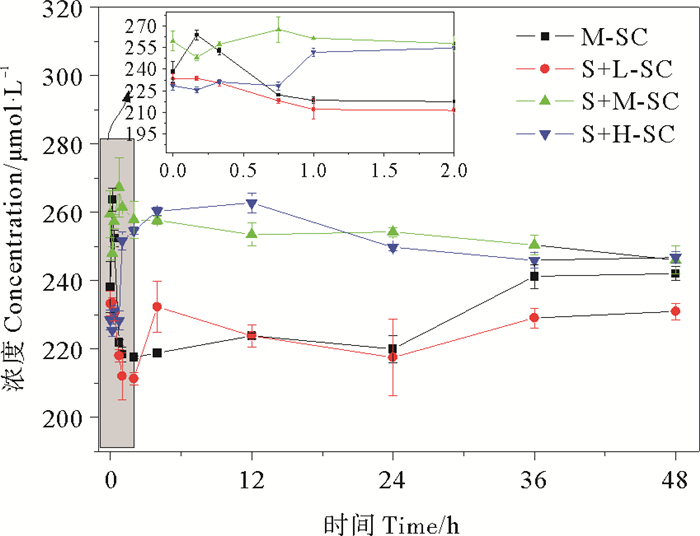
2.2 水体中溶解氧随时间的变化研究表明,当水体中骨条藻密度>5×103 cells/mL时即可形成赤潮[18-19],故实验选取了高于该值的三个初始藻密度进行了48 h内溶解氧的定时测定。其中,0~12、24~36 h为光照时段,其他为黑暗时段。以藻体单独存在的中藻密度体系为例,由图 3可发现DO含量具有在光照时段上升,黑暗时段下降的明显趋势,这与我们的预测是一致的:藻类在光照条件下发生光合作用产生的O2使体系中DO上升,而黑暗条件下藻类则会通过呼吸作用消耗氧气导致DO下降。低、中、高藻密度藻体与沉积物共存体系下的DO的测定结果表明,实验初期各实验体系溶解氧波动明显,规律不一,原因是沉积物存在导致了对水体中磷的竞争性吸附,而沉积物上的磷的吸附解吸动态过程又直接影响着藻的对营养盐的摄入。当体系中藻密度比较低(如本文的低藻密度体系)时,该影响并不明显,随着时间的增长,仍会呈现在光照时段DO上升,黑暗时段DO下降的趋势,光合作用产O2和呼吸作用耗氧过程较为稳定。中藻密度体系在实验过程中的DO含量变化也不大。但随藻密度增至1.0×105 cell/mL,过量的藻体通过对营养盐的摄取大量生长繁殖,并在0~12 h光照时段通过光合作用释放大量O2而使水体中DO含量激增;同时随着体系中磷的减少,藻类又因新陈代谢、死亡分解后消耗大量氧气,导致实验后期DO含量又有明显下降。且已有研究发现,含藻水体中76.9%的溶解氧源于藻类的光合作用,其中的57.5%又被藻类自身呼吸作用所利用消耗[27],期间还伴随着藻类消亡过程中的耗氧,大气压强作用下水-气界面的空气扩散等,以致使得以上整个过程DO随时间变化发生着一定的波动。
|
图 3 水体中溶解氧随时间的变化 Fig. 3 Change of dissolved oxygen with time in various coexistence conditions |
体系对磷的消耗速率可认为是某时刻下单位时间内P的浓度减少量(μmol·L-1·s-1或μmol·L-1·min-1、μmol·L-1·h-1)。利用各实验体系对P的消耗随时间的变化曲线,在特定时刻下将磷的浓度对时间t求导,以获得该时刻下体系消耗P的速率,如表 2所示。
|
|
表 2 体系不同时刻的耗磷速率及其与溶解氧含量的相关性分析结果 Table 2 Phosphorus consumption rate in each system at different time and the correlation with DO |
各实验体系对磷的消耗速率几乎均随时间变化而逐渐降低,甚至有出现负值情况,可能有藻体死亡导致了磷的释放发生。对不同体系各取样点消耗P的速率(rP)和该时刻下的溶解氧浓度(CDO)进行相关性分析表明,两者通常并无明显相关性,仅在高藻密度藻与沉积物共存体系中,耗磷速率与溶解氧含量呈显著负相关(p<0.05),可能是由于高藻密度的藻体当与沉积物共存时,藻体对磷的吸收因沉积物吸附磷的竞争影响显得更为显著,新陈代谢较为缓慢,但此时因光合作用仍较强,所产生的氧使水体中DO明显上升而导致该现象。
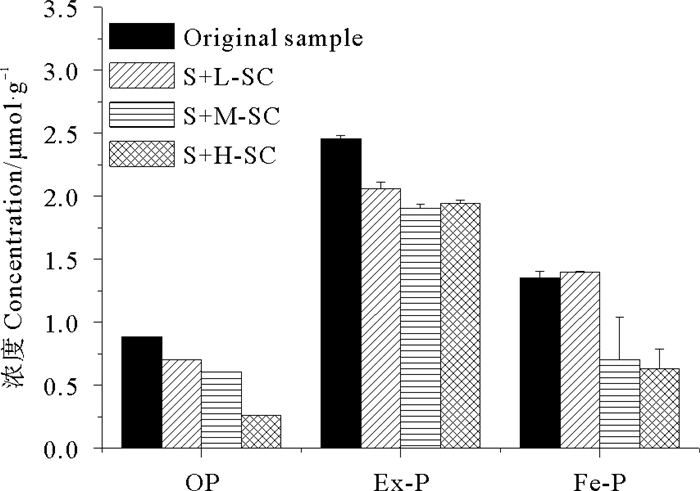
2.4 溶解氧对沉积物中各形态磷分布的影响研究表明,海洋沉积物对磷的吸附会对其中磷的形态分布产生不同程度的影响[28],为进一步验证藻类存在时,DO的改变对沉积物中各形态磷迁移转化的影响规律,选取了吸附平衡的48 h进行沉积物中磷形态的测定分析。由于吸附到沉积物中的磷最终主要以可交换态磷(Ex-P)和铁结合态磷(Fe-P)的形式呈现[29],并考虑藻体吸收对有机磷可能产生的影响,本实验仅讨论各体系下沉积物中的有机磷(OP),Ex-P和Fe-P。
|
图 4 48 h时刻各沉积物样品中磷的形态分布 Fig. 4 Contents of OP, Ex-P and Fe-P in different sediment samples after 48 h |
由表 3可见,藻的加入会显著影响沉积物吸附磷后的形态分布情况。相较沉积物原样,各形态磷均有不同程度的减少。吸附48 h后,低藻密度共存体系中沉积物样品的Fe-P含量略有增加,表明少量的藻体对P的吸收作用未表现出很强的竞争性。在高密度藻量的情况下,藻类在光照时间段光合作用产O2与黑暗时间段呼吸作用耗O2使水体中DO波动较为明显,藻类因生长和繁殖所需而对P的吸收作用增强,使共存体系沉积物中的Ex-P,OP和Fe-P均呈现下降趋势,且OP和Fe-P的减少最为显著。研究表明,Ex-P通过物理结合吸附于沉积物表面,当环境中磷酸盐的含量不足以提供藻体生长繁殖时,Ex-P是比较容易能从沉积物中释放的磷形态[30],而OP和Fe-P是藻类存在时优先释放的形态,具有很好的生物可利用性[30-32]。其中,Fe-P含量的降低主要包括两方面:中肋骨条藻(Skeletonema costatum)属硅藻属细胞,其分解后释放出的Si可与P抢占铁、铝氧化物表面的吸附位点而致使沉积物上P吸附量下降,体系中藻密度越高该情况越显著;体系中DO含量在中藻密度0~48 h与高藻密度12~48 h期间降低明显, 与Fe-P降低的趋势一致。不同的氧浓度使金属元素以不同的价态存在于沉积物中,继而改变与磷的吸附紧密程度[1]:厌氧条件促使沉积物中Fe-P的释放,而好氧条件则大多会抑制Fe-P的释放[1, 4, 33]。这是由于厌氧状态下容易发生Fe3+-Fe2+的还原反应,从而致使Fe-P表面的氢氧化铁保护层转变为氢氧化亚铁,然后溶解释放至上覆水中,导致沉积物中Fe-P含量的减少[9]。
|
|
表 3 溶解氧浓度与沉积物样品中的Ex-P,OP和Fe-P含量 Table 3 Dissolved oxygen and contents of Ex-P, OP and Fe-P in different sediment samples |
(1) 中肋骨条藻(Skeletonema costatum)的存在显著影响了沉积物对水体中磷的吸附作用甚至促进了其向水体中的释磷行为,初始藻密度越大该现象越明显。
(2) 采用Au/Hg微电极可实现藻类生长过程中溶解氧的实时监测,高藻密度藻与沉积物共存体系的耗磷速率与体系DO含量呈显著负相关(p<0.05)。
(3) 水体中的DO含量一定程度上影响着沉积物对Fe-P的释放行为:DO浓度降低后促进沉积物中Fe-P向水体中释放,使得沉积物中Fe-P含量降低;Ex-P、OP和Fe-P是藻类存在时沉积物向水体中较易释放的形态。
致谢: 感谢中科院海洋研究所于仁成研究员在藻种及其培养方面给与的大力帮助。
| [1] |
李海宗, 潘梅. 富营养化水体底泥磷释放的研究进展[J]. 安徽农业科学, 2012, 40(21): 11008-11010, 11013. Li H Z, Pan M. Research progress of phosphorus release in sediment in eutrophic water[J]. Anhui Agricultural Science, 2012, 40(21): 11008-11010, 11013. DOI:10.3969/j.issn.0517-6611.2012.21.090 (  0) 0) |
| [2] |
Sondergaard M, Windolf J, Jeppesen E. Phosphorus fractions and profiles in the sediment of shallow Danish lakes as related to phosphorus load, sediment composition and lake chemistry[J]. Water Research, 1996, 30(4): 992-1002. DOI:10.1016/0043-1354(95)00251-0
(  0) 0) |
| [3] |
王晓丽, 潘纲, 包华影, 等. 黄河中下游沉积物对磷酸盐的吸附特征[J]. 环境科学, 2008, 29(8): 2137-2142. Wang X L, Pan G, Bao H Y, et al. Phosphate sorption characteristics onto sediments in the middle and lower reaches of the Yellow Rive[J]. Environmental Science, 2008, 29(8): 2137-2142. DOI:10.3321/j.issn:0250-3301.2008.08.009 (  0) 0) |
| [4] |
王晓蓉, 华兆哲, 徐菱, 等. 环境条件变化对太湖沉积物磷释放的影响[J]. 环境科学, 1996, 15(1): 16-19. Wang X Y, Hua Z Z, Xu L, et al. The effects of the environmental conditions on phosphorus release in lake sediments[J]. Environmental Science, 1996, 15(1): 16-19. (  0) 0) |
| [5] |
Brook A S, Edgington D N. Biogeochemical control of phosphorus cycling and primary production in Lake Michigan[J]. Limnology and Oceanography, 1994, 39(4): 961-968. DOI:10.4319/lo.1994.39.4.0961
(  0) 0) |
| [6] |
刘玉生, 邹兰, 郑丙辉. 光照、温度和藻类对底泥释放磷的影响[J]. 环境科学研究, 1992, 5(2): 41-44. Liu Y S, Zou L, Zheng B H. The effects of light, temperature and algae on release of phosphorus from suspended sediment in Lake Dianchi[J]. Environmental Science Research, 1992, 5(2): 41-44. DOI:10.3321/j.issn:1001-6929.1992.02.010 (  0) 0) |
| [7] |
Tuominen L. Increased bioavailability of sediment phosphorus due to silicate enrichment[J]. Water Research, 1998, 32(7): 2001-2008. DOI:10.1016/S0043-1354(97)00455-7
(  0) 0) |
| [8] |
Span D, Arbouille D, Hélène Howa, et al. Variation of nutrient stocks in the superficial sediments of Lake Geneva from 1978 to 1988[J]. Hydrobiologia, 1990, 207(1): 161-166. DOI:10.1007/BF00041453
(  0) 0) |
| [9] |
Krom M D, Berner R A. Adsorption of phosphate in anoxic marine sediments[J]. Limnology and Oceanography, 1980, 25(5): 797-806. DOI:10.4319/lo.1980.25.5.0797
(  0) 0) |
| [10] |
商少凌, 洪华生. 厦门西海域磷的研究[J]. 海洋环境科学, 1996, 15(1): 15-21. Shang S L, Hong H S. Study on phosphorus in Xiamen western Sea[J]. Marine Environmental Science, 1996, 15(1): 15-21. (  0) 0) |
| [11] |
Taillefert M, Luther G W, Nuzzio D B. The application of electrochemical tools for in situ measurement in aquatic systems[J]. Electroanalysis, 2015, 12(6): 401-412.
(  0) 0) |
| [12] |
Brendel P J, Luther G W. Development of a gold amalgam voltammetric microelectrode for the determination of dissolved Fe, Mn, O2, and S (-Ⅱ) in porewaters of marine and freshwater sediments[J]. Environmental Science&Technology, 1995, 29(3): 751-761.
(  0) 0) |
| [13] |
Luther G W, Brendel P J, Lewis B L, et al. Simultaneous measurement of O2, Mn, Fe, I- and S (-II) in marine pore waters with a solid-state voltammetric microelectrode[J]. Limnology and Oceanography, 1998, 43: 325-333. DOI:10.4319/lo.1998.43.2.0325
(  0) 0) |
| [14] |
Luther G W, Reimers C E, Nuzzio D B, et al. In situ deployment of voltammetric, potentiometric, and amperometric microelectrodes from a ROV to determine O2, Mn, Fe, I- and S (-2) and pH in porewaters[J]. Environmental Science&Technology, 1999, 33: 4352-4356.
(  0) 0) |
| [15] |
Xu K, Dexter S C, Luther G W. Voltammetric microelectrodes for biocorrosion studies[J]. Corrosion, 1998, 54: 814-823. DOI:10.5006/1.3284801
(  0) 0) |
| [16] |
司靖宇.金汞齐微电极的研制及其在测量海洋沉积物间隙水中DO、Mn2+和Fe2+的应用[D].福建: 厦门大学, 2008. Si J Y. Development of Hg-Au Microelectrodes for Measuring DO, Mn2+ and Fe2+ in Pore Water of Marine Sediments[D]. Fujian: Xiamen University, 2008. (  0) 0) |
| [17] |
Huang B, Ou L, Hong H, et al. Bioavailability of dissolved organic phosphorus compounds to typical harmful dinoflagellate Prorocentrum donghaiense Lu[J]. Marine Pollution Bulletin, 2005, 51: 838-844. DOI:10.1016/j.marpolbul.2005.02.035
(  0) 0) |
| [18] |
周玉萍.营养盐对东海赤潮优势藻竞争演替的影响[D].青岛: 中国海洋大学, 2015. Zhou Y P. The Influence of Nutrients on the Competition and Succession Between two Predominant Red Tide Algae of East China Sea[D]. Qingdao: Ocean University of China, 2015. (  0) 0) |
| [19] |
张晓辉, 胡建华, 周燕, 等. 赤潮预报和防治方法[J]. 河北渔业, 2006(3): 46-47. Zhang X H, Hu J H, Zhou Y, et al. Algal blooms prediction and control methods[J]. Hebei Fisheries, 2006(3): 46-47. DOI:10.3969/j.issn.1004-6755.2006.03.023 (  0) 0) |
| [20] |
国家质量技术监督局.海洋检测规范.第4部分, 海水分析[S].北京: 中国标准出版社, 2007. State Bureau of Quality and Technical Supervision. Marine Inspection Code. Part 4, Seawater Analysis[S]. Beijing: China Standard Press, 2007. (  0) 0) |
| [21] |
Luther G W, Madison A S. Determination of dissolved oxygen, hydrogen sulfide, Iron (II), and manganese (II) in wetland pore waters[M]//Methods in Biogeochemistry of Wetlands SSSA Bcok Series, No. 10, USA: [s.n.], 2013: 87-104.
(  0) 0) |
| [22] |
Aspila K I, Agemian H, Chau A S Y. A semi-automated method for the determination of inorganic, organic and total phosphate in sediments[J]. Analyst, 1976, 101(1200): 187-197. DOI:10.1039/an9760100187
(  0) 0) |
| [23] |
Ruttenberg K C. Development of a sequential extraction method for different forms of phosphorus in marine sediments[J]. Limnology and Oceanography, 1992, 37(7): 1460-1482. DOI:10.4319/lo.1992.37.7.1460
(  0) 0) |
| [24] |
朱媛媛, 刘素美. 胶州湾沉积物中各形态P的分布及其生物地球化学研究[J]. 海洋环境科学, 2010, 29(6): 785-789. Zhu Y Y, Liu S M. Study on distribution and biogeochemistry of various phosphorus forms in sediments of Jiaozhou Bay[J]. Marine Environmental Science, 2010, 29(6): 785-789. DOI:10.3969/j.issn.1007-6336.2010.06.003 (  0) 0) |
| [25] |
Conley D J, Humborg C, Rahm L, et al. Hypoxia in the Baltic Sea and basin-scale changes in phosphorus biogeochemistry[J]. Environmental Science and Technology, 2002, 36(24): 5315-5320. DOI:10.1021/es025763w
(  0) 0) |
| [26] |
Rozan T F, Taillefert M, Trouwborst R E, et al. Iron-sulfur-phosphorus cycling in the sediments of a shallow coastal bay:Implications for ediment nutrient release and benthic macroalgal blooms[J]. Limnology and Oceanography, 2002, 47(5): 1346-1354. DOI:10.4319/lo.2002.47.5.1346
(  0) 0) |
| [27] |
胡梅娟.藻华衰亡过程中湖泊氮、磷迁移转化过程及机理研究[D].重庆: 重庆大学, 2018. Hu H J. The Transport and Transformation of Nitrogen and Phosphorus During the Decomposition of Algae Bloom in Lakes: the Process and Mechanism Study[D]. Chongqing: Chongqing University, 2018. (  0) 0) |
| [28] |
吕昌伟, 孟婷婷, 张细燕, 等. 磷在不同类型湖泊沉积物上的吸附特征及形态再分布研究[J]. 农业环境科学学报, 2012, 31(2): 402-409. Lu C W, Meng T T, Zhang X Y, et al. Adsorption characters and form distribution of phosphorus in sediments from different type lakes[J]. Journal of Agro-environmental Science, 2012, 31(2): 402-409. (  0) 0) |
| [29] |
朱佳美, 曹晓燕, 刘素美, 等. 桑沟湾表层沉积物性质及对磷的吸附特征[J]. 环境科学, 2016, 37(2): 558-564. Zhu J M, Cao X Y, Liu S M, et al. Surface property and sorption characteristics of phosphorus onto surface sediments in Sanggou Bay[J]. Environmental Science, 2016, 37(2): 558-564. (  0) 0) |
| [30] |
曹文卿.东、黄海沉积物中磷的形态研究[D].青岛: 中国海洋大学, 2006. Cao W Q. A Study on the Speciation of Phosphorus in the Sediments of the East China Sea and the Yellow Sea[D]. Qingdao: Ocean University of China, 2006. (  0) 0) |
| [31] |
Wang S, Jin X, Zhao H, et al. Effects of organic matter on phosphorus release kinetics in different trophic lake sediments and application of transition state theory[J]. Journal of Oceanology and Limnology, 2011, 29(1): 53-62. DOI:10.1007/s00343-011-9047-4
(  0) 0) |
| [32] |
王圣瑞, 金相灿, 赵海超, 等. 沉水植物黑藻对上覆水中各形态磷浓度的影响[J]. 地球化学, 2006, 35(2): 179-186. Wang S R, Jin X C, Zhao H C, et al. Effect of submerged plantHydrilla verticillata on the concentrations of different phosphorus species in overlying water[J]. Geochemistry, 2006, 35(2): 179-186. DOI:10.3321/j.issn:0379-1726.2006.02.009 (  0) 0) |
| [33] |
Ingall E, Jahnke R. Evidence for enhanced phosphorus regeneration from sediments overlain by oxygen depleted waters[J]. Geochemica et Cosmochimia Acta, 1994, 58(11): 2571-2575. DOI:10.1016/0016-7037(94)90033-7
(  0) 0) |
2. Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education Institute for Advanced Ocean Study, Ocean University of China, Qingdao 266100, China;
3. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
 2020, Vol. 50
2020, Vol. 50


