2. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100
敌百虫是一种常用的广谱有机磷杀虫剂,化学名称为O, O-二甲基-(2, 2, 2-三氯-1-羟基乙基)膦酸酯,适用于水稻、麦类、蔬菜、果树等防治虫害[1],同时也可防治鱼病[2]。随着敌百虫的广泛应用,大量残留物在土壤、水体、食品等介质中被发现[3],不仅污染环境,而且对人类健康安全造成极大威胁。敌百虫基本结构中的磷酸基团可与动物乙酰胆碱酯酶活性位点上的谷氨酸发生磷酸化反应,抑制其活性,造成乙酰胆碱过量堆积而过度刺激效应器官,导致动物抽搐、昏迷、呼吸困难、直至死亡[4-5]。长期接触敌百虫,会对人体产生神经毒性[6],干扰人类内分泌系统;另外,敌百虫在水体介质中可以通过自发的脱氯化氢生成毒性更高的敌敌畏,它是更有效的胆碱酯酶抑制剂和神经性疾病诱导剂[7]。因此,有必要了解敌百虫在环境中的自发降解转化特性,以便开发有效的方法来治理敌百虫污染。
农药进入环境后会受到各种环境因素的影响,经过生物降解和非生物降解作用逐渐稳定或者去除。有机磷农药大多数品种为磷酸酯类或硫代磷酸酯类化合物[8],可以在酸性和碱性条件下发生水解。肖乾芬等[9]研究发现三唑磷在常温下可水解,且受温度、pH影响较大;Athanasopoulos等[10]发现相对湿度对甲基谷硫磷的降解速度影响较大,提出其降解途径主要为水解;Araújo等[11]进行光解实验时发现,避光条件下水解反应可降解湖水中32%的甲基对硫磷;Liu等[12]报告毒死蜱在河流中的水解半衰期从24 d到126 d不等,水解受环境因素影响较大。农药在水环境中的自发降解是农药非生物降解的一个重要方面,其不仅影响农药在环境中的归趋,也是评价农药在环境中的持久性及毒性的一个重要指标[13]。另外,水解作用是农药与水之间重要的化学反应,通过反应母体化合物结构发生改变,同时在反应过程中可产生一个或多个中间体,产物毒性发生变化,如在常温、碱性条件下,对硫磷可水解产生对硝基酚(p-NP)[14],毒性高,难以生物降解,是优先控制污染物。因此,研究有机磷农药在水体中的水化学降解,对于了解其在环境中的归趋及其生态毒理效应具有重要的意义,同时为控制和治理农药残留污染提供科学依据。目前,国内外有机磷农药水解研究主要涉及硫代磷酸酯类及相关衍生物[9, 15],磷酸酯类方面的研究较少,而敌百虫作为磷酸酯类的一种,其水解研究更是鲜有报道。本文研究了不同pH、温度对水体中敌百虫水解的影响,并通过检测鉴定水解产物,深入探讨其水解机理。
1 材料与方法 1.1 实验材料 1.1.1 试剂敌百虫标准品(纯度99%,购于德国Dr. Ehenstorfer公司),重水(纯度99.9%,购于Macklin公司),乙腈(色谱纯),超纯水;硼酸、盐酸、磷酸、柠檬酸、柠檬酸钠、柠檬酸氢二钠、氯化钾、氢氧化钠、磷酸二氢钾等(均为分析纯)
1.1.2 溶液配制用超纯水配制不同pH的缓冲溶液,具体配方和pH值见表 1。
|
|
表 1 不同缓冲液的配置 Table 1 Components ofvarious buffer solutions |
将上述pH缓冲液与相关玻璃容器在高温蒸汽灭菌锅中灭菌1 h,灭菌后用0.1 mol/L HCl或0.1 mol/L NaOH校正pH值,贮于棕色瓶中备用。
用色谱纯乙腈配制10 g/L的敌百虫标准母液10 mL备用,再用超纯水依次稀释配制500、200、100、50、20和10 mg/L的标准溶液,现配现用;用上述不同pH值的缓冲液配制100 mg/L的敌百虫溶液,现配现用。
1.2 实验设计 1.2.1 pH对敌百虫水解的影响取上述5种pH缓冲溶液配制的100 mg/L敌百虫溶液,各吸取50 mL分别加入到100 mL具塞锥形瓶中,将锥形瓶置于25 ℃恒温水浴装置中,每组3个平行,定期取样测定各缓冲液中敌百虫残留浓度。具体取样时间如下:pH=5和pH=6条件下1 d取样1次;pH=7条件下间隔6 h取样1次;pH=8条件下间隔0.5 h取样一次;pH=9条件下间隔2 min取样1次。整个水解试验避光,并保持容器密闭。
1.2.2 温度对敌百虫水解的影响取pH值为6、7、8的缓冲溶液配制的100 mg/L敌百虫溶液,各吸取50 mL分别加入到100 mL具塞锥形瓶中,将锥形瓶置于25、35、45和55 ℃恒温水浴中,每组3个平行,定期取样测定敌百虫残留浓度。具体取样安排如下:pH=6的敌百虫溶液在25、35、45和55 ℃条件下取样间隔时间分别为24、12、6和2 h;pH=7的敌百虫溶液不同温度下取样间隔时间分别为6、3、2和0.5 h;pH=8的敌百虫溶液不同温度下取样间隔时间分别为30、10、10和3 min。整个水解试验避光,并保持容器密闭。
1.2.3 敌百虫水解机理由于液相31P核磁共振(31P-NMR)技术检测限较高,为获得良好检测结果,取10 g/L的敌百虫标准母液,分别用pH值为5、6、7的缓冲溶液稀释敌百虫浓度至1 000 mg/L,各吸取5 mL分别加入到10 mL具塞试管中,置于25 ℃恒温水浴,反应1 d后,取0.5 mL溶液加入样品管,后加入0.5 mL重水(用于检测过程中锁场),涡旋混匀,转移至10 mm标准核磁管中,待测。
取上述反应1 d后的敌百虫溶液各1 mL,用超纯水稀释10倍后,立即加入20 mL二氯甲烷在旋转振荡器中萃取1 h,静置分层后,将上清液转移至新的离心管中,剩余物用无水硫酸钠脱水,氮气吹干,将干燥残留物溶于1 mL甲醇,待GC-MS分析[16]。
1.3 分析方法 1.3.1 敌百虫浓度的测定采用高效液相色谱法(HPLC)测定敌百虫的浓度,测定参考中华人民共和国国家标准《GB/T 334—2001敌百虫原药》[17],并进行适当调整。使用配备紫外检测器的高效液相色谱(HPLC,Agilent 1260,美国),色谱柱为Zorbax SB-C18色谱柱(4.6 mm×150 mm,5 μm)。选择乙腈+水(乙腈∶水=13∶87)作为流动相,其中水需要用磷酸调整pH=3;流速为1 mL/min;柱温为30 ℃;检测波长200 nm;进样体积为5 μL。
按照上述方法,对10、20、50、100、200和500 mg/L敌百虫标准溶液进行HPLC检测,结果以敌百虫浓度为纵坐标、峰面积为横坐标绘制标准曲线,得到标准曲线y=2.023 5x,相关系数R2=0.999 9,后续实验使用外标法测定溶液中敌百虫浓度。
1.3.2 敌百虫水解产物31P-NMR分析液相31P核磁共振(31P-NMR)可以根据振动频率的不同分析磷化合物形态[18],本实验使用配备10 mm液相宽带BBO探头的AVANCE Ⅲ 500 MHz核磁共振波谱仪(Bruker,瑞士),测定敌百虫水解产物中含P物质的化学结构。具体实验条件如下:31P的共振频率为161.9 MHz,扫描440~2 840次,测定温度为24 ℃,所有31P化学位移参比85%的正磷酸,使用90°脉冲采集光谱,采集时间为0.328 s,10 s弛豫延迟时间[19]。
1.3.3 敌百虫水解产物GC-MS分析使用配备HP-5MS(30 m×0.25 mm,0.25 μm)色谱柱的气相色谱-质谱(GC-MS,Agilent 8890b-5977,美国)联用仪鉴定水解产物。GC-MS操作条件如下:进样器和传输线温度分别为250和280 ℃;氦气(99.999%纯度)以1 mL/min的恒定流速用作载气;色谱柱在50 ℃下保持2 min,以15 ℃/min升温至260 ℃,并在260 ℃下保持5 min;离子源温度为230 ℃,电离能为70 eV;溶剂切除时间设置为3 min;进样量1 μL,不分流进样[20]。
1.4 数据处理使用Origin 2018、MestReNova 14等相关软件进行数据处理与分析。
2 结果与讨论 2.1 pH对敌百虫水解的影响如图 1所示,敌百虫在不同pH缓冲液中水解存在一定差异。如图 1(a)所示,在pH=5的缓冲液中,在360 h的反应时间下,敌百虫浓度几乎不变化(水解率 < 1%),所以当溶液pH=5时,敌百虫几乎不水解。当溶液pH值为6、7、8、9时,随着pH值的增加,敌百虫水解速度越来越快,将敌百虫残留量与水解时间作动力学方程拟合,发现其水解符合一级动力学方程,拟合度均高于90%。如表 2所示,在pH=6条件下,敌百虫水解速率为0.002 3,半衰期为301 h,水解速度缓慢,结合在pH=5条件下敌百虫几乎不水解的情况,可以得出敌百虫在酸性(pH < 6)条件下比较稳定,不易发生水解,且酸性越强越稳定;在中性(pH=7)溶液中,敌百虫水解速度明显加快,半衰期为31 h左右;在pH=8、9条件下,水解速率分别为0.38、8.99,半衰期为1.82、0.08 h,敌百虫的水解速率远高于酸性和中性条件。其中在pH=9的缓冲溶液中,仅需约1 h敌百虫即可水解完全,水解率超过99%。此结果符合大部分有机磷农药在pH值位于1~5的水溶液中较稳定但在碱性条件下水解速率大幅上升的规律[21],且pH=7~9条件下每增加一个单位pH值,敌百虫水解速率增加超10倍。同时,验证了陈烨等[22]提及的敌百虫的特性,即pH>6条件下,敌百虫水解反应进行的更快。另外,此研究表明,碱性条件下敌百虫水解速度不仅远远高于其他类农药如氟虫腈和氟乐灵,也远高于同类农药苯胺磷[23]。
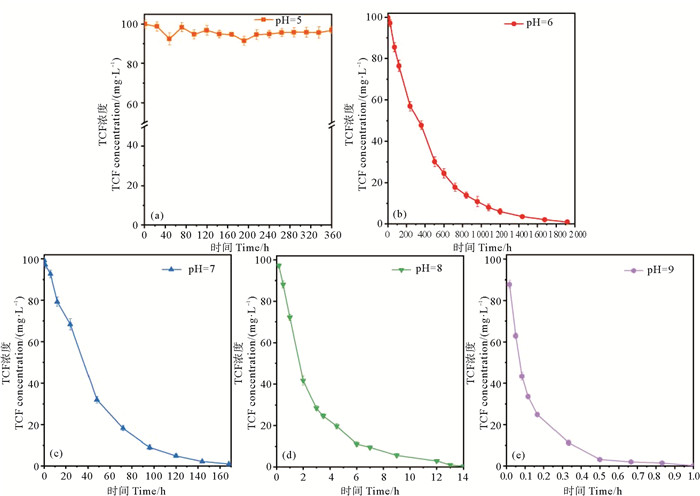
|
图 1 敌百虫在25 ℃不同pH缓冲溶液中的水解曲线 Fig. 1 Hydrolysis curve of trichlorfon in different pH buffer solutions at 25 ℃ |
|
|
表 2 敌百虫在25 ℃不同pH缓冲溶液中的水解动力学参数 Table 2 Hydrolysis kinetic parameters of trichlorfon at 25 ℃ and various pH |
由于敌百虫在pH=5条件下几乎不水解、在pH=9条件下水解速度过快不易取样检测,所以在探究不同温度对敌百虫水解的影响时,选择pH值为6、7、8的敌百虫溶液,在不同温度(25、35、45和55 ℃)下,定期取样检测。如表 3所示,敌百虫溶液在不同温度下的水解符合一级动力学规律,拟合度均大于99%,敌百虫的水解速度随着温度增加而增大。在pH=6条件下,敌百虫在25、35、45和55 ℃下的半衰期分别为300、91.2、19.67和6.15 h;pH=7时,不同温度下半衰期分别为30.72、9.54、2.49和0.88 h;pH=8时,不同温度下半衰期分别为1.82、0.8、0.38和0.15 h。由于有机化合物包括农药的水解属于热反应,其反应的活化能主要来源于分子间的碰撞,所以温度对敌百虫的水解速率有显著影响,即体系温度越高,化合物水解越快。通常用温度效应系数Q来反应水解速率常数与温度的关系。如表 3所示,在pH=6、7、8的条件下,温度每升高10 ℃,水解速率增加2.11~4.63倍,基本符合范特霍夫(van’t Hof)规则,即温度每上升10 ℃,反应速率提高2~4倍。该结果与农药病氰硝[24]的温度效应系数相近,高于硫肟醚[25]的温度效应系数。
|
|
表 3 敌百虫溶液在不同温度下的水解动力学参数 Table 3 Hydrolysis kinetic parameters of trichlorfon at different temperatures |
将表 3中水解速率常数(lnk)与反应温度(1/T)进行分析,如图 2所示,在pH=6条件下,水解速率常数与温度的关系为:lnk=-12 890.6/T+37.12;在pH=7条件下,关系为:lnk=-11 743.3/T+35.58;在pH=8条件下,关系为:lnk=-8 090.9/T+26.14,拟合度均大于99%,说明敌百虫溶液在不同温度下的水解反应符合阿伦尼乌斯(Arrhenius)公式(见式(1)),两边取对数得到式2,其斜率等于-Ea/R,截距为lnA。
| $ k=\mathrm{A} \cdot \mathrm{e}^{E \mathrm{a} / R T}, $ | (1) |
| $ \ln k=\ln \mathrm{A}-E \mathrm{a} / R T 。$ | (2) |
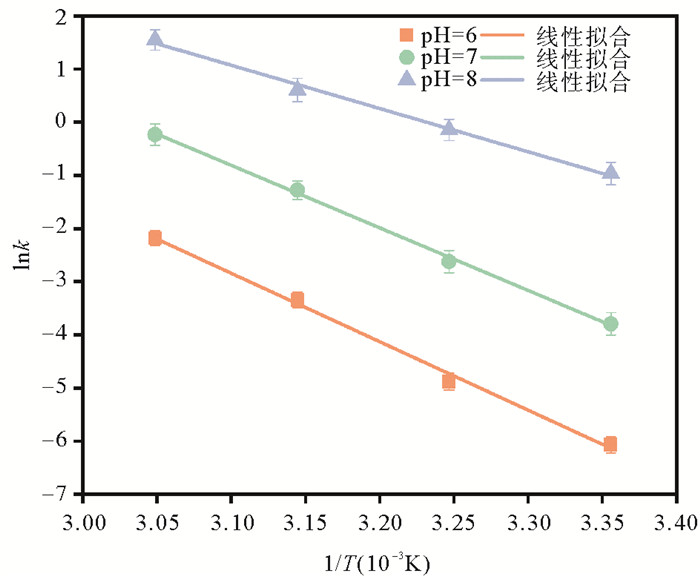
|
图 2 水解速率常数k与反应温度T的关系 Fig. 2 Relationship between hydrolysis rate constant k and reaction temperature T |
在不同温度下,影响水解反应速率的因素主要是活化能Ea和活化焓ΔH。水解反应活化焓ΔH可由公式3通过活化能Ea求出;由于频率因子A与化合物的活化熵ΔS之间有明显的相关性,活化熵ΔS可由公式4求出:
| $ \Delta H=E \mathrm{a}-R T, $ | (3) |
| $ \Delta S=R\left(\ln \mathrm{A}-k_B T / h\right) 。$ | (4) |
式中:R为气体常数(8.314 J/(K·mol));A为频率因子,是一常数;kB为玻耳兹曼常数(6.73×10-35 J/K);h为普朗克常量(6.625×10-34 J·S)。
不同温度条件下,敌百虫水解反应的相关热力学参数见表 4。活化能是基态反应物分子与过渡态之间的能量差,决定反应发生的快慢程度。由图 2可知,敌百虫水解反应的活化能与温度之间无明显相关性。在pH为6、7、8的条件下,敌百虫活化能分别是107.17、97.63、67.27 kJ/mol,参照赵华等[26]的标准,即活化能小于33.49 kJ/mol的化合物在常温下易水解,大于167.5 kJ/mol的化合物则不易水解,敌百虫水解能力属于中等,且随着pH增加越来越容易水解。敌百虫在不同pH条件下,其水解反应的活化焓与活化熵均随着温度的增加而减少,并表现出显著的相关性。活化焓越小,化合物反应的能垒越小,水解反应越容易进行;活化熵用来度量系统的混乱程度,pH=8的条件下,敌百虫水解反应的活化熵小于0,说明反应物分子比活化复合体分子具有更多的自由度,活化中化合物由松弛结构变为刚性结构[27]。
|
|
表 4 敌百虫水解反应的热力学特征 Table 4 Thermodynamic characteristics of trichlorfon hydrolysis |
核磁共振磷谱(31P-NMR)不仅可以分析不同环境中磷的组成及形态特征[28-29],也被用于分析有机磷农药中有效成分及水解、降解等产物[30-31]。将反应1 d后的不同条件下(pH=5、6、7)敌百虫溶液进行31P-NMR检测,得到相关谱图(见图 3)。
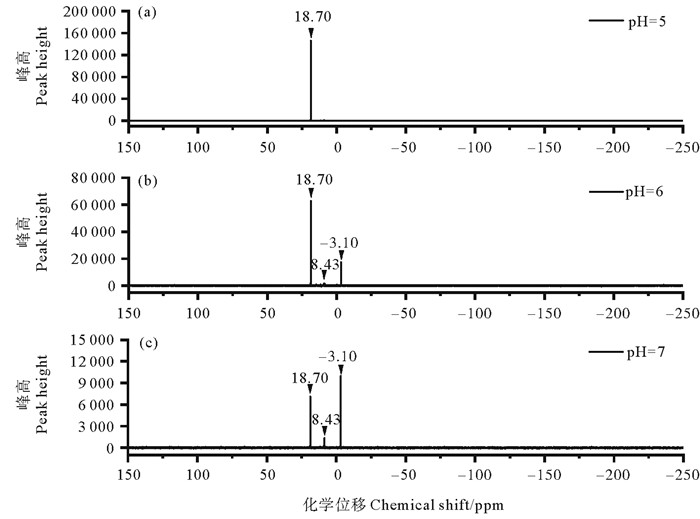
|
图 3 不同pH敌百虫溶液的31P-NMR谱图 Fig. 3 31P-NMR spectra of trichlorfon solutions with different pH |
由图 3(a)可知,在pH=5的敌百虫缓冲液中,只有在18.70 ppm处有一个明显的单峰信号,与Zahra等[19]检测的敌百虫信号位于18.95 ppm处相接近,说明在pH=5的条件下,敌百虫几乎不水解,与2.2所述结果相一致。由图 3(b)、(c)可知,敌百虫在pH=6、7的条件下主要水解产生两种含磷化合物,分别位于8.43、-3.10 ppm处。-3.10 ppm与Zahra等[13]检测的-2.80 ppm信号峰相接近,所以此峰为敌敌畏,且随着pH的增加,水解产生的敌敌畏在体系中占比增大。而位于8.43 ppm处的信号峰,是一种新的化合物,未被鉴别。由于磷酸一甲酯在31P-NMR图谱上的位置受pH影响较大,现有研究发现其位于2.6~5.6 ppm之间[32],所以推断8.43 ppm处化合物与磷酸一甲酯结构有类似,结合后续水解产物GC-MS分析,推断位于8.43 ppm处的物质为亚磷酸二甲酯。通过峰高变化发现,随着pH的增加,亚磷酸二甲酯占比也增大。与色谱法相比,31P-NMR技术可以一次同时分析多种含磷化合物,避免了萃取回收、化学衍生化等复杂处理,同时也适合一些热不稳定或极性太强的含磷物质检测,但与气相色谱(GC)或液相色谱(LC)相比灵敏度较低,需要物质浓度水平较高,两者结合分析适用范围更广。
2.4.2 GC-MS分析不同条件(pH=6、7)下的敌百虫溶液,经萃取浓缩,后进行GC-MS分离鉴定。根据MS图谱的碎片质量、丰度以及母体化合物的结构特点,结合NIST20.L图谱数据库推断敌百虫主要水解产物的分子结构,具体鉴定结果见表 5。由于敌百虫稳定性差,遇热易分解,可能因进样口温度过高导致敌百虫分解,所以本实验在后续GC-MS结果图谱分析中未找到其对应峰。
|
|
表 5 敌百虫在缓冲液中主要水解产物 Table 5 The main hydrolytic products of trichlorfon in buffer |
结合表 5中水解产物的结构分子,对敌百虫(Trichlorfon)可能的水解机理进行推测,结果见图 4。敌百虫在缓冲溶液中的水化学降解主要涉及2种途径。一是重排反应,敌百虫在水介质(pH=6~8)中发生重排转化成毒性更大的敌敌畏(Dichlorvos)[33]。通过31P-NMR分析发现,水解产物中敌敌畏占比较大,因此其是主要水解途径。首先,敌百虫与水分子或氢氧化物反应生成敌百虫醇盐,该中间体的醇盐部分带负电会攻击磷酰基中带正电荷的磷原子,产生一种三元环中间体,中间体开环后消除一个氯离子,生成敌敌畏[34]。此途径水解生成的敌敌畏毒性更高,提高了敌百虫的杀虫能力,有利于控制病虫害,提高作物产量;但另一方面,水解产物敌敌畏更低的半致死浓度导致使用敌百虫时对人体的危害增加,喷洒后农药残留也会对环境及各种非目标害虫生物产生更大的危害。因此,在农业活动中,我们应注意敌百虫的使用条件,尽量用偏酸性水溶解,在作业现场现配现用,尽可能减少或减缓敌敌畏的生成,保护生态环境及人类健康;在环境保护研究中,不应只聚焦敌百虫本身的降解治理,容易生成且毒性更强的敌敌畏的关注不可或缺。
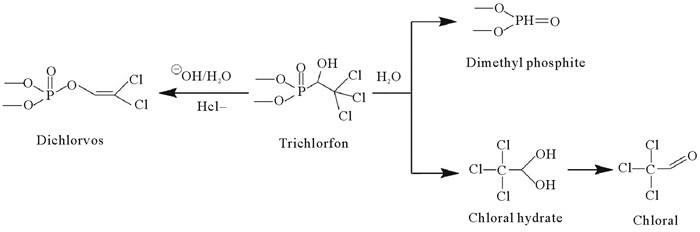
|
( pH=6、7 ) 图 4 敌百虫在缓冲溶液中的水解路径 Fig. 4 The hydrolysis paths of trichlorfon in buffer solution |
二是亲核取代反应。敌百虫O=P—C键上氧原子质子化,水分子进攻碳原子,P—C键断裂,生成亚磷酸二甲酯(Dimethyl phosphite)和水合氯醛(Chloral hydrate),水合氯醛也可脱水生成三氯乙醛(Chloral),这与我们GC-MS检测产物相一致。此途径与大部分有机磷农药水解模式相似,即水分子或氢氧化物作为亲核基团根据反应条件对磷原子或碳原子或两者都攻击而发生水解[35]。此途径发生化学键断裂,水解生成一些结构更简单的物质,敌百虫的毒性减小,可以为治理或修复敌百虫残留污染提供科学依据;同时,也在提醒我们在进行敌百虫降解研究时,不应忽略敌百虫本身水解所发挥的作用。
3 结语敌百虫的水解受水环境pH影响较大。敌百虫在pH=5条件下几乎不水解;在pH=6条件下水解速度较慢;在中性及碱性(pH=7~9)条件下水解速度明显加快。
敌百虫水解反应的活化焓与活化熵随着温度升高而降低,水解速度随着温度上升而提高,温度效应系数Q为2.11~4.63,基本符合范特霍夫(van’t Hof)规则。
经过31P-NMR分析、GC-MS分析,发现敌百虫在水溶液中的水解途径涉及到重排反应和亲核取代反应,其中重排反应是主要水解途径,其产物敌敌畏在水解体系中占比较大;而亲核取代反应途径的水解产物为亚磷酸二甲酯、水合氯醛、三氯乙醛等,占比较小。
本文详细解析了有机磷农药敌百虫的水解特性和水解途径,发现温度、pH显著影响敌百虫的自发水解,可用于指导农业活动中敌百虫的科学使用,减少毒性更强的敌敌畏的产生,保护环境与人类健康;另一方面,敌百虫可自发水解,在敌百虫生物降解研究中不可忽略其自身水解作用,需调整研究策略与方法,科学表征生物降解的作用与效果。
| [1] |
Li C, Chi K, Yu H, et al. Degradation, migration, and removal of trichlorfon on harvested apples during storage at room temperature[J]. Food Chemistry, 2022, 381: 132243. DOI:10.1016/j.foodchem.2022.132243 (  0) 0) |
| [2] |
Da Cruz M G, Jerônimo G T, Dos Santos Torres G, et al. Acute toxicity of trichlorfon and histological changes in the gills of Arapaima gigas, a neotropical fish from Amazon[J]. Aquaculture Reports, 2022, 25: 101229. DOI:10.1016/j.aqrep.2022.101229 (  0) 0) |
| [3] |
熊锋, 黄洁雯, 苏龙, 等. 敌百虫在胡萝卜田样品中的残留分析方法及消解动态[J]. 农药, 2018, 57(3): 204-206, 221. Xiong F, Huang J W, Su L, et al. Residue analysis method and degradation dynamics of trichlorfon in carrot and soil[J]. Agrochemicals, 2018, 57(3): 204-206, 221. DOI:10.16820/j.cnki.1006-0413.2018.03.014 (  0) 0) |
| [4] |
Casida J E, Quistad G B. Serine hydrolase targets of organophosphorus toxicants[J]. Chemico-Biological Interactions, 2005, 157-158: 277-283. DOI:10.1016/j.cbi.2005.10.036 (  0) 0) |
| [5] |
Hulse E J, Haslam J D, Emmett S R, et al. Organophosphorus nerve agent poisoning: managing the poisoned patient[J]. British Journal of Anaesthesia, 2019, 123(4): 457-463. DOI:10.1016/j.bja.2019.04.061 (  0) 0) |
| [6] |
Wang X, Chang X, Zhao L, et al. Trichlorfon exposure in common carp (Cyprinus carpio L.) leads to oxidative stress, neurotoxicity, and immune responses[J]. Aquaculture, 2022, 548: 737681. DOI:10.1016/j.aquaculture.2021.737681 (  0) 0) |
| [7] |
Li W, Ma Y, Li L, et al. The dissipation rates of trichlorfon and its degradation product dichlorvos in cabbage and soil[J]. Chemosphere, 2011, 82(6): 829-833. DOI:10.1016/j.chemosphere.2010.11.027 (  0) 0) |
| [8] |
钟宁, 曾清如, 姜洁凌, 等. 有机磷农药的降解及其研究进展[J]. 现代农药, 2005, 4(6): 1-6. Zhong N, Zeng Q R, Jiang J L, et al. Advance of studies on the technology of biodegradation and photodegradation of organophosphorus pesticide[J]. Modern Agrochemicals, 2005, 4(6): 1-6. (  0) 0) |
| [9] |
肖乾芬, 王晓栋, 魏忠波, 等. 三唑磷农药水解动力学研究[J]. 农药, 2005, 44(8): 356-358. Xiao Q F, Wang X D, Wei Z B, et al. Hydrolysis kinetics of the pesticide triazophos[J]. Chinese Journal of Pesticides, 2005, 44(8): 356-358. DOI:10.16820/j.cnki.1006-0413.2005.08.005 (  0) 0) |
| [10] |
Athanasopoulos P E, Kyriakidis N V, Stavropoulos P. A study on the environmental degradation of pesticides azinphos methyl and parathion methyl[J]. Journal of Environmental Science and Health. Part B, Pesticides, Food Contaminants, and Agricultural Wastes, 2004, 39(2): 297-309. (  0) 0) |
| [11] |
Araújo T M, Campos M N N, Canela M C. Studying the photochemical fate of methyl parathion in natural waters under tropical conditions[J]. International Journal of Environmental Analytical Chemistry, 2007, 87(13-14): 937-947. DOI:10.1080/03067310701523471 (  0) 0) |
| [12] |
Liu B, McConnell L L, Torrents A. Hydrolysis of chlorpyrifos in natural waters of the Chesapeake Bay[J]. Chemosphere, 2001, 44(6): 1315-1323. DOI:10.1016/S0045-6535(00)00506-3 (  0) 0) |
| [13] |
欧晓明. 农药在环境中的水解机理及其影响因子研究进展[J]. 生态环境, 2006, 15(6): 1352-1359. Ou X M. Hydrolysis and its influencing factors of pesticides in environment: a review[J]. Ecology and Environment, 2006, 15(6): 1352-1359. (  0) 0) |
| [14] |
Wanamaker E C, Chingas G C, McDougal O M. Parathion hydrolysis revisited: in situ aqueous kinetics by 1H NMR[J]. Environmental Science & Technology, 2013, 47(16): 9267-9273. (  0) 0) |
| [15] |
Chen R, Zhang L, Luo X, et al. Aminolysis and hydrolysis of an organophosphorus pesticide: A theoretical insight into the reaction mechanism for thio methyl parathion[J]. Computational and Theoretical Chemistry, 2021, 1203: 113348. DOI:10.1016/j.comptc.2021.113348 (  0) 0) |
| [16] |
Tian J, Dong Q, Yu C, et al. Biodegradation of the organophosphate trichlorfon and its major degradation products by a novel aspergillus sydowii PA F-2[J]. Journal of Agricultural and Food Chemistry, 2016, 64(21): 4280-4287. DOI:10.1021/acs.jafc.6b00909 (  0) 0) |
| [17] |
中华人民共和国国家质量检验检疫总局. GB/T 334-2001敌百虫原药[S]. 中国: 中国标准出版社, 2001. General Administration of Quality Superison, Inspection and Quarantine of the People's Republic of China. GB/T 334-2001 Trichlorfon technical[S]. China: China Standards Press, 2001. (  0) 0) |
| [18] |
Reitzel K, Ahlgren J, DeBrabandere H, et al. Degradation rates of organic phosphorus in lake sediment[J]. Biogeochemistry, 2007, 82(1): 15-28. DOI:10.1007/s10533-006-9049-z (  0) 0) |
| [19] |
Talebpour Z, Ghassempour A, Zendehzaban M, et al. Monitoring of the insecticide trichlorfon by phosphorus-31 nuclear magnetic resonance (31P NMR) spectroscopy[J]. Analytica Chimica Acta, 2006, 576(2): 290-296. DOI:10.1016/j.aca.2006.06.014 (  0) 0) |
| [20] |
Jiang K, Zhang N, Zhang H, et al. Investigation on the gas-phase decomposition of trichlorfon by GC-MS and theoretical calculation[J]. Plos One, 2015, 10(4): 121389. (  0) 0) |
| [21] |
苏寿承. 有机磷农药的分子结构和化学性质[J]. 浙江林学院学报, 1988(3): 79-88. Su S C. The molecular structure and chemical properties of organophosphorus pesticides[J]. Journal of Zhejiang Forestry University, 1988(3): 79-88. (  0) 0) |
| [22] |
陈烨, 许秀艳, 王超, 等. 地表水中敌百虫测定技术难点探讨[J]. 中国环境监测, 2015, 31(2): 108-113. Chen Y, Xu X Y, Wang C, et al. Discussions about analysis difficulties of determination of trichlorfon in surface water[J]. Environmental Monitoring in China, 2015, 31(2): 108-113. (  0) 0) |
| [23] |
Ramesh A, Balasubramanian M. Kinetics and hydrolysis of fenamiphos, fipronil, and trifluralin in aqueous buffer solutions[J]. Journal of Agricultural and Food Chemistry, 1999, 47(8): 3367-3371. DOI:10.1021/jf980885m (  0) 0) |
| [24] |
佘苓坤, 胡德禹, 张钰萍, 等. 候选农药病氰硝水解和光解的特性[J]. 农药, 2012, 51(8): 575-577, 583. She L K, Hu D Y, Zhang Y P, et al. The hydrolysis and photolysis of candidate pesticide GU188[J]. Agrochemicals, 2012, 51(8): 575-577, 583. (  0) 0) |
| [25] |
欧晓明, 雷满香, 裴晖, 等. 新农药硫肟醚的水解研究[J]. 农业环境科学学报, 2007, 26(6): 2309-2315. Ou X M, Lei M X, Pei H, et al. Hydrolysis of novel insecticide sulfoxime in buffered solutions[J]. Journal of Agro-Environment Science, 2007, 26(6): 2309-2315. DOI:10.3321/j.issn:1672-2043.2007.06.055 (  0) 0) |
| [26] |
赵华, 徐浩, 叶兴祥. 甲胺磷等3种农药的水解研究[J]. 农药科学与管理, 2004, 25(10): 7-10. Zhao H, Xu H, Ye X X. Study on hydrolysis of methamidophos, triazophos and buprofezin[J]. Pesticide Science and Administration, 2004, 25(10): 7-10. (  0) 0) |
| [27] |
林智信, 安从俊, 刘义, 等. 物理化学[M]. 武汉: 武汉大学出版社, 2003: 1-85. Lin Z X, An C J, Liu Y, et al. Physical Chemistry[M]. Wuhan: Wuhan University Press, 2003: 1-85. (  0) 0) |
| [28] |
丰茹江, 李思敏, 张文强, 等. 基于液相31P核磁共振技术的不同地理区域湖泊沉积物生物质磷(Biogenic-P)形态特征研究[J]. 环境科学学报, 2019, 39(5): 1590-1598. Feng R J, Li S M, Zhang W Q, et al. Morphological characteristics of Biomass phosphorus (Biogenic-P) in lake sediments in different geographic regions based on liquid 31P nuclear magnetic resonance spectroscopy[J]. Acta Scientiae Circumstantiae, 2019, 39(5): 1590-1598. (  0) 0) |
| [29] |
管宏友, 张思兰, 郭涛. 基于31P核磁共振分析的植物体内磷分级研究[J]. 中国土壤与肥料, 2017(3): 15-19. Guan H Y, Zhang S L, Guo T. Characterization of plant derived phosphorus with phosphorus-31 nuclear magnetic resonance study[J]. Soil and Fertilizer Sciences in China, 2017(3): 15-19. (  0) 0) |
| [30] |
Hong F, Pehkonen S O, Brooks E. Pathways for the hydrolysis of phorate: product studies by 31P NMR and GC-MS[J]. Journal of Agricultural and Food Chemistry, 2000, 48(7): 3013-3017. (  0) 0) |
| [31] |
卢爱民, 陈敏, 徐江艳, 等. 核磁共振磷谱(31P-NMR)测定草铵膦原药中的有效成分[J]. 农药, 2018, 57(1): 26-28. Lu A M, Chen M, Xu J Y, et al. Determination of the effective content in glufosinate TC by Phosphorus-31 nuclear magnetic resonance (31P-NMR) spectroscopy[J]. Agrochemicals, 2018, 57(1): 26-28. (  0) 0) |
| [32] |
Benoit-Marquié F, de Montety C, Gilard V, et al. Dichlorvos degradation studied by 31P-NMR[J]. Environmental Chemistry Letters, 2004, 2(2): 93-97. (  0) 0) |
| [33] |
Janzen A F, Smyrl T G. Mechanism of alcohol to ester rearrangement in phosphorus compounds[J]. Canadian Journal of Chemistry, 1972, 50: 1205-1210. (  0) 0) |
| [34] |
Dust I M, Warren C S. Kinetics and Activation Parameters for the Alkaline Aqueous Rearrangement of Trichorfon[O, O-Dimethyl-(2, 2, 2-Trichloro-1-Hydroxyethyl) Phosphonate] to Dichlorvos[O, O-Dimethyl-O- (2, 2-Dichloroethenyl)Phosphate[J]. Water Quality Research Journal of Canada, 2001, 36(3): 589-604. (  0) 0) |
| [35] |
Balakrishnan V K, Dust J M, VanLoon G W, et al. Mechanism of abiotic degradation and soil-water interactions of pesticides and other hydrophobic organic compounds part 4-catalytic pathways in the catalytic pathways in the ethanolysis of fenitrothion, an organophosphorothioate pesticide[J]. Canadian Journal of Chemistry, 2001, 79(2): 157-173. (  0) 0) |
2. Laboratory of Marine Environmental Science and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China
 2023, Vol. 53
2023, Vol. 53


