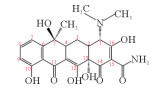
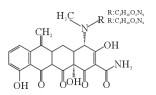
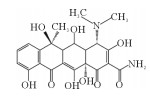
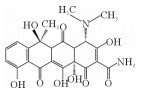
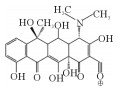
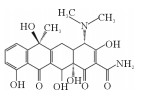
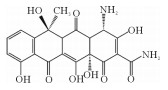
2. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100
抗生素因其成本低、使用便捷和疗效显著等优点,在预防和治疗水产细菌性传染病方面发挥着重要作用[1]。抗生素作为食物颗粒中的添加剂投入到养殖环境中,只有25%~75%可以被动物肠道所吸收,其余则通过粪便和尿液以母体化合物或代谢物的形式排泄,会对生态系统和人类健康造成不利影响。其中,四环素类抗生素因其低生产价格、高质量和高纯度,在水产养殖业和畜牧业被广泛使用,是世界上第二常用的抗生素[2]。在海水养殖区水域四环素类抗生素被频繁检出。Han等[3]对黄海沿岸海水养殖区中抗生素分布情况进行调查,一共检出15种抗生素,其中土霉素和多西环素的检出率较高(>60%),土霉素最高达到了42.63 ng·L-1。不同海水养殖区的四环素浓度差异很大,Na等[4]发现四环素是中国大连海水养殖场中的主要抗生素(范围:2.11~9.23 ng·L-1);而Chen等[5]在调查海陵岛海水养殖区抗生素分布情况时发现在虾幼体池塘氧四环素(Oxytetracycline,OTC)和TC的最高浓度分别是15 163和2 305 ng·L-1,这两种抗生素被广泛用于对虾养殖场,以预防细菌性疾病。四环素类抗生素在自然环境中难以被生物降解,且降解的中间产物可能具有更大的生物毒性,尽管目前在海水养殖废水中检测到的四环素浓度低,但低浓度的四环素已经具有抑菌作用,导致抗生素抗性基因的出现。因此,迫切需要研究一种从海水养殖废水中去除四环素的有效方法。
通常,四环素的处理技术主要包括吸附[6]、膜分离[7]、高级氧化[8]和微生物降解[9]。物理法操作简单,但其仅对抗生素进行了相的转移,治标不治本;高级氧化技术虽然能高效降解环境中的抗生素,但存在能耗和处理成本高等问题,难以应用于实际工程。生物处理技术则相对成熟,是目前处理抗生素的主体工艺,但存在抗生素抗性基因过量表达的风险,而酶降解技术因其反应温和,氧化污染物能力强受到了广泛关注,它既拥有生物处理技术的优点,也不必担心抗生素抗性基因的出现。漆酶(EC 1.10.3.2)是一种具有高催化活性和高特异性的含铜多酚氧化酶[10],具有良好的底物专一性及稳定性,可以催化酚类、芳胺类、羧酸及其他富含电子底物的单电子氧化,且产生无毒害物质,被广泛应用于农药降解[11]、印染脱色[12]、石油烃去除[13]、环境修复[14]等领域。然而,漆酶的构象结构容易受环境条件的变化而扭曲,损害其酶活性[15],再加上游离漆酶无法回收利用,其低稳定性和高生产成本限制了它的实际应用。
酶固定化是解决这一问题的有效手段,酶固定化是指通过物理或化学手段,将游离酶负载到载体材料上形成具有催化活性并能连续反应和使用的酶制剂[16]。因此本研究选择海藻酸钠、聚乙烯醇、明胶结合形成复合载体,使用活性炭吸附漆酶,采用吸附+包埋的方式制备固定化漆酶,研究固定化酶和游离漆酶的酶学性质,氧化还原介体、盐度和pH对固定化酶去除四环素的影响,使用超高效液相色谱质谱联用仪分析四环素可能的降解机理,为固定化漆酶广泛用于污染物去除、环境修复等领域提供理论依据。
1 材料与方法 1.1 实验材料漆酶(EC 1.10.3.2)为市售商品漆酶,购自上海丹尼悦生物科技有限公司;2, 2’-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS,≥99%);盐酸四环素(TC),生物技术级;丁香醛(SA);1-羟基苯并三唑(HBT),分析纯;甲酸,色谱纯均购自上海麦克林生物科技有限公司;乙腈,色谱纯(≥99%),购自德国默克公司;其余试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 实验仪器L5紫外可见分光光度计(上海仪电分析仪器有限公司);HH-4数显恒温水浴锅(常州丹瑞实验仪器设备有限公司);CHA-SA数显气浴恒温振荡器(常州普天仪器制造有限公司);AB SciEX OTrap 4500 HPLC-MS/MS联用系统,配备Thermo Ultimate 3000型液相系统,电喷雾离子源(ESI)(美国AB公司);C18色谱柱(100 mm×2.1 mm,1.9 μm)(美国赛默飞世尔科技有限公司)。
1.3 固定化漆酶的制备首先按照适当比例称取海藻酸钠、聚乙烯醇、明胶,加入去离子水,于水浴锅内80 ℃加热溶化,冷却至室温备用;配制10 g·L-1漆酶溶液,加入0.5 g(5 g·L-1)活性炭进行吸附;然后将酶液与包埋液混匀,将混合液用注射器匀速滴入4%CaCl2饱和硼酸溶液中进行交联,形成水凝胶球。将形成的水凝胶球放置在交联剂中4 ℃固定4 h后取出,蒸馏水反复冲洗数次后放入Na2HPO4-柠檬酸缓冲液(pH=5,0.1 mol·L-1)中,4 ℃备用。形成的水凝胶球直径约2 mm。
1.4 实验用水本实验用水为模拟海水养殖废水,葡萄糖、NH4Cl和KH2PO4分别为50、80和9 mg·L-1,调节pH为7.0~8.3,盐度为30。加入盐酸四环素作为目标污染物。实验时取适量四环素储备液(100 mg·L-1)于该模拟海水养殖废水中,稀释至所需浓度,具体水质指标如表 1。
|
|
表 1 实验用水的水质指标 Table 1 Water quality index of experimental water |
使用ABTS为底物测试漆酶活性[17]。3 mL反应混合物由柠檬酸缓冲液(pH=5,0.1 mol·L-1)、1 mmol·L-1 ABTS和游离漆酶或固定化漆酶样品组成,在420 nm处测定5 min内的吸光度变化。一个酶活力单位定义为每分钟使OD值增加1.0所需要的酶量[18]。同组实验测定的最高酶活性记为100%,相对酶活性定义为其余酶活性与最高酶活性的百分比。
1.5.2 四环素的测定使用高效液相色谱与三重四级杆质谱联用技术(HPLC-MS/MS)测定四环素的浓度。色谱柱采用Thermo Hypersil GOLD C18色谱柱(100 mm×2.1 mm,1.9 μm),流动相A为0.3%甲酸水,流动相B为乙腈,水/乙腈(v/v)比为30∶70,流速0.25 mL·min-1,电喷雾离子源(ESI)以正模式运行,离子化电压5 500 V,离子源温度450 ℃,进样量1 μL,气帘气40 psi,柱温30 ℃,去簇电压90 V。由于水样中含有无机盐杂质,采用固相萃取对水样中盐酸四环素预处理后测定。
1.5.3 降解产物的测定水样前处理方式同盐酸四环素测定的前处理方式一致。色谱检测条件为:色谱仪为安捷伦1290UPLC,色谱柱采用waters BEH C18色谱柱(50 mm×2.1 mm,1.7 μm),流动相A为0.1%甲酸水溶液,流动相B为甲醇,梯度洗脱,进样流速0.3 mL·min-1,进样量为2 μL;质谱仪为安捷伦Q-TOF6500,电喷雾电离模式(ESI)模式在50~1 000 m/z范围内分析正离子,雾化气温度为350 ℃,雾化气气流12 L·min-1,喷雾电压+3 200 V。
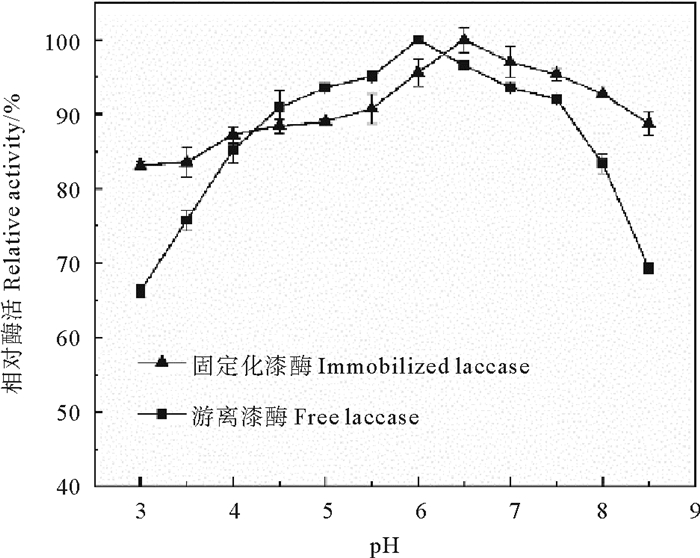
2 结果与讨论 2.1 游离漆酶与固定化漆酶酶学性质研究 2.1.1 pH对漆酶活性的影响漆酶的活性与活性电位氨基酸的电离状态密切相关,而反应体系酸碱度能显著影响其电离状态[19]。因此,在25 ℃下,评估pH在3~8.5的范围内游离和固定化漆酶酶活性的影响,实验重复三次,结果如图 1所示。游离漆酶和固定化漆酶活性均随着pH的升高呈现出先升高后降低的趋势。对于游离漆酶,最佳pH为6,随着pH的变化,活性损失变化较大,pH<4.5或pH>7.5均不利于漆酶活性,在pH为3时,相对活性仅为66.29%,pH为8.5时,相对活性仅为69.32%。对于固定化酶,最佳pH为6.5,在较宽的pH范围内保持着较高的相对酶活性,活性稳定在80%以上,即固定化漆酶的pH稳定性明显优于游离漆酶。
|
图 1 pH对游离和固定化漆酶酶活性的影响 Fig. 1 Effect of pH on the activity of free and immobilized laccase |
有研究认为,反应体系pH的变化会改变漆酶分子的带电状态,不同的pH值会导致不同的微环境。等离子点会影响漆酶和载体的净电荷,从而阻碍或激活漆酶活性[20-21],对催化反应造成影响。当体系中pH改变时,制备的水凝胶球具有pH缓冲功能,有效地缓冲了溶液中H+和OH-的变化,使固定化酶微环境的变化小于体系中的变化;同时,酶分子结构不易受到体系环境变化的冲击,使得酶对pH的敏感性降低,从而提高了固定化漆酶对pH变化的稳定性。漆酶的最佳反应pH从6变到了6.5,这种变化在其他文献中也有报道,如Wen等[17]在使用膨润土衍生的介孔材料固定化漆酶时发现,游离酶的最佳pH为4,而固定化酶的最佳pH为5;Shao等[22]将漆酶固定在中空介孔碳纳米球上时发现,游离酶的最佳pH为5.5,固定化酶的最佳pH为4.5。最佳pH的改变可能归因于漆酶周围微环境影响的相互作用,本研究使用海藻酸钠和聚乙烯醇作为主体包埋材料,形成的水凝胶球富含羟基,使得固定化载体附近微环境的H+浓度偏高,溶液中pH必须向碱性偏移,从而使固定化酶在pH=6.5表现出最大酶活性[23]。
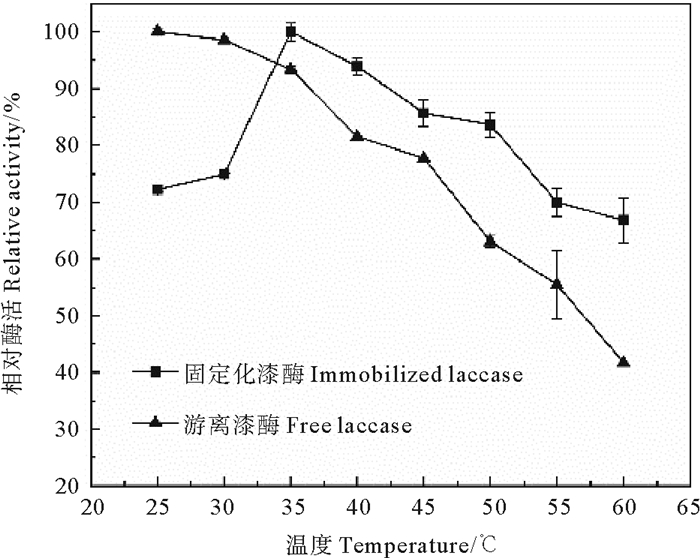
2.1.2 温度对漆酶活性的影响酶通常对温度敏感,在高温条件下活性会降低,通过将酶固定在合适的载体上,能够改善酶活性的降低程度。本研究称取等量固定化酶和游离漆酶(0.75 g·L-1)至50 mL蒸馏水中,恒温振荡1 h,在25~60 ℃范围内探究了温度对酶活性的影响,实验重复三次。如图 2所示,游离漆酶的最佳反应温度为25 ℃,此后,温度升高酶活性下降,反应温度为60 ℃时相对酶活性仅为41.79%。在25~35 ℃条件下,固定化漆酶的酶活性随着温度的增加而增加,35 ℃达到最大值,为29.30 U·g-1,温度的升高有助于酶与底物的结合进程,从而加快反应速率。随着温度的进一步升高,酶活性降低,60 ℃时,固定化酶相对酶活性为66.81%,比相同温度下游离漆酶相对酶活性高25.02%。高温下相对酶活性的降低与酶结构的热变性导致的部分酶失活有关[24],但固定化后形成的凝胶结构对酶蛋白分子的空间结构具有保护作用,增加了漆酶的刚度,使其不受构象变化的影响[25],酶蛋白分子的催化活性中心得到保护,使固定化漆酶耐热性有所提高。
|
图 2 温度对游离和固定化漆酶酶活性的影响 Fig. 2 Effect of temperature on the activity of free and immobilized laccase |
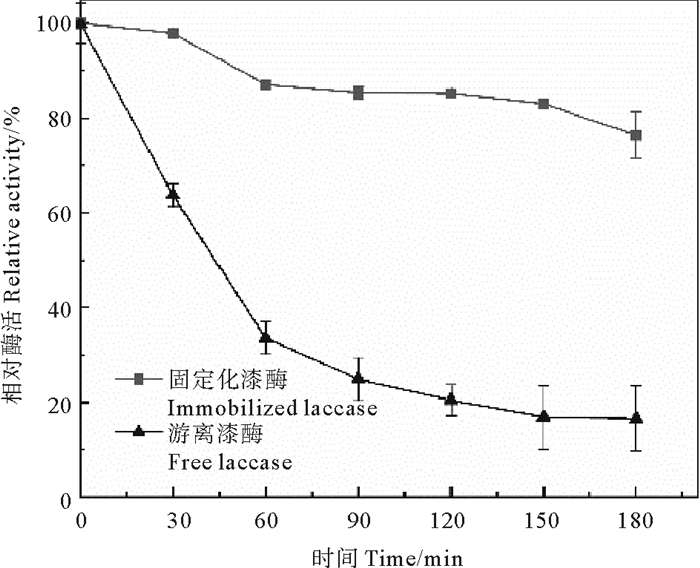
称取等量固定化酶和游离漆酶(0.75 g·L-1)至50 mL Na2HPO4-柠檬酸缓冲液中,60 ℃、150 r/min恒温振荡3 h,每隔30 min取样测定酶活性来评估漆酶的热稳定性,实验重复三次。相对酶活性定义为t时刻的活性与零时刻活性相比的百分数,使用一级动力学模型模拟酶的失活动力学,计算酶失活常数(Kd)和半衰期(t1/2)。结果如图 3所示。
|
图 3 游离和固定化漆酶的热稳定性 Fig. 3 Thermal stability of free and immobilized laccase |
由图 3可知,游离酶和固定化酶在60 ℃培养3 h后,与游离漆酶相比,固定化酶显示出了优异的热稳定性。游离酶仅保留了其初始催化活性的16.53%,这是由于高温下漆酶的3D结构发生了变化[26];而固定化酶酶活性的下降趋势相对缓和,60 ℃培养3 h后保留了其初始催化活性的76.31%,相对酶活性是游离漆酶的4.6倍。固定化酶热稳定性的提高反映在其失活常数Kd和酶半衰期t1/2的值上,游离漆酶的Kd值和t1/2为0.010 2 min-1和67.96 min,而包埋的固定化酶的Kd值和t1/2为0.001 4 min-1和495.11 min。这是由于漆酶和水凝胶球载体之间形成了共价键或氢键降低了漆酶分子的运动活性,分子构象变化自由度降低,对酶蛋白分子起到保护作用。
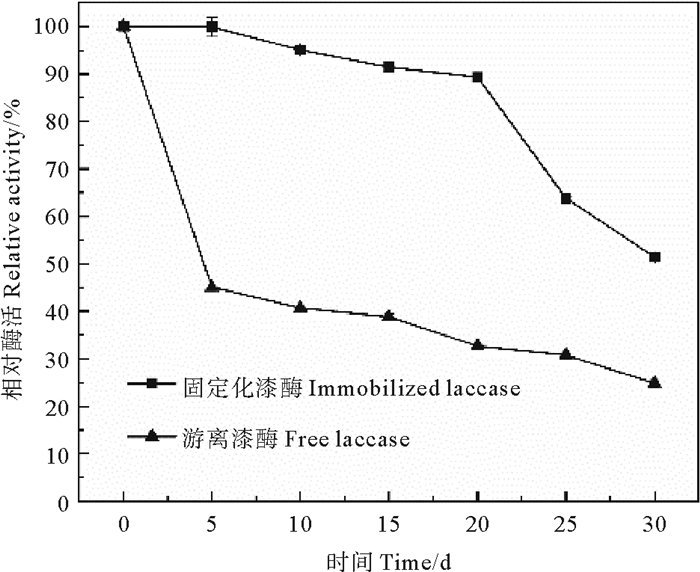
2.1.4 储存稳定性酶的储存稳定性对其应用于实际而言至关重要。图 4显示了游离和固定化漆酶在4 ℃下储存30 d的储存稳定性。游离酶和固定化酶的相对活性均随储存时间的延长而下降,但游离漆酶活性损失更加明显。游离酶在第5天就已经保留不到50%的活性,第30天仅保留24.84%的活性。固定化漆酶的相对活性下降非常缓慢,前20天保留90%以上的初始活性,此后由于水凝胶球外侧的CaCl2溶解导致漆酶泄露,相对活性下降比较明显,但在第30天也保持了一半以上的相对活性。结果表明,经过包埋+吸附固定的漆酶储存稳定性大幅提升,酶与载体之间的相互作用使得酶蛋白分子的结构刚性增强[27],同时载体材料也为漆酶提供了微环境的保护。
|
图 4 游离和固定化漆酶的储存稳定性 Fig. 4 Storage stability of free and immobilized laccase |
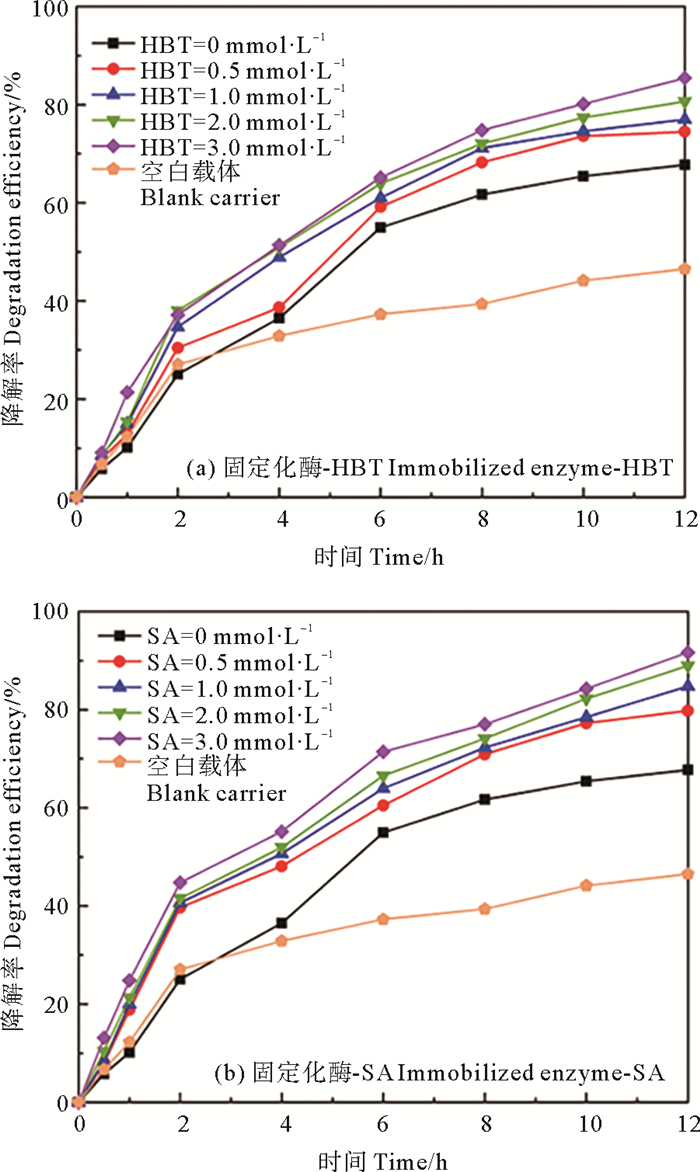
有研究认为, 漆酶的氧化还原电势较低(300~800 V),并且漆酶的铜活性中心深埋于分子内部,阻碍了底物分子将电子传递给漆酶,氧化能力有限[28], 而一些低分子量的介体(如SA、HBT)添加到漆酶氧化系统中可以提高漆酶的氧化能力,增强物质的降解。因此,本实验在漆酶浓度1.5 g·L-1、盐度30、不调节体系pH的条件下,研究了两种氧化还原介体(SA、HBT)和不同浓度的介体(0、0.5、1、2和3 mmol·L-1)对漆酶降解四环素(1 mg·L-1)的影响。结果如图 5所示。
|
图 5 氧化还原介体对四环素去除效果的影响 Fig. 5 Effects of redox mediator on tetracycline removal |
固定化空白载体对四环素具有明显的吸附作用,反应2 h,TC浓度降至729.26 μg·L-1,去除率达27.07%,是一个比较快速地吸附过程。随后,TC浓度缓慢降低,反应12 h后,TC浓度为534.88 μg·L-1,固定化空白载体吸附了约46%的TC,空白载体对TC的吸附趋于饱和。不添加任何介体的固定化酶12 h后去除了体系中67.78%的四环素,当介体加入到反应体系后,随着介体浓度的增加,四环素的去除效率明显增加。在SA存在的情况下,SA浓度为0.5、1、2和3 mmol·L-1时,固定化酶对四环素的去除率分别为79.80%、84.78%、88.99%、91.69%;在存在介体HBT的情况下,HBT浓度为0.5、1、2和3 mmol·L-1时,固定化酶对四环素的去除率分别为74.51%、76.99%、80.86%和85.43%。
由此可以看出,氧化还原介体类型和浓度显著影响漆酶介导反应中四环素的氧化速率。与SA相比,HBT对四环素去除的刺激较小,漆酶-SA系统在去除四环素方面的性能明显优于漆酶-HBT系统,表明SA在加速四环素催化氧化有着更加显著的促进作用。这与Shao等[22]、Ding等[29]的研究结果一致。SA和HBT的不同促进作用可能由于其结构、亲和力和作用机制的不同导致的。SA是天然介体,在漆酶介导的氧化系统中,SA中的甲氧基降低了苯氧基的氧化还原电位,同时增加了苯氧基的电子密度[30],与HBT相比,SA更容易被漆酶氧化;而HBT是一种合成介体,增强机制归因于氮羟基的催化作用[31]。
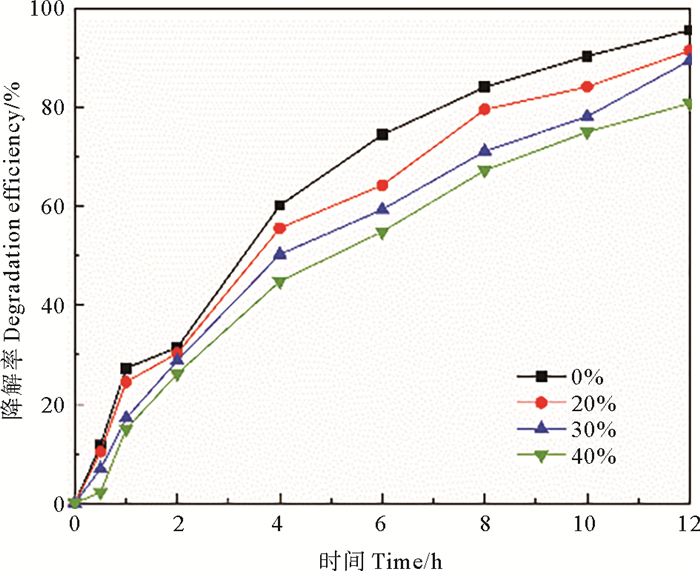
2.2.2 盐度对四环素去除率的影响漆酶应用于海水养殖废水中抗生素去除的实用价值大,而现有的研究集中在漆酶在缓冲体系或纯水体系对四环素的降解。因此本实验探究了在不同盐度条件下漆酶对海水养殖废水中四环素的去除效果。本节实验使用海水晶模拟海水中的盐类物质,设置盐度为20、30、40,同时设置空白对照组,加入3 mmol·L-1SA,其余实验条件同2.2.1。结果如图 6所示。
|
图 6 盐度对四环素去除效果的影响 Fig. 6 Effects of salinity on tetracycline removal |
盐度增加,海水养殖废水中的四环素降解率呈下降趋势。盐度为0时,四环素的降解率为95.55%,随着盐度增加为20、30和40时,四环素降解率分别为91.43%、89.41%、80.79%,这可能是由于漆酶是含铜多酚氧化酶,模拟的海水养殖废水中大量Na+的存在会降低漆酶活性[32-33],抑制漆酶对底物的催化氧化,从而影响了四环素的去除。
2.2.3 pH对四环素去除率的影响反应体系的pH对漆酶的催化氧化性能影响较大,海水养殖废水的pH一般在7~8.5之间,因此研究了pH为7.0~8.5范围内漆酶对四环素的去除效果,太高或太低的pH值范围被认为是不相关的。
如图 7所示,在选定的pH范围内,随着pH值的增加,四环素的降解速率逐渐降低。当pH为7时,固定化酶对四环素的降解率达到最大值92.81%,反应速率常数分别为0.205 6 h-1。当pH为8.5时,固定化酶对四环素的去除率为85.31%。经固定化后载体材料可能提供了适合于固定化漆酶的表面电荷分布,并在酶活性电位周围产生了抵抗pH值变化的微环境,因此pH对固定化酶去除四环素的效果影响较小,仅降低了7.5%。漆酶去除海水养殖废水中四环素的最佳pH为7,这一结果与Tian等[34]的研究结果一致,其在使用漆酶降解TC和OTC溶液时,观察到TCs被漆酶-SA或漆酶-HBT体系转化时,最适pH为6.0~7.0左右;Kelber等[35]在使用漆酶降解阿霉素时发现随着体系pH的增加,降解率逐渐增加,直至在pH=7时达到最大值。
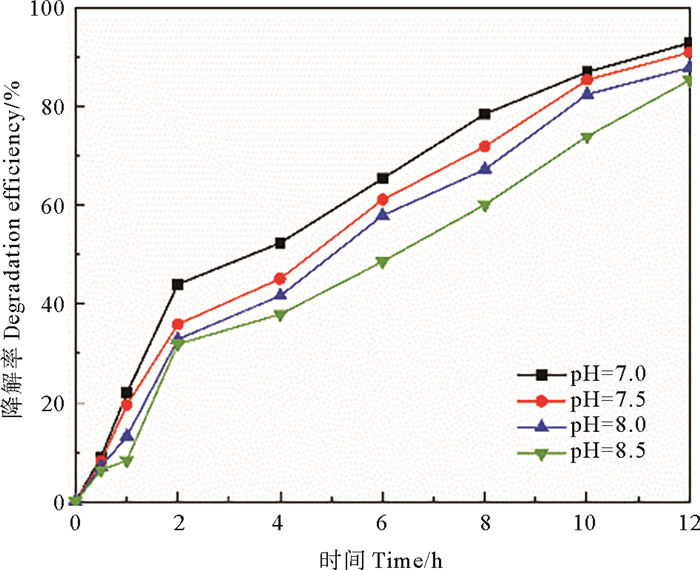
|
图 7 pH对四环素去除效果的影响 Fig. 7 Effects of pH on tetracycline removal |
四环素在弱碱性条件下降解率的下降可能是由于溶液中存在OH-,这些离子的存在会影响漆酶的结构和性质。由于OH-在Ⅱ型/Ⅲ型铜中的附着,OH-(碱性酸碱度)的存在抑制了漆酶中从Ⅰ型铜到Ⅱ/Ⅲ型铜的内部电子转移。漆酶的降解也取决于底物和T1铜中心之间的氧化还原电位差,当酸碱度增加时,氧化还原电位降低[36]。
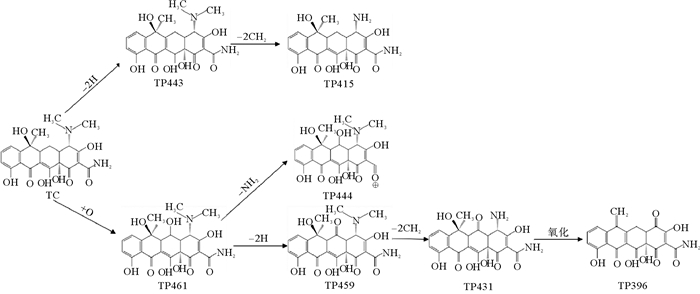
2.3 固定化漆酶对四环素的降解途径分析使用超高效液相色谱-质谱联用技术(UPLC-MS/MS)检测漆酶降解四环素的中间产物,并将其命名为TP618、TP461、TP459、TP444、TP443、TP431。从LC-MS结果中获得的四环素的主要降解产物见表 2,根据这些降解产物结合文献分析,提出了四环素的可能的降解途径,如图 8所示。
|
|
表 2 TC降解产物的准确质量和建议的分子结构 Table 2 Accurate mass measurements and proposed molecular structures of TC degradation products |
|
图 8 四环素的降解路径 Fig. 8 The propoesd degradation pathway of tetracycline |
漆酶催化氧化四环素的过程中,氧化、脱氢、脱甲基、脱氨基是主要反应。降解途径主要有两种:(1)TC通过脱氢反应降解为TP443,随后进行双脱甲基反应,连接到氮上的甲基官能团从碳骨架上断裂转化为TP415[40];(2)TC在3号位碳原子氧化形成的相应的酮(m/z=461),一方面通过脱氨基作用形成TP444;另一方面脱氢后形成TP459,然后氨基在1号位被双脱甲基形成TP431[22]。有研究认为,土霉素TP461和TP459是形成TP431的必要中间体[10]。虽然本研究未发现由Sun等[38]提出的m/z=396的化合物,但许多研究认为TP396是四环素降解的直接产物,TP396是通过TP431位置12的脱氢,1号位氧化和5号位的脱水形成的。最后,对于TP618这个产物,在过往的研究中,仅Llorca等[37]在检测漆酶降解四环素中间产物时有发现,但对R基团的结构性质仍不清楚。
3 结论(1) 考察固定化漆酶的酶学性质发现,漆酶固定化后,受到载体的保护,其三维结构更加稳定,限制了酶的泄露,确保了高催化活性的保留,固定化后的漆酶的热稳定性、储存稳定性有显著提高。
(2) 固定化漆酶对四环素的去除是吸附和催化氧化共同作用的结果。氧化还原介体类型及浓度显著影响固定化漆酶对四环素的去除,漆酶-SA系统在去除四环素方面的性能优于漆酶-HBT系统,在3 mmol·L-1SA存在的条件下,固定化漆酶和对四环素的去除率是91.69%。盐度增加,固定化漆酶对四环素的降解率降低,但保持了80%以上的降解率,能满足修复的需要。固定化漆酶去除海水养殖废水中四环素的最佳pH为7.0。
(3) 对四环素酶促转化降解产物的分析表明, 氧化、脱氢、脱甲基和脱氨基是导致四环素分子转化的主要过程。
| [1] |
Zhang M, He L Y, Liu Y S, et al. Fate of veterinary antibiotics during animal manure composting[J]. Science of the Total Environment, 2019, 650(10): 1363-1370. (  0) 0) |
| [2] |
Hou G G, Hao X Y, Zhang R, et al. Tetracycline removal and effect on the formation and degradation of extracellular polymeric substances and volatile fatty acids in the process of hydrogen fermentation[J]. Bioresource Technology, 2016, 212: 20-25. DOI:10.1016/j.biortech.2016.03.156 (  0) 0) |
| [3] |
Han Q F, Zhao S, Zhang X R, et al. Distribution, combined pollution and risk assessment of antibiotics in typical marine aquaculture farms surrounding the Yellow Sea, North China[J]. Environment International, 2020, 138: 105551. DOI:10.1016/j.envint.2020.105551 (  0) 0) |
| [4] |
Na G S, Fang X D, Cai Y Q, et al. Occurrence, distribution, and bioaccumulation of antibiotics in coastal environment of Dalian, China[J]. Marine Pollution Bulletin, 2013, 69(1-2): 233-237. DOI:10.1016/j.marpolbul.2012.12.028 (  0) 0) |
| [5] |
Chen H, Liu S, Xu X R, et al. Antibiotics in typical marine aquaculture farms surrounding Hailing Island, South China: Occurrence, bioaccumulation and human dietary exposure[J]. Marine Pollution Bulletin, 2015, 90(1-2): 181-187. DOI:10.1016/j.marpolbul.2014.10.053 (  0) 0) |
| [6] |
Zhu H, Chen T, Liu J, et al. Adsorption of tetracycline antibiotics from an aqueous solution onto graphene oxide/calcium alginate composite fibers[J]. RSC Advances, 2018, 8(5): 2616-2621. DOI:10.1039/C7RA11964J (  0) 0) |
| [7] |
Pandele A M, Lovu H, Orbeci C, et al. Surface modified cellulose acetate membranes for the reactive retention of tetracycline[J]. Separation and Purification Technology, 2020, 249(15): 117145. (  0) 0) |
| [8] |
Wu J G, Jiang Y X, Zha L Y, et al. Tetracycline degradation by ozonation and evaluation of biodegradability and toxicity of ozonation byproducts[J]. Canadian Journal of Civil Engineering, 2010, 37(11): 1485-1491. DOI:10.1139/L10-100 (  0) 0) |
| [9] |
Leng Y F, Bao J G, Chang G F, et al. Biotransformation of tetracycline by a novel bacterial strain Stenotrophomonas maltophilia DT1[J]. Journal of Hazardous Materials, 2016, 318(15): 125-133. (  0) 0) |
| [10] |
Yang J, Lin Y H, Yang X D, et al. Degradation of tetracycline by immobilized laccase and the proposed transformation pathway[J]. Journal of Hazardous Materials, 2017, 322: 525-531. DOI:10.1016/j.jhazmat.2016.10.019 (  0) 0) |
| [11] |
Chen X C, Zhou Q Z, Liu F M, et al. Removal of nine pesticide residues from water and soil by biosorption coupled with degradation on biosorbent immobilized laccase[J]. Chemosphere, 2019, 233: 49-56. DOI:10.1016/j.chemosphere.2019.05.144 (  0) 0) |
| [12] |
Saeed K, Seyed M B, Niyaz M M. Covalently immobilized laccase onto graphene oxide nanosheets: Preparation, characterization, and biodegradation of azo dyes in colored wastewater[J]. Journal of Molecular Liquids, 2019, 276(15): 153-162. (  0) 0) |
| [13] |
Moghimi H, Heidary T R, Hamedi J. Assessing the biodegradation of polycyclic aromatic hydrocarbons and laccase production by new fungus Trematophoma sp. UTMC 5003[J]. World Journal of Microbiology and Biotechnology, 2017, 33(7): 136-140. DOI:10.1007/s11274-017-2304-8 (  0) 0) |
| [14] |
Navada K K, Kulal A. Enzymatic degradation of chloramphenicol by laccase from Trametes hirsuta and comparison among mediators[J]. International Biodeterioration & Biodegradation, 2019, 138: 63-69. (  0) 0) |
| [15] |
Chang Q, Liu L, Muhammad Y, et al. Synthesis of magnetic Fe-N doped porous carbon possessing hollow-acicular structure with high activity and stability for lumbrukinase adsorptive immobilization[J]. Chemical Engineering Journal, 2018, 334(15): 1699-1708. (  0) 0) |
| [16] |
刘苑皓, 赵兴秀, 舒梨, 等. 多酚氧化酶的固定化及其酶学性质研究[J]. 中国调味品, 2020, 45(5): 33-41. Liu Y H, Zhao X X, Shu L, et al. Immobilization of polyphenol oxidase and its enzymatic properties[J]. China Condiment, 2020, 45(5): 33-41. (  0) 0) |
| [17] |
Wen X F, Zeng Z T, Du C Y, et al. Immobilized laccase on bentonite-derived mesoporous materials for removal of tetracycline[J]. Chemosphere, 2019, 222: 865-871. DOI:10.1016/j.chemosphere.2019.02.020 (  0) 0) |
| [18] |
谭小珊. 固定化漆酶修复石油污染沉积物的研究[D]. 河北: 燕山大学, 2020. Tan X S. Study on the Restoration of Petroleum Contamination Sediments by Immobilized Laccase[D]. Hebei: Yanshan University, 2020. (  0) 0) |
| [19] |
Zheng X B, Wang Q, Jiang Y J, et al. Biomimetic synthesis of magnetic composite particles for laccase immobilization[J]. Industrial & Engineering Chemistry Research, 2012, 51(30): 10140-10146. (  0) 0) |
| [20] |
Chen M, Xu P, Zeng G M, et al. Bioremediation of soils contaminated with polycyclic aromatic hydrocarbons, petroleum, pesticides, chlorophenols and heavy metals by composting: Applications, microbes and future research needs[J]. Biotechnology Advances, 2015, 33(6): 745-755. DOI:10.1016/j.biotechadv.2015.05.003 (  0) 0) |
| [21] |
Zhang Y, Zeng G M, Tang L, et al. Electrochemical sensor based on electrodeposited Graphene-Au modified electrode and Nano-Au carrier amplified signal strategy for attomolar mercury detection[J]. Analytical Chemistry, 2015, 87(2): 989-996. DOI:10.1021/ac503472p (  0) 0) |
| [22] |
Shao B B, Liu Z F, Zeng G M, et al. Immobilization of laccase on hollow mesoporous carbon nanospheres: Noteworthy immobilization, excellent stability and efficacious for antibiotic contaminants removal[J]. Journal of Hazardous Materials, 2019, 362: 318-326. DOI:10.1016/j.jhazmat.2018.08.069 (  0) 0) |
| [23] |
赵丽芳. 脂肪酶的固定化及其催化性能的研究[D]. 吉林: 吉林大学, 2008. Zhao L F. Study on Immobilization and Catalytic Performance of Lipase[D]. Jilin: Jilin University, 2008. (  0) 0) |
| [24] |
Singh A J, Strvastava P K. Purification and characterization of Glucose-6-Phosphate Dehydrogenase from Pigeon Pea (Cajanus cajan) Seeds[J]. Advances in Enzyme Research, 2014, 2(4): 134-149. DOI:10.4236/aer.2014.24014 (  0) 0) |
| [25] |
Zdarta J, Katarzyna J, Bachosz K, et al. A promising laccase immobilization using electrospun materials for biocatalytic degradation of tetracycline: Effect of process conditions and catalytic pathways[J]. Catalysis Today, 2020, 348: 127-136. DOI:10.1016/j.cattod.2019.08.042 (  0) 0) |
| [26] |
Zhang C Y, You S P, Zhang J X, et al. An effective in-situ method for laccase immobilization: Excellent activity, effective antibiotic removal rate and low potential ecological risk for degradation products[J]. Bioresource Technology, 2020, 308: 123271. DOI:10.1016/j.biortech.2020.123271 (  0) 0) |
| [27] |
Bayramoglu G, Akbulut A, Arica M Y. Immobilization of tyrosinase on modified diatom biosilica: Enzymatic removal of phenolic compounds from aqueous solution[J]. Journal of Hazardous Matericals, 2013, 244-245: 528-536. DOI:10.1016/j.jhazmat.2012.10.041 (  0) 0) |
| [28] |
潘雨. 光驱动强化漆酶/介体系统对木质素及其模型化合物的降解研究[D]. 重庆: 重庆大学, 2019. Pan Y. Degradation of Lignin and Its Model Compounds by Light-Driven Enhanced Laccase/Mediator System[D]. Chongqing: Chongqing University, 2019. (  0) 0) |
| [29] |
Ding H J, Wu Y X, Zou B C, et al. Simultaneous removal and degradation characteristics of sulfonamide, tetracycline, and quinolone antibiotics by laccase-mediated oxidation coupled with soil adsorption[J]. Journal of Hazardous Matericals, 2016, 307: 350-358. DOI:10.1016/j.jhazmat.2015.12.062 (  0) 0) |
| [30] |
Shi L L, Ma F Y, Han Y L, et al. Removal of sulfonamide antibiotics by oriented immobilized laccase on Fe3O4 nanoparticles with natural mediators[J]. Journal of Hazardous Materials, 2014, 279(30): 203-211. (  0) 0) |
| [31] |
Rahmani K, Faramarzi M, Mahvi A H, et al. Elimination and detoxification of sulfathiazole and sulfamethoxazole assisted by laccase immobilized on porous silica beads[J]. International Biodeterioration and Biodegradation, 2015, 97: 107-114. (  0) 0) |
| [32] |
冯义平, 沈梦瑶, 张伊健, 等. 典型金属离子对漆酶催化降解溴代阻燃剂四溴双酚A的影响研究[J]. 环境科学学报, 2020, 40(6): 2082-2089. Feng Y P, Shen M Y, Zhang Y J, et al. Effect of metal ions on laccase-catalyzed degradation of tetrabromobisphenol A[J]. Acta Scientiae Circumstantiae, 2020, 40(6): 2082-2089. (  0) 0) |
| [33] |
马辉. CotA漆酶活性残基饱和突变提高对活性黑5脱色活性及其降解机理研究[D]. 江苏: 江南大学, 2021. Ma H. Enhancing CotA-Laccase Decolorization Activity Via Site-Saturation Mutagenesis and Its Degradation Mechanism to Reactive Black 5[D]. Jiangsu: Jiangnan University, 2021. (  0) 0) |
| [34] |
Tian Q P, Dou X, Huang L, et al. Characterization of a robust cold-adapted and thermostable laccase from Pycnoporus sp. SYBC-L10 with a strong ability for the degradation of tetracycline and oxytetracycline by laccase-mediated oxidation[J]. Journal of Hazardous Materials, 2020, 382: 121084. (  0) 0) |
| [35] |
Kelbert M, Pereira C S, Daronch N A, et al. Laccase as an efficacious approach to remove anticancer drugs: A study of doxorubicin degradation, kinetic parameters, and toxicity assessment[J]. Journal of Hazardous Materials, 2020, 409(5): 124520. (  0) 0) |
| [36] |
Xu F. Effects of redox potential and hydroxide inhibition on the pH activity profile of fungal laccases[J]. Journal Biological Chemistry, 1997, 272: 924-928. (  0) 0) |
| [37] |
Llorca M, Rodríguez-Mozaz S, Couillerot C, et al. Identification of new transformation products during enzymatic treatment of tetracycline and erythromycin antibiotics at laboratory scale by an on-line turbulent flow liquid-chromatography coupled to a high resolution mass spectrometer LTQ-Orbitrap[J]. Chemosphere, 2015, 119: 90-98. (  0) 0) |
| [38] |
Sun K, Huang Q G, Li S Y, et al. Transformation and toxicity evaluation of tetracycline in humic acid solution by laccase coupled with 1-hydroxybenzotriazole[J]. Journal of Hazardous Materials, 2017, 331: 182-188. (  0) 0) |
| [39] |
Cazes M D, Belleville M P, Petit E, et al. Design and optimization of an enzymatic membrane reactor fortetracycline degradation[J]. Catalysis Today, 2014, 236: 146-152. (  0) 0) |
| [40] |
Tang Y, Li W Y, Muhammad Y, et al. Fabrication of hollow covalent-organic framework microspheres via emulsion-interfacial strategy to enhance laccase immobilization for tetracycline degradation[J]. Chemical Engineering Journal, 2021, 421: 129743. (  0) 0) |
2. The Key Laboratory of Marine Environmental Science and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China
 2023, Vol. 53
2023, Vol. 53