2. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100
氧苯酮是目前常用的广谱性紫外线吸收剂,它能有效吸收部分紫外光,防止紫外线照射到皮肤上造成光过敏损伤,故被广泛添加于各类化妆品中,如防晒霜、乳霜和面霜等[1]。
氧苯酮主要通过娱乐活动(如游泳或淋浴等)和工业废水排放进入水环境[2]。作为一种持久性有机污染物,氧苯酮在水环境中的半衰期为90 d~3 a[3],因此,氧苯酮会导致水生态系统持续不断地处于危害之中,对水生生物造成严重影响。同时由于氧苯酮在水生生态系统中存在普遍性和亲脂性,很容易被各种水生生物(如藻类、珊瑚、鱼类、浮游动物、节肢动物等)吸收,并沿食物链在更高级的消费者体内积累[4]。为减少水生生物以及水生态系统受到氧苯酮的危害,制定氧苯酮的水质基准迫在眉睫。
制定水质基准可以为水质标准提供相应的理论基础,同时也对环境风险评价、环境损害鉴定评估以及水质评价具有重大意义[5]。目前国际上常用的制定水质基准的方法为评价因子法(AF)、物种敏感度分布法(SSD)和物种敏感度排序法(SSR)[6],而对于氧苯酮的研究,国内外仅有学者通过评价因子法推导了氧苯酮预计无效应浓度(PNEC),并没有系统通过考虑各类生物的毒性数据推导氧苯酮的水生生物基准。因此,本研究对各类氧苯酮的水生生物毒性数据进行搜集筛选,并补充了相关毒理学试验,通过物种敏感度分布法推导出氧苯酮的水生生物水质基准。还在此基础上,通过商值法,对搜集自世界各地水体中的氧苯酮数据进行生态风险评估。
1 材料与方法 1.1 毒理学数据的搜集和筛选本研究所搜集筛选的氧苯酮毒性数据主要来自美国环境保护局ECOTOX毒性数据库(http://cfpub.epa.gov/ecotox/)和中国知网(http://www.cnki.com/)。
由于毒性数据的筛选对水质基准的推导极为重要,故本研究中所筛选的急性毒性数据,其暴露时间主要为96 h且毒性效应终点为死亡的半数致死浓度(LC50)[7-8]。慢性毒性数据采用的暴露时间不小于14 d,毒性效应终点为死亡、生长、发育和繁殖的无观察效应浓度(NOEC)或最低可观察效应浓度(LOEC)[7-8]。除此之外,对于具有多个毒性数据的物种,先去除偏离平均值超过一个数量级的数据,然后选取更敏感的测试终点以及相对暴露时间更长的毒性数据。
1.2 水生生物水质基准推导方法本研究采用SSD法推导氧苯酮的水生生物水质基准。基于水生生物的急性毒性值,推导氧苯酮的短期水质基准(Short-term water quality criterion,SWQC);基于水生生物的慢性毒性值,推导氧苯酮的长期水质基准(Long-term water quality criterion,LWQC)。首先对各类水生生物的毒性数据进行正态分布检验,若不符合正态分布则应将毒性数据进行对数转换并重新检验。随后将所有毒性数据由小至大进行排列,同时按最小毒性值的等级(1级)、最大毒性值等级(N级)来分配相应等级(R)[7]。最后计算出各物种毒性值的积累概率(P),相应公式如下:
| $ P = R/\left( {N + 1} \right) \times 100\% 。$ | (1) |
利用Origin 2018软件(OriginLab, Northampton, MA, USA)中的多种非线性曲线模型对处理后的数据进行拟合,对比模型拟合结果以及校正决定系数(Adjusted coefficient of determination)R2 和残差平方和(Residual sum of squares)RSS的大小,选定拟合结果最好的模型,得出其P值为5%的条件下污染物危害浓度(Hazardous concentration)HC5[10]。其中:RSS越趋向0,模型拟合的随机误差效应越低;R2越趋向1,模型拟合优度越高。随后依据拟合结果得到的HC5值进行水质基准计算,具体计算公式如下:
| $ \mathit{SWQC = H}{\mathit{C}_5}/AF 。$ | (2) |
式中:AF为评价因子,由于所搜集的有效毒性数据量超过15个且已覆盖水生植物、无脊椎动物和脊椎动物这3个营养级,故本研究中AF取2。
由于氧苯酮的慢性毒性数据不足,无法采用SSD法推导其相应的长期水质基准,故本研究采用US EPA提出的急慢性比率法(Final acute chronic ratio, FACR)进行推导[11],相应的计算公式如下:
| $ LWQC = SWQC/FACR 。$ | (3) |
式中:FACR为3科及以上的水生生物急慢性比(Acute to chronic ratio, ACR) 的几何平均值,而ACR中至少有一种鱼类和一种无脊椎动物。
1.3 生态风险评价本研究采用商值法(Risk quotient,RQ)对水体中氧苯酮的生态风险进行初步评价。以氧苯酮的环境暴露浓度最大值与其短期基准值的商来表征急性风险商,以氧苯酮的环境暴露浓度平均值与其长期基准值的商来表征慢性风险商[12]。当水体的风险商值RQ<0.1,表明氧苯酮对该水体中的暴露生物威胁程度较低,此时水环境处于相对安全状态;当0.1<RQ<1时,表明氧苯酮对该水体威胁程度适中;当风险商值RQ>1时,表明氧苯酮对该水体中的暴露生物威胁程度较高,此时水环境处于高风险状态,并且随着风险商值增大其生态风险程度也相应增加[12-13]。
1.4 毒性试验 1.4.1 试验材料草鱼(Ctenopharyngodon idella),属脊索动物门、鲤科,是一种典型的草食性鱼类,广泛分布于各大淡水水域中。同时它也是一种较为常用的试验室模式水生生物[14]。
草虾(Penaeus monodon),又称斑节对虾,属节肢动物门、对虾科,具有生长快、食性杂、生命力强等特点,被广泛用于科学研究[15]。
稀有鮈鲫(Gobiocypris rarus),属脊索动物门、鲤科,具有饲养方便、性成熟时间短、适应环境能力强以及可长期产卵等特点[16]。
草鱼购于广东广州猛虎水产批发店,草虾购于山东淄博皓之家水产批发店,稀有鮈鲫购于国家水生生物种质资源库。试验用氧苯酮(cas# 131-57-7)和其他消耗性试剂(如乙醇等)购于上海安谱试验科技有限公司,均为分析纯。
1.4.2 急性毒性试验方法 1.4.2.1 草鱼急性毒性试验试验方法参考文献[17]。试验用草鱼苗(C. idellus)规格:体长(31.6±3.4) mm,体质量(0.49±0.05) g。试验开始前将草鱼在室内鱼缸中驯养一周,且驯养期间死亡率不高于5%。
预试验:备8个容器,每个体积15 L,分别放入8 L溶液,试验用水为经过24 h曝气后的自来水,以一个容器为空白对照,一个容器为溶剂对照,试验组浓度分别为0.05、0.1、0.5、1、5、10 mg/L。每个容器中放8条鱼,在试验开始前24 h停止喂食。保持试验溶液温度为(20±1) ℃。暴露时间为48 h。每24 h更换一次相同浓度溶液,每天观察并记录试验情况,及时将死鱼取出。其中对玻璃棒轻触尾部没有反应的个体即判定为死亡个体。
正式试验:根据预试验结果,采用半静态试验方法,设定氧苯酮溶液浓度分别为1.35、1.82、2.46、3.32、4.48 mg/L。选择21个容器,每个容积15 L,分别放入10 L溶液,每个浓度组设置3组平行,同时设置空白对照组和溶剂对照组。随机选取10尾鱼放入每个试验容器中,所有鱼在30 min内转移完毕。试验过程中,每24 h更换一次相同浓度溶液,换液前、后分别测定各溶液溶解氧、pH和温度,保持溶液温度为(20±1) ℃、pH为7.97±0.34、溶解氧超过饱和溶解度的60%。试验暴露周期为96 h,每天观察并记录受试鱼死亡情况,及时清除死亡个体。
1.4.2.2 草虾急性毒性试验试验方法参考文献[17],试验用草虾的体长为(19±4) mm,体质量为(0.09±0.03) g,试验开始前将草虾在室内鱼缸中驯养一周,且驯养期间死亡率不高于5%。
预试验:备8个容器,每个体积15 L,分别放入4 L溶液,其中一个容器为空白对照,一个为溶剂对照。试验组浓度分别为0.05、0.1、0.5、1、5、10 mg/L。每容器中放20尾虾,在试验开始前24 h停止喂食。保持试验溶液温度为(20±1) ℃,暴露时间为48 h。每24 h更换一次相同浓度溶液,每天观察并记录,及时将死虾取出。
正式试验:根据预试验结果,采用半静态试验方法,设定氧苯酮溶液浓度分别为:1.35、1.82、2.46、3.32、4.48 mg/L。选择21个容器,每个容积15 L,分别放入4 L溶液,每个浓度组设置3组平行,同时设置空白对照组以及溶剂对照组。随机选取20尾虾放入每个试验容器中,所有鱼在30 min内转移完毕。试验期间,每24 h更换一次相同浓度溶液,换液前、后分别测定各溶液溶解氧、pH和温度,保持溶液温度为(20±1) ℃、pH为7.97±0.34、溶解氧超过饱和溶解度的60%。试验暴露周期为96 h,每天观察并记录受试虾死亡情况,及时清除死虾。
1.4.2.3 稀有鮈鲫胚胎急性毒性试验试验方法参考文献[17]。试验开始前将稀有鮈鲫雌雄配对在室内鱼缸中驯养,等到雌鱼产卵,开始记录产卵周期,并定期观察产卵数量。正式试验应在鱼卵受精且数量足够后立即开始,需挑选正常的受精卵(坏死的鱼卵颜色呈白色)进行试验。
预试验:备4个24孔板,每孔放入2 mL溶液和一个胚胎,每个浓度组设10个胚胎,并设置空白对照以及溶剂对照组。试验组浓度分别为0.2、0.4、0.8、1.6、3.2、6.4 mg/L。每24 h更换1次相同浓度溶液,换液前、后分别测定各溶液溶解氧、pH和温度,保持溶液温度为(25±1) ℃、pH为7.84±0.21、溶解氧超过饱和溶解度的60%,暴露时间为96 h。每天用显微镜观察并记录死亡率,畸形率以及孵化率等指标。
正式试验:根据预试验结果,采用半静态试验方法,设定氧苯酮溶液浓度为2、2.8、3.9、5.5、7.7 mg/L以及空白对照和溶剂对照组。备7个24孔板,将正常的受精卵转移到已预先调节的24孔板中,并装入在3 h内配置的试验溶液2 mL/孔。5个浓度组以及溶剂对照组在各自孔板上分配20枚卵,板内对照(空白)4个孔中分配4枚卵;空白对照组的培养板中分配24枚卵。试验期间,每24 h更换一次相同浓度溶液,换液前、后分别测定各溶液溶解氧、pH和温度,保持溶液温度为(25±1) ℃、pH为7.97±0.34、溶解氧超过饱和溶解度的60%。试验暴露周期为96 h,每天观察并记录胚胎的死亡率、孵化率、畸形率和异常率等指标,测试胚胎的观察终点包括:胚胎凝固、缺少体节形成和缺乏心跳。
1.4.3 慢性毒性试验方法 1.4.3.1 草虾慢性毒性试验方法试验方法参考文献[17],采用半静态试验方法,参考草虾急性毒性试验数据结果,设定氧苯酮溶液浓度分别为:35.8、53.7、80.6、120.9、181.4、272.1 μg/L。选择24个容器,每个容积15 L,分别放入10 L溶液,每个浓度组设置3组平行,同时设置空白对照组以及溶剂对照组。随机选取50尾虾放入每个试验容器中,所有鱼在30 min内转移完毕。试验期间,每天定量喂食并更换一次相应浓度溶液,换液前、后分别测定各溶液溶解氧、pH和温度,保持溶液温度为(20±1) ℃、pH为7.84±0.21、溶解氧超过饱和溶解度的60%。试验暴露周期为21 d,每天观察并记录受试虾死亡情况以及行为变化,及时清除死虾。
1.4.3.2 稀有鮈鲫慢性毒性试验方法试验方法参考文献[17]。根据胚胎急性毒性试验结果,设定氧苯酮溶液浓度5组以及空白对照和溶剂对照组。试验前期胚胎阶段方案参照急性毒性试验方案,每个浓度组设置3个平行,每个平行10个卵,约3 d左右,胚胎孵化后将其转移至结晶皿继续培养,每个结晶皿加入250 mL暴露液。试验期间,每24 h更换一次相同浓度溶液。换液前、后分别测定各溶液溶解氧、pH和温度,保持溶液温度为(25±1) ℃、pH为7.97±0.34、溶解氧超过饱和溶解度的60%。此外,待胚胎孵化后,每天一并给仔鱼喂食定量的摇蚊幼虫,供其生长需求。试验暴露周期为21 d,每天观察并记录胚胎以及仔鱼的行为情况。胚胎的观察终点包括:胚胎凝固、缺少体节形成和缺乏心跳。仔鱼观察终点包括:(1)死亡标志:体发白,不游动,没有心跳,无机械性刺激异常表现。(2)异常表现:如畸形。(3)异常行为:如换气过度、不协调的游泳、非典型的静止和非典型的进食行为。
1.4.4 数据分析软件本研究采用IBM SPSS 25软件(IBM Corp., Armonk, NY, USA)对试验所得的数据进行分析,计算出试验物种的急性以及慢性毒性值。利用Origin 2018软件绘制试验结果的拟合图形,同时利用软件中的模型拟合所搜集的急性毒性数据,以计算出HC5值。
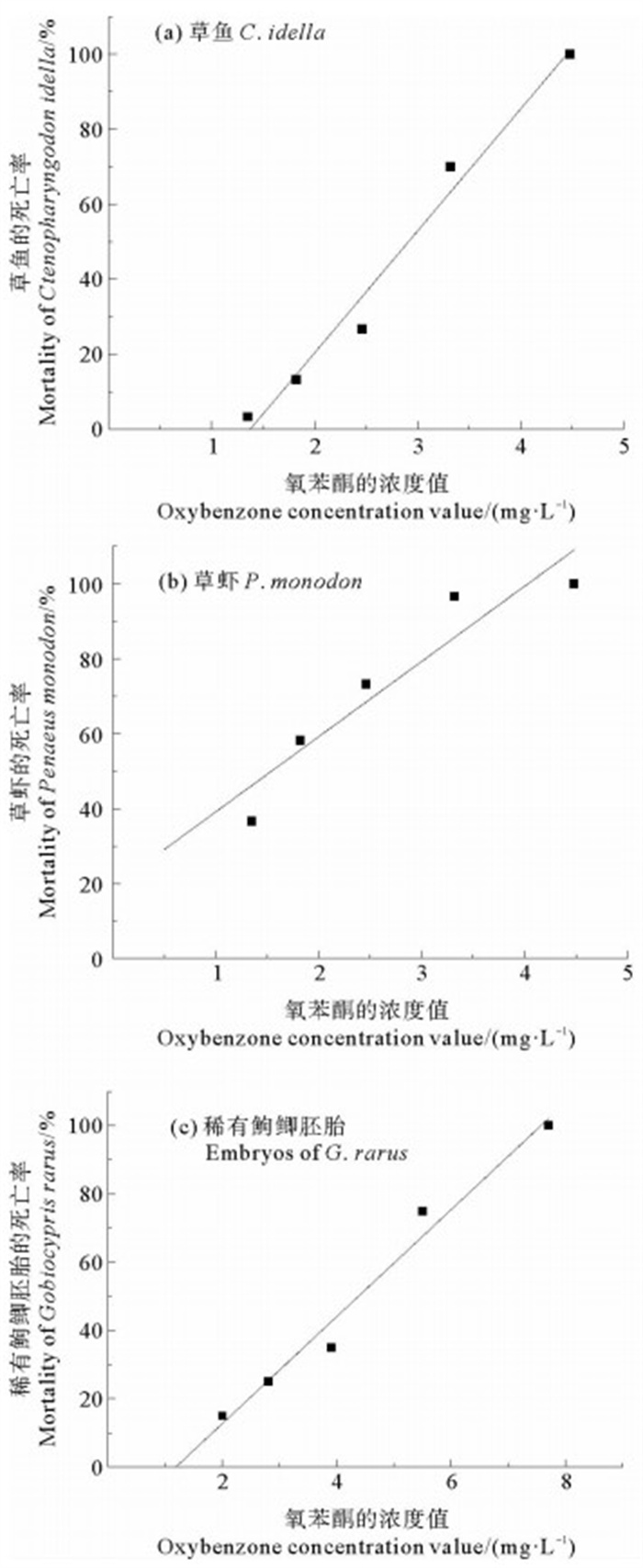
2 结果 2.1 急性毒性试验结果 2.1.1 草鱼的急性毒性试验结果试验中空白对照以及溶剂对照组平均死亡率均为0,暴露组1.35、1.82、2.46、3.32、4.48 mg/L的死亡率分别为3.3%、13.3%、26.7%、70%和100%。采用直线回归法对试验数据进行拟合分析。以氧苯酮试验浓度为X,平均死亡率转换的概率单位为Y,得到氧苯酮对草鱼96 h急性毒性试验的线性回归方程为:
| $ Y = 0.329X - 0.449, {r^2} = 0.972, p = 0.002 < 0.05 。$ |
式中线性拟合图见图 1(a)。通过概率分析得到草鱼的96 h-LC50为2.841 mg/L,95%置信限为2.628~3.088 mg/L。
|
图 1 氧苯酮对三种水生生物的致死率 Fig. 1 Mortality rate of oxybenzone to three aquatic organisms |
试验中空白对照以及溶剂对照组平均死亡率均为0,暴露组1.35、1.82、2.46、3.32、4.48 mg/L的死亡率分别为36.7%、58.3%、73.3%、96.7%和100%。采用直线回归法对试验数据进行拟合分析。以氧苯酮试验浓度为X,平均死亡率转换的概率单位为Y,得到氧苯酮对草虾96 h急性毒性试验的线性回归方程为:
| $ Y = 0.201X - 0.191, {r^2} = 0.886, p = 0.017 < 0.05 。$ |
式中线性拟合图形见图 1(b)。通过概率分析得到草虾的96 h-LC50为1.691 mg/L,95%置信限为1.462~1.870 mg/L。
2.1.3 稀有鮈鲫胚胎急性毒性试验结果急性毒性试验结果见表 1,采用胚胎死亡率来计算稀有鮈鲫的急性毒性值,利用直线回归法对死亡率数据进行拟合分析。以氧苯酮试验浓度为X,平均死亡率转换的概率单位为Y,得到氧苯酮对稀有鮈鲫胚胎96 h急性毒性试验的线性回归方程为:
| $ Y = 0.157X - 0.187, {r^2} = 0.977, p = 0.001 < 0.05 。$ |
|
|
表 1 稀有鮈鲫胚胎急性毒性试验结果 Table 1 Results of embryonic acute toxicity text of G. rarus |
式中线性拟合图形见图 1(c)。通过概率分析得稀有鮈鲫的96 h-LC50为4.184 mg/L,95%置信区间为3.667~4.791 mg/L。
2.2 慢性毒性试验结果 2.2.1 草虾的慢性毒性试验结果试验中空白对照以及溶剂对照组平均死亡率为6.7%,暴露组35.8、53.7、80.6、120.9、181.4和272.1 μg/L的死亡率分别为11.3%、18.7%、22%、25.3%、28.7%和70.7%。通过SPSS 25软件中的Dunn-Sidak多组数据间差异分析,结果表明,从53.7 μg/L试验组开始,虾的死亡率与对照组出现显著差异,经拟合分析得出氧苯酮对草虾的NOEC(35.8 μg/L)、LOEC(53.7 μg/L)。
2.2.2 稀有鮈鲫慢性毒性试验结果稀有鮈鲫慢性毒性试验结果见表 2,通过SPSS 25软件中的Dunn-Sidak多组数据间差异分析。结果表明:从71.7 μg/L试验组开始,稀有鮈鲫的死亡率以及畸形率与对照组出现显著差异;从39.8 μg/L试验中开始,异常率与对照组出现显著差异;对于孵化率而言,任何试验组均与对照组无差别。本研究采用畸形率作为慢性毒性指标,得出氧苯酮对稀有鮈鲫的NOEC(39.8 μg/L),LOEC(71.7 μg/L)。
|
|
表 2 稀有鮈鲫慢性毒性试验结果 Table 2 Results of chronic toxicity test of Gobiocypris rarus |
通过搜集、筛选以及试验得到的氧苯酮对水生生物的急性毒性数据涵盖了7门、15科、21物种(见表 3);而慢性毒性数据涵盖了5门、7科、9物种(见表 4)。
|
|
表 3 氧苯酮的急性毒性数据 Table 3 Acute toxicity data of oxybenzone |
|
|
表 4 氧苯酮的慢性毒性数据 Table 4 Chronic toxicity data of oxybenzone |
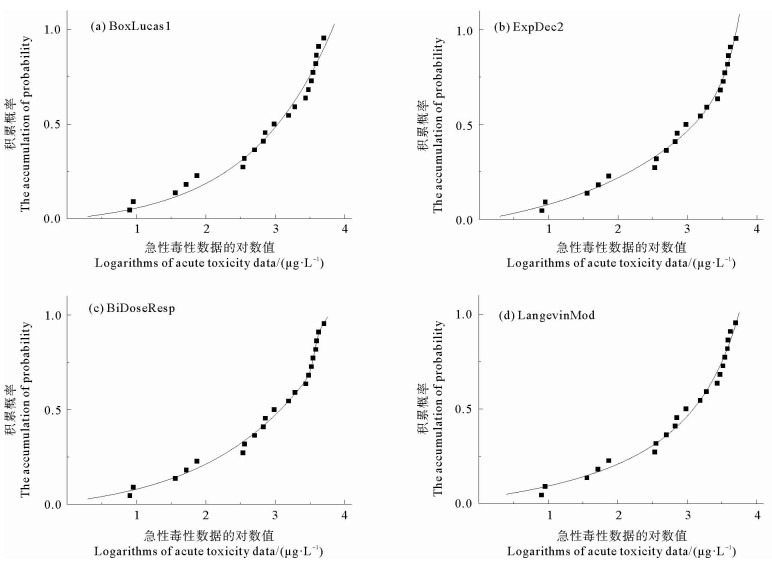
将筛选获得以及试验补充的的氧苯酮急性毒性数据进行K-S检验。经检验,毒性数据的对数值符合正态分布(双尾显著性值:0.2>0.05,均值2.779,标准偏差0.888),可用于急性水质基准推导。将不同物种的毒性数据的对数值作为横坐标、其对应的累积概率值作为纵坐标绘制SSD曲线,通过Origin 2018中多种非线性函数模型进行拟合,得到了相应拟合曲线,其中BoxLucas1、ExpDec2、BiDoseResp和LangevinMod模型的R2均大于97%,拟合结果较好,拟合图形见图 2。结合曲线拟合表征参数值(见表 5),BiDoseResp模型的R2最大且RSS最小,故该模型对毒性数据的拟合结果最好(见图 2(c)),选择该模型数据推导水质基准值,其中HC5为4.262 μg/L,由AF取值2,则SWQC为2.131 μg/L。采用FACR法对LWQC值进行推导,根据6个物种计算得到的FACR值为18.86(见表 6),经计算LWQC为0.113 μg/L。
|
图 2 不同模型拟合氧苯酮急性毒性数据的SSD曲线 Fig. 2 SSD curves of oxybenzone acute toxicity data fitted by different models |
|
|
表 5 不同模型拟合氧苯酮急性毒性数据的表征参数 Table 5 Characterization parameter of oxybenzone acute toxicity data fitted by different models |
|
|
表 6 推导氧苯酮最终急慢性比率的毒性数据 Table 6 derived toxicity data for the final acute to chronic ratio of oxybenzone |
本文搜集筛选了来自世界各地典型水体(如河流、湖泊、近海海湾、污水处理厂等)中氧苯酮的环境暴露数据(见表 7)。氧苯酮的暴露浓度范围为0~1 395 000 ng/L,其中美国夏威夷圣约翰岛海水中的氧苯酮浓度最高。经计算,在所搜集的水体数据中,各地水体的急性风险商的集中在0.001~65.46,急性风险商的平均值为3.04;慢性风险商则集中在0.011~650.4,其平均值为30.78。存在急性高风险的水体占所有研究水体的4.5%,急性中风险的水体占27.3%,急性低风险的水体68.2%,故在急性风险商中,主要以中低风险为主;而存在慢性高风险的水体占所研究水体的31.8%,慢性中风险的水体占22.7%,慢性低风险的水体占45.5%。由此可见,慢性风险商中,低、中、高风险的区别并不显著。
|
|
表 7 世界各地水域中氧苯酮的生态风险商值 Table 7 Ecological risk quotient values of oxybenzone in waters around the world |
通过急性毒性试验,发现随着氧苯酮含量的升高,草鱼和草虾明显出现了游动迟缓,摄食无力等表现。这说明氧苯酮即使没有导致生物死亡,也能对生物生理机能造成显著的影响。而对于稀有鮈鲫胚胎试验的观察表明,氧苯酮能够对胚胎的孵化以及存活产生不同程度的抑制作用,随着浓度的升高,胚胎往往没有孵化便已经畸形或者死亡,而对照组则没有相应的阳性反应。Blüthgen等[26]研究表明,氧苯酮作为一种雌激素类似物,从而会导致涉及类固醇生成和激素通路的基因发生改变,影响鱼类的胚胎发育及生殖受精等过程,这应该是造成相关毒性效应的根本原因。此外,Jannesson等[40]研究发现,氧苯酮作为一种内分泌和神经系统的干扰物,可以诱发鱼类发育和出生缺陷,而本研究在稀有鮈鲫胚胎慢性试验中也发现,添加不同浓度的氧苯酮后,幼鱼发生了不同程度的畸形以及行为障碍,如抽搐、斜向游泳甚至不游动等。
3.2 水生生物水质基准分析Yang等[18]筛选以及试验补充用以推导氧苯酮PNEC值的毒性数据包含大型溞、日本青鳉和月牙藻的NOEC,通过AF法推导得出PNEC值为1.8 μg/L。而Paredes等[20]筛选以及试验得出氧苯酮的毒性数据包含糠虾、海胆、紫贻贝以及球等鞭金藻的NOEC,采用AF法推导得出PNEC值为0.013 9 μg/L。本研究所采用的毒性数据有日本青鳉、虹鳟鱼、稀有鮈鲫、斑马鱼、金鱼、大型蚤、草虾、球等鞭金藻以及月牙藻的NOEC,采用FACR法推导出得出LWQC为0.113 μg/L,结果介于两者之间,与两个各差一个数量级。主要原因可能有以下几点:(1)Yang等[17]和Paredes等[19]所采用的毒性数据较少,涵盖的营养级不够全面,且部分毒性数据暴露时长不足14 d,而本研究所采用的数据经过严格筛选,去除异常数据,且覆盖面更大,更具有代表性;(2)Yang等[17]和Paredes等[19]采用AF法,仅通过几个毒性数据中的最低值对氧苯酮PNEC值进行推导,而本研究采用的FACR值,综合考虑了各个物种的慢性毒性数据以及由急性毒性数据所推导的SWQC值,故所得到的LWQC值更具合理性。
3.3 生态风险评估分析通过研究不同水体受污染的情况,能够得出海水水体受到氧苯酮的危害相对于淡水水体更严重,且旅游业发达的海滩地区水域污染最显著,这是由于海滩旅游区防晒霜等含有氧苯酮的化妆品使用较为普遍,导致其大量进入海水,危害海洋生态系统。Sieratowicz等[41]研究表明,随着沿海旅游业的蓬勃发展,经由游客活动被带入到海洋生态系统中的防晒霜数量呈现逐年上升的趋势,每年约有14 000 t防晒霜进入世界海洋珊瑚礁系统,这是导致海水中氧苯酮含量升高的主要原因。从风险商表征看出,世界各地水体均受到氧苯酮不同程度的危害,慢性风险尤为突出,各国不可忽视氧苯酮对水生态系统造成的影响,尤其是对海洋生态系统造成的危害。
3.4 不确定性分析由于受限于毒性数据、拟合模型等因素,本研究所得结论只能反映现有数据条件下的结果,其中存在的不确定因素主要有: (1)毒性数据不确定性。对于推导的氧苯酮水质基准而言,最好的情况的对海水和淡水分开研究以制定,得出的结论会更具有针对性。而对于特定水域而言,针对当地特有物种进行制定相应水质基准则更具代表性。故该基准能否反映所有水生生物的真实情况具有不确定性。(2)模型不确定性。本文在推导基准的过程中采用了Origin软件,该软件基于一些理论假设模型,这些理论假设模型和现实场景的差异肯定也会对结果带来不确定性。此外,在进行数据拟合的过程中,常用的模型都不可能做到完美地拟合每一个数据点,这也是风险评价不确定性的来源之一。(3)参数不确定性。参数的不确定性涉及试验误差、数据的选择和外推的不确定性等。
4 结论(1) 本研究对草鱼、草虾、稀有鮈鲫3种物种进行了氧苯酮的急慢性毒性试验,其中对稀有鮈鲫进行了胚胎毒性试验,从产卵到孵化成仔鱼等一系列过程进行了观测研究,得出了相应的毒理学数据。其中草鱼的LC50为272 μg/L;草虾的LC50为1 539 μg/L,LOEC为53.7 μg/L。稀有鮈鲫的LC50为4 184 μg/L,LOEC为71.7 μg/L。
(2) 本研究通过搜集整理的氧苯酮毒理学数据,结合补充毒性试验数据,以物种敏感度分布法为基础,采用BoxLucas1、ExpDec2、BiDoseResp和LangevinMod模型对氧苯酮的急性毒性数据进行拟合,其中BiDoseResp模型拟合最佳,以此为基础,推导出氧苯酮的SWQC值为2.131 μg/L。由于慢性毒性数据不足,故采用急慢性比法推导得出氧苯酮的LWQC值为0.113 μg/L。
(3) 本研究在推导出氧苯酮的急慢性基准值的基础上,采用商值法对各水域环境中氧苯酮的生态风险进行了初步评估。结果表明,目前世界各地水域急性生态风险相对较低,但是慢性生态风险较为明显,尤其是旅游业发达的海域地区(如美国夏威夷圣约翰岛以及夏威夷瓦胡岛的慢性生态风险均处于高风险水平),应引起沿海国家的重视。
| [1] |
Baker L A, Horbury M D, Greenough S E, et al. Probing the ultrafast energy dissipation mechanism of the sunscreen oxybenzone after UVA irradiation[J]. Journal of Physical Chemistry Letters, 2015, 6(8): 1363-1368. DOI:10.1021/acs.jpclett.5b00417 (  0) 0) |
| [2] |
Giokas D L, Salvador A, Chisvert A. UV filters: From sunscreens to human body and the environment[J]. Trend Anal Chem, 2007, 26: 360-374. DOI:10.1016/j.trac.2007.02.012 (  0) 0) |
| [3] |
Vione D, Caringella R, De L E, et al. Phototransformation of the sunlight filter benzophenone-3 (2-hydroxy-4-methoxybenzophenone) under conditions relevant to surface waters[J]. Science of the Total Environment, 2013, 463-464: 243-251. DOI:10.1016/j.scitotenv.2013.05.090 (  0) 0) |
| [4] |
Sieratowicz A, Kaiser D, Behr M, et al. Acute and chronic toxicity of four frequently used UV filter substances for Desmodesmus subspicatus and Daphnia magna[J]. Journal of Environmental Science and Health Part A Toxic/Hazardous Substances and Environmental Engineering, 2011, 46(12): 1311-1319. (  0) 0) |
| [5] |
朋玲龙, 王先良, 王菲菲, 等. 国外水质健康基准的研究进展及其对我国基准制订的启示[J]. 环境与健康杂志, 2014, 31(3): 276-279. Peng L L, Wang X L, Wang F F, et al. Research progress of foreign water quality health criteria and its enlightenment to China[J]. Journal of Environment and Health, 2014, 31(3): 276-279. (  0) 0) |
| [6] |
Posthuma L, Suter G W I, Traas T P. Species Sensitivity Distributions in Ecotoxicology[M]. Boca Raton, CRC: Lewis Publishers, 2002.
(  0) 0) |
| [7] |
中华人民共和国国家环境保护标准. HJ 831-2017淡水水生生物水质基准制定指南[S]. 北京: 中国环境出版社, 2017. National environmental protection standards of the People's Republic of China. HJ 831-2017 Guidelines for the Development of Freshwater Aquatic Water Quality Standards[S]. Beijing: China Environment Press, 2017. (  0) 0) |
| [8] |
United States Environmental Protection Agency (US EPA). Guidelines for Deriving Numerical National Water Quality Criteria for the Protection of Aquatic Organisms and Their Uses. National Technical Information Service Accession Number PB85-227049[R]. Washington DC: US EPA, 1985: 1-54.
(  0) 0) |
| [9] |
National Institute of Public Health and the Environment (RIVM). Guidance Document on Deriving Environmental Risk Limits in the Netherlands[R]. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu, 2001.
(  0) 0) |
| [10] |
Hoque M T, Yusoff F M, Law T, et al. Effect of hydrogen sulphide on liver somatic index and Fulton's condition factor in Mystus nemurus[J]. Journal of Fish Biology, 2005, 52(1): 23-30. (  0) 0) |
| [11] |
United States Environmental Protection Agency (US EPA). Guidelines for Deriving Numerical National Water Quality Criteria for the Protection of Aquatic Organisms and Their Uses. National Technical Information Service Accession Number PB85-227049[R]. Washington DC: US EPA, 1985: 1-54.
(  0) 0) |
| [12] |
Parkhurst B R, Warren W. Aquatic Ecological Risk Assessment: A Multi-tiered Approach, Project 91-AER-1[R]. Alexandria(VA): Water Environment Research Foundation, 1996.
(  0) 0) |
| [13] |
European Chemicals Bureau (ECB). Technical Guidance Document on Risk Assessment in Support of Commission Directive 93/67/EEC on Risk Assessment for New Notified Substances, Commission Regulation (EC) No. 1488/94 on Risk Assessment for Existing Substances and Directive 98/8/EC of the European Parliament and of the Council Concerning the Placing of Biocidal Products on the Market. Part Ⅱ: Environmental Risk Sssessment[R]. Ispra, Italy: European Chemicals Bureau, European Commission Joint Research Center, European Communities, 2003.
(  0) 0) |
| [14] |
徐镜波, 马逊风. 温度、氨对鲢、鳙、草、鲤鱼的影响[J]. 中国环境科学, 1994(3): 214-219. Xu J B, Ma X F. Effects of temperature and ammonia on silver carp, bighead carp, grass and carp[J]. China Environmental Science, 1994(3): 214-219. (  0) 0) |
| [15] |
孙振中, 刘淑梅, 戚隽渊, 等. 非离子氨氮对罗氏沼虾幼体的毒性研究[J]. 水产科技情报, 1999(4): 30-32. Sun Z Z, Liu S M, Qi J Y, et al. Study on the toxicity of non-ion ammonia nitrogen to Macrobrachium rosenbergii larvae[J]. Aquatic Science and Technology Information, 1999(4): 30-32. (  0) 0) |
| [16] |
曹文宣, 王剑伟. 稀有鮈鲫——一种新的鱼类实验动物[J]. 实验动物科学与管理, 2003(20): 96-99. Cao W X, Wang J W. Gobio gobio, a new experimental fish animal[J]. Journal of Experimental Animal Science and Management, 2003(20): 96-99. (  0) 0) |
| [17] |
农业部农药检定所. 经济合作与发展组织(OECD)化学品测试准则[M]. 北京: 中国农业出版社, 2013. Institute for the Control of Agrochemicals, MOA. OECD Guidelines for the Testing of Chemicals[M]. Beijing: China Agriculture Press, 2013. (  0) 0) |
| [18] |
Yang D, Wang W Q, Pei Z T, et al. Acute toxicity and ecological risk assessment of benzophenone-3 (BP-3) and benzophenone-4 (BP-4) in ultraviolet (UV)-filters[J]. Public Health, 2017, 14(11): 1414. (  0) 0) |
| [19] |
Kim S, Jung D, Kho Y, et al. Effects of benzophenone-3 exposure on endocrine disruption and reproduction of Japanese medaka (Oryzias latipes) —A two generation exposure study[J]. Aquat. Toxicol, 2014, 155: 244-252. DOI:10.1016/j.aquatox.2014.07.004 (  0) 0) |
| [20] |
Paredes E, Perez S, Rodil R, et al. Ecotoxicological evaluation of four UV filters using marine organisms from different trophic levels Isochrysis galbana, Mytilus galloprovincialis, Paracentrotus lividus and Siriella armata[J]. Chemosphere, 2014, 104: 44-50. DOI:10.1016/j.chemosphere.2013.10.053 (  0) 0) |
| [21] |
Fent K, Kunz P Y, Zenker A, et al. A tentative environmental risk assessment of the UV-filters 3-(4-methylbenzylidene-camphor), 2-ethyl-hexyl-4-trimethoxycinnamate, benzophenone-3, benzophenone-4 and 3-benzylidene camphor[J]. Marine Environmental Research, 2010, 69: 4-6. DOI:10.1016/j.marenvres.2009.10.010 (  0) 0) |
| [22] |
Li M H. Acute toxicity of benzophenone-type UV filters and paraben preservatives to freshwater planarian, Dugesia japonica[J]. Toxicological & Environmental Chemistry, 2012, 94(3): 566-573. (  0) 0) |
| [23] |
Downs C A, Winter E K, Segal R, et al. Toxicopathological effects of the sunscreen UV filter, oxybenzone (benzophenone-3), on coral planulae and cultured primary cells and its environmental contamination in Hawaii and the U.S. virgin islands[J]. Archives of Environmental Contamination and Toxicology, 2016, 70(2): 265-288. DOI:10.1007/s00244-015-0227-7 (  0) 0) |
| [24] |
Esperanza M, Seoane M, Rioboo C, et al. Differential toxicity of the UV-filters BP-3 and BP-4 in Chlamydomonas reinhardtii: A flow cytometric approach[J]. Science of the Total Environment, 2019, 669: 412-420. DOI:10.1016/j.scitotenv.2019.03.116 (  0) 0) |
| [25] |
Coronado M, Haro H D, Deng X, et al. Estrogenic activity and reproductive effects of the UV-filter oxybenzone (2-hydroxy-4-methoxyphenyl-methanone) in fish[J]. Aquat Toxicol, 2008, 90(3): 182-187. DOI:10.1016/j.aquatox.2008.08.018 (  0) 0) |
| [26] |
Blüthgen N, Zucchi S, Fent K. Effects of the UV filter benzophenone-3 (Oxybenzone) at low concentrations in zebrafish (Danio rerio)[J]. Toxicological & Environmental Chemistry, 2012, 263(2): 184-194. (  0) 0) |
| [27] |
Liu H, Sun P, Yang S, et al. Hepatic oxidative stress biomarker responses in freshwater fish Carassius auratus exposed to four benzophenone UV filters[J]. Ecotoxicology and Environmental Safety, 2015, 119: 116-122. DOI:10.1016/j.ecoenv.2015.05.017 (  0) 0) |
| [28] |
Tsui M M P, Leung H W, Wai T C, et al. Occurrence, distribution and ecological risk assessment of multiple classes of UV filters in surface waters from different countries[J]. Water Research, 2014, 67: 55-65. DOI:10.1016/j.watres.2014.09.013 (  0) 0) |
| [29] |
Ma B N, Lu G H, Liu F L, et al. Organic UV filters in the surface water of Nanjing, China: Occurrence, distribution and ecological risk assessment[J]. Bull Environ Contam Toxicol, 2016, 96: 530-535. (  0) 0) |
| [30] |
Li W, Ma Y, Guo C, et al. Occurrence and behavior of four of the most used sunscreen UV filters in a wastewater reclamation plant[J]. Water Research, 2007, 41(15): 3506-3512. DOI:10.1016/j.watres.2007.05.039 (  0) 0) |
| [31] |
Pai C W, Leong D, Chen C Y, et al. Occurrences of pharmaceuticals and personal care products in the drinking water of Taiwan and their removal in conventional water treatment processes[J]. Chemosphere, 2020, 256: 127002. (  0) 0) |
| [32] |
Bargar T A, Alvarez D A, Garrison V H. Synthetic ultraviolet light filtering chemical contamination of coastal waters of virgin islands national park, St. John, US. Virgin Islands[J]. Marine Pollution Bulletin, 2015, 101: 193-199. (  0) 0) |
| [33] |
Tashiro Y, Kameda Y. Concentration of organic sun-blocking agents in seawater of beaches and coral reefs of Okinawa Island, Japan[J]. Marine Pollution Bulletin, 2013, 77(1-2): 333-340. (  0) 0) |
| [34] |
Ekpeghere K I, Kim U J, O S H, et al. Distribution and seasonal occurrence of UV filters in rivers and wastewater treatment plants in Korea[J]. Science of the Total Environment, 2016, 542: 121-128. (  0) 0) |
| [35] |
Balmer M E, Buser H R, Müller M D, et al. Occurrence of some organic UV filters in wastewater, in surface waters, and in fish from Swiss lakes[J]. Environmental Science and Technology, 2005, 39(4): 953-962. (  0) 0) |
| [36] |
Magi E, Scapolla C, Carro M D, et al. Emerging pollutants in aquatic environments: Monitoring of UV filters in urban wastewater treatment plants[J]. Analytical Methods, 2013, 5: 428-433. (  0) 0) |
| [37] |
Langford K H, Thomas K V. Inputs of chemicals from recreational activities into the Norwegian coastal zone[J]. Journal of Environmental Monitoring, 2008, 10: 894-898. (  0) 0) |
| [38] |
Rodríguez A S, Sanz M R, Rodríguez J R B. Occurrence of eight UV filters in beaches of Gran Canaria (Canary Islands). An approach to environmental risk assessment[J]. Chemosphere, 2015, 131: 85-90. (  0) 0) |
| [39] |
Silva C P D, Emídio E S, Marchi M R R D. The occurrence of UV filters in natural and drinking water in São Paulo State (Brazil)[J]. Environmental Science and Pollution Research, 2015, 22: 19706-19715. (  0) 0) |
| [40] |
Jannesson L, Birkhed D, Scherl D, et al. Effect of oxybenzone on PGE2-production in vitro and on plaque and gingivitis in vivo[J]. Journal of Clinical Periodontology, 2004, 31: 91-94. (  0) 0) |
| [41] |
Sieratowicz A, Kaiser D, Behr M, et al. Acute and chronic toxicity of four frequently used UV filter substances for Desmodesmus subspicatus and Daphnia magna[J]. Journal of Environmental Science and Health Part A Toxic/Hazardous Substances and Environmental Engineering, 2011, 46(12): 1311-1319. (  0) 0) |
2. Key Laboratory of Marine Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China
 2022, Vol. 52
2022, Vol. 52


