长牡蛎(Crassostrea gigas)是中国主要海水贝类养殖品种,具有生长快,产量高的特点。为达到遗传改良的目的,促进牡蛎养殖业的持续健康发展,近年来,牡蛎育种学家开展了多项选择和杂交育种工作,如Li等[1]开展了长牡蛎中日韩三个地理群体的选育工作并培育出新品种“海大1号”;Zhang等[2]将长牡蛎与香港巨牡蛎的杂交子代与亲代回交,通过选育回交子代培育出新品种“华南1号”。实践证明科学的育种方法可以提高牡蛎的表型性状,创造出巨大的经济及社会价值,而杂交育种作为一种传统的育种手段,能够结合双亲的优良性状,甚至产生某些双亲所没有的性状,创造出全新的变异类型[3]。
岩牡蛎(Crassostrea nippona)自然分布于日本和韩国东南沿海,由于其味道鲜美,出肉率高,且壳形优美,可夏季供应市场,经济价值十分可观。岩牡蛎性成熟期是2~3 a[4],相比长牡蛎生长速度较慢。长牡蛎和岩牡蛎同属于巨蛎属(Crassostrea),存在互补性状,若能进行种间杂交,有望培育出具有杂种优势的新品种。鉴于种间杂交技术难度高,容易出现配子不亲和、杂交子代生长缓慢等问题[5],因此需要对胚胎发育的早期性状如配子兼容性、细胞遗传学等进行研究,以探索利用种间杂交培育新品种的可行性。
配子不兼容是指来自一个个体的精子与另外一个个体的卵子不能完成受精作用[6],属于合子前生殖隔离[7]。配子兼容性是贝类种间杂交的重要研究内容之一,配子不兼容主要是与控制配子结合相关的基因发生变异所致,如控制结合素(Bindin)、细胞溶素(Lysin)等合成的基因[8]。学者们从受精细胞学方面研究了长牡蛎×熊本牡蛎(C.sikamea)[9]、岩牡蛎×长牡蛎[10]、栉孔扇贝(Chlamys farreri)×虾夷扇贝(Patinopecten yessoensis)[11]、华贵栉孔扇贝(Chlamys nobilis)×栉孔扇贝(Chlamys farreri)[12]及紫贻贝(Mytilus edulis)×厚壳贻贝[13](M.coruscus)的早期胚胎发育;从受精及孵化方面研究了香港巨牡蛎(C.hongkongensis)×长牡蛎[14]、葡萄牙牡蛎(C.angulata)×熊本牡蛎[15]、紫扇贝(Argopecten purpuratus)×海湾扇贝(A.irradians irradians)[16]、海湾扇贝×虾夷扇贝[17]的生殖隔离机制。而合子不育是指两个物种的配子可以发生受精作用,但是受精后胚胎发育过程受阻的现象,属于合子后生殖隔离[7]。合子育性水平也是种间杂交的重要研究内容之一,种间杂交生殖能力的减弱是由于减数分裂异常导致[18],在贝类种间杂交中存在许多能够受精却无法进行胚胎发育的现象,对合子育性进行研究,是提高种间杂交成功率的重要前提。
本研究以配子兼容性作为合子受精前隔离指标,以合子育性作为合子受精后隔离指标,对长牡蛎和岩牡蛎生殖隔离格局进行探讨,这对研究长牡蛎和岩牡蛎的种间杂交、物种形成与进化等都具有重要意义。
1 材料与方法 1.1 实验材料实验亲贝选用2015年构建的岩牡蛎养殖群体和2016年构建的长牡蛎“海大1号”群体。为解决岩牡蛎与长牡蛎性腺发育不同步的问题,将岩牡蛎置于莱州海益苗业有限公司20 m3水泥池进行室内催熟,促熟期间水温27~31 ℃,盐度29~32,至2017年7月下旬,岩牡蛎性腺发育成熟;7月初将性成熟的长牡蛎置于17~18 ℃冷水中抑制其排卵,海水温度由循环式冷水机调控。
1.2 实验设计选择对牡蛎受精孵化较为重要的3个指标(温度、盐度和精子浓度)来阐明长牡蛎和岩牡蛎种间配子兼容性与合子育性水平。综合考虑长牡蛎和岩牡蛎的适应特点,设计5个温度梯度(17、21、25、29和33 ℃)和5个盐度梯度(18、22、26、30和34),为保证实验数据准确,每个交配组合设置3个生物学重复。选择性腺饱满的长牡蛎和岩牡蛎雌雄各5个个体,解剖性腺组织获取精卵并将每个种类的5个个体卵子混合到一起,精子混合到一起,进行完全双列杂交,得到4个交配组合:长牡蛎♀×长牡蛎♂(GG)、长牡蛎♀×岩牡蛎♂(GN)、岩牡蛎♀×长牡蛎♂(NG)、岩牡蛎♀×岩牡蛎♂(NN)。实验于2 L水族箱中进行,卵子密度为30~ 40个/mL。温度实验中,利用循环式冷水机和加热棒控制温度,盐度保持在29;盐度实验中,温度保持在28 ℃。
精子密度是评估种间杂交配子兼容性的重要因素,并可能解释受精障碍的进化机制[19]。参照Banks等[20]对贝类杂交配子兼容性格局的分析,设计5个精子浓度梯度(100、101、102、103和104个/μL),其中精子通过血球计数板测定密度。温度设置为28 ℃,盐度设置为29。
1.3 数据处理为保证方差齐性,受精率及孵化率均转化为反正弦函数,精子浓度转化为对数函数。实验数据采用SPSS 19.0软件进行单因素方差分析(One-Way ANOVA),并结合Turkey多重比较分析温度、盐度对种间配子兼容性和合子育性的影响。显著性水平设为P < 0.05。
2 结果 2.1 温度对受精率和孵化率的影响如图 1所示,GG组受精率受温度影响较小,维持在78%~87%之间;NN组受精率随温度的升高先增大后降低,29 ℃时受精率最高,为82.8%;GN与NG组最适受精温度为分别为21和25 ℃,对应受精率分别是43.7%和42.8%。方差分析显示,17~33 ℃时GG组受精率显著高于2个杂交组(P < 0.05);21~33 ℃时NN组显著高于2个杂交组(P < 0.05);在17~33 ℃之间时2个杂交组受精率无显著性差异(P > 0.05)(见表 1)。
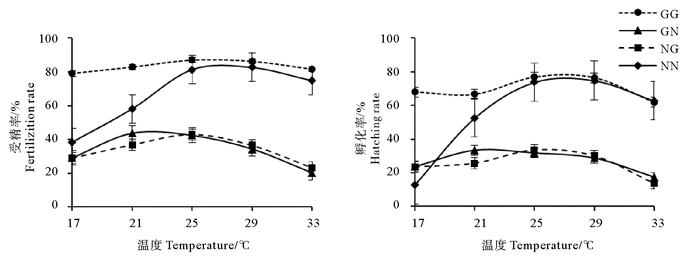
|
图 1 温度对配子兼容性和合子育性的影响 Fig. 1 Effect of temperature on gamete compatiblity and zygote fertility |
|
|
表 1 温度对配子兼容性和合子育性影响的方差分析 Table 1 Analysis of variance for the effect of temperature on gamete compatibility and zygote fertility |
4个实验组孵化率变化趋势与受精率基本类似,GG、GN、NG和NN组孵化率最大值分别为76.9%、33.5%、33.4%和74.8%。方差分析表明,在17和21℃,GG与NN差异显著(P < 0.05),随着温度升高,两自繁组孵化率差异不显著(P > 0.05);当温度为17~33 ℃时,GG组孵化率显著高于两杂交组(P < 0.05),在21~33 ℃之间时,NN组显著高于两杂交组(P < 0.05);同受精率一样,两杂交组孵化率无显著性差异(P > 0.05)(见表 1)。方差分析结果表明,温度是影响NN、NG、GN受精率和孵化率的主要因素,但对GG影响较小(见表 2)。
|
|
表 2 温度、盐度作用对配子亲和力及合子育性的影响 Table 2 Analyses of variance showing temperature and salinity effects for gamete compatibility and zygote fertility |
GG组受精率受盐度影响较小,维持在76.9%~86.6%之间;NN组受精率随盐度的升高先增加后降低,最适盐度为30,对应受精率为85.0%;GN组受精率在30时出现最大值,为31.6%,随后随盐度的升高而降低;NG组在26时出现最大值41.2%,相比于NG组,GN组受盐度影响小(见图 2)。方差分析显示,GG和NN组受精率在盐度18~22时差异显著(P < 0.05),在26~34之间差异不显著(P > 0.05),自繁组受精率显著大于两杂交组(P < 0.05);GN和NG组受精率在18~34之间差异显著(P < 0.05)(见表 3)。
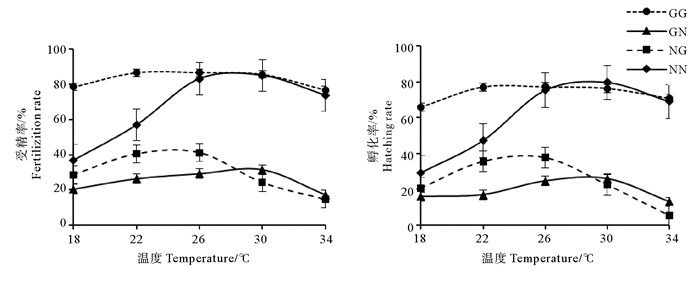
|
图 2 盐度对配子兼容性和合子育性的影响 Fig. 2 Effect of salinity on gamete compatiblity and zygote fertility |
|
|
表 3 盐度对配子兼容性和合子育性影响的方差分析 Table 3 Analysis of variance for the effect of salinity on gamete compatibility and zygote fertility |
4个实验组孵化率变化趋势与受精率基本一致,GG、GN、NG和NN组最大孵化率分别为77.3%、25.9%、37.7%和79.8%。GG和NN组受精率在盐度18~22时差异显著(P < 0.05),在26~34之间差异不显著(P > 0.05);在18~34,GG组与2个杂交组差异显著(P < 0.05);盐度为18时,NN、GN和NG三组差异均不显著;而盐度为18、22、30和34时,GN与NG组差异不显著(P < 0.05)。盐度是影响NN、NG、GN组受精率和孵化率最主要因素,但是对长牡蛎影响不显著(P > 0.05)。温度和盐度的交互作用对杂交组受精率和孵化率具有显著影响(见表 3)。
2.3 精子浓度如图 3所示,自繁组的受精率和孵化率显著高于2个杂交组(P < 0.05);相比于其他3组,GG组受精率受精子浓度影响小,NN组受精率在精子浓度103个/μL时最大,为88.3%,其后随精子浓度增加有减小趋势;当精子浓度为100 ~ 104个/μL时,GN和NG两组受精率随精子浓度的增大而增大,最大受精率出现在104个/μL,分别是43.9%和46.2%,两组之间受精率差异不显著(P >0.05)。就孵化率而言,GG、GN、NG和NN组最大孵化率分别为76.1%、39.9%、44.2%和81.9%,2个自繁组在精子浓度100、101和102个/μL时差异显著(P < 0.05),但随着精子浓度继续升高,差异不显著(P > 0.05);两杂交组孵化率在精子浓度100 ~ 104个/μL时差异不显著(P > 0.05)(见表 4)。
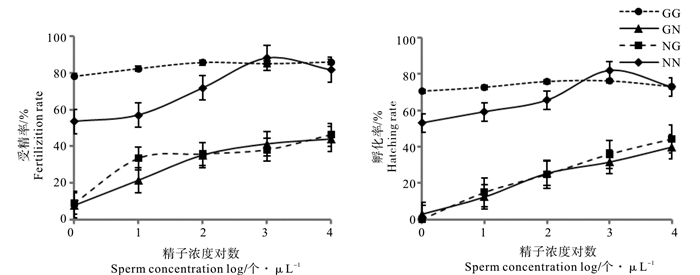
|
图 3 精子浓度对配子兼容性和合子育性的影响 Fig. 3 Effect of sperm concentration on gamete compatiblity and zygote fertility |
|
|
表 4 精子浓度对配子兼容性和合子育性影响的方差分析 Table 4 Analysis of variance for the effect of sperm concentration on gamete compatibility and zygote fertility |
配子兼容性水平与精子和卵子结合的能力密切相关,一般而言,配子不兼容表现为不完全受精并且经常是单向受精[6]。本研究表明长牡蛎与岩牡蛎种间杂交是双向受精,即产生正反交子代,但是种间杂交受精率较低,在最佳实验条件下仅为40%~50%,远远低于自繁组受精率,也低于其他巨蛎属种间杂交受精率,如长牡蛎♂×香港巨牡蛎♀(61.6%)[21]、香港巨牡蛎♂×熊本牡蛎(57.2%)[22]、熊本牡蛎♂×香港巨牡蛎♀(82.1%)[22]、葡萄牙牡蛎♂×香港巨牡蛎♀ (61.9%)[23],这可能是由于岩牡蛎与长牡蛎亲缘关系较远造成遗传差异大[24],生殖细胞不能正常结合,从而表现出受精障碍。
温度、盐度和精子浓度对NN、NG和GN三组受精率具有显著影响,但对GG组合受精率影响不显著,表明长牡蛎对温度和盐度具有较强的耐受性,这与Gagnaire等[25]的结论一致。大量研究表明较高的精子浓度有助于提高种间杂交的受精率[18, 26-27],但是过高精子浓度会导致畸形率的增加,本研究杂交组受精率随精子浓度增加呈现出递增趋势,均显著低于自繁组,杂交组精子能够游向卵子发生趋化作用,但是多数精子不能与异种卵子完成受精作用,配子识别蛋白的分化可能导致了两物种受精的不完全兼容性[28]。在温度实验中杂交组最适温度(GN组21 ℃,NG组25 ℃)相比于自繁组NN(29 ℃)偏低。盐度实验中,GG和NG组最适盐度为26,GN和NN组最适盐度为30,表现出适盐性的父系遗传趋势,而在牡蛎远缘杂交中,幼虫表型性状在前期一般会表现出强烈的母本效应[21]。这种适盐性的父系遗传是否会维持,有待于对稚贝及成贝进行进一步的研究。
3.2 合子育性分析胚胎发育是检验合子育性的重要参考。由于种间杂交亲本间存在生殖隔离,杂交子代可能会出现胚胎发育速度变化和畸形等现象[21]。对于海洋双壳贝类而言,合子不育指精卵能够发生受精作用但无法发育到D形幼虫或发育至D形幼虫无法继续生长的现象[29]。本研究中,4个组孵化率在实验条件下与受精率呈正相关,正反交子代均得到正常D形幼虫,且杂交组幼虫发育至D形幼虫未观察到明显的延迟,说明长牡蛎与岩牡蛎杂交子孵化成败的关键是受精过程,种间杂交子在孵化阶段具有较好的合子育性,幼虫及稚贝阶段的生长发育情况有待于进一步观察。
对于种间杂交而言,同一杂交组合在不同实验环境条件下结果往往不同[29]。张跃环[21]在不同地点对香港巨牡蛎和长牡蛎种间杂交进行实验,得到了显著不同的幼虫及稚贝数量。考虑到本研究中实验因素对种间受精率及孵化率具有显著影响,在以后的实验中,通过设置不同的外界环境条件来获得更高受精率和孵化率的种间杂交子代是一条可行的途径。
4 结语本研究证明温度、盐度和精子浓度对长牡蛎和岩牡蛎种间配子兼容性和合子育性具有较大影响,并确定了长牡蛎和岩牡蛎杂交子孵化的最适温度和盐度:GN和NG组最适温度分别为21和25 ℃,最适盐度分别为30和26。两者能够双向受精且获得正常D形幼虫,至于合子后生殖隔离有待于进一步研究。本研究结果为进一步开展长牡蛎和岩牡蛎的种间杂交工作、研究两者之间的进化关系提供了重要的基础资料。
| [1] |
Li Q, Wang Q, Liu S, et al. Selection response and realized heritability for growth in three stocks of the Pacific oyster Crassostrea gigas[J]. Fisheries Science, 2011, 77(4): 643-648. DOI:10.1007/s12562-011-0369-0
(  0) 0) |
| [2] |
Zhang Y H, Zhang Y, Li J, et al. Artificial interspecific backcrosses between the hybrid of female Crassostrea hongkongensis ×male C. gigas, and the two parental species[J]. Aquaculture, 2016, 450: 95-101. DOI:10.1016/j.aquaculture.2015.07.013
(  0) 0) |
| [3] |
Rahman M A, Arshad A, Marimuthu, et al. Inter-specific hybridization and its potential for aquaculture of fin fishes[J]. Asian Journal of Animal & Veterinary Advances, 2013, 8(2): 139-153.
(  0) 0) |
| [4] |
Douke A, Munekiyo M, Tsuji S, et al. Reproduction cycle of Iwagaki oyster Crassostrea nippona in western Wakasa Bay[J]. Cultivation Technique Research, 1998, 26(2): 91-98.
(  0) 0) |
| [5] |
张国范, 刘晓, 阙华勇, 等. 贝类杂交及杂种优势理论和技术研究进展[J]. 海洋科学, 2004, 28(7): 54-60. Zhang G F, Li X, Que H Y, et al. The theory and application of hybridization and heterosis in marine mollusks[J]. Marine Sciences, 2004, 28(7): 54-60. DOI:10.3969/j.issn.1000-3096.2004.07.013 (  0) 0) |
| [6] |
Rawson P D, Slaughter C, Yund P O. Patterns of gamete incompatibility between the blue mussels Mytilus edulis and M. trossulus[J]. Marine Biology, 2003, 143(2): 317-325. DOI:10.1007/s00227-003-1084-x
(  0) 0) |
| [7] |
陈婕, 罗觅, 陶敏, 等. 动物和植物远缘杂交比较研究[J]. 中国科学:生命科学, 2016, 46(10): 1139-1161. Chen J, Luo M, Tao M, et al. A comparative study of distant hybridization in plants and animals[J]. Scientia Sinica Vitae, 2016, 46(10): 1139-1161. (  0) 0) |
| [8] |
Palumbi S R, Metz E C. Strong reproductive isolation between closely related tropical sea urchins (genus Echinometra)[J]. Molecular Biology & Evolution, 1991, 8(2): 227-239.
(  0) 0) |
| [9] |
滕爽爽, 李琪, 李金蓉. 太平洋牡蛎(Crassostrea gigas)与熊本牡蛎(C. sikamea)杂交的受精细胞学观察及子一代的生长比较[J]. 海洋与湖沼, 2010, 41(6): 914-922. Teng S S, Li Q, Li J R. Cytological observations of nuclear behavior and comparative growth of the hybrids between Crassostrea gigas and C. sikamea[J]. Oceanologia et Limnologia Sinica, 2010, 41(6): 914-922. (  0) 0) |
| [10] |
滕爽爽, 李琪, 孔令峰. 岩牡蛎和太平洋牡蛎杂交的受精细胞学观察[J]. 中国海洋大学学报(自然科学版), 2009, 39(S1): 338-342. Teng S S, Li Q, Kong L F. Cytological observations of nuclear behavior in the eggs of Reciprocal hybrid crosses between Crassostrea gigas and C. nippona[J]. Periodical of Ocean University of China, 2009, 39(S1): 338-342. (  0) 0) |
| [11] |
杨爱国, 王清印, 刘志鸿, 等. 虾夷扇贝×栉孔扇贝人工受精过程的荧光显微观察[J]. 海洋水产研究, 2002, 23(3): 1-4. Yang A G, Wang Q Y, Liu Z H, et al. Cytological observation on cross fertilization of Chlamys farreri and Patinopecten yesoensis with fluorescent microscope[J]. Marine Fisheries Research, 2002, 23(3): 1-4. (  0) 0) |
| [12] |
王珏, 毕克, 黄晓婷, 等. 华贵栉孔扇贝♀×栉孔扇贝♂远缘杂交的受精细胞学观察[J]. 生物技术通报, 2006, 6: 122-126. Wang Y, Bi K, Huang X T, et al. Cytological observation on hybrid fertilization on Chlamys nobilis ♀×Chlamys farreri♂ with fluorescent microscope[J]. Biotechnology Bulletin, 2006, 6: 122-126. DOI:10.3969/j.issn.1002-5464.2006.06.028 (  0) 0) |
| [13] |
陈兴强, 李荣华, 王春琳, 等. 紫贻贝(Mytilus edulis)与厚壳贻贝(M. coruscus)杂交的细胞学观察及子一代的早期生长比较[J]. 海洋与湖沼, 2017, 48(3): 600-608. Chen X Q, Li R H, Wang C L, et al. Cytological observation on nuclear behavior of hybrids between Mytilus edulis and M. coruscus and comparison in early-stage growth[J]. Oceanologia et Limnologia Sinica, 2017, 48(3): 600-608. (  0) 0) |
| [14] |
张跃环, 王昭萍, 闫喜武, 等. 香港巨牡蛎与太平洋牡蛎种间配子兼容性[J]. 生态学报, 2013, 33(10): 3047-3055. Zhang Y H, Wang Z P, Yan X W, et al. Analysis of gamete compatibility between Crassostrea hongkongensis and C. gigas[J]. Acta Ecologica Sinica, 2013, 33(10): 3047-3055. (  0) 0) |
| [15] |
苏家齐, 王昭萍, 张跃环, 等. 葡萄牙牡蛎与熊本牡蛎种间配子亲和力及合子育性分析[J]. 水产学报, 2015, 39(3): 353-360. Su J Q, Wang Z P, Zhang Y H, et al. Analysis of gamete compatibility and zygote fertility for Crassostrea angulate and Crassostrea sikamea[J]. Journal of Fisheries of China, 2015, 39(3): 353-360. (  0) 0) |
| [16] |
Wang C, Liu B, Li J, et al. Introduction of the Peruvian scallop and its hybridization with the bay scallop in China[J]. Aquaculture, 2015, 310(3-4): 380-387.
(  0) 0) |
| [17] |
刘宪杰, 常亚青. 扇贝种间杂交的可行性及幼体早期发育的初步研究[J]. 大连海洋大学学报, 2006, 21(4): 346-349. Liu X J, Chang Y Q. the feasibility of the hybridization in four species of scallop and the early development of their offsprings[J]. Journal of Dalian Ocean University, 2006, 21(4): 346-349. DOI:10.3969/j.issn.1000-9957.2006.04.011 (  0) 0) |
| [18] |
Kregting L T, Thomas F I, Bass A L, et al. Relative effects of gamete compatibility and hydrodynamics on fertilization in the green sea urchin Strongylocentrotus droebachiensis[J]. Biological Bulletin, 2014, 227(1): 33-39. DOI:10.1086/BBLv227n1p33
(  0) 0) |
| [19] |
Mccartney M A, Lessios H A. Quantitative analysis of gametic incompatibility between closely related species of neotropical sea urchins[J]. Biological Bulletin, 2002, 202(2): 166-181. DOI:10.2307/1543653
(  0) 0) |
| [20] |
Banks M A, Mcgoldrick D J, Borgeson W, et al. Gametic incompatibility and genetic divergence of Pacific and Kumamoto oysters, Crassostrea gigas and C. sikamea[J]. Marine Biology, 1994, 121(1): 127-135. DOI:10.1007/BF00349481
(  0) 0) |
| [21] |
张跃环.香港巨牡蛎(Crassostrea hongkongensis)与长牡蛎(C. gigas)种间杂交效应及遗传改良研究[D].青岛: 中国海洋大学, 2012. Zhang Y H. Interspecific Hybridization Effect and Genetic Improvement Between Two Cupped Oyster, Crassostrea hongkongensis and C. gigas [D]. Qingdao: Ocean University of China, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10423-1012505772.htm (  0) 0) |
| [22] |
Zhang Y H, Li J, Zhang Y, et al. Performance evaluation of reciprocal hybrids derived from the two brackish oysters, Crassostrea hongkongensis, and Crassostrea sikamea, in southern China[J]. Aquaculture, 2017, 473: 310-316. DOI:10.1016/j.aquaculture.2017.02.031
(  0) 0) |
| [23] |
Zhang Y H, Zhang Y, Li J, et al. Phenotypic trait of Crassostrea hongkongensis ♀×C. angulate ♂ hybrids in southern China[J]. Aquaculture Research, 2016, 47(11): 3399-3409. DOI:10.1111/are.2016.47.issue-11
(  0) 0) |
| [24] |
Boudry P, Heurtebise S, Lapegue S. Mitochondrial and nuclear DNA sequence variation of presumed Crassostrea gigas and Crassostrea angulata specimens: A new oyster species in Hong Kong[J]. Aquaculture, 2003, 228(1-4): 15-25. DOI:10.1016/S0044-8486(03)00443-5
(  0) 0) |
| [25] |
Gagnaire B, Frouin H, Moreau K, et al. Effects of temperature and salinity on haemocyte activities of the Pacific oyster, Crassostrea gigas (Thunberg)[J]. Fish & Shellfish Immunology, 2006, 20(4): 536-547.
(  0) 0) |
| [26] |
Xu F, Zhang G F, Xiao L, et al. Laboratory hybridization between Crassostrea ariakensis and C. sikamea[J]. Journal of Shellfish Research, 2009, 28(3): 453-458. DOI:10.2983/035.028.0305
(  0) 0) |
| [27] |
Zheng H P, Xu F, Zhang G. Crosses between two subspecies of bay scallop Argopecten irradians, and heterosis for yield traits at harvest[J]. Aquaculture Research, 2011, 42(4): 602-612. DOI:10.1111/are.2011.42.issue-4
(  0) 0) |
| [28] |
Moy G W, Springer S A, Adams S L, et al. Extraordinary intraspecific diversity in oyster sperm bindin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(6): 1993-1998. DOI:10.1073/pnas.0711862105
(  0) 0) |
| [29] |
Gaffney P M, Allen S K. Hybridization among Crassostrea species: A review[J]. Aquaculture, 1993, 116(1): 1-13. DOI:10.1016/0044-8486(93)90217-M
(  0) 0) |
 2018, Vol. 48
2018, Vol. 48


