2. 青岛海洋科学与技术试点国家实验室,山东 青岛 266237;
3. 青岛瑞滋集团有限公司,山东 青岛 266408
凡纳滨对虾(Litopenaeus vannamei)俗称南美白对虾,隶属于节肢动物门(Arthropoda),与斑节对虾(Penaeus monodon)和罗氏沼虾(Macrobrachium rosenbergii)同为世界三大虾类养殖品种[1]。作为中国重要的养殖经济品种之一,凡纳滨对虾的养殖规模和产量一直处于高速增长状态。据统计,2020年中国凡纳滨对虾的总产量高达186万t[2]。然而,随着养殖规模的扩大和集约化程度的加剧,水质恶化和病害频发成为制约我国对虾养殖业可持续发展的主要因素[3]。在养殖生产中,常用抗生素和化学药物防治对虾的细菌性疾病,但长期使用抗生素易造成养殖生物的肠道菌群失调,抗生素的长期使用也容易使细菌产生耐药性,并在机体内残留,危及人体健康[3-5]。
益生菌作为抗生素绿色友好的替代品之一,近年来一直是水产养殖业研究的热点[3, 6-7]。水产养殖中常用的益生菌包括芽孢杆菌、乳酸菌、光合细菌和酵母等,已被广泛研究并应用于饲料添加剂或作为水质改良剂[7]。乳酸菌是水产养殖中最受关注的益生菌之一,其益生作用主要包括促进养殖动物肠道消化吸收、调节肠道菌群稳态、提高非特异性免疫力等[6-8]。屎肠球菌(Enterococcus faecium)是常见的乳酸菌之一,其代谢可产生有机酸、细菌素和过氧化氢等物质,益生作用已在畜禽和反刍动物养殖中得到明确验证,可有效抑制有害微生物的生长,维持肠道菌群平衡,增强机体免疫反应,促进营养物质的吸收,并具有改善机体生长性能的效果[9-12]。然而,在水产养殖中,与其他益生菌相比,尽管屎肠球菌也具有一定的实际应用,但对其合理的使用剂量及其益生作用的相关研究目前还少见报道。
本研究以凡纳滨对虾为研究对象,评估了5种不同添加浓度的屎肠球菌对幼虾的生长、非特异性免疫指标和抗病力的影响,旨在为屎肠球菌在凡纳滨对虾养殖中的合理应用提供科学依据。
1 材料与方法 1.1 实验动物健康凡纳滨对虾购自青岛正大农业发展有限公司。本研究中对虾原养殖海水盐度为18左右,但实验基地所用海水盐度为30左右,故对虾暂养期间海水盐度每日升高2对对虾进行高盐度训化,直至盐度30,并继续暂养2周。暂养结束后,对虾禁食处理24 h,后随机挑选450尾健康、大小均匀的对虾(0.94±0.20) g,均匀分配到45 L水族箱中,每个水族箱密度为15尾。
1.2 实验菌株和实验设计实验用屎肠球菌(E. faecium,编号:HK)来自中国海洋大学水产学院养殖生态实验室,该菌株分离自健康凡纳滨对虾肠道,其16S rRNA序列的NCBI登陆号为ON076015。在37 ℃恒温培养箱中用加强培养基将屎肠球菌株活化培养24 h,直至其生长到对数期。将屎肠球菌液在4 ℃,3 000 r·min-1条件下离心10 min收获菌体。之后,用无菌生理盐水漂洗2~3次屎肠球菌体,并用无菌生理盐水制成浓度为1×109 cfu/mL的屎肠球菌悬液备用。将屎肠球菌液稀释或浓缩到所需浓度。
本研究分别设置了5个不同的屎肠球菌添加浓度,分别为1×108、1×109、1×1010、1×1011和1×1012 cfu/kg(分别记为FSA、FSB、FSC、FSD和FSE),以商品饲料作为对照(CON),实验周期为42 d。
1.3 饲料制备本研究选用青岛正大农业发展有限公司凡纳滨对虾商品配合饲料作为基础饲料(饲料主要成分见表 1),制备了不同屎肠球菌添加浓度的实验饲料。具体方法为:先将海藻酸钠和蒸馏水以3.15 g∶100 mL比例混匀,于90 ℃电磁炉下加热至完全溶解,然后将溶解后的海藻酸钠和鱼油以100 mL∶4.2 mL比例混匀;之后,将重悬后的菌体用30 mL注射器均匀喷洒到饲料表面,混匀后再按一定比例添加海藻酸钠和鱼油混合物;最后,将配合饲料揉搓均匀并阴干保存于4 ℃冰箱备用。对照组除不添加菌液之外,其他配制与处理组相同。
|
|
表 1 基础饲料主要成分 Table 1 Composition of the basic feed |
养殖实验期间,每天投喂4次,投喂时间分别为10:00、14:00、18:00和22:00。每天的具体投喂量视对虾摄食情况而定,总投喂量为对虾体质量的4%~5%。每次投喂1 h后或换水前收集水族箱中的残饵和粪便。经淡水冲洗2次去除盐分后,置于80 ℃烘箱中烘干并称重记录。实验期间,每日换水1次,换水量1/3~1/2。
1.5 样品采集与处理养殖实验结束后,对对虾进行称重记录。对虾饥饿24 h后,每个水族箱采集10尾对虾,每个处理组共采集50尾对虾,分别采集对虾的血液和肝胰腺样品。血液在4 ℃冰箱静置过夜离心(3 000 r·min-1,10 min)后,将离心管中上层血清取出置于-80 ℃冰箱备用待测。用灭菌的剪刀和镊子采集对虾肝胰腺和肠道,肝胰腺剪碎后充分浸润到含有RNA保护液的灭菌离心管中。RNA保护液中的样品于4 ℃冰箱静置24 h后,保存在-80 ℃冰箱备用待测。
1.6 指标测定 1.6.1 生长指标对虾的生长情况通过成活率、特定生长率和饲料效率等确定,具体公式如下:
| $ \begin{array}{l} \;\;\;\;{\rm{成活率}} (\mathrm{SR})=( {\rm{实验后对虾数量}} / {\rm{实验前放养数}}\\ {\rm{量}}) \times 100 \% ; \end{array} $ | (1) |
| $ \begin{array}{l} \;\;\;\;{\rm{特定生长率}} (\mathrm{SGR})=\left[\left(\ln W_{\mathrm{t}}-\ln W_0\right) / t\right] \times \\ 100 \% ; \end{array} $ | (2) |
| $ \text { 饲料效率 }(\mathrm{FER})=\left(W_{\mathrm{t}}-W_0\right) / W_{\mathrm{f}} \times 100 \% { 。} $ | (3) |
式中:W0、Wt分别为对虾初体质量和末体质量(g);t为实验周期(d);Wf为实验期间投入的饲料量(g)。
1.6.2 血清非特异性免疫指标对虾血清用于测定超氧化物歧化酶(Superoxide dismutse,SOD)、碱性磷酸酶(Alkaline phosphatase,AKP)、酸性磷酸酶(Acid phosphatase,ACP)、溶菌酶(Lysozyme,LZM)、酚氧化酶(Phenoloxidase,PO)和总一氧化氮合酶(Total nitric oxide synthase,TNOS)。测定所使用的试剂盒购置于南京建成生物有限公司,并严格参照对应的说明书进行测定。
1.6.3 免疫信号通路相关基因表达肝胰腺组织样品总RNA以Trizol法提取,并用琼脂凝胶电泳检测总RNA的完整度。用Thermo NanoDrope 2000微量紫外分光光度计检测样品中总RNA的浓度和纯度是否达到实验标准,之后按照试剂盒说明书反转录样品总RNA从而得到cDNA。利用荧光实时定量PCR方法测定各处理对虾肝胰腺中相关免疫基因的表达水平,即SOD、LZM、proPO、LGBP、HSP70、Imd、Toll、Relish、TOR、4E-BP、eIF4E1α和eIF4E2。具体测定步骤按照SYBRQR Premix Ex TaqTM(Tli RNaseH Plus)Kit(TaKaRa, Japan)试剂盒说明书进行。反应体系总量为20 μL,包括10 μL SYBR Premix Ex TaqTM Ⅱ(2×),0.5 μL正向引物(浓度10 μmol·L-1),0.5 μL反向引物(浓度10 μmol·L-1),0.4 μL ROX Reference Dye Ⅱ(50×),3.0 μL cDNA,5.6 μL DEPC处理水。qPCR反应程序设定如下:95 ℃持续30 s;95 ℃持续10 s,降至60 ℃持续1 min,共40个循环;95 ℃持续15 s,降至60 ℃持续1 min,最后95 ℃持续15 s。扩增结束后,采用2-ΔΔCt相对定量的方法计算各处理凡纳滨对虾肝胰腺相关免疫基因的相对表达量。引物扩增效率整体范围在90%~110%之间。本研究qRT-PCR使用的引物序列详见表 2。
|
|
表 2 实时荧光定量使用的引物序列 Table 2 Sequences of the primers used in real-time qPCR |
攻毒实验所使用的副溶血弧菌(Vibrio parahaemolyticus)由中国海洋大学水产学院养殖生态实验室分离于患病凡纳滨对虾。培养条件为:TSB培养基,28 ℃,18~24 h。培养数代后用血球计数板法与平板培养法相结合的方法共同统计有效活菌数量。正式攻毒实验开始前,参考实验室的前期研究结果,根据对虾规格,以每尾对虾25 μL的注射量,分别设置了1×107~5×107 cfu·mL-15个不同的副溶血弧菌浓度梯度,进行了14 d预实验,最终确定副溶血弧菌的半数致死浓度为2×107 cfu·mL-1。从对照组和各处理组随机挑选24尾对虾进行正式攻毒实验,为期14 d。每个处理设置3个重复,每个重复8尾对虾,弧菌注射浓度为2×107 cfu·mL-1,每日观察和统计各处理组中对虾状态和日死亡数量情况。
1.7 数据统计分析通过SPSS 22.0软件进行实验数据统计分析。所有数据在满足方差齐性和正态分布检验后,进行单因素方差分析和Tukey’s多重比较分析,显著性水平为P<0.05。数据以平均值±标准误差(Mean±S.E.M)来表示。
2 结果 2.1 对虾生长情况饲料中添加不同浓度屎肠球菌HK下凡纳滨对虾生长情况如表 3所示。对虾成活率在80.0%~92.0%之间,各处理组间差异不显著(P>0.05)。FSB和FSC组对虾末体质量和特定生长率均显著高于对照组,其中,FSC组对虾特定生长率显著高于其他处理组,FSC组饲料效率显著高于FSA组和对照组(P<0.05),其他各组组间差异不显著(P>0.05)。
|
|
表 3 凡纳滨对虾的成活率、生长率和饲料效率(平均值±标准误差) Table 3 Survival rate, specific growth rate and feed efficiency ratio of L.vannamei(Mean±S.E.M) |
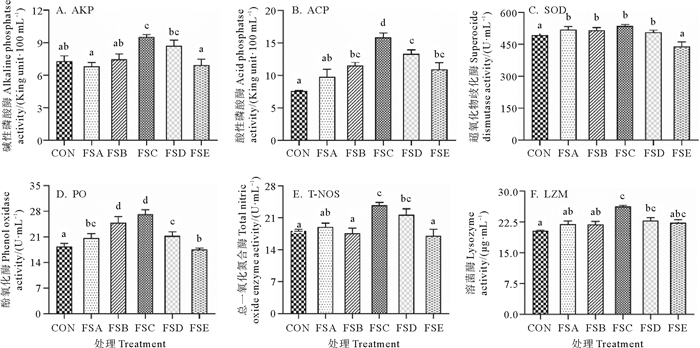
饲料中添加不同浓度屎肠球菌HK对凡纳滨对虾非特异性免疫指标的影响如图 1所示。其中FSC组对虾血清中碱性磷酸酶活性显著高于对照、FSA、FSB和FSD组(P<0.05)。除FSC组外,其他各处理组与对照组差异不显著(P>0.05,见图 1A)。
|
( FSA、FSB、FSC、FSD和FSE分别表示添加浓度为1.0×108、1.0×109、1.0×1010、1.0×1011和1.0×1012 cfu/kg的屎肠球菌HK处理组,CON为对照组。图中不同的字母表示相互之间差异显著(P<0.05)。下图同。FSA, FSB, FSC, FSD and FSE are treatments groups fed with different doses of E. faecium, i.e., 1.0×108, 1.0×109, 1.0×1010, 1.0×1011 and 1.0×1012 cfu/kg feed, and CON is the control group. Data with different letters means significant difference with each other (P < 0.05). The same as follows. ) 图 1 饲料中添加屎肠球菌HK对凡纳滨对虾血清非特异性免疫指标的影响 Fig. 1 Effects of E. faecium on the non-specific immune indexes in the serum of L. vannamei |
除FSA组,各处理组酸性磷酸酶活性显著高于对照组,其中,FSC组显著高于其他各处理组(P<0.05),但FSA组与对照组差异不显著(P>0.05,见图 1B)。
除FSE组,各处理组超氧化物歧化酶和酚氧化酶活性均显著高于对照组(P<0.05),而FSA、FSB、FSC与FSD组超氧化物歧化酶活性组间差异不显著(P>0.05)。以FSC组酚氧化酶活性最高,但与FSB组差异不显著(P>0.05,见图 1C—D)。
FSC和FSD组总一氧化氮合酶活性和溶菌酶浓度显著高于对照组(P<0.05),但两组组间差异不显著,且FSA、FSB和FSE组与对照组组间差异不显著(P>0.05,见图 1E—F)。
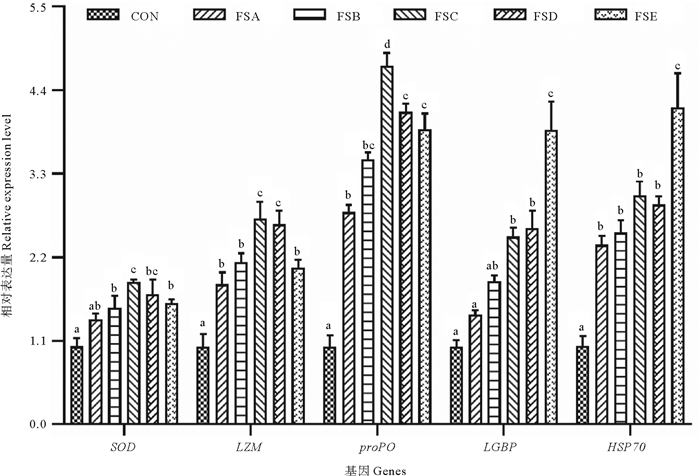
2.3 SOD、LZM、proPO、LGBP和HSP70基因表达水平比较分析了FSA、FSB、FSC、FSD、FSE组与对照组对虾肝胰腺SOD、LZM、proPO、LGBP和HSP70基因相对表达量情况(见图 2)。可以看出,FSC、FSD和FSE组5个基因的相对表达量均显著高于对照组(P<0.05),但FSA组的SOD和LGBP和FSB组的LGBP表达水平与对照相差不大(P>0.05)。FSC组SOD、LZM和proPO相对基因表达量显著高于FSA、FSB和FSE组,FSE组LGBP和HSP70相对基因表达量显著高于其他各处理组(P<0.05)。
|
图 2 屎肠球菌HK不同添加浓度对凡纳滨对虾肝胰腺SOD、LZM、proPO、LGBP和HSP70基因相对表达量的影响 Fig. 2 Effects of E. faecium HK in different concentration on the relative expression levels of SOD, LZM, proPO, LGBP and HSP70 in the hepatopancreas of L. vannamei |
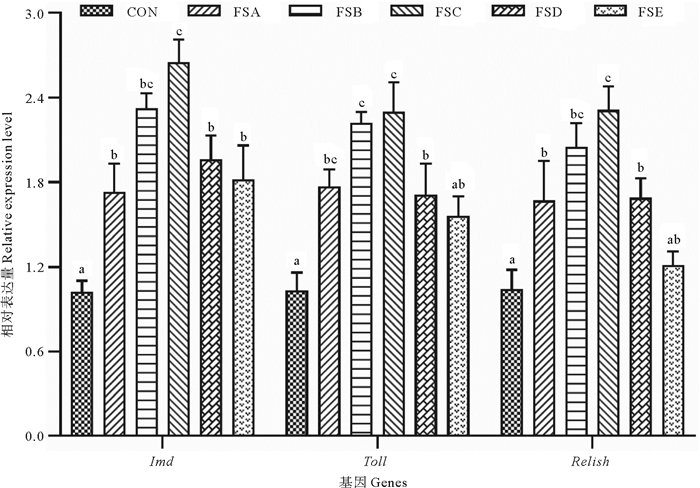
比较分析了FSA、FSB、FSC、FSD、FSE组与对照组对虾肝胰腺Imd、Toll和Relish基因相对表达量情况(见图 3)。可以看出,FSA、FSB、FSC、FSD组对虾肝胰腺Imd、Toll和Relish基因相对表达量显著高于对照组(P<0.05),但FSE组Toll和Relish基因相对表达量与对照组差异不大(P>0.05)。不同处理组比较,FSC组Imd、Toll和Relish基因相对表达量显著高于FSD和FSE组(P<0.05),Imd和Relish基因相对表达量显著高于FSA组,但与FSB组差异不显著,Toll基因表达量与FSA和FSB组差异不显著(P>0.05)。
|
图 3 屎肠球菌HK不同添加浓度对凡纳滨对虾肝胰腺Imd、Toll和Relish基因相对表达量的影响 Fig. 3 Effects of E. faecium HK in different concentration on the relative expression levels of Imd、Toll and Relish in the hepatopancreas of L. vannamei |
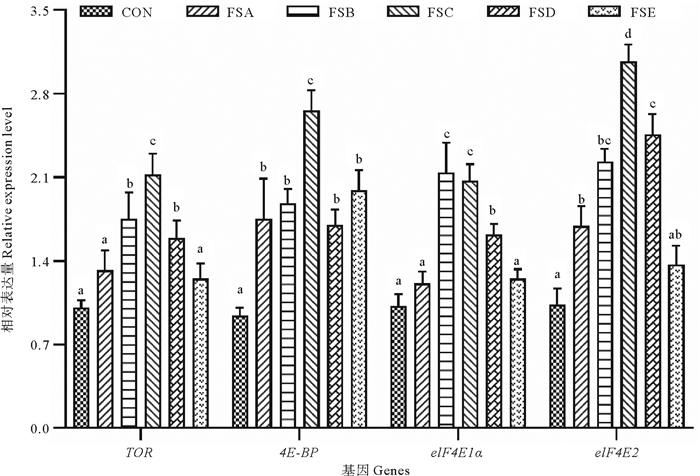
本研究对比了FSA、FSB、FSC、FSD、FSE组与对照组对虾肝胰腺TOR、4E-BP、elF4E2和elF4E1α相对基因表达情况(见图 4)。可以看出,FSB、FSC和FSD组TOR、4E-BP、elF4E2和elF4E1α相对基因表达量显著高于对照组(P<0.05),FSA和FSE组与对照组TOR和elF4E1α相对基因表达量差异不显著,FSE组与对照组elF4E2基因表达量差异不显著(P>0.05)。FSA和FSE组4E-BP相对基因表达量显著高于对照组(P<0.05),FSA组elF4E2基因相对表达量显著高于对照组(P<0.05)。
|
图 4 屎肠球菌HK不同添加浓度对凡纳滨对虾肝胰腺mTOR信号通路相关基因相对表达量的影响 Fig. 4 Effects of E. faecium HK in different concentration on the relative expression levels of mTOR signaling pathway related genes in the hepatopancreas of L. vannamei |
凡纳滨对虾副溶血弧菌攻毒实验结果如图 5所示。可以看出,FSC组对虾积累死亡率显著低于FSA组和对照组(P<0.05),其他各处理组间差异不显著(P>0.05)。
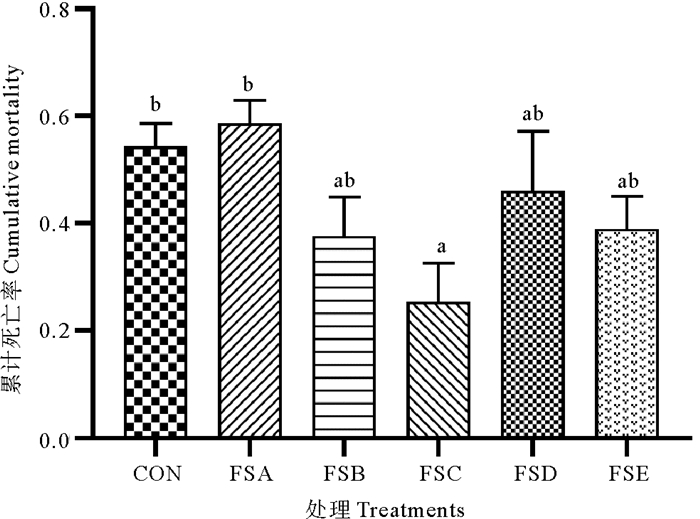
|
图 5 副溶血弧菌攻毒凡纳滨对虾累计死亡率 Fig. 5 Cumulative mortality of L. vannamei challenged with V. parahaemolvticus |
近年来,随着人们对抗生素不合理使用所导致的细菌耐药性的负面作用影响以及“替抗”、“禁抗”相关规范与政策的相继出台,作为一种新型的水产养殖饲料添加剂,益生菌在水产养殖中受到广泛的关注,已成为抗生素最有力的替代者之一[16-17]。乳酸菌是水产养殖中使用最广泛的益生菌之一,其益生作用主要包括促进养殖动物肠道消化吸收、调节肠道菌群稳态、提高非特异性免疫力等[6-8, 18-19]。作为乳酸菌的屎肠球菌在畜牧行业应用广泛[20-23],尽管在水产养殖中也有一定的实际应用,但与其他乳酸菌比较,对其合理的使用剂量及其益生作用的相关研究目前尚少见报道。现有研究表明,屎肠球菌具有耐热性强、耐药性强、胃酸及黏附力强等生物学特性[24],为其在畜禽生产中的应用提供了重要基础。本研究发现,饲料中添加适宜浓度的屎肠球菌HK可显著提高凡纳滨对虾的生长和饲料效率,尤其是在1×1010 cfu/kg添加剂量下,对虾体现出最佳的生长性能。从已有的屎肠球菌在水产动物中的研究报道看,以每4天泼洒一次1×107 cfu/mL屎肠球菌ZJ4或间歇性投喂添加5×109 cfu/kg商品化屎肠球菌饲料均显著提高了尼罗罗非鱼(Oreochromis niloti-cus)的生长性能[25-26],投喂添加5×1011cfu/kg屎肠球菌CGMCC1. 2136也可显著提高拟鲤(Rutilus rutilus caspicus)的生长速率。而利用屎肠球菌发酵的豆粕,则可通过提高鱼体抗氧化能力、降低炎性反应及调节肠道菌群等一定程度上抵消因豆粕替代部分鱼粉后对大菱鲆(Scophthalmus maximus)的生理上产生的负面影响[27]。可以看出,屎肠球菌的合理应用可有效改善水产动物的生长性能,但由于屎肠球菌在水产养殖中研究与应用的数据有限,其合理的使用剂量以及应用方式尚需进一步研究确定。
3.2 饲料中添加屎肠球菌HK对凡纳滨对虾血清非特异性免疫酶活性的影响甲壳动物缺乏适应性免疫,完全依靠先天免疫系统,其免疫系统主要由细胞免疫和体液免疫构成[28-29]。对虾血清中的非特异免疫酶和免疫因子在非特异性免疫中发挥着重要作用,例如碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)、酚氧化酶(PO)、溶菌酶(LZM)总一氧化氮合酶(T-NOS)和凝集素等[30-32]。一般认为,AKP和ACP参与水生动物的免疫防御,属于能够水解有机磷脂的磷酸酶[31-32]。同时,AKP与甲壳动物钙、磷的吸收和甲壳素的形成和分泌直接相关,并参与免疫系统催化和代谢[33-34]。ACP是机体巨噬细胞溶酶体的标志酶,且可反映巨噬细胞活化程度[34]。SOD在所有细胞中普遍存在,能够破坏氧自由基,提高机体免疫力,反映出机体的抗应激能力[35-36]。PO由proPO系统产生,能够去除机体中过氧化氢,与甲壳动物的免疫密切相关[37]。LZM可以破坏细菌细胞壁中N-乙酰胞壁酸和N-乙酰氨基葡萄糖之间的β-1、4-糖苷键,从而消化分解细菌,抑制外源性微生物的生长,增强免疫力[31-32]。NOS催化的一氧化氮(NO)具有抗菌、抗病毒和抗寄生虫作用[33]。适宜的益生菌可有效调节水产动物的非特异免疫能力,但不同参数的响应可能与益生菌类型及动物种类有关,存在较大差别。例如,Wang等研究表明,水体泼洒屎肠球菌ZJ4显著增强了尼罗罗非鱼髓过氧化氢酶和吞噬细胞呼吸爆发活性[25]。饲料中添加5×1011 cfu/kg屎肠球菌CGMCC1. 2136则有效提高了拟鲤血清中总免疫球蛋白含量、AKP和LZM活性,添加5×1010 cfu/kg屎肠球菌W24后乌鳢(Channa argus)肝脏和肠道中SOD、CAT、谷胱甘肽过氧化物(GSH-Px)等抗氧化能力参数显著增强[38],但Natori的研究仅发现间歇投喂5×109 cfu/kg屎肠球菌可提高尼罗罗非鱼呼吸爆发活性[26]。本研究发现,饲料中添加一定浓度的屎肠球菌可不同程度地提高凡纳滨对虾血清免疫相关酶活,但对虾非特异免疫反应可能存在明显的剂量效应。在1×108 cfu/kg屎肠球菌低添加量下,对虾血清AKP、ACP、T-NOS活性及LZM含量与对照组差异不显著,1×1012 cfu/kg屎肠球菌高添加量下,AKP、SOD、PO、T-NOS活性和LZM含量与对照组也差异不大。相比较,添加1×1010 cfu/kg和1×1011 cfu/kg屎肠球菌则可有效提高对虾血清非特异免疫能力,对虾血清中AKP、ACP、SOD、PO、T-NOS活性和LZM浓度显著高于对照组。
3.3 屎肠球菌不同添加浓度对对虾免疫相关基因表达水平的影响甲壳类动物具备多种由外源性病原体激活的防御机制。如多种防御分子,包括Toll受体、凝集素、脂多糖(LPS)、β-1, 3-葡聚糖结合蛋白(LGBP)、含硫酯蛋白(TEPs)、酚氧化酶原(proPO)、免疫蛋白等体液因子及机制[36-40]。此外,脂多糖和β-1, 3-葡聚糖结合蛋白(LGBP)是重要的模式识别蛋白(PRPs),可识别革兰氏阴性菌的脂多糖和β-1,3-葡聚糖(βG),从而激活对虾的先天免疫[41]。同时,先天免疫可以激活相关的免疫基因来抵御微生物的入侵。在本研究中,FSC、FSD和FSE组肝胰腺组织中SOD、LZM、proPO、LGBP和HSP70基因的相对表达量均显著上调。这些结果与其他学者的研究一致,即一定浓度的屎肠球菌可以有效提高水生动物的免疫和抗应激能力,并诱导免疫相关基因的表达[26, 42]。5个处理组相比较,饲料中添加1×1010 cfu/kg屎肠球菌HK可有效促进对虾肝胰腺组织中免疫基因相对表达量的提高。
Toll和Imd信号通路调控不同抗菌肽的基因表达水平。其中,Imd信号通路介导甲壳动物对革兰氏阴性菌的先天免疫[43]。核转录因子NF-κB在甲壳类动物的先天免疫中发挥关键作用,而Relish则是NF-κB家族的一部分。mTOR信号通路作为一种信号转导通路,在营养调节和细胞生长中起着重要作用[44]。此外,雷帕霉素靶蛋白(TOR)通过核糖体蛋白S6激酶多肽1(S6K1)和真核翻译起始因子4E-结合蛋白(4E-BPS)启动翻译并刺激蛋白质合成,而4E-BP参与了mTORC1的调控[45]。帽结合蛋白eIF4E,即eIF4E1、eIF4E2、eIF4E3等,不仅是细胞生长所必需的蛋白,而且与mTORC1下游细胞过程中的免疫密切相关[46]。本研究发现,饲料中添加屎肠球菌HK显著提高了凡纳滨对虾肝胰腺器官中Toll、Imd和Relish基因的表达水平。这些结果与Sha等[47]的研究结果相似,该学者也发现饲料中添加屎肠球菌NRW-2可在凡纳滨对虾中诱导出较高的免疫相关基因表达水平。mTOR信号通路与对虾的生长和抗病性均密切相关,结合本研究各处理组对虾生长情况及副溶血弧菌攻毒数据,表明添加1×1010 cfu/kg屎肠球菌HK可诱导凡纳滨对虾较高的免疫相关基因表达水平,显著提高对虾的抗病力。
3.4 饲料中添加不同浓度屎肠球菌对凡纳滨对虾抗病力的影响细菌性病害是对虾养殖业的主要病害之一,主要包括副溶血弧菌、哈维氏弧菌(Vibrio harveyi)、溶藻弧菌(Vibrio alginolyticus)、创伤弧菌(Vibrio vulnificus)等多个种属,其中副溶血弧菌是一种普遍存在于海水中,对水生动物具有较高致病性的细菌之一[48-51]。世界范围内,副溶血弧菌导致的急性肝胰腺坏死病(AHPND)每年给对虾养殖业造成了巨大损失[48]。通过合理添加益生菌、益生元和后生元等添加物,提高对虾的免疫力和对病原菌的抵抗力,是目前对虾健康养殖管理的方式之一。目前常用的益生菌(乳酸菌、芽孢杆菌和酵母菌等)均可不同程度地提高对虾的抗病力。例如,李佳徽等[52]研究发现,在日粮中添加粪肠球菌和嗜酸乳杆菌促进了凡纳滨对虾生长性能,同时也提高了副溶血弧菌的抗病力。同样,添加复合益生菌也可有效提高凡纳滨对虾抗副溶血弧菌感染能力[53]。本研究表明,不同添加剂量比较,添加1×1010 cfu/kg屎肠球菌HK的对虾在副溶血性弧菌攻毒后抗病力显著提高,累积死亡率显著降低,且与对虾特定生长率、血清非特异性免疫酶活性和免疫相关信号通路基因表达水平等指标的变化有较好的对应关系。因此,在本研究中,对虾对副溶血弧菌抗病力的提高可能与适宜浓度屎肠球菌HK添加对机体产生的益生作用直接相关。
4 结论饲料中添加不同浓度屎肠球菌HK能有效促进凡纳滨对虾的生长,提高对虾血清的非特异性免疫酶活性和免疫相关基因表达水平,增强对虾对副溶血弧菌的抗病力。以特定生长率作为评价指标,在凡纳滨对虾的养殖应用中,屎肠球菌HK在饲料中的最适添加量为1×1010 cfu/kg。
| [1] |
王兴强, 马甡, 董双林. 凡纳滨对虾生物学及养殖生态学研究进展[J]. 海洋湖沼通报, 2004(4): 94-100. Wang X Q, Ma S, Dong S L. Studies on the biology and cultural ecology of Litopenaeus vannamei: A review[J]. Transactions of Oceanology and Limnology, 2004(4): 94-100. (  0) 0) |
| [2] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2021. Ministry of Agriculture and Rural Affairs of the People's Republic of China, Aquaculture Extension System in China, China Society of Fisheries. China Fishery Statistical Yearbook[M]. Beijing: China Agriculture Press, 2021. (  0) 0) |
| [3] |
Dash G, Raman R P, Prasad K P, et al. Evaluation of Lactoba-cillus plantarum as feed supplement on host associated microflora, growth, feed efficiency, carcass biochemical composition and immune response of giant freshwater prawn, Macrobrachium rosenbergii (de Man, 1879)[J]. Aquaculture, 2014, 432: 225-236. DOI:10.1016/j.aquaculture.2014.05.011 (  0) 0) |
| [4] |
陈昌福, 王玉堂. 水产养殖中抗生素类药物使用现状、问题与对策(连载一)[J]. 中国水产, 2015(4): 65-68. Chen C F, Wang Y T. Current situation. problems and countermeasures of antibiotic use in aquaculture (serial Ⅰ)[J]. China Fisheries, 2015(4): 65-68. DOI:10.3969/j.issn.1002-6681.2015.04.023 (  0) 0) |
| [5] |
Boxall A B A, Kolpin D W, Halling-Sørensen B, et al. Peer reviewed: Are veterinary medicines causing environmental risks?[J]. Environmental Science & Technology, 2003, 37(15): 286-294. (  0) 0) |
| [6] |
Decamp O, Moriarty D J W, Lavens P. Probiotics for shrimp larviculture: Review of field data from Asia and Latin America[J]. Aquaculture Research, 2008, 39(4): 334-338. DOI:10.1111/j.1365-2109.2007.01664.x (  0) 0) |
| [7] |
Li H D, Tian X L, Dong S L. Growth performance, non-specific immunity, intestinal histology and disease resistance of Litopenaeus vannamei fed on a diet supplemented with live cells of Clostridium butyricum[J]. Aquaculture, 2019, 498: 470-481. DOI:10.1016/j.aquaculture.2018.09.003 (  0) 0) |
| [8] |
曲木, 唐子鹏, 赵子续, 等. 乳酸菌在水产养殖中的应用[J]. 生物化工, 2021, 7(3): 131-134. Qu M, Tang Z P, Zhao Z X, et al. Application of lactic acid bacteria in aquaculture[J]. Biological Chemical Engineering, 2021, 7(3): 131-134. DOI:10.3969/j.issn.2096-0387.2021.03.038 (  0) 0) |
| [9] |
Lei X J, Lee S I, Lee K Y, et al. Effects of a blend of organic acids and medium-chain fatty acids with and without Enterococcus faecium on growth performance, nutrient digestibility, blood parameters, and meat quality in finishing pigs[J]. Canadian Journal of Animal Science, 2018, 98(4): 852-859. DOI:10.1139/cjas-2017-0126 (  0) 0) |
| [10] |
He Y, Liu X, Dong Y, et al. Enterococcus faecium PNC01 isolated from the intestinal mucosa of chicken as an alternative for antibiotics to reduce feed conversion rate in broiler chickens[J]. Microbial Cell Factories, 2021, 20(1): 1-14. DOI:10.1186/s12934-020-01497-9 (  0) 0) |
| [11] |
Maod A, Mz B, Nme A, et al. The evaluation of growth performance, blood health, oxidative status and immune-related gene expression in Nile tilapia (Oreochromis niloticus) fed dietary nanoselenium spheres produced by lactic acid bacteria[J]. Aquaculture, 2020, 515: 734571. DOI:10.1016/j.aquaculture.2019.734571 (  0) 0) |
| [12] |
Abushelaibi A, Al-Mahadin S, El-Tarabily K, et al. Charac-terization of potential probiotic lactic acid bacteria isolated from camel milk[J]. LWT-Food Science and Technology, 2017, 79: 316-325. DOI:10.1016/j.lwt.2017.01.041 (  0) 0) |
| [13] |
孙艳, 刘飞, 宋晓玲, 等. 饲料中添加益生菌对凡纳滨对虾(Litopenaeus vannamei)非特异免疫基因表达量和抗病力的影响[J]. 海洋与湖沼, 2012, 43(4): 845-851. Sun Y, Liu F, Song X L, et al. Effects of adding probiotics in the feed on non-specific immune gene expression and disease of Litopenaeus vannamei[J]. Oceanologia et Limnologia Sinica, 2012, 43(4): 845-851. (  0) 0) |
| [14] |
葛倩倩, 李健, 梁俊平, 等. 中国明对虾Imd免疫信号通路相关基因克隆及表达分析[J]. 中国海洋大学学报(自然科学版), 2014, 44(1): 46-51. Ge Q Q, Li J, Liang J P, et al. Cloning of Imd immune signal pathway relating genes of Fenneropenaeus chinensis and their expression analysis[J]. Periodical of Ocean University of China, 2014, 44(1): 46-51. (  0) 0) |
| [15] |
Duan Y, Zhang Y, Dong H, et al. Effects of dietary poly-β-hydroxybutyrate (PHB) on microbiota composition and the mTOR signaling pathway in the intestines of Litopenaeus vannamei[J]. Journal of Microbiology, 2017, 55(12): 946-954. DOI:10.1007/s12275-017-7273-y (  0) 0) |
| [16] |
Tran N T, Li Z, Ma H, et al. Clostridium butyricum: A promising probiotic confers positive health benefits in aquatic animals[J]. Reviews in Aquaculture, 2020, 12(4): 2573-2589. DOI:10.1111/raq.12459 (  0) 0) |
| [17] |
范志聪, 陈婷, 孙加节, 等. 禁抗形势下的替抗产品分析与选择[J]. 广东饲料, 2021, 30(5): 11-14. Fan Z C, Chen T, Sun J J, et al. Analysis and selection of substitute antibody products under the situation of antibiotics prohibition[J]. Guangdong Feed, 2021, 30(5): 11-14. DOI:10.3969/j.issn.1005-8613.2021.05.003 (  0) 0) |
| [18] |
Ziaei-Nejad S, Rezaei M H, Takami G A, et al. The effect of Bacillus spp. bacteria used as probiotics on digestive enzyme activity, survival and growth in the Indian white shrimp Fenneropenaeus indicus[J]. Aquaculture, 2006, 252(2-4): 516-524. DOI:10.1016/j.aquaculture.2005.07.021 (  0) 0) |
| [19] |
Liu H, Li Z, Tan B, et al. Isolation of a putative probiotic strain S12 and its effect on growth performance, non-specific immunity and disease-resistance of white shrimp, Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2014, 41(2): 300-307. (  0) 0) |
| [20] |
Hu C J, Xing W G, Liu X H, et al. Effects of dietary supplementation of probiotic Enterococcus faecium on growth performance and gut microbiota in weaned piglets[J]. AMB Express, 2019, 9(1): 1-12. DOI:10.1186/s13568-018-0728-7 (  0) 0) |
| [21] |
Wu Y, Zhen W, Geng Y, et al. Effects of dietary Enterococcus faecium NCIMB 11181 supplementation on growth performance and cellular and humoral immune responses in broiler chickens[J]. Poultry Science, 2019, 98(1): 150-163. DOI:10.3382/ps/pey368 (  0) 0) |
| [22] |
文静, 孙建安, 周绪霞, 等. 屎肠球菌对仔猪生长性能、免疫和抗氧化功能的影响[J]. 浙江农业学报, 2011, 23(1): 70-73. Wen J, Sun J A, Zhou X X, et al. Effects of Enterococcus faecium on growth performance, immune and antioxidant function of piglets[J]. Acta Agriculturae Zhejiangensis, 2011, 23(1): 70-73. (  0) 0) |
| [23] |
王卫卫, 张安荣, 陈志敏, 等. 屎肠球菌对肉鸡生长性能和血清生化指标的影响[J]. 饲料工业, 2021, 42(11): 38-43. Wang W W, Zhang A R, Chen Z M, et al. Effects of Enterococcus faecium on growth performance and serum biochemical indices of broilers[J]. Feed Industry, 2021, 42(11): 38-43. (  0) 0) |
| [24] |
白天天, 郭雪峰. 屎肠球菌的特性及其在畜牧生产中的应用研究进展[J]. 中国畜牧杂志, 2021, 57(2): 16-20. Bai T T, Guo X F. Characteristics of Enterococcus faecium and its application in livestock production[J]. Chinese Journal of Animal Science, 2021, 57(2): 16-20. (  0) 0) |
| [25] |
Wang Y B, Tian Z Q, Yao J T, et al. Effect of probiotics, Enterococcus faecium, on tilapia (Oreochromis niloticus) growth performance and immune response[J]. Aquaculture, 2008, 277(3-4): 203-207. DOI:10.1016/j.aquaculture.2008.03.007 (  0) 0) |
| [26] |
Tachibana L, Telli G S, de Carla Dias D, et al. Effect of feeding strategy of probiotic Enterococcus faecium on growth performa-nce, hematologic, biochemical parameters and non-specific immune response of Nile tilapia[J]. Aquaculture Reports, 2020, 16: 100277. DOI:10.1016/j.aqrep.2020.100277 (  0) 0) |
| [27] |
Li C, Zhang B, Liu C, et al. Effects of dietary raw or Enterococcus faecium fermented soybean meal on growth, antioxidant status, intestinal microbiota, morphology, and inflammatory responses in turbot (Scophthalmus maximus L.)[J]. Fish & Shellfish Immunology, 2020, 100: 261-271. (  0) 0) |
| [28] |
Zhang Q, Li F, Zhang X, et al. cDNA cloning, characterization and expression analysis of the antioxidant enzyme gene, catalase, of Chinese shrimp Fenneropenaeus chinensis[J]. Fish & Shellfish Immunology, 2008, 24(5): 584-591. (  0) 0) |
| [29] |
Duan Y, Liu P, Li J, et al. Molecular responses of calreticulin gene to Vibrio anguillarum and WSSV challenge in the ridgetail white prawn Exopalaemon carinicauda[J]. Fish & Shellfish Immunology, 2014, 36(1): 164-171. (  0) 0) |
| [30] |
Hao K, Liu J Y, Ling F, et al. Effects of dietary administration of Shewanella haliotis D4, Bacillus cereus D7 and Aeromonas bivalvium D15, single or combined, on the growth, innate immunity and disease resistance of shrimp, Litopenaeus vannamei[J]. Aquaculture, 2014, 428: 141-149. (  0) 0) |
| [31] |
Bayne C J, Gerwick L. The acute phase response and innate immunity of fish[J]. Developmental & Comparative Immunology, 2001, 25(8-9): 725-743. (  0) 0) |
| [32] |
邹广众, 孙虎山. 水产甲壳动物免疫学研究进展与前景展望[J]. 生命科学仪器, 2009, 7(6): 17-21. Zou G Z, Sun H S. Research advances and prospect in aquatic crustaceans immunology[J]. Life Science Instruments, 2009, 7(6): 17-21. DOI:10.3969/j.issn.1671-7929.2009.06.004 (  0) 0) |
| [33] |
Cheng T. Immunodeficiency diseases in marine mollusks: Measure-ments of some variables[J]. Journal of Aquatic Animal Health, 1989, 1(3): 209-216. DOI:10.1577/1548-8667(1989)001<0209:IDIMMM>2.3.CO;2 (  0) 0) |
| [34] |
Blasco J, Puppo J, Sarasquete M C. Acid and alkaline phosphatase activities in the clam Ruditapes philippinarum[J]. Marine Biology, 1993, 115(1): 113-118. DOI:10.1007/BF00349392 (  0) 0) |
| [35] |
刘昂, 查产方, 张振霞, 等. 对虾免疫系统及调控机制的研究进展[J]. 韩山师范学院学报, 2013(3): 60-66. Liu A, Zha G C, Zhang Z X, et al. Research progress of immunity systems and regulatory mechanisms of penaeid shrimps[J]. Journal of Hanshan Normal University, 2013(3): 60-66. (  0) 0) |
| [36] |
Wang G X, Wang Y, Wu Z F, et al. Immunomodulatory effects of secondary metabolites from thermophilic Anoxybacillus kamchatkensis XA-1 on carp, Cyprinus carpio[J]. Fish & Shellfish Immunology, 2011, 30(6): 1331-1338. (  0) 0) |
| [37] |
Amparyup P, Charoensapsri W, Tassanakajon A. Prophenoloxidase system and its role in shrimp immune responses against major pathogens[J]. Fish & Shellfish Immunology, 2013, 34(4): 990-1001. (  0) 0) |
| [38] |
Kong Y, Li M, Chu G, et al. The positive effects of single or conjoint administration of lactic acid bacteria on Channa argus: Digestive enzyme activity, antioxidant capacity, intestinal microbiota and morphology[J]. Aquaculture, 2021, 531: 735852. DOI:10.1016/j.aquaculture.2020.735852 (  0) 0) |
| [39] |
Luo K, Tian X, Wang B, et al. Evaluation of paraprobiotic applicability of Clostridium butyricum CBG01 in improving the growth performance, immune responses and disease resistance in Pacific white shrimp, Penaeus vannamei[J]. Aquaculture, 2021, 544: 737041. DOI:10.1016/j.aquaculture.2021.737041 (  0) 0) |
| [40] |
Huang Y, Ren Q. Research progress in innate immunity of freshwater crustaceans[J]. Developmental & Comparative Immunology, 2020, 104: 103569. (  0) 0) |
| [41] |
Yao C L, Ji P F, Wang Z Y, et al. Molecular cloning and expression of NOS in shrimp, Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2010, 28(3): 453-460. (  0) 0) |
| [42] |
Tarkhani R, Imani A, Hoseinifar S H, et al. The effects of host-associated Enterococcus faecium CGMCC1. 2136 on serum immune parameters, digestive enzymes activity and growth performance of the Caspian roach (Rutilus rutilus caspicus) fingerlings[J]. Aquaculture, 2020, 519: 734741. DOI:10.1016/j.aquaculture.2019.734741 (  0) 0) |
| [43] |
Wang Z, Chen Y H, Dai Y J, et al. A novel vertebrates Toll-like receptor counterpart regulating the anti-microbial peptides expression in the freshwater crayfish, Procambarus clarkii[J]. Fish & Shellfish Immunology, 2015, 43(1): 219-229. (  0) 0) |
| [44] |
Naugler W E, Karin M. NF-κB and cancer-identifying targets and mechanisms[J]. Current Opinion in Genetics & Development, 2008, 18(1): 19-26. (  0) 0) |
| [45] |
Seiliez I, Gabillard J C, Skiba-Cassy S, et al. An in vivo and in vitro assessment of TOR signaling cascade in rainbow trout (Oncorhynchus mykiss)[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2008, 295(1): 329-335. (  0) 0) |
| [46] |
Laplante M, Sabatini D. mTOR signaling in growth control and disease[J]. Cell, 2012, 149(2): 274-293. (  0) 0) |
| [47] |
Sha Y, Wang L, Liu M, et al. Effects of lactic acid bacteria and the corresponding supernatant on the survival, growth perfor-mance, immune response and disease resistance of Litopenaeus vannamei[J]. Aquaculture, 2016, 452: 28-36. (  0) 0) |
| [48] |
闫雪松. 南美白对虾养殖过程中主要病害及防治措施[J]. 渔业致富指南, 2011(20): 54-57. Yan X S. The main diseases and control measures in Litopenaeus vannamei culturing[J]. Fishery Guide to be Rich, 2011(20): 54-57. (  0) 0) |
| [49] |
Lightner D V, Redman R M, Bell T A. Observations on the geographic distribution, pathogenesis and morphology of the baculo-virus from Penaeus monodon Fabricius[J]. Aquaculture, 1983, 32(3-4): 209-233. (  0) 0) |
| [50] |
Zhou J, Fang W, Yang X, et al. A nonluminescent and highly virulent Vibrio harveyi strain is associated with "bacterial white tail disease" of Litopenaeus vannamei shrimp[J]. PLoS One, 2012, 7(2): 29961. (  0) 0) |
| [51] |
郭聪. 海南凡纳滨对虾机体内三种常见弧菌鉴定, 分子血清型研究及其拮抗菌筛选[D]. 海口: 海南大学, 2016. Guo C. Identification, Molecular Serotype and Antagonistic Bacteria Screening of Vibrio harveyi, V. alginolyticus and V. parahaemolyticus Isolated from the Body of Litopenaeus vannamei[D]. Haikou: University of Hainan, 2016. (  0) 0) |
| [52] |
李佳徽, 王明阳, 田相利, 等. 三种不同乳酸菌对凡纳滨对虾生长, 抗病力及肠道菌群结构的影响[J]. 中国海洋大学学报(自然科学版), 2021, 51(4): 44-54. Li J H, Wang M Y, Tian X L, et al. Effects of different lactic acid bacteria added to feed on the growth performance, disease resistance and intestinal microflora of Litopenaeus vannamei[J]. Periodical of Ocean University of China, 2021, 51(4): 44-54. (  0) 0) |
| [53] |
杨运楷, 宋晓玲, 王海亮, 等. 一种复合益生菌对凡纳滨对虾抗副溶血弧菌感染能力的影响[J]. 渔业科学进展, 2020, 41(3): 133-141. Yang Y K, Song X L, Wang H L, et al. Effects of a compound probiotics on the ability of Litopenaeus vannamei to resist Vibrio parahaemolyticus infection[J]. Progress in Fishery Sciences, 2020, 41(3): 133-141. (  0) 0) |
2. Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. Qingdao Ruizi Group Company Limited, Qingdao 266408, China
 2023, Vol. 53
2023, Vol. 53


