棘皮动物、脊索动物类和半索亚门类动物共同构成了后口动物,这使得棘皮动物成为研究脊索动物类起源的重要节点。棘皮动物成体具有独特五重对称结构,其神经系统一般包括一个围口神经环和相连的5条径向神经线,这5条径向神经线穿梭在身体的纵肌和环肌之间。大多数棘皮动物(除了海百合类)的神经系统都被认为包含两个独立的部分:外神经系统和深层神经系统,它们被基底膜所分隔[1-2],在神经系统进化的研究中占据了重要的地位。然而由于棘皮动物神经系统结构的独特性及难以定位,使得其中央神经系统研究远远落后于其他动物。
海参纲(Holothuroidea)是棘皮动物进化中出现最晚的一个纲,和海胆纲(Echinoidea)的亲缘关系最近[2]。仿刺参(Apostichopus japonicus)作为海参纲的代表种,是我国重要的海产经济物种, 具有极高的食用与医用价值,主要分布于我国辽宁、河北、山东沿岸浅海[3]。目前仿刺参以其独特的进化地位和特殊的生理特性(再生,自溶,夏眠)日益受到关注[4-7],然而关于仿刺参的神经定位的研究国内外尚鲜有报道,有限的研究主要集中在少数几种神经肽的发掘和组织定位[1, 8-9]。本研究中,我们利用组织学技术结合棘皮动物神经的特异性抗体1E11[10],初步探究刺参肠道中神经的定位。已有研究表明,刺参肠道具有很强的再生能力以及长期夏眠萎缩后的快速修复能力[11-12],然而相关研究都主要局限于传统的组织学描述,并没有对此过程中起到关键作用的神经定位进行分析,我们期望通过肠道神经定位的基础研究,为刺参特殊生理机制以及刺参神经生物学的研究提供理论支持。
1 材料与方法 1.1 实验动物和暂养条件仿刺参成体体重(100±10) g,取自山东省青岛市胶南刺参养殖场。实验前,置于实验室循环水水槽内暂养7 d,水温15~18 ℃。定量投喂人工配合饲料(海泥和鼠尾藻(Sargassum thunbergii)按比例混合而成),以确保刺参尽快适应环境。
1.2 样品固定及制备取健康状况良好不吐肠的仿刺参9~10头,停食72 h,待其排空消化道内食物残渣后,将其放入盛有1 L新鲜海水配置的0.3 mol/L硫酸镁溶液中。待仿刺参运动减弱,触手、管足伸展且不再收缩为止。取出仿刺参个体,进行解剖,取出肠道样品,大小尺度约1~2 mm2, 蒸馏水对其进行冲洗。
HE,米利根染色样品制备:波恩液固定12~24 h;样品经不同浓度梯度酒精脱水(70%、80%、95%、95%、100%和100%,每步30 min);完全脱水后组织转入100%酒精:二甲苯=1:1的混合液中30 min,在二甲苯中透明20 s;透明后样品依次在二甲苯:石蜡=1:1,石蜡中分别浸泡25 min,二次浸泡在纯石蜡中50 min包埋,冷却后修片,切片厚度调整为7 μm。
1E11免疫组化样品制备:样品在pH=7.4的4%多聚甲醛/PBS中短时间固定最多10 min,固定之后,样品用PBS(3×5 min)洗涤,然后通过在一系列上升浓度蔗糖溶液(10%,20%和30%,每步3 h,室温)中抚育被凝冻保护。样品用OCT包埋后,立刻放入-80 ℃冰箱中。用莱卡CM3050 S低温切片12 μm并在多聚赖氨酸载玻片上收集,保存在-20 ℃。
1.3 切片染色 1.3.1 HE染色切片用苏木精和伊红分别染色后,擦去切片周围多余二甲苯,迅速在切片上滴加适量中性树胶,盖上载玻片,注意不要有气泡,玻片晾干后用Nikon E 600显微镜观察切片并拍照。
1.3.2 米利根染色切片用二甲苯澄清5 min,在纯酒精中水合5 min,切片用如下方法染色:溶液A(2.25 g重铬酸钾、2.25 mL浓盐酸加入含25 mL的95%酒精和75 mL的蒸馏水中)中5 min,蒸馏水洗涤2 min; 溶液B(0.1 g品红加入100 mL蒸馏水中)中5 min,蒸馏水快洗30 s; 溶液C(1 g磷钼酸加入100 mL蒸馏水中)中1 min,蒸馏水洗2 min; 溶液D(2 g的Orange G和1 g的磷钼酸分别加入100 mL蒸馏水中)中染色5 min,蒸馏水水洗2 min; 溶液E(1 mL冰醋酸加入100 mL蒸馏水中)、F(在100 mL蒸馏水中加入Fast green FCF 0.1 g,冰醋酸0.2 mL),E中分别染色2、5和3 min。这个过程完成之后,切片在纯酒精中脱水5 min,二甲苯中澄清5 min,迅速在切片中央滴加一滴中性树胶,盖上盖玻片,用中性树胶盖片。染色好的切片用尼康Eclipse E600显微镜观察并拍照。
1.3.3 免疫组化染色将样品玻片浸入修复缓冲液(pH=6.0的缓冲液:0.1 mol/L的A液(柠檬酸钠Na3C6H5O7·2H2O 29.4g加蒸馏水至1 L)16.2 mL,0.1 mol/L的B液(柠檬酸C6H5O7·H2O 21.0 g加蒸馏水至1 L)3.8 mL,加蒸馏水稀释至200 mL进行抗原热修复,高压灭菌锅内120 ℃,7 min,自然冷却至室温后将玻片从修复缓冲液中取出,将载玻片四周擦干净,用免疫组化防水笔将组织圈起;在圈起的组织上滴加1%H2O2-PBS(1 μL H2O2,1 mL PBS),湿盒内室温孵育20 min消除内源性酶,PBST漂洗5 min×3;漂洗后,组织上滴加5%羊血清/PBST溶液,在湿盒内37 ℃封闭背景2 h,甩去多余液体,不洗。
实验组样品滴加1:3(5%羊血清:PBST)稀释的鼠源一抗1E11(加拿大维多利亚大学Dr. Robert D. Burke[13]提供),对照组样品滴加1:10(5%羊血清:PBST)稀释的一抗1E11,玻片湿盒内4℃过夜;次日PBST漂洗3次,1次5 min;漂洗过后,实验组、对照组组织上滴加稀释后的羊抗鼠辣根过氧化酶二抗(药明康德AB-ASS1021)(二抗:2%羊血清/PBST 1:500稀释),将其放入湿盒内37 ℃孵育3 h,随后PBST漂洗3次,一次5 min。
用增强型DAB显色缓冲液发色,直到能观察到染色,迅速对切片用PBS,灭菌水顺序洗涤,然后滴加Hydromount,盖上盖玻片,用Olympus BX51显微镜观察并拍照。
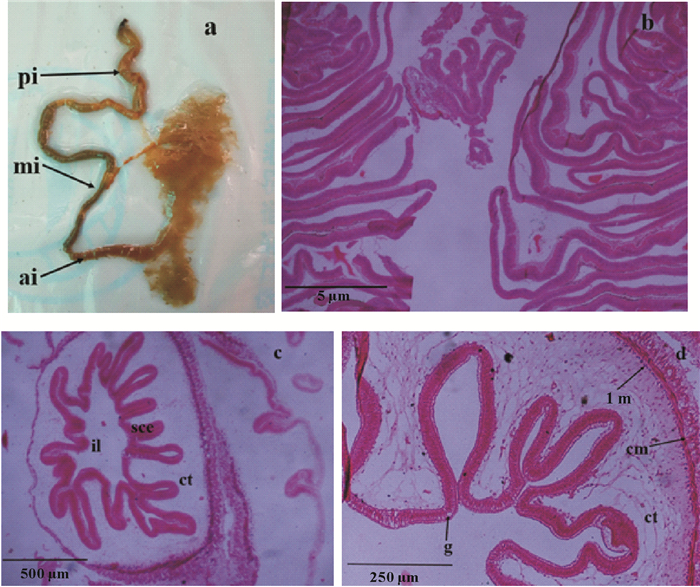
2 结果与讨论 2.1 肠道组织学结构及神经定位仿刺参的肠道根据其延伸的方向和附着的位置可分为前肠、中肠和后肠,前肠附着于背肠系膜,位于食道、胃下方,肠道向下延伸快到泄殖腔处为第一下降部即前肠,然后其转向左边往上延伸为上升部即中肠,中肠附着于侧肠系膜,至咽部下方沿腹中线向下延伸至肛门为第二下降部即后肠,后肠附着于腹肠系膜上(见图 1a)。
|
(a.刺参肠道解剖图;b.肠道中肠横切HE染色;c.肠道后肠横切HE染色;d.图c局部放大图。a. The intestinal tract of A. japonicus; b. Transverse section of the mid-intestine with HE staining; c. Transverse section of the posterior intestine with HE staining; ; d. Local magnification of figure c. il:肠腔;sce:单层柱状上皮;ct:结缔组织;g:杯状细胞;lm:纵向肌肉;cm:环形肌肉; ai:前肠; mi:中肠; pi:后肠。il: Intestine lumen; sce:Simplecolumnarepithelium; ct: Connective tissue; g: Goblet cells; lm: Longitudinal muscle; cm: Circular muscle; ai: Anterior intestine; mi: Mid-intestine; pi: Posterior intestine.) 图 1 仿刺参肠道的HE染色图 Fig. 1 The HE staining images of intestine of A. japonicus |
仿刺参肠壁由外向内分为4层:(1)外层的体腔上皮层即浆膜层;(2)肌肉层,其内层为纵肌层,外层为环肌层;(3)内部结缔组织层即黏膜下层;(4)肠腔上皮层即黏膜层。仿刺参中肠上皮皱襞不规则,常形成高、窄的褶皱,且方向较单一,有的褶皱还有分支(见图 1b),而后肠皱襞与中肠相比较低,无横向皱襞,纵向皱襞较规则且高低不一,其黏膜下层疏松结缔组织与中肠相比较厚,黏膜层向疏松结缔组织凹陷,形成近似长方形或三角形的褶皱,其黏膜上皮多由单层柱状细胞构成,且细胞排列整齐(见图 1c),图 1d中可看出后肠黏膜上皮中有少量椭圆形空泡状的杯状细胞,HE染色为无色,且肌肉层也呈现外环内纵排列,环形肌纤维比纵肌纤维更明显,其外膜由复层上皮细胞和结缔组织构成。
仿刺参肠道内壁有横向、纵向褶皱,中肠常形成高而窄且方向单一的褶皱,后肠多为较规则的纵向褶皱,后肠黏膜层多为单层或复层的黏膜上皮与崔龙波[14]的结论一致。同时,仿刺参的前肠和中肠因细胞内含较多的核酸,且呈现非特异性酯酶和蛋白酶脂酶活性而起主要的消化吸收作用[14],而中肠内壁与后肠相比,其内壁大量高而窄的褶皱,在结构上扩大了吸收面积,体现了结构功能相统一的原理。
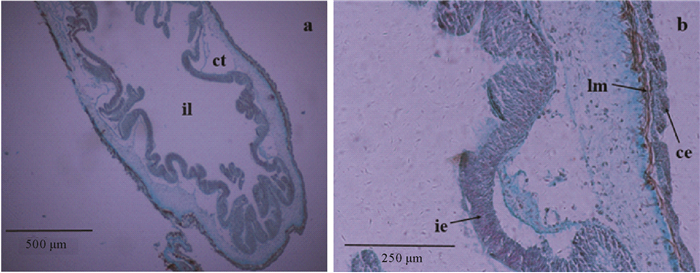
米利根染色结果表明:核、肌肉染为红色,胶原蛋白(纤维)染为蓝色,神经系统染为浅紫色。从图 2b中可看出肠壁的纵向肌肉染为红色,整条纵肌偏紫,表明肌肉细胞中神经纤维的存在;肠腔上皮层中神经成分较多(颜色深),其次是体腔上皮层(黑色箭头),这与García-Arrarás[15]在海参(Holothuria glaberrima)中的研究结果类似,他们在H. glaberrima肠壁中发现,从外向内的体腔上皮层、肌肉层、内部结缔组织层和内里的肠腔上皮层中均含有神经成分。
|
(a.后肠横切米利根染色;b.图a为局部放大图。a.Transverse section of the posterior intestine with Milligan staining; b. Local magnification of figure a.il:肠腔;ct:结缔组织;lm:纵向肌肉;ce:体腔上皮;ie:肠腔上皮。il: Intestine lumen; ct: Connective tissue; lm: Longitudinal muscle; ce: Coelomic epithelium layer; ie: Intestine epithelium layer.) 图 2 仿刺参肠道的米利根染色图 Fig. 2 The Milligan staining images of intestine of A.japonicus |
相比HE染色法显示组织细胞的基本结构而言,米利根染色法更适用于观察肌肉、胶原、神经系统的分布,其能使组织中的各主要成分以不同颜色显现出来,色彩对比鲜明,更易观察染色结果[16]。Inoue[1]、Tamori[9]等分别用米利根染色来研究仿刺参径向神经线的组织学结构,为后续研究神经肽NG1WYamide和stichopin的分布及功能验证提供理论基础;而Inoue[17]等利用米利根染色观察了仿刺参体壁整体的神经纤维和分支分布,为仿刺参体壁纵向肌肉受内神经支配结论的提出奠定了基础。
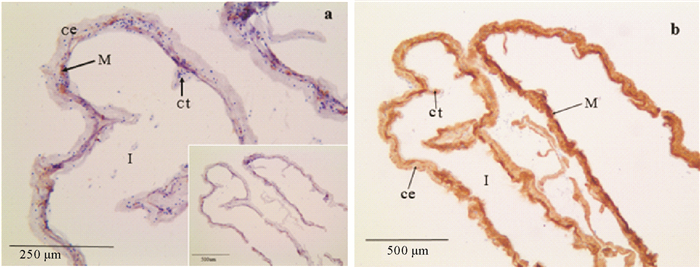
2.2 肠道中免疫组化神经定位1E11是突触结合蛋白B的神经元特异性抗体[13, 18]。Burke等[13]的研究表明球海胆(Strongylocentrotus purpuratus)径向神经提取物中1E11对突触结合蛋白B的特异性结合。目前已经在许多棘皮动物的幼体和部分成体中验证了1E11的神经元特异性结合特性,这使得1E11单克隆抗体成为棘皮动物神经的公认标记物[9-10, 18-19]。本研究同样发现1E11是仿刺参成体神经组织的良好标识物。研究中我们利用1E11抗体对仿刺参肠道阴性对照组(1:10稀释)、实验组(1:3稀释)神经组织进行化学定位,采用DAB染色,最终呈现出的棕黄色颗粒为阳性杂交位点。研究结果表明,1E11在阴性对照组中的肌肉层中有表达,而在最外层的体腔上皮层和肌肉层下方的内部结缔组织中鲜有活性反应(见图 3a);实验组中1E11在肠道组织的阳性反应广泛而强烈,体腔上皮层、肌肉层、内部结缔组织层均有染色,且肌肉层中染色最深(见图 3b)。
|
(a.肠道1E11免疫组织化学反应阴性对照(1:10稀释);b.肠道1E11免疫组织化学反应,箭头呈强阳性反应(1:3稀释)。a. Intestinal 1E11 immunohistochemical reaction in negative control(1:10 dilution); b. Intestinal 1E11 immunohistochemical reaction, the arrow shows the strong positive reaction (1:3 dilution).I:肠腔;M:肌肉层;ct:相连组织;ce:体腔上皮。I. Intestine lumen; M. Muscle layer; ct: Connective tissue; ce: Coelomic epithelium layer.) 图 3 仿刺参肠道横切1E11免疫组化染色 Fig. 3 The Immunohistochemistry 1E11 staining images of the cross-section intestine of A.japonicus |
仿刺参神经系统不同于脊椎动物,没有脑部结构,是由围口神经环和分散辐射对称的5条径向神经线整合在一起,形成网状结构。尽管仿刺参的神经系统较为简单且缺乏特化的感受器,但仿刺参在正常情况下的复杂且协调的运动及其特殊的生理现象[5, 7, 20]显示了其神经系统网络的高度协调性[2]。
Anderson等[21]研究表明,在与海参亲缘关系很近的海星(Leptasterias pusilla)臂的再生依赖于神经的再生。而在海参纲动物中,肠道是其吐脏再生的首个器官[20],García-Arrarás[15]用单克隆抗体和标记技术在海参肠道再生完成之前观察到了神经成分,与我们的研究结果一致;此外,Díaz-Miranda等[22]在海参中第一次分离纯化了海参纲的肽类物质GFSKLYFamide和SGYSVLYFamide,并用放射免疫分析方法检测到其分布于肠道的神经细胞和纤维中,其中GFSKLYFamide会导致海参肠道的肌肉张力松弛[23]。这同样支持了我们利用1E11免疫组化染色结果中肌肉染色强阳性结果。除再生外,刺参在夏眠这一特殊生理习性期间,最显著的变化是肠道组织的整体退化,变细变短[24],在夏眠解除后,其肠道组织迅速在短时间内恢复正常的尺寸和功能。Inoue等[1]研究表明神经肽NGIWYamide在调节仿刺参肠肌活性方面有一定的作用。结合本文的研究结果,推测仿刺参肠道内存在可控制夏眠期间肠道肌肉的神经肽,而其通过神经系统起作用。
3 结语本研究利用HE、米利根染色及免疫组化技术对仿刺参肠道的组织学结构及神经分布进行了观察、分析和探讨。研究发现,仿刺参中肠内壁常形成高且窄的褶皱,这一扩大吸收面积的结构特点与其主要起消化吸收作用的功能一致,通过米利根染色发现仿刺参肠壁的纵向肌肉、肠腔上皮层和体腔上皮层均存在神经成分,免疫组化研究结果显示1E11在肠道的每个组织层均有表达,且肌肉层中分布最多。本研究中观察到的仿刺参肠道内存在的神经组织是神经系统的一部分,我们推测其在调控肌肉神经支配上起作用,参与肠道的再生过程及长期夏眠萎缩后的肠道快速修复过程,关于这一点尚待深入研究。
| [1] |
Inoue M, Birenheide R, Koizumi O, et al. Localization of the neuropeptide NGIWYamide in the holothurian nervous system and its effects on muscular contraction[J]. Proceedings of the Royal Society of London B: Biological Sciences, 1999, 266(1423): 993-1000. DOI:10.1098/rspb.1999.0735
(  0) 0) |
| [2] |
朱峰.仿刺参Apostichopus japonicus胚胎发育和主要系统的组织学研究[D].青岛: 中国海洋大学, 2009. Zhu F. The Study on Embryonic Development and Major Organs' Histology of Sea Cucumber Apostichopus japonicus[D]. Qingdao: Ocean University of China, 2009. (  0) 0) |
| [3] |
严芳, 胡炜, 李成林, 等. 饲料中添加活性酵母制剂对刺参生长、免疫力和抗病力的影响[J]. 动物营养学报, 2017, 29(2): 583-589. Yan F, Hu W, Li C L, et al. Effects of dietary active yeast products on growth, immunity and disease resistance of sea cucumber (Apostichopus japonicas Selenka)[J]. Chinese Journal of Animal Nutrition, 2017, 29(2): 583-589. DOI:10.3969/j.issn.1006-267x.2017.02.026 (  0) 0) |
| [4] |
梁晓旺.刺参自溶过程中体壁胶原组织变化的研究[D].大连: 大连工业大学, 2015. Liang X W. Changes of Collagenous Tissue in Body Wall of Autolytic Sea Cucumber Stichopus japonicus[D]. Dalian: Dalian Polytechnic University, 2015. (  0) 0) |
| [5] |
赵业.刺参Apostichopus japonicus (Selenka)夏眠期间基因表达模式及DNA甲基化基础特征研究[D].北京: 中国科学院研究生院, 2015. Zhao Y. Histological Study on the Digestive Tract of the Apostichopus japonicus in Aestivation[J]. Beijing: Graduate University of Chinese Academy of Sciences, 2015. http://cdmd.cnki.com.cn/Article/CDMD-80068-1015387735.htm (  0) 0) |
| [6] |
徐冬雪.仿刺参热胁迫响应的分子调控特征研究与SNP标记筛选[D].北京: 中国科学院大学, 2016. Xu D X. Research of Molecular Mechanisms of Heat Shock Response and Heat-resistance SNP in Sea Cucumbers Apostichopus japonicus[D]. Beijing: University of Chinese Academy of Sciences, 2016. (  0) 0) |
| [7] |
Yang H, Hamel J F, Mercier A, et al. The Sea Cucumber Apostichopus japonicus: History, Biology and Aquaculture[M]. USA: Academic Press, 2015.
(  0) 0) |
| [8] |
Iwakoshi E. Comparative aspects of structure and action of bioactive peptides isolated from the seacucumber Stichopus japonicus[J]. Peptide Chemistry, 1995, 48(5): 261-264.
(  0) 0) |
| [9] |
Tamori M, Saha A K, Matsuno A, et al. Stichopin-containing nerves and secretory cells specific to connective tissues of the sea cucumber[J]. Proceedings of the Royal Society of London B: Biological Sciences, 2007, 274(1623): 2279-2285. DOI:10.1098/rspb.2007.0583
(  0) 0) |
| [10] |
Nakajima Y, Kaneko H, Murray G, et al. Divergent patterns of neural development in larval echinoids and asteroids[J]. Evolution & Development, 2004, 6(2): 95-104.
(  0) 0) |
| [11] |
杨红生. 刺参生物学:理论与实践[M]. 北京: 科学出版社, 2014. Yang H S. The Biology of Sea Cucumber Apostichopus japonicus: Theory and Practice[M]. Beijing: Science Press, 2014. (  0) 0) |
| [12] |
苏琳, 陈慕雁, 王天明, 等. 刺参夏眠不同时期划分以及前肠各组织层厚度定量分析[J]. 海洋科学, 2012, 36(12): 1-5. Su L, Chen M Y, Wang T M, et al. The division of different stages of aestivation and quantitative analysis of tissue layers thickness of anterior intestine in sea cucumber Apostichopus japonicus[J]. Marine Science, 2012, 36(12): 1-5. (  0) 0) |
| [13] |
Burke R D, Osborne L, Wang D, et al. Neuron-specific expression of a synaptotagmin gene in the sea urchin Strongylocentrotus purpuratus[J]. Journal of Comparative Neurology, 2006, 496(2): 244-251.
(  0) 0) |
| [14] |
崔龙波, 董志宁, 陆瑶华. 仿刺参消化系统的组织学和组织化学研究[J]. 动物学杂志, 2000, 35(6): 2-4. Cui L B, Dong Z N, Lu Y H. Histological and histochemical studies on the digestive system of Apostichopus japonicus[J]. Chinese Journal of Zoology, 2000, 35(6): 2-4. DOI:10.3969/j.issn.0250-3263.2000.06.001 (  0) 0) |
| [15] |
García-Arrarás J E, Díaz-Miranda L, Torres I I, et al. Regeneration of the enteric nervous system in the sea cucumber Holothuria glaberrima[J]. Journal of Comparative Neurology, 1999, 406(4): 461-475. DOI:10.1002/(ISSN)1096-9861
(  0) 0) |
| [16] |
赵鹏, 杨红生, 孙丽娜. 仿刺参(Apostichopusjaponicus)摄食和运动器官的结构与功能[J]. 海洋通报, 2013, 32(2): 178-183. Zhao P, Yang H S, Sun L N. Study on the structures and functions of feeding and locomotor organs of sea cucumber Apostichopus japonicus[J]. Marine Science Bulletin, 2013, 32(2): 178-183. (  0) 0) |
| [17] |
Inoue M, Tamori M, Motokawa T. Innervation of holothurian body wall muscle: Inhibitory effects and localization of 5-HT[J]. Zoological Science, 2002, 19(11): 1217-1222. DOI:10.2108/zsj.19.1217
(  0) 0) |
| [18] |
Saha A K, Tamori M, Inoue M, et al. NGIWYamide-induced contraction of tube feet and distribution of NGIWYamide-like immunoreactivity in nerves of the starfish Asterina pectinifera[J]. Zoological Science, 2006, 23(7): 627-632. DOI:10.2108/zsj.23.627
(  0) 0) |
| [19] |
Lin M, Mita M, Egertová M, et al. Cellular localization of relaxin-like gonad-stimulating peptide expression in Asterias rubens: New insights into neurohormonal control of spawning in starfish[J]. Journal of Comparative Neurology, 2017, 525(7): 1599-1617. DOI:10.1002/cne.v525.7
(  0) 0) |
| [20] |
郑法新.刺参器官再生的组织学与相关基因研究[D].青岛: 中国海洋大学, 2006. Zheng F X. The Study of HistoIogy of Organ Regeneration and Regeneration-related Gene of Apostichopus japonicus (SeIenka).[D]. Qingdao: Ocean University of China, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10423-2006181496.htm (  0) 0) |
| [21] |
Anderson J M. Studies on visceral regeneration in sea-stars. Ⅱ. Regeneration of pyloric caeca in Asteriidae, with notes on the source of cells in regenerating organs[J]. The Biological Bulletin, 1965, 128(1): 1-23. DOI:10.2307/1539385
(  0) 0) |
| [22] |
Díaz-Miranda L, Price D A, Greenberg M J, et al. Characterization of two novel neuropeptides from the sea cucumber Holothuria glaberrima[J]. The Biological Bulletin, 1992, 182(2): 241-247. DOI:10.2307/1542117
(  0) 0) |
| [23] |
Díaz-Miranda L, García-Arrarás J E. Pharmacological action of the heptapeptide GFSKLYFamide in the muscle of the sea cucumber Holothuria glaberrima (Echinodermata)[J]. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1995, 110(2): 171-176. DOI:10.1016/0742-8413(94)00094-Q
(  0) 0) |
| [24] |
李润玲, 丁君, 张玉勇, 等. 刺参(Apostichopus japonicus)夏眠期间消化道的组织学研究[J]. 海洋环境科学, 2006, 25(4): 15-19. Li R L, Ding J, Zhang Y Y, et al. Histological study on the digestive tract of the Apostichopus japonicus in aestivation[J]. Environmental Science of Sea, 2006, 25(4): 15-19. DOI:10.3969/j.issn.1007-6336.2006.04.005 (  0) 0) |
 2019, Vol. 49
2019, Vol. 49


