2. 潼关中金冶炼有限责任公司,陕西 潼关 714300
2. Tongguan Gold Smelting Co.,Ltd.,Tongguan,714300,China
氰化提金是目前有效的提金方法,它在金的提取中占有很大的比例。在我国采用金精矿氰化—锌粉置换工艺的矿山比较普遍。氰化提金工艺中,主要有铜、铁、锌等金属离子消耗氰化物。氰化物的消耗过高,不仅带来企业成本增加,还由于循环溶液中铜含量过高,造成铜的置换严重影响金的置换和回收,使金的总回收率降低[1]。为降低铜积累,须定期排放部分贫液,过量的氰化物随贫液的排放会造成严重的环境污染。寻找一个低氰化物消耗、成本低、环境效益好的综合处理工艺成为我们研究的目的。
1 氰化物消耗的主要去向分析氰化浸出是在矿浆中进行的。氰化物配成溶液后,首先分解成CN-离子与矿浆中溶解的金、银、铜等金属离子络合,生成金属络合物,还有一部分与溶液中的硫化矿物反应,生成硫氰酸盐,消耗氰化物。一般来说,氰化过程中氰化物消耗主要有以下方面。
1.1 生成贵金属络合物金精矿中含有一定量的金、银等贵金属,矿石与氰化物接触时,CN-与单体解离的金、银离子或暴露在矿石表面的金、银反应,生成 Au(CN)2-、Ag(CN)2-络合物,同时消耗部分氰化物,反应如下:
| $\text{Au}+2\text{C}{{\text{N}}^{-}}\to \text{Au}\left( \text{CN} \right)_{2}^{-}$ | (1) |
| $\text{Ag}+2\text{C}{{\text{N}}^{-}}\to \text{Ag}\left( \text{CN} \right)_{2}^{-}$ | (2) |
生成贱金属络合物是氰化过程中氰化物消耗的主要方面。由于金矿石或金精矿中一般含有多种元素,其中大部分元素可与CN-离子反应生成相应的络合物。金精矿中含量较多的铜、铁、锌与CN-离子作用分别生成Cu(CN)32-、Fe(CN)64-、Zn(CN)42-等络合物离子。反应如下:
| $2\text{C}{{\text{u}}_{2}}+14\text{NaCN+2}{{\text{H}}_{\text{2}}}\text{O+}{{\text{O}}_{\text{2}}}\text{=4NaOH+2N}{{\text{a}}_{\text{3}}}\text{Cu(CNS)(CN}{{\text{)}}_{\text{3}}}\text{+2N}{{\text{a}}_{\text{2}}}\text{Cu(CN}{{\text{)}}_{\text{3}}}$ | (3) |
| $\text{ZnS}+4\text{NaCN}=\text{N}{{\text{a}}_{\text{2}}}\text{Zn(CN}{{\text{)}}_{4}}+N{{a}_{2}}\text{S}$ | (4) |
| $\text{FeS}+6\text{NaCN}+2{{\text{O}}_{2}}=\text{N}{{\text{a}}_{4}}\text{Fe}{{(CN)}_{6}}+N{{a}_{2}}\text{S}{{\text{O}}_{4}}$ | (5) |
金精矿中一般含有30%左右的硫,其中 90% 的硫主要以黄铁矿、磁黄铁矿、白铁矿等形式存在,铁的硫化物是金浮选的主要载体矿物,尽管黄铁矿氧化较慢,当控制条件不适宜时,硫成为消耗氰化物的主要对象之一[2]。
铁的硫化物在氰化液中反应十分复杂。黄铁矿(FeS2)在氰化过程中的氧化过程如下:
| ${{\text{S}}^{2-}}\to \text{S}_{2}^{2-}\to {{\text{S}}_{0}}\to {{\text{S}}_{2}}\text{O}_{3}^{2-}\to \text{SO}_{2}^{2-}\to \text{SO}_{4}^{2-}$ |
在缺氧条件下,这些可溶性硫化物易与氰根负离子起反应生成硫氰根负离子和氢氧根负离子,消耗氰化物。
| $\text{S+CN}={{(CNS)}^{-}}$ | (6) |
| $\text{Fe}{{\text{S}}_{2}}+\text{NaCN}=\text{FeS+NaCNS}$ | (7) |
| $\text{FeS}+7\text{NaCN}+{{\text{H}}_{2}}\text{O+}\frac{1}{2}{{\text{O}}_{2}}=\text{N}{{\text{a}}_{4}}\text{Fe}{{(CN)}_{6}}+NaCNS+2NaOH$ | (8) |
在溶液中,随pH值不同,氰化物在一定程度上水解,其反应为:
| $\text{C}{{\text{N}}^{-}}+{{\text{H}}_{\text{2}}}\text{O}=\text{H}{{\text{O}}^{-}}+\text{HCN}$ | (9) |
消耗部分氰化物。在 25℃时:
| $\text{HCN=}{{\text{H}}^{\text{+}}}\text{+C}{{\text{N}}^{-}}$ |
| ${{\text{K}}_{298}}=\frac{[{{H}^{+}}]\times [C{{N}^{-}}]}{[HCN]}=6.2\times {{10}^{10}}$ |
当[CN-]=[HCN]时,有[H+] = 6.2×10-10,则pH = 9.21。
当溶液pH值为11~12时,
氰化物溶解后几乎全部以CN- 离子存在于溶液中。在氰化浸金中,金浸出的有效成份是 CN- 离子,控制溶液 pH值在11以上CN- 离子浓度达到98% 以上。pH值低,有利于 HCN 形成挥发,氰化物消耗量增大。
2 实际生产中氰化物消耗存在的主要问题以某冶炼厂实际生产为例:
2.1 生产概况(1) 工艺流程(氰化—锌粉置换工艺)(如图 1所示)。
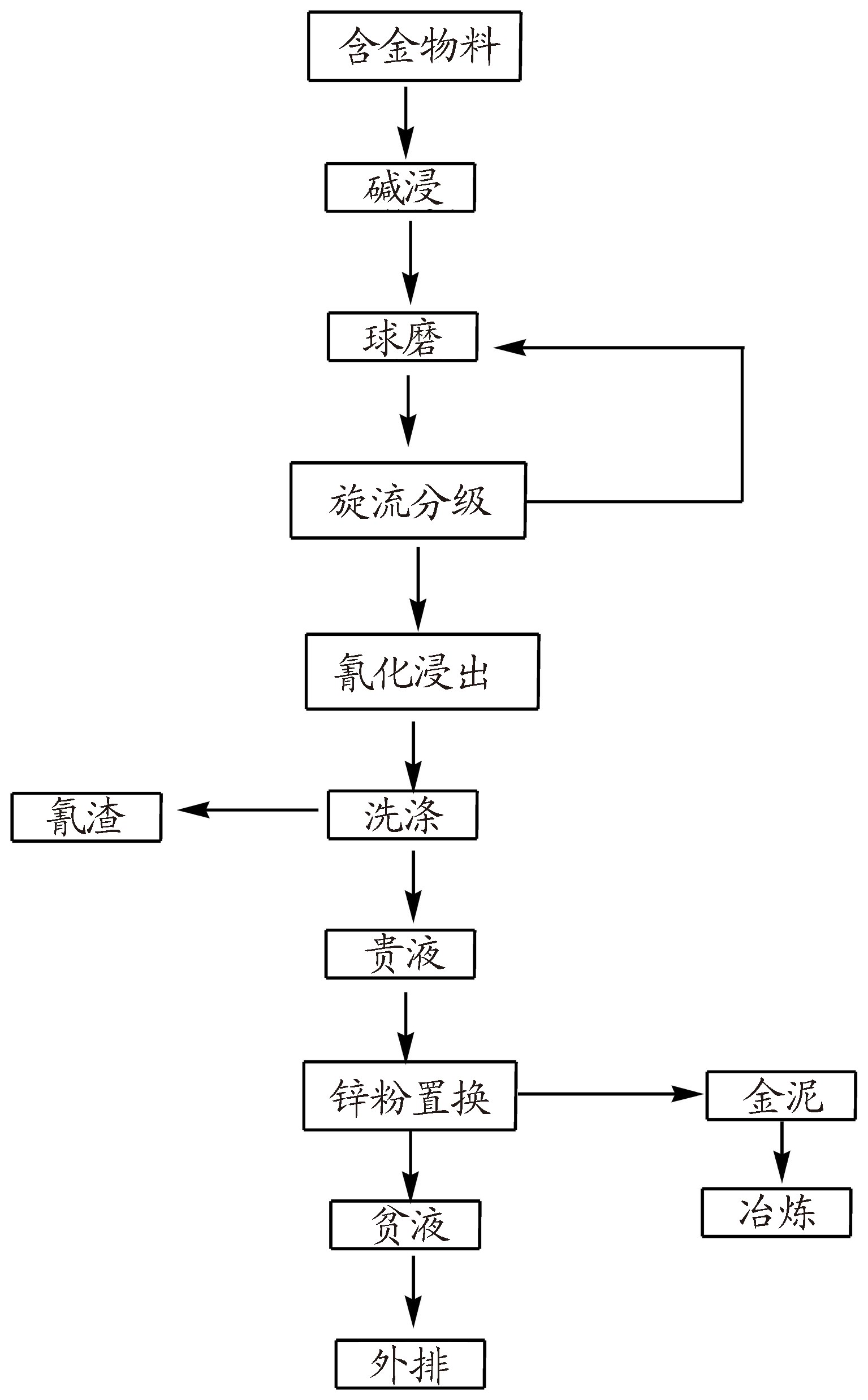
|
图 1 金精矿氰化—锌粉置换工艺流程 |
(2) 生产能力:25×103 kg/d。
(3) 主要药剂:
Pb(NO3)2 (化学纯),西安化学试剂厂生产。
CaO (工业级),氧化钙含量大于98%,陕西富平庄里化工厂生产。
Zn粉,-325目占95%以上,含量大于98%,河南中原化工厂生产。
液体NH4CN (工业品,含量30%~33%),河北任丘元氏化工厂生产,耗量70 g/kg。
(4) 原料:
原料来自当地矿山选矿厂,以含金多金属浮选金精矿为主。原料中含铜2%左右,含铅10%左右,含硫大于30%。金精矿中主要组成元素含量分析及铜、铅物相分析见表 1和表 2。
| 表 1 金精矿多元素分析 |
| 表 2 金精矿中铜、铅物相分析 |
(5) 氰化浸出主要技术参数见表 3。
| 表 3 氰化浸出主要技术参数 |
(6) 贵液元素分析见表 4。
| 表 4 贵液元素分析 |
(7) 贫液主要元素分析见表 5。
| 表 5 贫液主要元素成分 |
(8) 氰渣成份见表 6。
| 表 6 氰渣主要成分 |
(9) 吨矿排出含氰污水1.8 m3,含氰化物1.4 kg/m3,其中随氰渣(三层浓缩沉砂)0.8 m3,贫液排出1.0 m3。
2.2 70 g/kg(NH4CN 30%)液氰消耗在工艺中的平衡 2.2.1. 已溶铜消耗氰化物的估算已知1000kg金精矿可溶铜0.3%,即3 g/kg(平均值)。在pH>12的氰化液中,铜氰络离子约90%呈[Cu(CN)3]2-,其余10%呈[Cu(CN)4]3-形式。其中:[Cu(CN)3]2-消耗液氰为18.6 g/kg,[Cu(CN)4]3-消耗液氰为2.7 g/kg,共消耗液氰为21.3 g/kg。
2.2.2. 排出厂外氰化物污水中带走液氰量的估算已知贫液中含NH4CN,1.4 kg/m3;排出的含氰污水有两个途径,贫液1.0×10-3 m3/kg、氰渣0.8×10-3 m3/kg。氰渣中带出的含氰污水含氰化物是1.4 kg/m3;平均吨矿排除污水中含液氰总量为8.4 g/kg。
2.2.3. 水解、挥发消耗液氰量的估算在常规氰化条件下(氰化物耗量5 g/kg),空气搅拌和水解损失约占45%,吨矿水解挥发损失液氰总量为7.5 g/kg。
由液氰消耗平衡表知,有32.8 g/kg(占总耗量47%)的液氰消耗不知去向。
| 表 7 液氰消耗平衡表 |
(1) 经常出现,随着浸出时间的延长,浸出率反而下降,已溶金再沉淀。
(2) 经常出现,随着浸出时间的延长,溶液中碱度增加。现场用草酸作标准溶液,酚酞作指示剂,测定游离氧化钙含量,实际上应广泛地认作是测定溶液中的碱度。现场1#~4#浸出槽碱度为3×10-4~4×10-4,5#~6#浸出槽碱度为10×10-4~15×10-4,最高可达16×10-4~17×10-4。
(3) 有时出现用硝酸银滴定时有浑浊沉淀,终点不明。
(4) 采用SSZ-3水环式风压机供风,各浸出槽只设置一根充气管,风压不够,供风不足。
(5) 脱氧较差的条件下,置换指标仍基本满意。
2.3.2. 对降低消耗氰化物分析(1) 原料中含10% 的铅,主要以方铅矿的形式存在。由于方铅矿与氰化物反应比较缓慢,因此不认为是消耗氰化物的主要对象[3]。
(2) 由于原料中含有大于30% 的硫。如前所述,其中绝大多数的硫主要是以黄铁矿、磁黄铁矿等形式存在。这些硫化矿物,当控制条件不当时就成为消耗氰化物的主要对象。反应如前1.3所述。
由此可见,已溶金再沉淀,硝酸银滴定终点不明,说明浸出液供氧不足,呈还原性,与现场供风系统供风不足,互证。
浸出过程中,碱度剧增的原因其一是由于供风不足,缺氧,大量生成CNS- 和OH-;其二是浸出过程中添加液体氰化物含有3%~8% 的NH4OH。
3 降低氰化物消耗的途径 3.1 强化充气,改善供氧质量(1) 加大充气力度,提高氧气供给,降低液氰的不必要消耗。目前大多数氰化厂用低压(0.2 MPa)无油润滑空压机供风,供风量在0.5~1.0 m3/min槽。通过改进插入浸出槽的供风管质量,并在管端设置小孔风帽,提供大量小直径气泡,改善空气传递,安装逆止阀门,防止回风倒灌等措施以提高供风质量。
(2) 保留和优化现有的预先碱浸工序,强化对其的充气力度。
(3) 由于供氧改善,置换脱氧条件下不适应的矛盾有可能突现。对此,应经常检查射流泵,检查喷咀、喉管、管道是否堵塞变形,喷咀底板是否位移进水口位置等;检查冷凝泵,防止因真空脱氧质量提高后,冷凝泵无力抽液的矛盾出现;检查置换系统所有管路,杜绝漏气可能。
3.2 适当添加铅盐铅盐能够加快浸出速度,提高金的浸出率,降低氰化物消耗[3]。铅盐的氧化电位大于氰化浸金所需氧化剂的最小电位 -0.54 V。根据浸金过程热力学分析:氰化过程中,只要氧化剂的氧化电位大于 -0.54 V,这种氧化剂就可以用于强化浸金过程,而铅盐的氧化电位Pb2+/Pb为 -0.126 V,大于 -0.54 V,能够满足浸金过程的热力学要求,这也是它能够强化浸金过程的前提。
在氰化浸金的pH值范围内,铅盐可以作为金的氧化剂去溶解金而自身被还原。铅盐氧化金生成金铅合金,如AuPb2可以覆盖在金粒的部分表面。而AuPb2与Au可以形成原电池,AuPb2作为正极,Au作为负极。通过原电池的形成作用,极大地加速了Au的溶解和浸出。
在正极AuPb2:
| $\frac{1}{2}{{\text{O}}_{\text{2}}}+2{{\text{H}}^{\text{+}}}+2\text{e=}{{\text{H}}_{\text{2}}}\text{O}$ |
在负极Au:
| $\text{Au}+2\text{C}{{\text{N}}^{-}}-\text{e=Au}\left( \text{CN} \right)_{2}^{-}$ |
总反应:
| $\frac{1}{2}{{\text{O}}_{\text{2}}}\text{+2Au}+4\text{C}{{\text{N}}^{-}}+2{{\text{H}}^{\text{+}}}\text{=Au}\left( \text{CN} \right)_{2}^{-}+{{\text{H}}_{\text{2}}}\text{O}$ |
在浸前加入Pb(NO3)2可降低矿浆中可溶性金属离子的含量,因此使氰化物耗量降低。由于矿浆中干扰离子减少,使金氰络合物生成机会增加。如在磁黄铁矿分子结构中,有一个结合得不牢固的硫原子易氧化生成可溶性硫化物,在氰化浸出过程中消耗大量的氰化物,添加硝酸铅可减少矿浆中硫离子的存在及沉降部分可溶性硫化物,因而使氰化物消耗降低,金的浸出率提高。
| $\text{F}{{\text{e}}_{\text{7}}}{{\text{S}}_{\text{8}}}+\text{PbO}=\text{PbS}+7\text{FeS+}\frac{1}{2}{{\text{O}}_{2}}$ |
注:在氰化碱性介质条件下,铅生成PbO和PbO22-,再和S2-、FeSO4、FeO2等反应,生成不溶于水、不影响浸金的硫化物。
适量添加铅盐,的确有助于提高金的浸出,降低氰化物消耗,但不能加入的铅盐太多,否则将使原电池的作用停止,甚至生成Pb(OH)2沉淀,使金的溶解速度大大降低。经我们反复试验,适用该冶炼厂金精矿硝酸铅添加量为0.035 g/kg左右为宜。
3.3 控制合理的氧化钙(CaO)浓度在氧化提金过程中,必须添加石灰,且保持合适的氧化钙浓度是十分重要的,其作用主要有:(1) 提高了浸出液的pH值,降低了生产HCN的浓度和减少了HCN气体形式的挥发;(2) 由于溶液中添加有Ca2+ 离子,铜的浸出率明显降低,阻止了Fe(CN)64的生成,CNS- 离子的浓度液降低,Ca2+离子阻止了CN -离子与Cu和S的结合,因而有效地降低了氰化物的消耗[4]。
经过反复试验,结合当地原料实际,我们认为添加氧化钙12 g/kg比较合理。
3.4 循环溶液净化再生基于现场有3 g/kg矿可溶铜与氰化物反应生成[Cu(CN)3]2- 和[Cu(CN)4]3-,导致因此消耗液氰21.3 g/kg,占总耗量的30%,同时溶液中大量铜氰络离子的存在又导致置换困难;金泥质量下降(现场金泥含金仅7%);溶液含铜高达4 200 ug/L,难以循环使用等弊病。因此,产生了溶液净化再生的必要性和可能性。
化学沉淀法再生净化含铜氰溶液的原理如下:
(1) 酸化:铜(锌)氰络合离子分解
| $\text{C}{{\text{u}}_{2}}{{\left( \text{CN} \right)}_{2}}+2\text{H}{{\text{N}}_{4}}\text{CNS}+{{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}=\text{C}{{\text{u}}_{2}}{{(\text{CNS})}_{2}}+{{\left( \text{H}{{\text{N}}_{\text{4}}} \right)}_{2}}\text{S}{{\text{O}}_{4}}+2\text{C}{{\text{N}}^{-}}+2{{\text{H}}^{+}}$ |
| ${{\left( \text{H}{{\text{N}}_{4}} \right)}_{\text{2}}}\text{ZN}{{\left( \text{CN} \right)}_{\text{4}}}\text{+3}{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}=\text{ZnS}{{\text{O}}_{4}}+2\text{N}{{\text{H}}_{4}}\text{HS}{{\text{O}}_{4}}+4\text{C}{{\text{N}}^{\text{-}}}+4{{\text{H}}^{+}}$ |
| ${{\text{H}}^{\text{+}}}+\text{C}{{\text{N}}^{-}}=\text{HCN}$ |
(2) 中和:
| ${{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}+\text{Ca}{{(OH)}_{2}}=\text{CaS}{{\text{O}}_{\text{4}}}+2{{\text{H}}_{2}}\text{O}$ |
| $\text{HCN}={{\text{H}}^{+}}+\text{C}{{\text{N}}^{-}}$ |
对待处理溶液,添加硫酸,降低溶液pH值,促使金属氰络合离子分解产生沉淀和HCN,将沉淀固液分离,从而实现对溶液净化的目的。将净化后的溶液,添加石灰乳,提高pH值,使溶液中残余的H2SO4与Ca(OH)2或CaCO3作用生成钙盐沉淀,经固液分离后将其从沉淀溶液中除去。此时,HCN 又以CN- 形式存在,实现了CN-再生的目的[5]。
3.5 控制外排溶液量贫液返回,变溶液开路浸出为闭路浸出。根据水量平衡可知,吨矿排出NH4CN 1.4 kg/m3的溶液1m3,相当于回收30% NH4CN 4.7 g/kg。
4 结语在氰化提金的工业实践中,通过有效地解决好浸出过程中的供氧问题,并适当添加铅盐;控制合理的氧化钙浓度,保持pH值在12左右;通过净化溶液再生,降低循环液中的铜积累;采取贫液返回,减少外排溶液损失的氰化物等措施,不仅大大降低了氰化物的消耗,而且提高了金的浸出率,减少了炼金次数,且使金泥品位提高,降低了生产成本,同时减少了HNO3和H2SO4的用量,提高了经济效益并降低了环境污染,为企业实现可持续发展,提供了发展的新思路、新途径。
| [1] | 高腾跃, 刘奎仁, 韩庆, 等. 电沉积回收氰化尾液中铜和氰化物的研究[J]. 东北大学学报, 2015, 36(1): 81–85. |
| [2] | 徐天允, 徐正春. 金的氰化与冶炼[M]. 北京: 冶金工业出版社, 1996. |
| [3] | 李玉昭, 王启运. 黄金选冶[M]. 西安: 西安冶金建筑学院出版社, 1993. |
| [4] | 曹会兰. 锌粉置换提金中铜影响的研究[J]. 宝鸡文理学院学报, 2003(1): 39–41. |
| [5] | 曹会兰. 氰化废水零排放工艺研究及应用[J]. 渭南师范学院学报, 2003(5): 41–42. |
 2016, Vol. 31
2016, Vol. 31