婴儿和新生儿期是脑发育成熟关键时期,髓鞘形成,水分子量发生变化,MRI上呈现灰白质不同于成人的信号对比[1]。磁敏感加权成像是利用组织间磁化率差异而形成对比[2],以梯度回波序列为基础,三维采集,加上运动伪影抑制技术,可以获得脑静脉在血氧水平依赖(blood oxygen level dependence, BOLD)上的信息,敏感地反映静脉系统脱氧血红蛋白含量变化[3, 4]。本研究基于3.0T磁共振磁敏感加权成像,分析正常新生儿大脑相位位移解剖规律及其与周龄间相关性,评价SWI在新生儿脑发育评估中的应用价值。
1 材料与方法 1.1 正常新生儿纳入标准①胎龄28-40周(平均约35+6周)的正常早产儿或足月儿,MRI检查时间为出生后2-30 d; 临床和影像学资料完整。②Apgar评分1 min≥7分,5 min 10分; 孕母情况良好、无基础疾病,各项检查均无异常。③扫描过程中自然睡眠或使用镇静剂。④无MRI扫描禁忌证。
1.2 资料收集收集2012年3月-2013年10月武汉大学中南医院新生儿科80例正常新生儿。这80例研究对象均有完整临床资料和影像学资料,图像采集均使用Siemens Magnetom Trio 3.0T超导MR扫描仪,8通道头颅线圈。MRI扫描时间均在出生后2 d-1个月。80例新生儿胎龄为28-40周,平均约35+6周,年龄为2-27 d,平均16 d,其中男性47例,女性33例。在常规扫描基础上增加SWI序列:TR/TE为25 ms、20 ms,矩阵256×256,FOV 140×140,扫描时间3 min 44 s; 可以获得幅值图、SWI图、相位图。
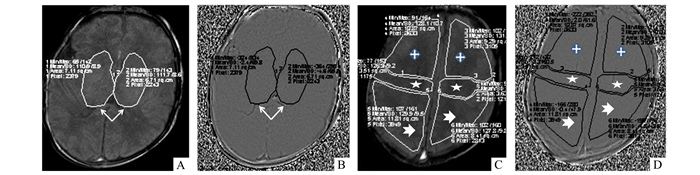
1.3 实验数据采集和后处理将原始数据导入后处理工作站,以SWI幅值图为基础,取相应层面相位图的相位位移值。所取感兴趣区为双侧基底节区(取基底节最大层面)、中央回、额叶及顶叶; 双侧大脑半球对称性测量取双侧其平均值(图 1A-1D)。深部灰质相位值测量选择显示深部静脉层面并作为感兴趣区(包括双侧尾状核、豆状核及丘脑); 测量皮质静脉相位值时,在幅值图上选能最好显示U型中央沟的层面,大脑边缘及大脑镰周围的组织不作为感兴趣区。在幅值图上手动绘制感兴趣区,然后在相位图上同一层面取同一部位位移值,包括均值(x)和标准差(s)。通过统一计算公式得出最终相位位移值(PS); 再计算相位位移比率计算得到深部灰质区和大脑皮质区相位位移比率(相比率,phase shift ratio,PRS)。公式如下:相比率=深部灰质区相位位移值/([额叶相位位移值+中央区相位位移值+顶叶相位位移值]/3)。
|
图 1 PS值测量示意图(双侧对称测量,取其平均值) A:幅度图; B:相位图,双侧深部灰质测量区(白箭); C:幅度图; D:(相位图)双侧额叶皮质区(白+),双侧中间皮质区(白五角星),双侧顶叶皮质区(白箭头) |
SPSS 19.0版软件方差分析组间PS值差异,P<0.05为有统计学意义; Spearsman相关性分析正常新生儿相位位移比率(PSR)与MRI检查时周龄相关性。
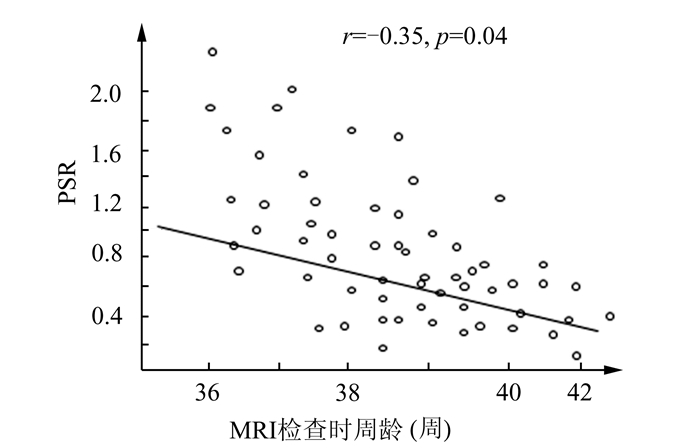
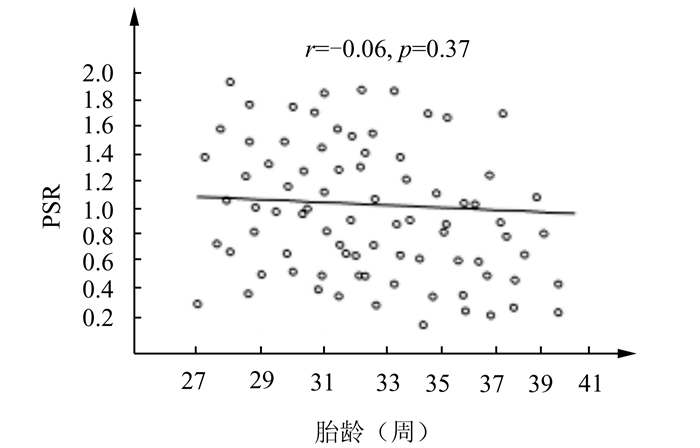
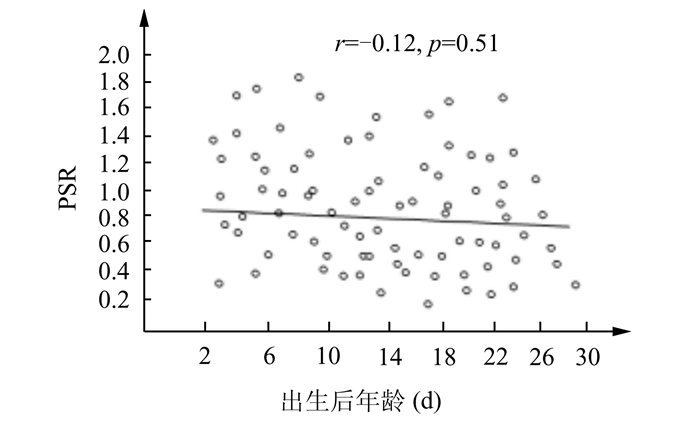
2 结果正常新生儿脑深部灰质区、中央区、额叶区及顶叶区PS及各组间的比较结果如下(表 1、表 2)。正常新生儿深部灰质区相位位移值均值为0.052±0.010;额叶大脑皮质区为0.059±0.010、中央回大脑皮质区为0.045±0.009、顶叶大脑皮质区为0.039±0.009;大脑皮质区相位位移值均值为0.048±0.009。深部灰质区和大脑皮质区相比率计算结果范围是0.139-2.746。深部灰质区静脉相位位移值高于大脑皮质区(P<0.01),在大脑皮质区,额叶皮质相位位移值明显高于中央区及顶叶区(P<0.01)。正常组脑部深部灰质区和大脑皮质区相比率与MRI检查时周龄成负相关(r=-0.35,P=0.04)(图 2)。深部灰质区和大脑皮质区相比率与胎龄及出生后年龄无明显相关性(图 3、4)。
| 表 1 正常新生儿深部灰质区和大脑皮质区相位位移值(深部灰质与大脑皮质均值比较) |
| 表 2 正常新生儿大脑皮质区相位位移值 |
|
图 2 正常新生儿深部灰质区和大脑皮质区PSR与MRI检查时周龄关系散点图 |
|
图 3 正常新生儿深部灰质区和大脑皮质区PSR与胎龄的关系散点图 |
|
图 4 正常新生儿深部灰质区和大脑皮质区PSR与年龄的关系散点图 |
SWI是安全的三维MRI成像技术,一次扫描能提供相位幅度像、相位像、最小密度投影像和SWI像,对血液成分、铁和钙化等矿物质在脑部的沉积敏感性高,已经成为新生儿和小孩脑部MRI检测的常规序列,可提供有价值的诊断和预后评估的额外信息,拓宽了MRI在新生儿神经系统疾病的诊断范围[1]。有研究报道在新生儿缺血缺氧性脑病SWI发现脑白质和灰质的微出血灶及扩张髓静脉,增加了其诊断敏感性和特异性的[8]。本文利用SWI分析正常新生儿大脑相位位移解剖规律及其与周龄间相关性,定量评价SWI在新生儿脑发育评估中的应用价值。
新生儿中枢神经系统不成熟,各部位脑血流分布不平衡同时,其脑循环自动调节功能也不完善[4],导致各部位脱氧血红蛋白含量差异明显; 这种差异使新生儿脑组织BOLD (血氧水平依赖)效应呈现明显变化并呈显著的时间相关性[5]。SWI-Phase (相位像)在BOLD效应的基础上能够定量敏感反映大脑脱氧血红蛋白含量的差异[6],即相位图上相位位移值的变化。由于新生儿脑血流分布不平衡,正常情况下,灰质及脑干核团血流量最多,皮质下白质血流量较少; 脑血流分布状态与该部分供血动脉及发育状态有关。本文结果表明在正常新生儿大脑PS存在解剖学差异,深部灰质区PS高于皮质区,皮质区PS从高到低为额叶皮质区、中央区和顶叶区; 提示新生儿脑血流分布不平衡性。脑血流自动调节功能:当灌注压升高时,脑血管收缩使血流减少; 反之则增加。在新生儿尤其是早产儿脑血流自动调节范围小,轻微的血压波动就会导致缺血或过度灌注。如新生儿在窒息缺氧时,出现低氧血症、高碳酸血症,脑血流自身调节功能破坏,造成脑组织的缺血缺氧性损伤[6]。而早产儿脑白质本身血流量偏低,安全范围小,容易引起脑白质缺血损伤,导致脑室周围白质软化[7]。
新生儿期和婴儿期是脑组织发育成熟最重要的时期,神经细胞的分裂主要在胎儿期完成,出生后脑发育主要表现为髓鞘的形成、突触生长。本文结果表明深部灰质区和大脑皮质区相位位移比率随着妊娠并出生后周龄增长而不同程度降低,提示其神经系统发育的关键时期。脑髓鞘形成及水分下降使灰白质对比也发生着变化,在MRI信号上大致可分为5个时期:Ⅰ期:出生时灰白质含水量相当,中间区及边缘区均呈高信号,对比不明显,中央区呈低信号,新生儿均属于此期。Ⅱ期:大脑皮质内开始有髓鞘形成,白质含水量仍然很高,故中间区为高信号,边缘区为低信号,中央区仍为低信号。出生后1-6个月者大部分属于此期。Ⅲ期:白质内水分逐渐下降并伴髓鞘形成,因为脑组织髓鞘化是从后向前进行的,所以此期枕叶的中间区和边缘区开始呈等信号,额叶及颞叶的中间区仍为高信号,中央区仍为低信号。6-9个月者属于此期。Ⅳ期:此时白质内髓鞘化逐渐完善、水分不断下降,中间区信号减低,与边缘区信号基本相似,呈等信号,中央区则为稍低信号。9-12个月者属于此期,即等信号期。Ⅴ期:随着月龄增加,大脑深部白质水分减少,低于灰质区,边缘区皮质逐渐变薄,白质范围逐渐扩大。中间区呈低信号,边缘区和中央区成中等信号。出生12-18个月者大部分属于此期,18个月-2岁均属于此期,也称灰白质信号倒转期。
刚出生新生儿脑细胞分化不全,轴突和树突少且短,研究表明[7-9]出生时内囊后肢已有髓鞘化,而此时脑皮质较薄,深部灰质较大脑皮质发育早。SWI显示为深部灰质区相位位移值高于大脑皮质区。另外,在大脑皮质区,额叶相位位移值最大,其次是中央区,最小是顶叶区。可能是新生儿出生时基底节区发育早、功能活跃、耗氧量大,故脱氧血红蛋白浓聚,相位位移值高[10-12]。皮质区各叶脑功能各异,耗氧量不同,其中以额叶耗氧量较高。这些区域是典型的高代谢区,例如深部灰质、感觉运动区、视觉通路等[13, 14],可能与早期髓鞘形成、脑灌注增加、葡萄糖高摄取、波谱变化等[15-17]。髓鞘形成有一定的规律:从尾侧到头侧,从背侧至腹侧; 从中央向外周; 皮质早于白质; 感觉功能区早于运动功能区; 白质区放射神经束早于连合神经束。髓鞘形成过程中会伴有胶质增生,并且这种胶质增生早于髓鞘,它会提供含有髓鞘脂质前体(PMGC)的胞质颗粒,这种颗粒含有胆固醇和磷脂,会缩短T1时间。MRI图像上灰白质信号的变化与髓鞘形成和水分减少有关,T1WI图像上髓鞘形成的高信号变化在出生后6-8个月基本完成,和胶质增生是一致的; 随着髓鞘的成熟,髓鞘脂质膜内层会产生疏水的磷脂和脂质构成复合体,疏水性逐渐增加,水分逐渐下降,从而使T2WI信号减低。T2WI信号减低反映了髓鞘形成和水分减低的一致性。
出生后2岁内是脑组织发育的快速时期,脑重可迅速增加,脑胶质细胞增多、白质纤维髓鞘化[18]。脑发育主要表现之一是髓鞘形成和成熟,髓鞘形成有一定的规律:从尾侧到头侧,从背侧至腹侧; 从中央向外周; 皮质快于白质; 感觉功能区早于运动功能区; 白质区放射神经束早于连合神经束[19-21]。本研究结果也显示深部灰质区和大脑皮质区相位位移比率关系提示随着出生后日龄增加,大脑皮质区相位位移值增加快于深部灰质区,即皮质的髓鞘发育快于白质。
总之,正常新生儿脑深部灰质区相位位移值明显高于皮质区; 大脑皮质区相位位移值从大到小依次为额叶区、中央区和顶叶区。符合新生儿期深部灰质区功能活跃、耗氧量大,皮质区额叶相对功能活跃特点。静脉系统在深部灰质区和大脑皮质区相位位移比率随着MRI检查时周龄的增长而不同程度减小; 提示新生儿随着年龄增长,皮质区发育更快。综上所述,磁敏感加权成像相位位移值测量可作为判断新生儿脑发育定量的无创性检测方法。确定正常新生儿脑不同部位相位位移值参考范围,可前瞻性定量、无创判断新生儿脑是否发育正常。
| [1] | Tocchio S, Kline-Fath B, Kanal E, et al. MRI evaluation and safety in the developing brain[J]. Semin Perinatol, 2015, 39(2): 73-104. DOI: 10.1053/j.semperi.2015.01.002. |
| [2] | Haacke EM, Mittal S, Wu Z, et al. Susceptibility-weighted imaging: technical aspects and clinical applications, part 1[J]. AJNR, 2009, 30: 19-30. |
| [3] | Niwa T, Aida N, Takahara T, et al. Imaging and clinical characteristics of children with multiple foci of microsusceptibility changes in the brain on susceptibility-weighted MRI[J]. Pediatr Radiol, 2010, 40: 1657-1662. DOI: 10.1007/s00247-010-1665-z. |
| [4] | Meoded A, Poretti A, Northington FJ, et al. Susceptibility weighted imaging of the neonatal brain[J]. Clin Radiol, 2012, 67(8): 793-801. DOI: 10.1016/j.crad.2011.12.004. |
| [5] | Peters S, Pahl R, Claviez A, et al. Detection of irreversible changes in susceptibility-weighted images after whole-brain irradiation of children[J]. Neuroradiology, 2013, 55(7): 853-859. DOI: 10.1007/s00234-013-1185-2. |
| [6] | Kersbergen KJ, Benders MJ, Groenendaal F, et al. Different patterns of punctate white matter lesions in serially scanned preterm infants[J]. PLoS One, 2014, 9(10): e108904. DOI: 10.1371/journal.pone.0108904. |
| [7] | Gang Q, Zhang J, Hao P, et al. Detection of hypoxic-ischemic brain injury with 3D-enhanced T2* weighted angiography (ESWAN) imaging[J]. Eur J Radiol, 2013, 82(11): 1973-1980. DOI: 10.1016/j.ejrad.2013.05.023. |
| [8] | Neil JJ, Shiran SI, Mckinstry RC, et al. Normal brain in human newborns: apparent diffusion coefficient and diffusion anisotropy measured by using diffusion tensor MR imaging[J]. Radiology, 1998, 209(1): 57-66. DOI: 10.1148/radiology.209.1.9769812. |
| [9] | Wu YW, Backstrand KH, Zhao S, et al. Declining diagnosis of birth asphyxia in California: 1991-2000[J]. Pediatrics, 2004, 114(6): 1584-1590. DOI: 10.1542/peds.2004-0708. |
| [10] | Engelbrecht V, Rassek M, Preiss S, et al. Age-dependent changes in magnetization transfer contrast of white matter in the pediatric brain[J]. AJNR, 1998, 19(10): 1923-1929. |
| [11] | Hashioka A, Kobashi S, Kuramoto K, et al. A neonatal brain MR image template of 1 week newborn[J]. Int J Comput Assist Radiol Surg, 2012, 7(2): 273-280. DOI: 10.1007/s11548-011-0646-5. |
| [12] | 黄新明, 孙斌, 薛蕴. 磁敏感加权成像检测帕金森病患者脑铁沉积[J]. 中华医学杂志, 2010, 90: 3054-3058. |
| [13] | Huppi PS, Inder TE. Magnetic resonance techniques in the evaluation of the perinatal brain:recent advance and future direction[J]. Semin Neonatol, 2001, 6: 195-210. DOI: 10.1053/siny.2001.0039. |
| [14] | Van Buchem MA, Steens SC, Vrooman HA, et al. Global estimation of myelination in the developing brain on the basis of magnetization transfer imaging: a preliminary study[J]. AJNR, 2001, 22(4): 762-766. |
| [15] | Fockele DS, Baumann RJ, Shih WJ, et al. Tc-99m HMPAO SPECT of the brain in the neonate[J]. Clin Nucl Med, 1990, 15: 175-177. DOI: 10.1097/00003072-199003000-00008. |
| [16] | Huppi PS, Posse S, Lazeyras F, et al. Magnetic resonance in preterm and term newborns:1H spectroscopy in developing human brain[J]. Pediatr Res, 1991, 30: 574-578. DOI: 10.1203/00006450-199112000-00017. |
| [17] | Xu D, Bonifacio SL, Charlton NN, et al. MR spectroscopy of normative premature newborns[J]. J Magn Reson Imaging, 2011, 33: 306-311. DOI: 10.1002/jmri.v33.2. |
| [18] | Chalian M, Tekes A, Meoded A, et al. Susceptibility-weighted imaging (SWI): a potential non-invasive imaging tool for characterizing ischemic brain injury[J]. J Neuroradiol, 2011, 38: 187-190. DOI: 10.1016/j.neurad.2010.12.006. |
| [19] | Paus T, Collins DL, Evans AC, et al. Maturation of white matter in the human brain: a review of magnetic resonance studies[J]. Brain Res Bull, 2001, 54(3): 255-266. DOI: 10.1016/S0361-9230(00)00434-2. |
| [20] | Chugani HT, Phelps ME, Mazziotta JC. Positron emission tomography study of human brain functional development[J]. Ann Neurol, 1987, 22: 487-497. DOI: 10.1002/(ISSN)1531-8249. |
| [21] | Garfinkle J, Shevell MI. Prognostic factors and development of a scoring system for outcome of neonatal seizures in term infants[J]. Eur J Paediatr Neurol, 2011, 15: 222-229. DOI: 10.1016/j.ejpn.2010.11.002. |
 2016, Vol. 37
2016, Vol. 37

