中枢神经系统炎性脱髓鞘病变是自身免疫性疾病,常见原发病变包括多发性硬化(multiple sclerosis, MS)、视神经脊髓炎(neuromyelitisoptiea, NMO)、播散性脑脊髓炎(disseminated encephalomyelitis, DEM)等,其中一种特殊类型在影像学上表现为占位效应,而临床症状少,似脑肿瘤,被称为瘤样炎性脱髓鞘病(tumor-like inflammatory demyelinating disease, TIDD)[1, 2],亦称肿瘤性脱髓鞘病(tumefactive demyelinating lesions,TDLs),或称脱髓鞘假瘤(demyelinating pseudotumor,DPT)。有学者认为TIDD是MS的一种特殊类型,或者是MS或者DEM之间的过渡类型[3, 4]。现将我科收治的1例拟诊为胶质瘤,后确诊为TIDD的病例,结合文献分析临床特征,并探讨和分析误诊原因。
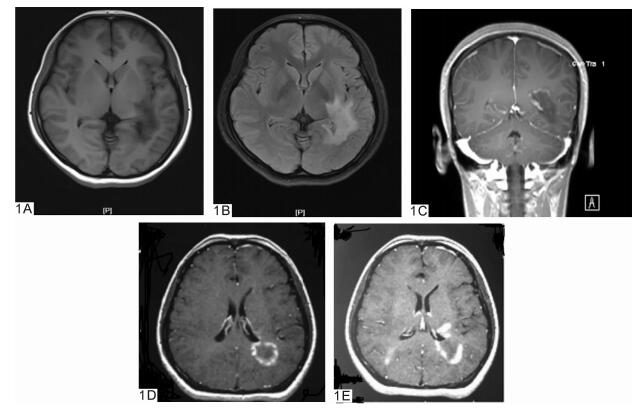
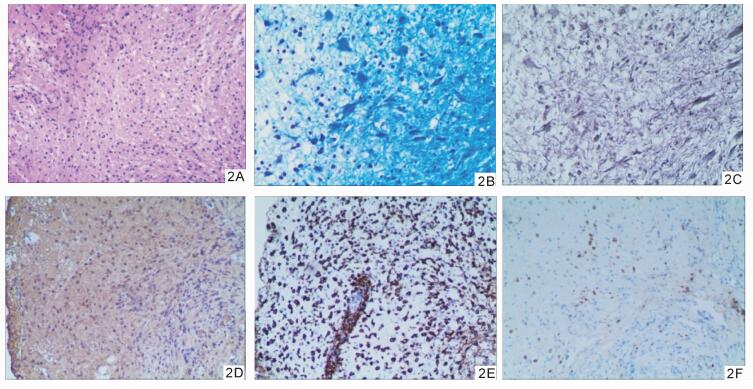
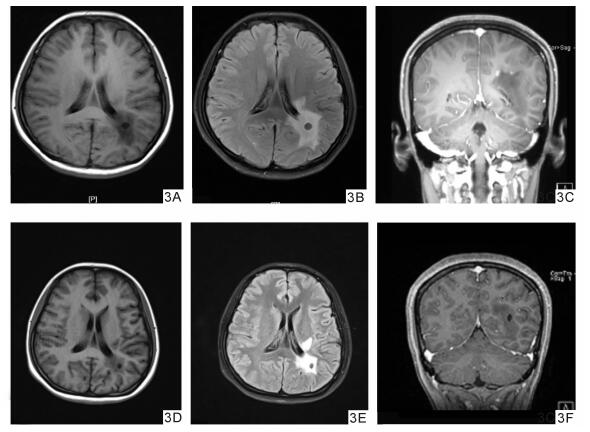
1 病例资料患者女,24岁,因“视物模糊4个月,记忆减退2个月”入院(于2015年7月9日被武汉大学中南医院收住院)。患者诉于4个月前无明显诱因出现视物模糊,劳累后加重,休息后缓解,近2个月出现记忆减退,未诉其他异常。既往体健,一般体检未见异常。体检:BP 122/74 mmHg,HR 78次/min,神经系统检查:神志清楚,言语清晰,命名困难,近记忆力下降,双侧瞳孔等大等圆,D=3.0 mm,对光反射灵敏,眼球活动可,未见眼震,双侧眼底正常,眼压、视野未见异常,双眼视力1.2;双侧额纹及鼻唇沟对称,伸舌居中,颈软,四肢肌力5级,肌张力正常,腱反射正常,病理征阴性,粗查深浅感觉及共济运动无异常,脑膜刺激征阴性。辅助检查:神经心理学评估:MMSE量表20分(高中文化水平),MOCA量表15分;血常规分析、尿液分析检测、肝肾糖电解质、血脂全套、甲状腺功能、肿瘤标志物全套和病毒七项未见异常;抗O类风湿全套未见异常,抗核抗体检测(ANA+ENA)阴性;脑脊液生化、脑脊液常规、脑脊液细菌检查(墨汁、抗酸、革兰染色)未见明显异常;脱落细胞学检查(液基)未见异常细胞; 脑脊液压力100 mmH2O。入院查头颅MRI (图 1A, 1B) T1 Flair低信号,T2 Flair高信号,增强MRI示病灶边缘强化;波谱分析示:与对侧正常脑组织相比较,病灶侧Cho/Cr比值升高,NAA/Cr及NAA/Cho比值降低。入院考虑拟诊断为低级别分化胶质瘤,考虑手术治疗。外院复查MRI (图 1C)示:增强MRI可见环形或“C”形强化。考虑炎性脱髓鞘改变可能。为进一步明确诊断,在立体定向下行活检术,在左侧病灶处取出大小分别为0.3 cm×0.2 cm×0.2 cm和0.5 cm×0.5 cm×0.3 cm两块脑组织,病检镜下(图 2)可见:(左侧枕病灶)脑组织角质增生,大量组织细胞反应,血管周围见少量淋巴细胞浸润,髓鞘片灶状脱失;组织化学染色可见:髓鞘染色可见髓鞘片灶状脱失,轴索染色(+);一步法免疫组化标记:胶质细胞GFAP (+), Oligo-2(+), S100(+), MGMT (+), EGFR (++), Syn (-), EMA (-), WF-1(-),IDH1(-), P53(+), Ki67标记指数约1%;髓鞘MBP (+); 轴索NF (+); 神经元Neu-N (-), 淋巴细胞LCA (+), 组织细胞CD68(+);血管内皮CD34(+)。病理检查结果排除胶质瘤,确诊为炎性脱髓鞘改变,遂修正诊断为:瘤样炎性脱髓鞘病。给予甲强龙1 000 mg冲击治疗3 d, 改为500 mg治疗3 d,地塞米松10 mg维持5 d后逐渐减量并改为强的松口服,逐渐停药。患者诉近记忆能力、命名困难等逐渐改善,视物模糊好转,3周后复查头颅MRI (图 3)示:病灶减小,增强MRI示:强化减弱。5周后(2015年10月15日)复查MMSE量表26分,复查头颅MRI (图 3)示:病灶明显缩小,增强MRI示边缘未见强化灶。
|
图 1 1例瘤样脱髓鞘病治疗前后MRI影像 1A.t1-flair (激素治疗前) a-1;1B.t2-flair (激素治疗前) a-2;1C.激素治疗前增强MRI可见“开环征”a-3;1D.激素治疗前增强MRI; 1E.激素治疗前b-2 |
|
图 2 病变处轴索病理切片照片 2A.病变处HE染色×100; 2B.病变处髓鞘组化染色×200; 2C.病变处轴索组化染色×200; 2D.病变处轴索组化染色×200; 2E.病变处CD68免疫组化染色×200; 2F.病变处LCA免疫组化染色×100 |
|
图 3 治疗后MRI照片 3A.t1-flair (激素治疗3周后); 3B.T1激素治疗3周后; 3C.激素治疗3周后增强MRI; 3D.t1激素治疗5后; 3E.t2激素治疗5周后; 3F.激素治疗5周后增强MRI |
一般认为TIDD发病多与疫苗接种、病毒感染等因素有关[2];青年时发病,多数呈亚急性起病,仅有少部分急性起病;TIDD患者临床表现不典型,多单一病程,智能障碍有时是早期的临床表现或主要症状,大小便障碍在TIDD患者中常见,尤其是脊髓或双侧半球均有脱髓鞘病灶时。少数TIDD患者脑脊液压力轻度增高,较少超过250 mmH2O (1 mmH2O=0.133 3 kPa)。脑脊液髓鞘碱性蛋白(MBP)的含量常有明显增高,王起[3]等对一些TIDD患者的脑脊液MBP检测发现均有不同程度升高,均值可超过正常值上限的数十倍。本例患者由于病变累及海马、颞叶、枕叶,临床表现出现记忆减退、命名困难、视物模糊等症状。
2.2 影像学特征CT平扫及增强扫描:CT平扫对TIDD诊断及鉴别诊断意义不大,病灶一般出现低密度影,边界清楚,有些边界模糊,增强扫描多无明显强化,有些可见病灶及周边轻度强化。TIDD患者CT平扫不出现高信号,当脑占位病变在头颅CT平扫呈现高信号,且较脑皮质的密度还高时,此类病灶一般可排除TIDD可能[4]。
MRI检查:从病变的边界来看,TIDD在MRI上的病变边界比较清楚,病变常累及脑皮质及皮质下,而且可以多发,散在分布。急性或亚急性期DWI多为高信号,随时间变化信号强度逐渐变弱[1]。TIDD患者在MRI T1-flair表现低信号,T2-flair表现高信号。MRI增强扫描对TIDD早期诊断有重要意义。急性或亚急性期增强多呈现病灶强化。急性期(小于1个月)多为强化灶呈团块或片状,亚急性期(大于1个月)可见环形或形似“C”形强化,慢性期(3个月后)强化越来越不明显[3]。Masdeu等针对中枢神经系统病灶MRI增强扫描出现环形强化的病例分析得出结论,非闭合性环形强化,即“开环征”,对TIDD的诊断意义相当大[5]。有文献报道,非脱髓鞘病变如炎症、肿瘤等,仅少数患者出现“C”形强化[6]。“开环征”是TIDD的比较典型表现,具有高度的特异性[7-9]。目前一般认为巨噬细胞的浸润和受累病灶区域的血脑屏障的破坏是导致病灶强化程度不同的原因[8]。
本例患者发病2月后增强MRI可见典型的“开环征”(见图 1),激素治疗3周后复查头颅MRI (d)示:病灶减小,增强MRI示:强化减弱。5周后(2015年10月15日)复查MMSE量表26分,复查头颅MRI (e)示:病灶明显缩小,增强MRI示边缘未见强化灶。
有些病例出现强弱不等的混杂信号,表示病灶处于不同时期,或者处在不断的发展变化[10]。从这种角度讲,TIDD的病灶的强化特点可以反映病程。有文献报道TIDD病灶内缘可见线条状的强化影,垂直于侧脑室强化影,认为是小静脉在炎症刺激下扩张充血所致[7, 10],这一征象为TIDD又一特点。
磁化传递成像(MTI)技术特点是能增加正常组织与病灶组织之间对比,利用这一技术可较早发现亚临床病灶,可作为一种补充手段,尤其对于常规MRI序列无法显示脑组织是否存在病变。不过,目前这一技术仅用于神经系统疾病的科学研究。
2.3 1H-MRS检查主要用于分析活体组织代谢、生化改变及化合物定量分析的一种新技术,近来应用于TIDD诊断以及与胶质瘤的鉴别诊断。Kaqeyama等[11]研究TIDD患者病灶侧与对侧正常脑组织,结果显示:Cho/Cr比值升高,NAA/Cr、NAA/Cho比值降低;急性期病灶中心出现Lac峰,提示存在无氧酵解,这可能是髓鞘破坏后脂质释放引起的游离脂肪酸增多导致引起。有报道[12]病理证实的瘤样炎性脱髓鞘病、低级别胶质瘤(low grade glioma, LGG)波谱分析得出一致结果,而且发现与对侧正常脑组织相比较,LGG组患者病灶侧Cho/Cr比值升高,NAA/Cr及NAA/Cho比值降低,差异有统计学意义(P < 0.05)。TIDD组与LGG组病灶区比较,Cho/Cr比值、NAA/Cho比值差异P < 0.05,而NAA/Cr比值差异P>0.05。也就是说,TIDD病变与LGG病变中细胞增殖的程度有差异,而神经元损伤的程度无明显差异。我们知道,NAA峰与神经元的活力与密度有关, Cho峰反映细胞膜更新的速度,出现上述结果,可能因为LGG中肿瘤细胞的高速增殖,使其细胞密度远远大于TIDD中的胶质增生,导致Cho明显升高。这对TIDD疾病的诊断有一定价值。故1H-MRS对TIDD和LGG的诊断及鉴别具有一定帮助。
2.4 病理学特征普通的HE染色不能确诊,需依靠髓鞘和免疫组化染色[13]。在急性期或亚急性期病理改变主要是神经轴索相对完好,而神经髓鞘被破坏。光镜下可见星形细胞明显增生,可伴有不同程度的异型性和病理核分裂,细胞质丰富,形似肥胖型星形细胞。由于冰冻切片组织图像极似肥胖型星型细胞瘤,因此常误诊。巨噬细胞和淋巴细胞浸润是瘤样炎性脱髓鞘病的显著特征之一,几乎所有病例中都会出现[14]。红染颗粒状的巨噬细胞同许多肥胖型星形细胞混杂在一起[14]。同时大部分病例可见到泡沫状的吞噬细胞、淋巴细胞及浆细胞呈袖套样浸润在血管周围。免疫组化CD68染色时巨噬细胞表达阳性,这种现象在没有经过治疗的胶质瘤中十分罕见,可作为鉴别参考。
本例发病后4个月病检(见2C)示:大量组织细胞反应,血管周少量淋巴细胞浸润,组织化学染色:髓鞘染色可见髓鞘片灶状脱失,轴索染色(+);一步法免疫组化标记;胶质细胞iGFAP (+), 髓鞘MBP (+); 轴索NF (+); 神经元Neu-N (-), 淋巴细胞LCA (+), 组织细胞CD68(+),瘤样炎性脱髓鞘病诊断明确,与脑胶质瘤相鉴别。
2.5 TIDD的治疗规范TIDD治疗非常重要,应参照多发性硬化症(MS)糖皮质激素冲击治疗方案[15]。糖皮质激素诊断性治疗对于TIDD与脑胶质瘤的鉴别也有一定意义。TIDD对激素治疗敏感,预后良好,较少复发[16]。TIDD患者大多接受激素治疗后病灶减小,症状改善,一般无明显或严重的后遗症。与典型的MS比较,预后良好,但复发时病情恶化预后不良。本例患者激素治疗3周以后,病灶减小,头颅MRI强化减弱。
有学者认为较早使用干扰素可改变TIDD发展病程,减轻并发症及延缓向MS的发展转变,改善预后[17]。但因为停药后易复发,目前干扰素治疗尚存争议[18]。血浆置换、维生素D治疗等因为报道少,疗效有待进一步的研究。
2.6 预后与典型的MS比较,预后良好,但复发时病情恶化患者预后不良。提醒注意的是,TIDD患者患有MS的风险大大提高[7]。
2.7 鉴别诊断TIDD极易被误诊为胶质瘤,在临床诊断胶质瘤时应与TIDD鉴别。①胶质瘤常起病隐匿、病程较长、以中老年人多见,而TIDD患者起病急, 病程较短,青年人为主;②胶质瘤临床症状呈进行性加重,早期很少出现智能损害,常到中晚期因为肿瘤组织生长到一定程度压迫脑组织时才出现智能损害症状,而TIDD患者大小便功能障碍常见;③影像学上,脑胶质瘤在CT多呈高密度或等密度影,较少病例可呈低密度或混杂密度影,增强时可强化;TIDD患者在CT平扫时呈低密度影,增强扫描无明显强化或病灶及周边轻度强化;如果头颅CT平扫见到高信号的脑内占位病变一般可排除TIDD可能。MRI增强扫描低级别胶质细胞瘤可能不出现强化,但高级别胶质细胞瘤(胶质瘤分级≥3级)强化明显,多呈现团块状强化,出现环形强化的现象较TIDD少见[5],MRI增强扫描出现“开环征”典型表现,可以作为TIDD与肿瘤鉴别的有意义依据之一[7-9];④1H-MRS对TIDD和LGG的诊断和鉴别具有一定临床价值;⑤病检是两者鉴别诊断最有效的方法。
2.8 诊断中存在的问题及对策当前临床中对TIDD诊断仍存在一些困难,原因之一是TIDD较低发病率,对其缺乏充分认识;其次在诊断过程中未能有效结合多种影像学技术(如头颅CT、增强MRI、MRS)进行综合评价,同时缺乏相应的诊断标准;第三,糖皮质激素的不规范不合理使用在一定程度上增加了鉴别诊断的难度。
针对此病特点,笔者建议:对于亚急性或慢性起病,不论既往是否有脱髓鞘病史、发病前是否有疫苗接种史,有或无明确诱因,脑或脊髓白质单个或多发病灶,T1低信号、T2高信号, 呈MRI环状强化的病例,怀疑该病;中枢神经系统占位性病变,脑内病灶MRI强化后出现垂直分布征象, 脊髓白质内病灶MRI强化,邻近未见继发空洞,符合脱髓鞘病变的特征,怀疑该病;对怀疑为该病的病例,应行腰穿检查,检查脑脊液蛋白含量、寡克隆带等[19];结合影像及临床考虑诊断为TIDD可能性很大的病例,可以考虑先诊断性行糖皮质激素等药物治疗,密切观察疗效及影像学变化再作判断;对于难以鉴别的T1DD患者,应尽量避免采取手术切除、放疗、伽马刀等有创治疗,脑活检相对安全,创伤小,术后并发症极少。可行脑立体定向活体组织检查术,最终确诊须靠病理学及免疫组化检查。
综上,瘤样炎性脱髓鞘病(TIDD)虽易与脑胶质瘤混淆,但在临床表现、影像学特点等方面尚存在差异,应进行综合判断,必要时脑活检明确诊断,以减少临床上的误诊误治。
| [1] |
张文洛, 戚晓昆, 刘建国, 等. 瘤样炎性脱髓鞘病的影像学特点观察[J].
中华神经外科杂志, 2007, 23 (9): 696-699.
Zhang WL, Qi XK, Liu JG, et al. Imageology characteristics of tumor-like inflammatory demyelinating diseases[J]. Chinese Journal of Neurosurgery, 2007, 23(9): 696-699. |
| [2] | Kepes JJ. Large focal tumor-like demyelinating lesions of the brain:intermediate entity between multiple sclerosis and acute disseminated encephalomyelitis?A study of 31 patients[J]. Ann Neurol, 1993, 33: 18-27. DOI: 10.1002/(ISSN)1531-8249. |
| [3] |
王起, 戚晓昆, 刘建国, 等. 脱髓鞘假瘤35例的临床表现和影像及病理特点[J].
中华神经科杂志, 2007, 40 (7): 456-459.
Wang Q, Qi XK, Liu JG, et al. Clinical features, neuroimaging findings and pathological characteristics of 35 patients with demyelinating pseudotumors of brain[J]. Chinese Journal of Neurology, 2007, 40(7): 456-459. |
| [4] | Kim DS, Na DG, KimKH, et al. Distinguishing tumefactive demyelinating lesions from glioma or central nervous system lymphoma:added value of unenhanced CT compared with conventional contrast-enhanced MR imaging[J]. Radiology, 2009, 251: 467-475. DOI: 10.1148/radiol.2512072071. |
| [5] | Masdeu JC, Quinto C, Olivera C, et al. Open-ring imagingsign:highly specific for atypical brain demyelination[J]. Neurology, 2000, 54(7): 1427-1433. DOI: 10.1212/WNL.54.7.1427. |
| [6] | Erana-Rojas IE, Barboza-Quintana A, Ayala AG, et al. Demyelinating pseudotumor[J]. Ann Diagn Pathol, 2002, 6(5): 265-271. DOI: 10.1053/adpa.2002.35737. |
| [7] | Ahintas A, Petek B, Isik N, et al. Clinical and radiological characteristics of tumefactive demyelinating lesions:follow-up study[J]. Muit Scler, 2012, 18: 1448-1453. DOI: 10.1177/1352458512438237. |
| [8] | Tan HM, Chan LL, Chuah KL, et al. Monophasic, solitary tumefactive demyelinating lesion:neuroimaging features and neuropathological diagnosis[J]. Br J Radiol, 2004, 77(914): 153-156. DOI: 10.1259/bjr/26682607. |
| [9] |
张文洛, 戚晓昆, 刘建国, 等. 瘤样炎性脱髓鞘病MRI的临床意义[J].
脑与神经疾病杂志, 2010, 18 (4): 253-256.
Zhang WL, Qi XK, Liu JG, et al. Clinical significance of MRI for tumor-like inflammatory demyelinating diseases[J]. Journal of Brain and Nervous Diseases, 2010, 18(4): 253-256. |
| [10] | Hardy TA, Chataway J. Tumefactive demyelination:an approach to diagnosis and management[J]. J Neurol Neurosury Psychiatry, 2013, 84: 1047-1053. DOI: 10.1136/jnnp-2012-304498. |
| [11] | Kaqeyama T, Gotoh Y, Sano F, et al. Diagnosis of pediatric multiplesclemsisinitially presenting with tumefactive demyelinating lesion using 1H-magnetic resonance spectroscopy[J]. Rinsho Shinkeiqaku, 2011, 51: 688-693. DOI: 10.5692/clinicalneurol.51.688. |
| [12] |
王婷婷, 付宝生, 贺丹, 等. 1H-MRS在瘤样炎性脱髓鞘病与低级别胶质瘤鉴别诊断中的应用[J].
脑与神经疾病杂志, 2015, 23 (1): 12-16.
Wang TT, Fu BS, He D, et al. Application of 1H-MRS in differential diagnosis of tumor-like inflammatory demyelinating disease and low grade glioma[J]. Journal of Brain and Nervous Diseases, 2015, 23(1): 12-16. |
| [13] |
吕长虹, 王顺和, 孙晓川, 等. 瘤块样脱髓鞘病变脑组织活检临床病理及细胞凋亡特点[J].
中华神经科杂志, 2006, 39 (7): 448-451.
Lü CH, Wang SH, Sun XC, et al. Clinicopathological features of and apoptosis in patients with tumefactive demyelinating lesion:a biopsy study[J]. Chinese Journal of Neurology, 2006, 39(7): 448-451. |
| [14] |
周庚寅, 高鹏, 曹吉臣, 等. 疑似星形细胞瘤的脱髓鞘假瘤[J].
临床与实验病理学杂志, 2004, 20 (6): 670-673.
Zhou GY, Gao P, Cao JC, et al. Demyelinating pseudotumor looking like astrocytoma:2 cases report and review of the literature[J]. Chinese Journal of Clinical and Experimental Pathology, 2004, 20(6): 670-673. |
| [15] |
中华医学会神经病学分会, 中华神经科杂志编辑部. 中国多发性硬化及相关中枢神经系统脱髓鞘疾病的诊断和治疗专家共识(草案)[J].
中华神经科杂志, 2006, 39 (12): 862-864.
Chinese Society of Neurology, Chinese Journal of Neurology editorial department. Chinese expert consensus of diagnosis and treatment of multiple sclerosis and related central nervous system demyelinating disease (draft)[J]. Chinese Journal of Neurology, 2006, 39(12): 862-864. |
| [16] |
贺丹, 杨丽, 陈德强, 等. 多序列磁共振成像在一例多发性硬化诊断中的应用体会[J].
脑与神经疾病杂志, 2011, 19 (1): 35-38.
He D, Yang L, Chen DQ, et al. The applied comprehend of multi-sequence magnetic resonance imaging in the diagnosis of one multiple sclerosis[J]. Journal of Brain and Nervous Diseases, 2011, 19(1): 35-38. |
| [17] | Miller DH, Chard DT, Ciccarelli O. Clinically isolated syndromes[J]. Lancet Neurol, 2012, 11(2): 157-169. DOI: 10.1016/S1474-4422(11)70274-5. |
| [18] | Visser F, Wattjes MP, Pouwels PJ, et al. Tumefaetivemultirpie sclerosis lesions under finsolimod treatment[J]. Neurology, 2012, 79: 2000-2003. DOI: 10.1212/WNL.0b013e3182735cb3. |
| [19] |
郭秀海, 吴卫平, 朱克, 等. 假瘤型炎性脱髓鞘病的临床及病理[J].
脑与神经疾病杂志, 2002, 10 (4): 193-196.
Guo XH, Wu WP, Zhu K, et al. Clinical and pathological study of tumor-like inflammatory demyelinating diseases[J]. Journal of Brain and Nervour Diseases, 2002, 10(4): 193-196. |
 2016, Vol. 37
2016, Vol. 37

 ,
,