缺血性脑血管疾病是一类以脑血流量减少, 脑血管储备功能下降为特点的疾病。脑缺血性疾病患者通常存在不同程度脑灌注不足, 可以表现为脑缺血或脑出血导致的神经功能缺失。其病因多为烟雾病或脑动脉粥样硬化。脑血运重建能通过改善脑血流动力学而有效预防脑梗塞, 降低脑出血风险。CT灌注是非侵袭性检测, 能精确的测量许多重要的参数,如:脑血容量(CBV)、脑血流量(CBF)、平均通过时间(MTT)、达峰时间(TTP)[1]。CT灌注不仅可以作为术前手术指征的判断, 而且可以通过观察血流动力学改善情况而评估治疗的有效性, 预测远期预后。已有研究表明烟雾病行搭桥手术能改善术前延迟的平均通过时间(MTT)[2]。但是与动脉粥样硬化性疾病相比, 这些血流动力学参数变化的区别并不十分明确。本研究中, 我们回顾性分析颞浅-大脑中动脉搭桥(STA-MCA)+脑-硬脑膜-颞肌血管融通术(EDMS)治疗症状性脑缺血疾病患者, 通过CT灌注评估烟雾病与动脉粥样硬化患者脑血流动力学改善情况, 判断手术对烟雾病和动脉粥样硬化性脑动脉闭塞的有效性和差异。
1 资料与方法 1.1 患者资料收集2016年6月-2018年1月武汉大学人民医院神经外科经颞浅-大脑中动脉搭桥(STA-MCA)+脑-硬脑膜-颞肌血管融通术(EDMS)(以下简称STA-MCA+EDMS)治疗的烟雾病与非烟雾病缺血性疾病患者的临床资料以及术前和术后3个月CT灌注成像结果。共收集28例, 其中16例为烟雾病患者(烟雾病组),另外12例既往均发生过缺血性卒中并且有严重的颈内动脉或大脑中动脉粥样硬化性狭窄(非烟雾病组)。烟雾病组患者平均年龄40.5岁, 其中男性6例; 非烟雾病组患者平均年龄54.8岁, 其中男性9例; 术后均随访3个月到1年, 所有病人均于术后3个月行美国国立卫生研究院卒中量表评分(NIHSS评分)。部分烟雾病与动脉粥样硬化相关烟雾病综合征脑血管造影极其相似, 可以采用高分辨率磁共振血管成像(MRA)鉴别, 由于烟雾病动脉管壁弹性内膜增生, 中膜纤维变性及无炎症细胞或脂质细胞浸润, 其MRA多表现为管壁向心性增厚且增强后无或轻度强化[3]。
1.2 影像数据的处理与统计学的分析在每个灌注CT研究中,我们选择了一个感兴趣的区域(ROI),该区域位于症状半球最受影响的区域。选择的ROI是CBF最显著降低的地方,有明确的灌注不足。CBV、MTT、CBF和TTP在同一区域测量。通过健侧与患侧对比计算出其相对值rCBF、rMTT、rCBV和rTTP。采用GraphPad Prism 6.0软件进行数据处理。研究中所有的值均为平均值±标准差, 在本研究中,统计分析采用配对样本t检验,P<0.05时为差异有统计学意义。
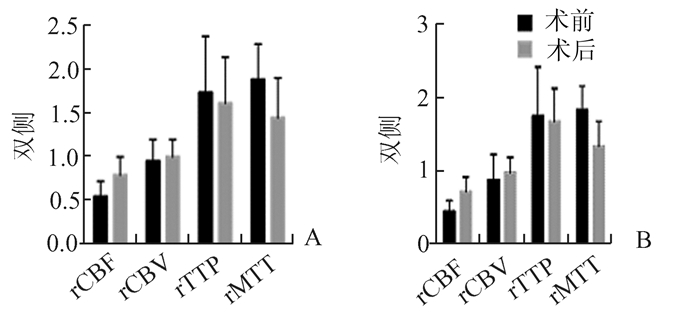
2 结果烟雾病组和非烟雾病组手术均进展顺利, 术中荧光造影显示吻合口通畅, 所有患者术后复查全脑血管造影均证实吻合口通畅, 术后随访3个月至1年均无新发脑梗塞或脑出血。术后随访NIHSS评分总分较术前下降。术前术后CT脑灌注数据进行统计学分析, 结果显示:烟雾病组和非烟雾病组相对脑血流量(rCBF)较术前增加, 相对平均通过时间(rMTT)较术前缩短; 相对脑血流量(rCBF)增加, 相对平均通过时间(rMTT)减少在非烟雾病脑缺血性疾病和烟雾病组具有统计学意义(P<0.05)。两组术后相对脑血容量(rCBV)和相对达峰时间(rTTP)改变不明显(见图 1,2)。
|
图 1 CT灌注相关参数术前术后改变 A:烟雾病组;B:非烟雾病 |
|
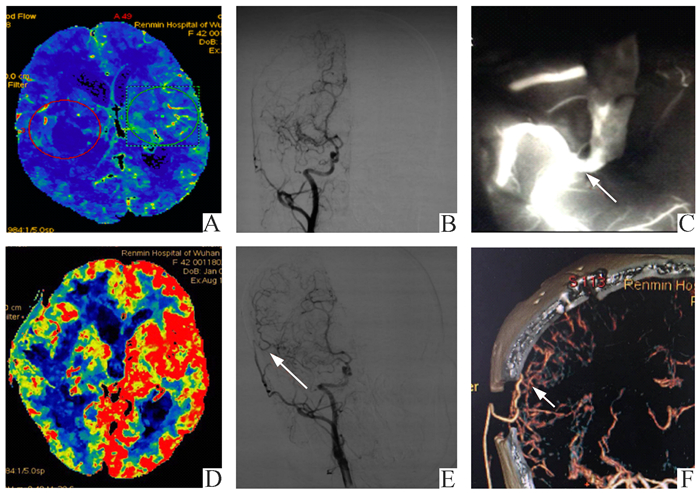
图 2 患者术前术后脑灌注DSA图像及术中荧光造影 A, D:分别为术前术后灌注脑血流量变化; B为术前颈内动脉造影;C:为术中荧光造影图像, 箭头所指为吻合口; E:为术后颈动脉造影,箭头所指为颞浅与大脑中吻合口显影;F:为术后CTA检查,箭头为吻合口 |
无论是烟雾病还是非烟雾病脑动脉闭塞性疾病, 直接血运重建能否改善患者生活质量, 降低脑卒中发病率仍存在争议。过去认为半暗带是可以挽救的,死亡区是不能挽救的。梗死超过6-8 h不提倡再通。现在认为梗死核心区90%-95%的细胞确实已经死亡,但梗死周围区很大,此部分区域内大量的细胞并未死亡,如果实施晚通,则能维持梗死周围区细胞存活[4]。颈动脉内膜剥脱, 颞浅-大脑中动脉搭桥正是基于这一晚通理念。目前, 大脑血运重建是进展性烟雾病和药物难治性, 症状性颈动脉狭窄的重要手术方式。已有大量研究表明颞浅-大脑中动脉搭桥治疗的有效性[5]。脑血运重建潜在的并发症包括缺血和过度灌注综合征, 搭桥术后过度灌注综合征发生率约为11.6%-24.7%。患者术后形成新的神经症状, 伴随潜在脑血流增加, 并且不能用脑缺血、脑萎缩、癫痫解释时可考虑此诊断。有研究表明, 术后脑血流灌注增加超过15%, 术后高灌注风险增加, 且年龄的增加与症状性高灌注的发生有显著的关系[6]。在缺血与过度灌注之间找到一个平衡点尤为重要, 也充满挑战。血流动力学评估不仅可证实搭桥通畅性, 也可用于评估吻合口下游脑灌注、术后脑过度灌注综合征出现的可能性及预测患者远期预后。
有相关研究证表明:成人行STA-MCA+EDMS效果优于单独直接或间接血运重建, 本研究中28例患者均行STA-MCA+EDMS术[7]。大脑中动脉搭桥术后桥血管合适的血流量是手术成败关键, 也是患者预后的决定性因素。部分时候患者术野无合适供体血管无法实施搭桥手术, 或者术野只存在部分孤岛样血管因无合适的血管网络, 搭桥易造成血液淤积而出血。受体血管的选择决定于桥血管血流量, 部分患者脑血流压力梯度逆向分布, 搭桥后容易出现血流受阻。术前造影检查可提供皮层血管的分布信息, 预测其能否承受一定流量的供血。大脑中动脉血管网络完整程度与桥血管血流量需相匹配, 否则过高供血容易出现过度灌注而出血。搭桥术后若灌注显示rCBF无明显改变, 则推测可能吻合口欠通畅; 若CBV较术前显著增加, 而MTT正常, 则可能是血流无法通过正常的血管网络迅速分配而出现过度灌注。本研究中患者术后MTT较术前缩短且CBF增加证明搭桥吻合口通畅且受体血管选择合适。
成功的搭桥可以阻止神经功能的恶化和反复发作的短暂脑缺血发作。定量评估脑血流灌注和脑血管储备功能对于评价脑动脉狭窄病人术前血流动力学恶化和手术改善至关重要。术中准确评估桥血管血流量及受体血管的血流量对术后灌注的改善和术后高灌注预测具有重要意义。目前, 术中脑血流的评估方法有:磁共振、定量多普勒超声、极光散斑成像、吲哚氰绿皮质脑血流分析和术中大脑中动脉测压。定量多普勒能通过评估供体血管的血流来推测下游脑实质的灌注。极光散斑成像可以探测术后微循环血流改变。Flow 800是一个相对较新的软件工具已经融入术中显微镜, 可以通过术中吲哚氰绿灌注评估时间分布动力学, 可较全面掌握血流灌注时间、灌注量、血流速度、手术干预前后血流动态性对比分析等参数, 为确定缺血区域, 选择受体血管, 判断桥血管血流通畅性提供依据[8]。术中大脑中动脉压力的测定对评估脑灌注和术后过度灌注的风险具有一定参考意义。过度灌注的危险因素包括:狭窄侧与正常侧的脑血流量比值、术前大脑中动脉压力、压力的增加率、吻合前大脑中与桡动脉压力比值、血管储备及颞浅动脉直径等[9]。本研究采用术中吲哚氰绿荧光造影判断吻合口是否通畅。
术后脑血流灌注改善的评估可以使我们对缺血性卒中患者脑血管搭桥术后疗效和远期预后的评价更加全面。术后评估脑血流量的方法也较多, 包括:氙-CT、CT灌注、磁共振灌注、PET和SPECT。PET可显示梗死区摄氧量改善; SPECT可以通过乙酰唑胺试验测定脑血管储备功能, 但PET和SPECT需要提供电离辐射,相对于其他方式来说它的成本要高一些, 且SPECT并不是严格定量的, 它的空间分辨率也很差。氙- CT采集时间相对较长,容易产生运动伪影,且一些患者因吸入氙气而出现恶心、呕吐、头痛、甚至呼吸衰竭。磁共振灌注是一个非侵袭性的检查, 具有很高空间分辨率, 能提供CBV、MTT与CBF等参数, 但检查时间较长, 费用较贵, 且磁共振灌注对脑血流量的定量比CT灌注更复杂。CT灌注是一项针对脑代谢的检查手段,其最早是应用于脑肿瘤的检查, 近年来CT灌注越来越多地应用于研究缺血性脑血管疾病。CT灌注参数中, MTT对组织的低灌注最敏感, 但对缺血损伤程度和发生脑梗的危险性评价不如CBF和CBV, CBF反映血流动力学的改变, 异常灌注区代表缺血组织; CBV异常灌注区多代表核心梗死区; 依据局部CBV、MTT、TTP与CBF的关系可以判断出脑循环储备力是否发挥作用, 脑循环储备下降到脑代谢储备力下降, 进而导致神经元不可逆的坏死。CT灌注CBV正常或增加、CBF正常、MTT延长、TTP延长多表示侧枝循环建立。CBV显著增加、CBF显著增加、MTT缩短或正常、TTP缩短或正常代表出现过度灌注。本研究中所有病人术前术后均采用CT灌注检查。我们发现:rCBF较术前增加、rMTT较术前缩短、rCBF增加, rMTT减少在非烟雾病脑缺血性疾病和烟雾病组具有统计学意义(P<0.05)。两组术后rCBV和rTTP改变不明显, 且术后对所有搭桥患者进行3月至半年的随访发现患者均未出现新发脑梗塞或脑出血, 且患者术后3个月的NIHSS评分较术前有所降低, 因此我们认为对于症状性烟雾病或非烟雾病颅内外动脉狭窄患者性颞浅-大脑中动脉搭桥具有一定临床意义, 表明晚通可能会改善预后, 但是其中机制如何,还有待进一步研究。有研究将术前烟雾病与动脉粥样硬化性疾病血流参数相比较, 结果显示:动脉粥样硬化患者脑血流量更低, 烟雾病脑血容量更高, 平均通过时间在动脉粥样硬化患者中更高, 其原因可能是烟雾病患者存在更多侧枝循环和代偿机制。Sasagawa等研究表明:动脉粥样硬化患者平均通过时间改善更加明显, 其原因可能是搭桥术后吻合口血流可逆流至M1-M2分叉处, 从而在动脉粥样硬化疾病中覆盖范围较广, 且动脉粥样硬化患者组织转运时间不受影响, 故平均通过时间减少明显[10]。而在烟雾病患者中, 其血管的病变通常累积到远端的小动脉甚至皮层血管, 搭桥术后血液通过独特的血管网络分配, 因此其改善不明显。本研究中, 烟雾病组和非烟雾病组术后CT灌注平均通过时间参数较术前也明显改善, 与Sasagawa的研究结果大致相符。但关于烟雾病与动脉粥样硬化患者血流参数区别尚未见显著差异。
本研究尚存在一些局限性: ①样本量较少, 样本的收集多为症状性脑梗塞或烟雾病, 缺乏无症状患者且对术后患者随访时间偏短; ②由于技术和设备的限制, 对术前和术后感兴趣区域的选择及血流量等参数的测定可能存在一定的误差。因此对于评估颞浅-大脑中动脉搭桥(STA-MCA)+脑-硬脑膜-颞肌血管融通术(EDMS)治疗脑动脉闭塞性疾病的有效性, 搭桥手术对烟雾病和脑动脉粥样硬化狭窄血流动力学的影响及找到合适的评估手段尚需进一步研究。
| [1] | Thierfelder KM, Sommer WH, Baumann AB, et al. Whole-brain CT perfusion: reliability and reproducibility of volumetric perfusion deficit assessment in patients with acute ischemic stroke[J]. Neuroradiology, 2013, 55(7): 827-835. DOI: 10.1007/s00234-013-1179-0. |
| [2] | Tian B, Xu B, Liu Q, et al. Adult Moyamoya disease: 320-multidetector row CT for evaluation of revascularization in STA-MCA bypasses surgery[J]. Eur J Radiol, 2013, 82(12): 2342-2347. DOI: 10.1016/j.ejrad.2013.09.006. |
| [3] | Kim JM, Jung KH, Sohn CH, et al. High-resolution MR technique can distinguish moyamoya disease from atherosclerotic occlusion[J]. Neurology, 80, 8(775): 776. |
| [4] | Mcbride DW, Wu G, Nowrangi D, et al. Delayed recanalization promotes functional recovery in rats following permanent middle cerebral artery occlusion[J]. Transl Stroke Res, 2018, 9(2): 185-198. DOI: 10.1007/s12975-018-0610-6. |
| [5] | Li X, Huang Z, Wu MX, et al. Effect of adventitial dissection of superficial temporal artery on the outcome of superficial temporal artery-middle cerebral artery bypass in moyamoya disease[J]. Aging & Disease, 2017, 8(4): 384-391. |
| [6] | Zhao WG, Luo Q, Jia JB, et al. Cerebral hyperperfusion syndrome after revascularization surgery in patients with moyamoya disease[J]. Br J Neurosurg, 2013, 27(3): 321-325. DOI: 10.3109/02688697.2012.757294. |
| [7] | Xu B, Song DL, Mao Y, et al. Superficial temporal artery-middle cerebral artery bypass combined with encephalo-duro-myo-synangiosis in treating moyamoya disease: surgical techniques, indications and midterm follow-up results[J]. Chin Med J (Engl), 2012, 125(24): 4398-4405. |
| [8] | Rennert RC, Strickland BA, Ravina K, et al. Assessment of hemodynamic changes and hyperperfusion risk following extracranial-to-intracranial bypass surgery using intraoperative indocyanine green-based flow analysis[J]. World Neurosurg, 2018, 114: 352-360. DOI: 10.1016/j.wneu.2018.03.189. |
| [9] | Matano F, Murai Y, Tanikawa R, et al. Intraoperative middle cerebral artery pressure measurements during superficial temporal artery to middle cerebral artery bypass procedures in patients with cerebral atherosclerotic disease[J]. J Neurosurg, 2016, 125(6): 1-7. |
| [10] | Sasagawa A, Mikami T, Hirano T, et al. Characteristics of cerebral hemodynamics assessed by CT perfusion in moyamoya disease[J]. J Clin Neurosci, 2017, 47: 183-189. |
 2018, Vol. 39
2018, Vol. 39


