2. 新乡医学院第一附属医院 河南 新乡 453100;
3. 武汉大学中南医院 湖北 武汉 430071
2. The First Affiliated Hospital of Xinxiang Medical University, Xinxiang 453100, Henan, China;
3. Zhongnan Hospital of Wuhan University, Wuhan 430071, Hubei, China
子宫内膜异位症(endometriosis,EMT)是指具有生长功能的子宫内膜组织(腺体和间质)出现在子宫腔被覆内膜以外的其他身体部位,简称内异症。EMT引起的不孕约占不孕妇女总数的30%-50%[1]。研究表明,EMT患者子宫容受性降低是导致其不孕的主要原因。子宫内膜接受态是指内膜处于一种允许胚胎着床的状态,是在结构和功能上具有瞬时性的内膜保证胚胎着床的特性[2]。子宫内膜容受性的高低是治疗不孕症成功与否的关键,一些不孕症患者由于子宫内膜容受性存在缺陷导致妊娠失败。因此,研究影响子宫内膜呈现接受态的分子机制已成为近年来生殖医学领域的研究热点。
组蛋白甲基转移酶(SET and MYND domain containing protein2,SMYD2)是SMYD家族的一个成员,可以甲基化组蛋白,也可以甲基化p53、视网膜母细胞瘤(Rb)等非组蛋白,从而发挥多种生物学功能,包括染色质重塑、转录、信号转导和细胞周期调控。SMYD2表达广泛,与多个系统的形成以及发育密切相关,SMYD2蛋白在胚胎发育、肿瘤发生和演进过程中发挥多种生物学功能[3]。
有研究表明,p53与子宫内膜接受性的高低密切相关,在子宫内膜蜕膜化过程中也有重要作用。此外,SMYD2可以甲基化p53进而影响其参与的多种生理功能。目前,国内外尚未有关于SMYD2与子宫内膜异位症关系的研究报道,本研究主要探讨SMYD2在EMT中的作用和可能的分子机制。
1 材料与方法 1.1 材料 1.1.1 药物及试剂SMYD2抑制剂AZ505(MedChem Express公司),兔抗SMYD2抗体、鼠抗p53抗体、兔抗p-p53抗体(Abcam公司),17β-雌二醇(E2)、孕酮(P4)、环磷酸腺苷(cAMP)(Sigma公司),山羊抗兔、抗鼠荧光二抗488、Trizol、反转录试剂盒(Invitrogen公司),胶原酶Ⅰ(Roche公司),胎牛血清FBS、1×HBSS缓冲液(Gibco公司),青链霉素(P/G)(Thermo fisher公司),DMEM/HIGH GLUCOSE培养基、胰蛋白酶(HyClone公司),FAST SYBR-Green(Applied biosystems公司)。
1.1.2 人子宫内膜收集所有人子宫内膜标本通过宫腔镜获得,病人知情并签署了知情同意书,试验经医院伦理委员会批准。取得的标本一部分用4%多聚甲醛固定用于组织学切片鉴定月经周期,一部分迅速用干冰冰冻用于RNA提取和蛋白检测,还有一部分用于子宫内膜基质细胞体外分离培养。对照组选择由于输卵管因素导致的不孕症患者,在腹腔镜下和超声检测确诊不患有EMT,收集增生期(proliferative phase,PP)、分泌早期(early secretory phase,ESP)、分泌中期(middle secretory phase,MSP)和分泌晚期(late secretory phase,LSP)内膜共27例;实验组选择由于EMT引起不孕的患者,在腹腔镜下确诊为EMT,收集MSP内膜4例。纳入标准:对照组——①输卵管原因不孕患者,②腹腔镜下和超声检测确诊不患有EMT,③月经周期正常,无内分泌、免疫和代谢疾病,没有激素相关疾病并且收集标本前3个月未接受过激素治疗;实验组——①输卵管正常,②腹腔镜下确诊为EMT,③月经周期正常,无内分泌、免疫和代谢疾病,没有激素相关疾病并且收集标本前3个月未接受过激素治疗。排除标准:对照组——①患除输卵管原因外的其他妇科疾病,月经周期不正常,②患有内分泌、免疫和代谢疾病,③近3个月内接受过激素治疗;实验组——①患有除EMT外的其他妇科疾病,月经周期不正常,②患有内分泌、免疫和代谢疾病,③近3个月内接受过激素治疗。
1.2 方法 1.2.1 子宫内膜基质细胞(endometrial stromal cell,ESC)分离培养将子宫内膜组织分离成2-3 mm小段,用含P/G的1×HBSS清洗3次,置于胶原酶Ⅰ中,37 ℃水浴摇床中消化1 h,然后用200、400目筛网过滤,接种细胞,用含P/G的10% FBS/DMEM培养,培养到第6代开始相关检测和药物处理。
1.2.2 子宫内膜基质细胞蜕膜化处理细胞分别按3×105/ml、1.5×105/ml接种于6孔板和放有爬片的24孔板,待细胞长至90%汇合时进行处理,对照组和EMT组细胞均设有对照组、蜕膜化组、蜕膜化+抑制剂组,每组6个复孔。用雌孕激素和环磷酸腺苷联合诱导内膜基质细胞蜕膜化,即在含P/G的2% FBS/DMEM培养基中加入10 nmol/L E2,1 μmol/L P4和0.5 mmol/L cAMP,蜕膜化+抑制剂组即为在蜕膜化的基础上加入1 μmol/L SMYD2特异性抑制剂AZ505,细胞培养144 h,用Trizol收取6孔板细胞待提取RNA进行相关基因表达检测,细胞爬片用于免疫细胞化学进行相关蛋白检测。
1.2.3 免疫荧光法组织以10 μm厚度切片,热固定后用4%多聚甲醛固定,1×PBS洗1次,ddH2O洗1次,柠檬酸钠溶液进行抗原修复20 min,ddH2O洗1次,1×PBS洗1次,10%马血清封闭37 ℃孵育1 h,加相应抗体4 ℃过夜。1×PBS洗涤3次,荧光二抗室温孵育1 h,1×PBS洗涤2次,在DAPI/PBS中37 ℃孵育15 min,1×PBS洗涤1次,加荧光介质,封片。
1.2.4 免疫细胞化学细胞爬片用1×PBS洗涤3次,4%多聚甲醛固定,1×PBS洗涤3次,0.2% Triton X-100室温20 min,1×PBS洗涤3次,10% BSA封闭37 ℃孵育1 h,加相应抗体4 ℃过夜。1×PBS洗涤3次,荧光二抗室温孵育1 h,1×PBS洗涤3次,加荧光介质,封片。
1.2.5 Real-time PCR提取子宫内膜和基质细胞RNA,反转录产生cDNA。然后用FAST SYBR-Green进行PCR反应。由于甘油醛-3-磷酸脱氢酶(GAPDH)在组织中的表达相对恒定,用GAPDH作为对照,PCR反应条件为95 ℃变性20 s;95 ℃退火1 s;60 ℃延伸20 s,扩增40个循环。所用引物序列见表 1。
| 表 1 实验所用引物序列 |
全部数据以x±s表示,用SPSS 20.0统计软件对实验结果进行分析,两组间均数比较采用t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 SMYD2及p53在子宫内膜组织和ESC中的表达Real-time PCR结果显示,在对照组子宫内膜中,白血病抑制因子(leukemia inhibitory factor,LIF) mRNA在MSP期较PP期、ESP期表达增高,到LSP期又降低(P<0.05)。EMT组LIF mRNA在MSP期较对照组MSP期表达降低,但P<0.05(图 1A)。
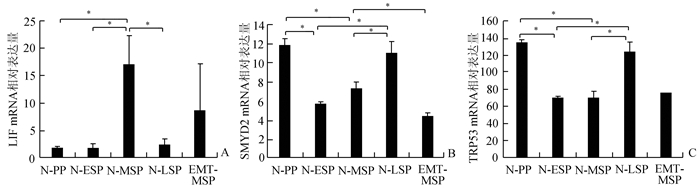
|
图 1 图 1人子宫内膜各时期LIF、SMYD2和TRp53 mRNA表达量 PP:增殖期; ESP:分泌早期; MSP:分泌中期; LSP:分泌晚期; N:对照组; EMT:内异症; *P<0.05 |
在对照组子宫内膜中,SMYD2 mRNA在ESP、MSP期较PP期表达降低(P<0.05),到LSP期又增高(P<0.05);在EMT组子宫内膜中,SMYD2 mRNA在MSP期较对照组MSP期表达降低(P<0.05)(图 1B)。转化相关蛋白53(transformation related protein 53, TRp53) mRNA在对照组ESP、MSP期较PP期表达下降,在LSP期又上升(P<0.05);在EMT组子宫内膜中,TRp53 mRNA在MSP期较对照组MSP期表达无差异(图 1C)。
免疫荧光结果显示p53蛋白在各时期子宫内膜上皮及基质细胞质中表达,与增生期相比,p53蛋白在对照组ESP期信号增强而在MSP期减弱,在LSP期又增强;而在EMT组MSP期信号较对照组MSP期增强;细胞免疫荧光结果可见对照组与EMT组基质细胞中p53蛋白表达均较弱(图 2A)。p-p53蛋白表达在子宫内膜上皮和基质细胞胞核,且其表达趋势与p53蛋白相似,在EMT组MSP期的信号较对照组MSP期增强;细胞免疫荧光结果可见其只表达在细胞核的特定位置,且在EMT组基质细胞中信号强于对照组(图 2B)。SMYD2蛋白也表达在子宫内膜上皮和基质细胞胞核中,在对照组PP期、ESP期和LSP期信号较强,在MSP期其表达减弱;在EMT组MSP期信号信号较对照组MSP期增强;基质细胞免疫荧光结果可见其较强信号(图 2C)。
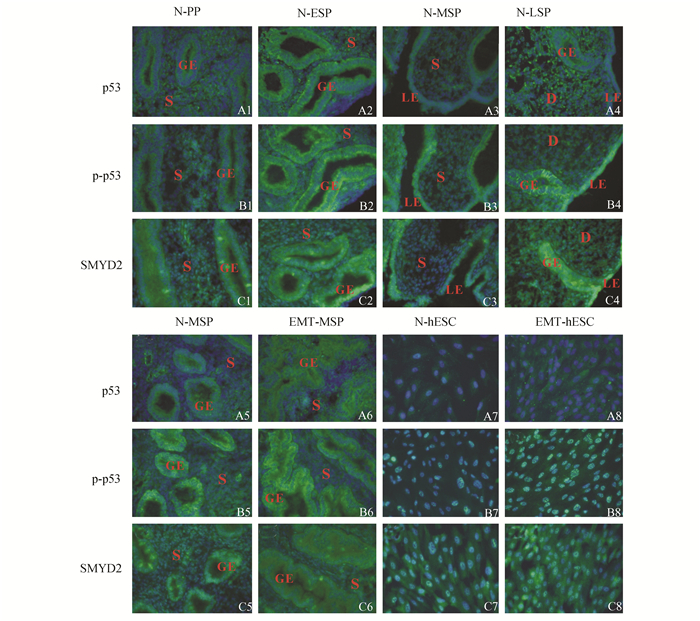
|
图 2 SMYD2、p53和p-p53蛋白在各时期子宫内膜组织和基质细胞中的表达(×200) GE:腺上皮; LE:腔上皮; S:基质; D:蜕膜区; N:对照组; EMT:内异症组; A1-A8:p53蛋白的表达(A1-A6为在组织中的表达,A7-A8为在基质细胞中的表达);B1-B8:p-p53蛋白的表达(其中B1-B6为在组织中的表达,B7-B8为在基质细胞中的表达);C1-C8:SMYD2蛋白的表达(其中C1-C6为在组织中的表达,C7-C8为在基质细胞中的表达) |
Real-time PCR结果显示,蜕膜化标志分子PRL在对照组和EMT组ESC蜕膜化过程中mRNA的表达在48,96,144 h蜕膜化组(E+P+C)均比空白组(control)表达增高(P<0.05),说明蜕膜化处理是成功的(图 3A、3D)。
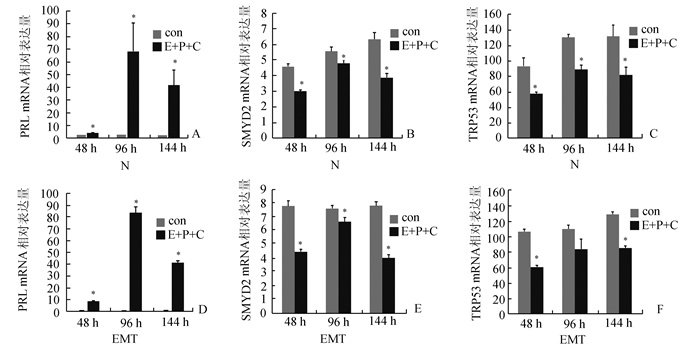
|
图 3 子宫内膜基质细胞蜕膜化过程中PRL、SMYD2和TRp53 mRNA的相对表达量 con:空白组; E+P+C:蜕膜化组; N:对照组; EMT:内异症组; 与空白组比较,*P<0.05 |
SMYD2 mRNA的表达在对照组和EMT组48,96,144 h蜕膜化细胞中均比空白组降低(P<0.05)(图 3B、3E)。TRp53 mRNA在对照组和EMT组48,144 h蜕膜化细胞中均比空白组表达降低(P<0.05)(图 3C、3F)。
细胞免疫荧光结果可见,蜕膜化144 h细胞变圆并出现多核细胞,在对照组和EMT组蜕膜化细胞中,p53蛋白(图 5A1-2、5D1-2)、p-p53蛋白(图 5B1-2、5E1-2)和SMYD2(图 5C1-2、5F1-2)蛋白的表达均比空白组减弱。
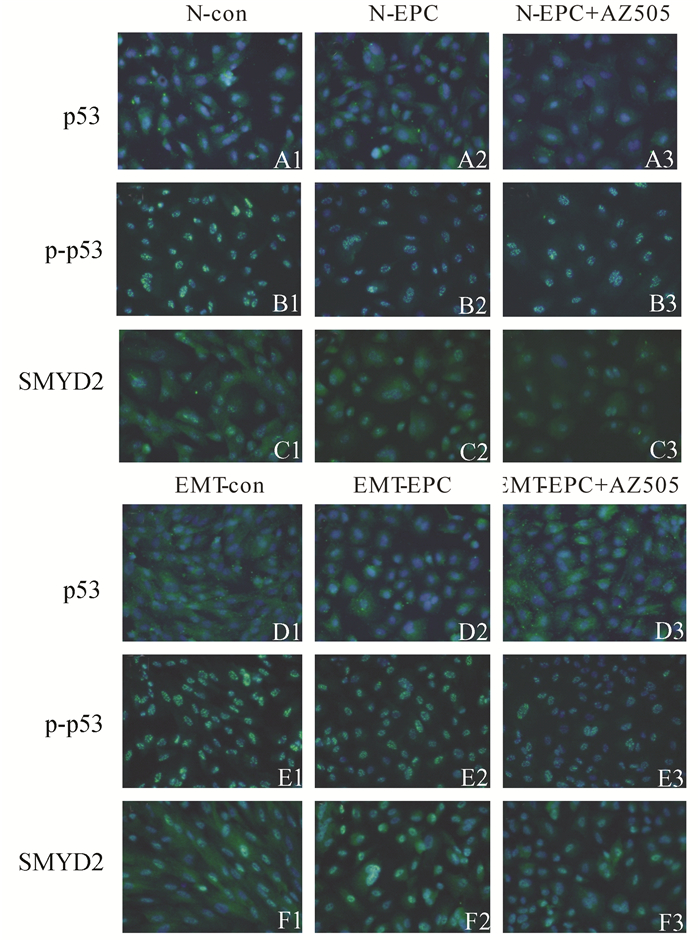
|
图 5 SMYD2、p53和p-p53蛋白在蜕膜化细胞的表达以及AZ505对其表达的影响(×200) con:空白组; E+P+C:蜕膜化组; EPC+AZ505:蜕膜化+抑制剂组; N:对照组; EMT:内异症组;A1-A3、D1-D3:p53蛋白在正常组、内异症组中的表达;B1-B3、E1-E3:p-p53蛋白在正常组、内异症组的表达;C1-C3、F1-F3:SMYD2蛋白在正常组、内异症组中的表达 |
Real-time PCR结果显示,用AZ505和EPC同时处理(EPC+ AZ505)ESC后,蜕膜化标志分子PRL mRNA在对照组细胞中的表达较蜕膜化细胞降低而在EMT组细胞中表达增高(P<0.05)(图 4A)。LIF mRNA的表达在对照组细胞中较蜕膜化细胞中增高(P<0.05),在EMT组细胞中较蜕膜化细胞表达降低(P<0.05)(图 4B)。而SMYD2 mRNA在对照组和EMT组的表达与蜕膜化细胞比较差异无统计学意义(图 4C)。TRp53 mRNA在对照组细胞较其蜕膜化细胞降低(P<0.05),在EMT组细胞中表达也降低,但P>0.05(图 4D)。
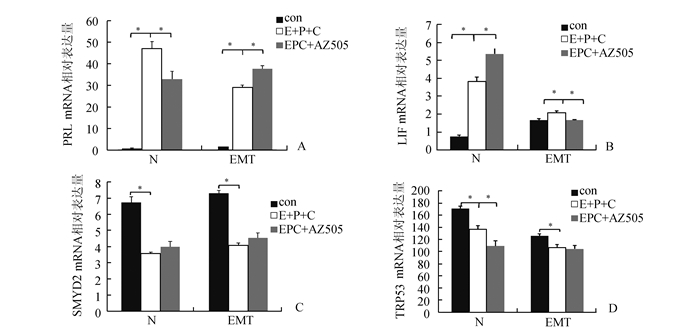
|
图 4 抑制剂AZ505对子宫内膜基质细胞蜕膜化过程中LIF、SMYD2和TRp53 mRNA表达的影响 con:空白组; E+P+C:蜕膜化组; EPC+AZ505:蜕膜化+抑制剂组; N:对照组; EMT:内异症组; *P<0.05 |
免疫细胞化学结果可见,加入SMYD2特异性抑制剂AZ505后,对照组和EMT组细胞中p53蛋白(图 5A2-3、5D2-3)、p-p53蛋白(图 5B2-3、5E2-3)和SMYD2蛋白的表达较蜕膜化组均减弱(图 5C2-3、5F2-3)。
3 讨论EMT是一种常见妇科疾病,发病率约占妇女的10%-15%,它是引起不孕的一个重要原因。目前,药物治疗与手术治疗是主要治疗手段,但并不能彻底根除,尤其对于希望保留生育功能的较年轻患者。因此,临床上需要寻求新的治疗方法和新的治疗靶点以消除病灶并缓解疼痛,促进生育和避免复发。
SMYD2是一种赖氨酸甲基转移酶,它可以甲基化组蛋白也可以甲基化非组蛋白从而发挥多种生物学功能。关于SMYD2的研究主要集中在它与肿瘤的发生和演进等方面。研究表明,SMYD2蛋白的过度表达与肿瘤的大小、淋巴管侵袭能力、肿瘤浸润、淋巴结转移和较高的癌症复发率有关,是癌症预后不良的一个重要因素[4, 5]。SMYD2通过抑制p53的肿瘤抑制作用而具有癌基因的功能。此外,SMYD2蛋白通过甲基化p53而具有保护心肌的功能[6]。有研究表明,p53可以调节LIF的转录水平,在着床阶段,缺乏p53时,着床时子宫中LIF的表达水平显著下降,从而导致着床失败[7]。在高接受态的子宫内膜,p53蛋白是高转录丰度基因的激活剂,而在低接受态子宫内膜中,它可以抑制频繁转录的基因[8]。此外,p53可以调节脂质代谢,缺失p53可以导致小鼠胚胎成纤维细胞和肝脏脂质堆积[9],小鼠子宫缺失p53基因会使着床位点脂质稳态被破坏,从而致使蜕膜细胞过早衰老并引起自发早产[10]。
目前,尚未有关于SMYD2与人子宫内膜相关的研究报道。分泌中期是子宫内膜处于接受态的时期,LIF是子宫内膜呈接受态的标志分子。本研究发现,TRp53和SMYD2 mRNA在对照组各时期内膜组织中的表达都是先降低再升高,在EMT组MSP期TRp53 mRNA比对照组有增高的趋势,而SMYD2 mRNA在EMT组MSP期较正常人MSP期表达降低。在基质细胞蜕膜化细胞过程中,SMYD2和TRp53 mRNA表达均降低,说明在蜕膜化的过程中SMYD2和p53发挥着作用,为进一步研究SMYD2和p53在蜕膜化过程中的作用,在蜕膜化过程中加入SMYD2特异性抑制剂AZ505,通过检测144 h时细胞中mRNA表达情况,发现蜕膜化标志分子PRL mRNA水平与蜕膜化细胞相比在对照组降低而在EMT组升高,进一步证明SMYD2在子宫内膜蜕膜化过程中有重要作用。但是,SMYD2 mRNA水平没有显著变化,细胞免疫荧光可见SMYD2蛋白信号减弱,说明抑制剂AZ505并不影响SMYD2转录水平,而是影响其蛋白的表达。LIF mRNA在对照组较蜕膜化细胞表达增加而在EMT组表达下降,TRp53 mRNA在对照组中表达较蜕膜化细胞降低而在EMT组无变化,说明SMYD2对LIF和p53在蜕膜化细胞中的表达有调节作用。
本研究检测了SMYD2和p53在子宫内膜组织和蜕膜化细胞的基本表达和加用抑制剂后的表达情况,初步证明SMYD2在蜕膜化过程中有重要作用以及它对p53和LIF的表达有调节作用,SMYD2可能通过和p53之间的相互作用与内异症不孕患者子宫内膜低接受态有关,并参与子宫内膜蜕膜化过程,它可能成为临床低着床率的机制提供新的思路并且为EMT导致的不孕患者提供治疗靶点,但SMYD2和p53与LIF之间的信号通路以及其在EMT中的具体机制尚待进一步研究。
| [1] | Opoien HK, Fedorcsak P, Omland AK, et al. In vitro fertilization is a successful treatment in endometriosis-associated infertility[J]. Fertil Steril, 2012, 97(4): 912-918. DOI: 10.1016/j.fertnstert.2012.01.112. |
| [2] | Krylova Y, Polyakova V, Kvetnoy I, et al. Immunohistochemical criteria for endometrial receptivity in Ⅰ/Ⅱ stage endometriosis IVF-treated patients[J]. Gynecol Endocrinol, 2016, 32(sup2): 33-36. DOI: 10.1080/09513590.2016.1232576. |
| [3] | Leinhart K, Brown M. SET/MYND lysine methyltransferases regulate gene transcription and protein activity[J]. Genes (Basel), 2011, 2(1): 210-218. DOI: 10.3390/genes2010210. |
| [4] | Komatsu S, Ichikawa D, Hirajima S, et al. Overexpression of SMYD2 contributes to malignant outcome in gastric cancer[J]. Br J Cancer, 2015, 112(2): 357-364. DOI: 10.1038/bjc.2014.543. |
| [5] | Sakamoto LH, Andrade RV, Felipe MS, et al. SMYD2 is highly expressed in pediatric acute lymphoblastic leukemia and constitutes a bad prognostic factor[J]. Leuk Res, 2014, 38(4): 496-502. DOI: 10.1016/j.leukres.2014.01.013. |
| [6] | Sajjad A, Novoyatleva T, Vergarajauregui S, et al. Lysine methyltransferase Smyd2 suppresses p53-dependent cardiomyocyte apoptosis[J]. Biochim Biophys Acta, 2014, 1843(11): 2556-2562. DOI: 10.1016/j.bbamcr.2014.06.019. |
| [7] | Yue X, Wu L, Hu W. The regulation of leukemia inhibitory factor[J]. Cancer Cell Microenviron, 2015, 2(3): e877. |
| [8] | Ponsuksili S, Murani E, Schwerin M, et al. Gene expression and DNA-methylation of bovine pretransfer endometrium depending on its receptivity after in vitro-produced embryo transfer[J]. PLoS One, 2012, 7(8): e42402. DOI: 10.1371/journal.pone.0042402. |
| [9] | Wang X, Zhao X, Gao X, et al. A new role of p53 in regulating lipid metabolism[J]. J Mol Cell Biol, 2013, 5(2): 147-150. DOI: 10.1093/jmcb/mjs064. |
| [10] | Lanekoff I, Cha J, Kyle JE, et al. Trp53 deficient mice predisposed to preterm birth display region-specific lipid alterations at the embryo implantation site[J]. Sci Rep, 2016, 6: 33023. DOI: 10.1038/srep33023. |
 2018, Vol. 39
2018, Vol. 39


