子宫颈癌是目前最为常见的妇科恶性肿瘤,其发病率逐年上升,患者年龄呈年轻化趋势[1]。转移是宫颈癌死亡的主要原因,对于远处转移患者,迄今尚缺乏有效的治疗手段,因此探讨影响宫颈癌侵袭与转移的相关因素将有助于发现针对性的治疗方案,为临床治疗宫颈癌提供新的靶点。
Bv8,也被称为前动力蛋白2(prokineticin 2,PROK2),是趋化因子家族成员,是由77个氨基酸构成的多肽[2]。在动物肿瘤模型及人类肿瘤组织中,均可检测到Bv8的高表达,且其阳性部位与多形核中性粒细胞(polymorphonuclear neutrophils, PMN)浸润密切相关[3, 4]。PMN作为天然免疫系统的重要组成部分,广泛存在于各种人类癌症中,参与构成了肿瘤炎症微环境,能够产生多种功能物质启动和促进肿瘤血管生成,从而促进肿瘤生长[5]。在动物肿瘤模型的的研究中发现,Bv8能够通过募集外周血中的PMN至肿瘤部位,介导独立于VEGF之外的肿瘤血管生成作用[3, 6],从而促进肿瘤进展。但是Bv8在宫颈癌肿瘤微环境中是如何被调控的,下游涉及的信号通路以及在宫颈癌中Bv8对肿瘤生长及血管生成的作用均尚未有研究报道。
多种细胞因子参与了肿瘤微环境的调控,这其中粒细胞集落刺激因子(granulocyte-colony stimulating factor,G-CSF),在慢性炎症肿瘤微环境中参与PMN的功能调控,增加外周血PMN的数量、促进肿瘤血管生成[7]。细胞外调节蛋白激酶(extracellular signal-regulated kinase,ERK)是信号转导与激活转录家族成员,参与调控G-CSF下游信号通路,在PMN的功能调控中起到重要作用[8]。
本研究首先在体外实验中研究用G-CSF刺激小鼠骨髓PMN后其中Bv8的生成情况,及ERK信号通路特异性抑制剂对Bv8生成的影响;随后我们通过体内实验,观察了正常小鼠及荷瘤小鼠骨髓PMN对U14宫颈癌细胞生长及血管生成的影响,以及阻断G-CSF及Bv8对肿瘤生长以及血管生成的影响。该研究为防治PMN相关的肿瘤侵袭转移提供新的理论依据。
1 材料与方法 1.1 动物及主要试剂6-8周龄雌性昆明小鼠,体质量18-20 g,购于湖北省医学实验动物中心。小鼠在华中科技大学同济医学院动物中心SPF级动物房饲养。U14小鼠宫颈癌细胞购买自中国细胞典藏中心。RPMI 1640培养液(美国Gibco公司),胎牛血清(杭州四季青生物工程有限公司),TRIzol(美国Invitrogen公司),逆转录试剂盒(日本Toyobo公司),SYBR Premix Ex TaqTM试剂盒(日本Takara公司),Percoll细胞分离液(美国GE公司),抗ERK蛋白抗体(美国Cell Signaling公司),ERK信号通路抑制剂PD98059(美国Merck4Bioscience公司),G-CSF细胞因子(美国Cell Signaling Technology公司)。PCR反应所用引物为上海英骏生物公司合成。免疫组织化学二抗试剂盒、免疫组织化学试剂及Western Blot试剂盒(武汉谷歌生物有限公司)。Anti-Bv8抗体(美国Genentech Inc.公司)。
1.2 主要仪器OLYMPUS-IX71显微镜(日本Olympus公司),Mini-PROTEIN Ⅱ Electrophoresis Cell电泳仪(美国Bio-Rad公司),Eppendorf 5417R低温高速离心机(德国Eppendorf公司),Mx3000P实时定量荧光PCR仪(美国Stratagene公司)。
1.3 G-CSF体外刺激骨髓中性粒细胞及特异性ERK信号通路抑制剂PD98059的使用G-CSF浓度为50 ng/ml,PD98059浓度为20 μmol,粉剂用DMSO稀释,体外刺激4 h。
1.4 SYBR green实时荧光定量聚合酶链式反应检测细胞中Bv8 mRNA表达按照TRIzol说明书提取PMN中总RNA,取1 μg总RNA用于反转录,反转录按照反转录酶试剂说明操作。所用引物序列:Bv8:上游5′-TGCTACTTCTGCTGCTACC-3′, 下游5′-CCGCACTGAGAGTCCTTGTC-3′。内参β-actin:上游5′-TGTCCCTGTATGCCTCTGG-3′,下游5′-CCTTTAGCACGCACTGTAG-3′。反应条件:94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,30个循环,72 ℃持续10 min。β-actin作为内参基因,MMP-9对β-actin的相对表达量用倍数表示,计算公式为2-△△CT。其中CT值表示荧光信号强度达到设定阈值的循环数,△CT=目的基因CT-内参基因CT,△△CT=实验组△CT-对照组△CT。
1.5 构建G-CSFR胞外域真核表达载体构建真核表达载体G-CSFR,为G-CSF受体的胞外域,表达后可封闭G-CSF的作用。具体方法参见参考文献[9]。
小鼠G-CSFR胞外域引物序列:mouse sG-CSFR, sense 5′-ACCCAAGCTGGCTAGCGTT-3′, antisense 5′-TGGCACTAAGCAGAAGAGGA-3′。
扩增G-CSFR胞外域,获取cDNA,将其插入真核质粒pcDNA3.1 (Invitrogen, Carlsbad, CA),具体方法其mRNA、蛋白检测参见参考文献[9]。
1.6 Western Blot检测细胞中ERK总蛋白及磷酸化蛋白表达提取培养细胞的总蛋白,测定样品蛋白浓度。取各组不同组分蛋白样品60 μg,10%聚丙烯酰胺凝胶电泳后电转移膜,加入稀释后的一抗4 ℃孵育过夜,特异性二抗及生物素-链霉菌抗生物素蛋白-过氧化酶室温孵育1 h,用质量分数0.05%二氨基联苯胺缓冲液避光显色。灰度扫描半定量各条带灰度值,分别用β-actin校正后计算各组分相对对照组的变化。
1.7 分离正常小鼠骨髓PMN(NBM-PMN)和荷瘤小鼠骨髓PMN(TBM-PMN)的方法分离NBM-PMN:颈椎脱臼处死正常昆明种小鼠,取其股骨和胫骨中的骨髓细胞,离心后2 ml PBS重悬。按照Percoll说明书配置100%Percoll应用液,随后配制体积比为54%, 64%, 72%的Percoll应用液各2 ml,浓度从高到低依次缓慢加入试管中,将骨髓细胞悬液小心加入上述铺好的Percoll应用液上,保持各层之间分界清晰,22 ℃,1 060 g无制动离心30 min。取64%/72%层间细胞,红细胞裂解液去除红细胞,洗细胞3遍即为NBM-PMN,用Ly6G和CD11b双阳性检测骨髓中性粒细胞纯度,细胞活力用台盼蓝染色鉴定(活力大≥95%,参见参考文献[9])。
分离TBM-PMN:将3×105个U14细胞接种于昆明种小鼠背部皮下,成瘤14 d后分离其骨髓PMN获取TBM-PMN,分离方法同NBM-PMN。
1.8 动物实验PMN与U14的混合接种实验:将1×105个U14细胞与1×106个小鼠骨髓PMN(分别为正常小鼠骨髓PMN或荷瘤小鼠骨髓PMN,分离方法参见1.7、1.8)混合后接种到小鼠右侧大腿肌肉,在成瘤后第10天处死小鼠后检测血管密度,第14天处死小鼠后称取瘤重。
小鼠混合接种部位转染表达G-CSFR的胞外域:用G-CSFR的胞外域处理小鼠时,在实验第0天接种肿瘤细胞,真核表达载体注射于荷瘤部位肌肉,隔天注射一次,注射量和方法分别是G-CSFR每次注射50 μg,溶解于100 μl生理盐水中,分别于第1,3,5,7,9天注射至肿瘤接种部位。
小鼠混合接种部位注射anti-Bv8抗体:用anti-Bv8抗体处理小鼠时,药物浓度为5 mg/kg,在实验第0天接种肿瘤细胞,抗体隔天注射一次,药物浓度和方法分别是anti-Bv8抗体每次注射5 mg/kg,溶解于100 μl生理盐水中,分别于第1、3、5、7、9天注射至肿瘤接种部位。
不进行G-CSFR、anti-Bv8干预的其他实验组,在第1、3、5、7、9天均注射100 μl生理盐水。
实验分组为:只接种U14肿瘤细胞的对照组(U14)、U14与正常小鼠骨髓PMN混合接种组(U14 + NBM-PMN)、U14与荷瘤小鼠骨髓PMN混合接种组(U14 + TBM-PMN)、U14与荷瘤小鼠骨髓PMN混合接种后隔天注射G-CSFR胞外域质粒组(U14 + TBM-PMN + G-CSFR)、U14与荷瘤小鼠骨髓PMN混合接种后隔天注射抗Bv8抗体组(U14 + TBM-PMN +anti-Bv8)。
1.9 免疫组织化学染色及血管密度检测称取瘤重后的组织石蜡包埋,每个标本分别制成两块不同的石蜡标本,以矫正误差。石蜡标本经脱蜡到水、封闭、抗原修复、抗原抗体反应(一抗4 ℃过夜,二抗室温1 h)、苏木素复染、脱水、中性树脂封片后制片。CD34抗体的阳性对照:已知有大量血管生成的肺腺癌组织。阴性对照:将一抗换成抗小鼠IgG。
血管密度计算方法:阅片经验丰富的病理科高年资医师人工计数,每张玻片分别计数20个高倍镜视野后取平均值。坏死以及染色有问题的部位不予选取。
1.10 统计学方法所有实验数据均应用SPSS 17.0统计学软件处理。P<0.05为差异有统计学意义。
2 结果 2.1 Bv8在宫颈癌组织中的表达免疫组织化学染色检测宫颈癌组织中Bv8蛋白的表达,该蛋白主要在中性粒细胞的胞质表达,呈棕黄色,苏木素复染细胞核,图中细胞核形态为分叶状的即为中性粒细胞,见图 1。结果说明在宫颈癌组织中可检测到Bv8的表达,其主要由中性粒细胞表达,且其表达在不同宫颈癌组织中存在差异。
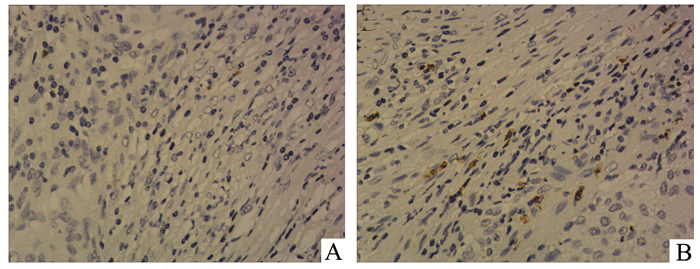
|
图 1 不同宫颈癌组织中Bv8蛋白的表达(×200) A:宫颈癌中Bv8的低表达;B:宫颈癌中Bv8的高表达 |
RT-PCR结果显示,与空白对照组相比,G-CSF刺激组PMN中Bv8的mRNA水平明显增加,差异有统计学意义(P=0.005 0),当用ERK特异性抑制剂PD98059抑制其激活后能够较为明显地抑制G-CSF的作用,差异有统计学意义(P=0.008 9),见图 2。上述结果说明,G-CSF能够增加骨髓PMN中Bv8 mRNA的表达,该作用可能是通过ERK信号途径的激活发挥作用的。
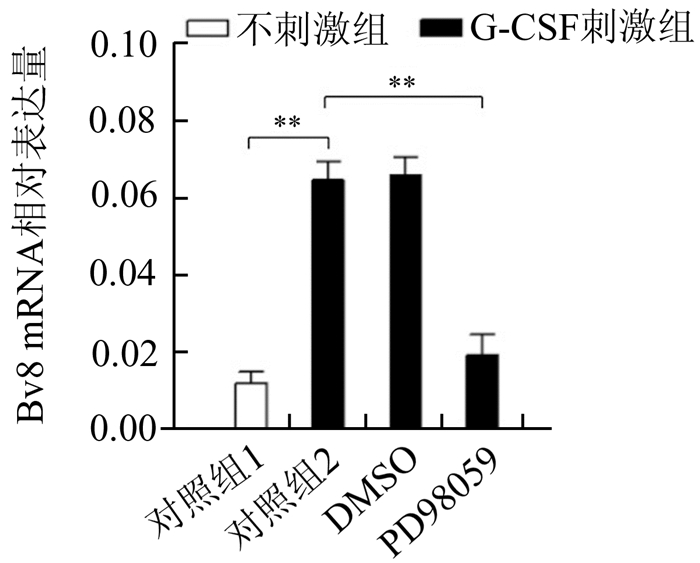
|
图 2 G-CSF刺激后PMN中Bv8 mRNA水平 对照组1:空白对照;对照组2:50 ng/ml G-CSF;DMSO:50 ng/ml G-CSF+DMSO; PD98059:50 ng/ml G-CSF+20 μmol PD98059。G-CSF:粒细胞集落刺激因子;DMSO:二甲基亚砜, **P<0.01 |
Western Blot法检测了PMN中ERK信号通路的激活情况,结果显示与空白对照组相比,G-CSF刺激组中PMN中磷酸化的ERK水平明显增加,差异有统计学意义(P=0.006 7),见图 3A, 3B。当用ERK特异性抑制剂PD98059抑制其激活后能够较为明显地抑制G-CSF的作用,差异有统计学意义(P=0.0 098),见图 3A,3B。上述结果说明,G-CSF能够激活骨髓PMN中的ERK信号通路。
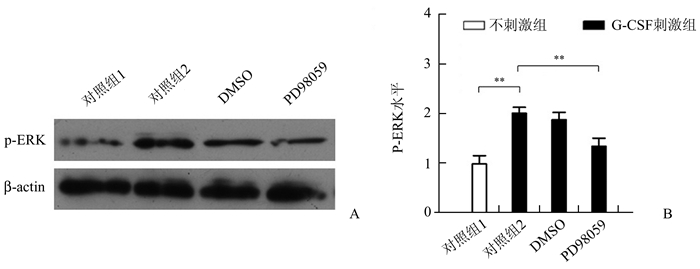
|
图 3 G-CSF刺激PMN后ERK信号通路的激活检测 A:Western Blot实验;B:Western Blot实验中p-ERK与β-actin的比值。对照组1:空白对照;对照组2:50 ng/ml G-CSF; DMSO:50 ng/ml G-CSF+DMSO;PD98059:50 ng/ml G-CSF+20 μmol PD98059。p-ERK:磷酸化的ERK,**P<0.01 |
与单纯接种U14宫颈癌细胞株相比,正常小鼠骨髓PMN抑制U14肿瘤细胞生长,而荷瘤小鼠骨髓PMN促进U14肿瘤细胞生长,G-CSFR拮抗G-CSF作用后,或者Bv8抗体综合Bv8的作用后,荷瘤小鼠骨髓PMN的促瘤作用减弱(图 4A)。检测上述5组肿瘤组织中的血管密度,结果显示与单纯接种U14细胞组的血管密度比较,正常小鼠骨髓PMN与U14肿瘤细胞混合接种后,肿瘤组织中的血管密度降低;荷瘤小鼠骨髓PMN与U14肿瘤细胞混合接种后,肿瘤中的血管密度升高;G-CSFR拮抗G-CSF作用后,或者用Bv8抗体综合Bv8的作用后,能够降低荷瘤小鼠骨髓PMN与U14肿瘤细胞混合接种组中血管的密度(图 4B和图 4C)。上述结果说明,与正常小鼠骨髓中性粒细胞相比,荷瘤小鼠骨髓中性粒细胞有促瘤功能,并且该功能可能与G-CSF和Bv8有关。
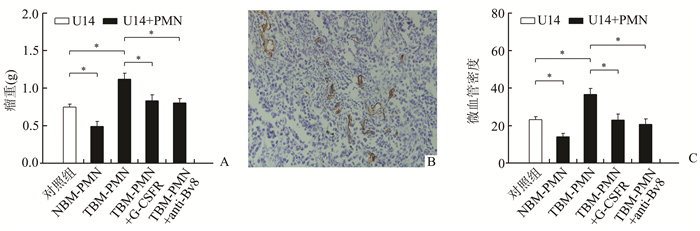
|
图 4 荷瘤小鼠骨髓中性粒细胞的促瘤功能以及拮抗G-CSF和Bv8后促瘤作用的减弱 A:混合接种实验中的瘤重;B,C: U14肿瘤组织中的微血管(×200)。PMN:多形核中性粒细胞;NBM-PMN:正常小鼠来源的骨髓PMN;TBM-PMN:荷瘤小鼠来源的骨髓PMN;G-CSFR:粒细胞集落刺激因子受体;anti-Bv8: anti-Bv8抗体, *P<0.05 |
肿瘤慢性炎症微环境中除外肿瘤细胞,一半以上的成分为肿瘤间质细胞,炎症相关免疫细胞作为肿瘤间质细胞其中的一种,其浸润与肿瘤的发生、发展和转移关系密切。在这些免疫细胞中,多形核中性粒细胞(PMN)占有很高的比例,作为肿瘤微环境中浸润的炎性细胞促进肿瘤细胞生长、转移以及启动和加速肿瘤血管生成[5]。近年来的临床研究表明,外周血PMN数量的增加以及PMN在肿瘤局部的浸润提示多种肿瘤的临床预后不良[10]。在宫颈癌病人中,肿瘤相关PMN的数量是局部宫颈癌转移复发以及高级别宫颈癌患者无复发生存时间的预测指标[11]。
Bv8,也被称为前动力蛋白2(prokineticin 2),是趋化因子家族成员,在1999年由Mollay首次报道,是由77个氨基酸构成的多肽[2]。研究表明,Bv8由多种参与免疫炎症反应的炎性细胞(如中性粒细胞、巨噬细胞、肿瘤相关成纤维细胞等)分泌[12],能够趋化PMN至炎症部位,调控多种炎性细胞因子的释放,参与了包括血管生成、神经形成、痛觉感知、组织发生及胃肠道蠕动等一系列病理生理过程[13]。已有文献报道,在RIP-Tag小鼠肿瘤模型的研究中发现,在肿瘤局部可以检测到Bv8蛋白的高表达,Bv8可以在肿瘤形成的早期趋化PMN至肿瘤部位,促进肿瘤生长及血管生成[4]。在多种小鼠肿瘤模型中,Bv8介导独立于VEGF之外的肿瘤血管生成作用,从而促进肿瘤进展[12]。在原发性肺腺癌患者肿瘤组织中可检测到Bv8蛋白的高表达,且其主要由浸润的PMN表达[3]。我们的研究结果则显示,在宫颈癌组织中可检测到Bv8的表达,且其主要由多形核中性粒细胞表达,其表达在不同宫颈癌组织中存在差异。但中性粒细胞中Bv8的调控及其在宫颈癌肿瘤微环境中的作用目前尚不清楚。
肿瘤微环境中的众多细胞因子参与调控PMN的功能,这其中粒细胞集落刺激因子(G-CSF)在正常生理条件下由机体产生,调控PMN的分化、成熟,趋化骨髓前体细胞及成熟的PMN进入血液,在肿瘤病理状态下,恶性肿瘤细胞和(或)肿瘤基质细胞能够分泌G-CSF [14],参与PMN在慢性炎症肿瘤微环境中的功能调控。在多种恶性肿瘤患者的血清中均能检测到G-CSF的水平升高,且其升高与患者的不良预后密切相关[15]。细胞外调节蛋白激酶ERK,参与调控G-CSF下游信号通路,有文献报道在骨髓源性细胞中ERK信号通路在诱导PMN促瘤功能、促进肿瘤血管生成中起到作用[16]。本研究结果显示,G-CSF能够上调PMN中Bv8 mRNA水平,该作用受到ERK信号通路的调控,抑制ERK信号通路的激活可显著减弱G-CSF在PMN中的这一作用。
我们已发表的研究结果显示,PMN能够通过生成和释放MMP-9,参与肿瘤基底膜重构,从而促进血管内皮生长因子(vascular endothelial growth factor,VEGF)介导的肿瘤血管生成[9]。目前临床上已有使用中和VEGF-A作用的贝伐单抗,用于治疗晚期及复发性宫颈癌患者,能够增加宫颈癌患者的无复发生存时间及总生存时间,但是在宫颈癌及其他癌症的治疗中该抗体的使用均存在耐药现象[1],提示存在独立于VEGF之外的肿瘤血管生成途径。而在动物模型的研究中发现,Bv8能够介导独立于VEGF之外的肿瘤血管生成,阻断Bv8的作用能够减弱这种VEGF的耐药现象[6],提示Bv8可能参与了宫颈癌的血管生成,在宫颈癌的转移及复发中发挥作用。本研究细胞学实验结果显示,G-CSF参与了PMN中Bv8 mRNA水平调控,由于Bv8是分泌型蛋白,本研究未直接检测PMN胞内Bv8的蛋白水平,随后我们设计体内实验,观察G-CSF及Bv8在U14宫颈癌细胞成瘤及血管生成中的作用。结果显示,荷瘤状态能够改变骨髓PMN功能,使PMN由抑制肿瘤生长转变为促进肿瘤生长,结合细胞学实验结果推测:在PMN的这一功能转变中,G-CSF促进PMN生成Bv8,从而促进肿瘤血管生成及肿瘤生长。在后续研究中,我们将结合患者临床病理资料及生存信息,研究宫颈癌组织中Bv8的表达与患者预后的关系,为高危患者提供疾病预后的新的预测指标。
慢性炎症肿瘤微环境是肿瘤的重要特征之一,PMN作为机体中数量最多的炎性免疫细胞,受到肿瘤微环境中多种细胞因子的调控,释放多种物质,促进肿瘤的发生、发展。Bv8作为PMN释放的蛋白因子,在细胞因子G-CSF的作用下,参与了肿瘤微环境中PMN功能的调控,促进了肿瘤生长及血管生成,在PMN参与的促肿瘤侵袭转移中发挥重要作用,抑制其激活可能会延缓肿瘤的进展,本研究为防治PMN参与的肿瘤血管生成提供了新的思路。
| [1] | Penson RT, Huang HQ, Wenzel LB, et al. Bevacizumab for advanced cervical cancer: patient-reported outcomes of a randomised, phase 3 trial (NRG Oncology-Gynecologic Oncology Group protocol 240)[J]. Lancet Oncol, 2015, 16(3): 301-311. DOI: 10.1016/S1470-2045(15)70004-5. |
| [2] | Mollay C, Wechselberger C, Mignogna G, et al. Bv8, a small protein from frog skin and its homologue from snake venom induce hyperalgesia in rats[J]. Eur J Pharmacol, 1999, 374(2): 189-196. DOI: 10.1016/S0014-2999(99)00229-0. |
| [3] | Zhong C, Qu X, Tan M, et al. Characterization and regulation of bv8 in human blood cells[J]. Clin Cancer Res, 2009, 15(8): 2 675-2 684. DOI: 10.1158/1078-0432.CCR-08-1954. |
| [4] | Hang LH, Luo H, Li SN, et al. Involvement of Spinal Bv8/Prokineticin 2 in a Rat Model of Cancer-Induced Bone Pain[J]. Basic Clin Pharmacol Toxicol, 2015, 117(3): 180-185. DOI: 10.1111/bcpt.2015.117.issue-3. |
| [5] | Shen M, Hu P, Donskov F, et al. Tumor-associated neutrophils as a new prognostic factor in cancer: a systematic review and meta-analysis[J]. PLoS One, 2014, 9(6): e98259. DOI: 10.1371/journal.pone.0098259. |
| [6] | Catchpole T, Daniels T, Perkins J, et al. Method development to quantify Bv8 expression in circulating CD11b+ cells in patients with neovascular age-related macular degeneration (nvAMD) exhibiting Anti-VEGF refractoriness[J]. Exp Eye Res, 2016, 148: 45-51. DOI: 10.1016/j.exer.2016.05.025. |
| [7] | Aliper AM, Frieden-Korovkina VP, Buzdin A, et al. A role for G-CSF and GM-CSF in nonmyeloid cancers[J]. Cancer Med, 2014, 3(4): 737-746. DOI: 10.1002/cam4.2014.3.issue-4. |
| [8] | Zou JM, Qin J, Li YC, et al. IL-35 induces N2 phenotype of neutrophils to promote tumor growth[J]. Oncotarget, 2017, 8(20): 33 501-33 514. |
| [9] | Yan B, Wei JJ, Yuan Y, et al. IL-6 cooperates with G-CSF to induce protumor function of neutrophils in bone marrow by enhancing STAT3 activation[J]. J Immunol, 2013, 190(11): 5 882-5 893. DOI: 10.4049/jimmunol.1201881. |
| [10] | Singel KL, Segal BH. Neutrophils in the tumor microenvironment: trying to heal the wound that cannot heal[J]. Immunol Rev, 2016, 273(1): 329-343. DOI: 10.1111/imr.2016.273.issue-1. |
| [11] | Carus A, Ladekarl M, Hager H, et al. Tumour-associated CD66b+ neutrophil count is an independent prognostic factor for recurrence in localised cervical cancer[J]. Br J Cancer, 2013, 108(10): 2 116-2 122. DOI: 10.1038/bjc.2013.167. |
| [12] | Shojaei F, Wu X, Zhong C. Bv8 regulates myeloid cell-dependent tumour angiogenesis[J]. Nature, 2007, 450(7 171): 825-831. |
| [13] | Chen B, Zhang H, Liu L, et al. PK2/PKR1 Signaling Regulates Bladder Function and Sensation in Rats with Cyclophosphamide-Induced Cystitis[J]. Mediators Inflamm, 2015, 2015: 289 519. |
| [14] | Li W, Zhang X, Chen Y, et al. G-CSF is a key modulator of MDSC and could be a potential therapeutic target in colitis-associated colorectal cancers[J]. Protein Cell, 2016, 7(2): 130-140. DOI: 10.1007/s13238-015-0237-2. |
| [15] | Aliper AM, Frieden-Korovkina VP, Buzdin A, et al. A role for G-CSF and GM-CSF in nonmyeloid cancers[J]. Cancer Med, 2014, 3(4): 737-746. DOI: 10.1002/cam4.2014.3.issue-4. |
| [16] | Achyut BR, Shankar A, Iskander AS, et al. Bone marrow derived myeloid cells orchestrate antiangiogenic resistance in glioblastoma through coordinated molecular networks[J]. Cancer Lett, 2015, 369(2): 416-426. DOI: 10.1016/j.canlet.2015.09.004. |
 2018, Vol. 39
2018, Vol. 39


