2. 武汉大学人民医院 血管外科 湖北 武汉 430060
2. Dept. of Vascular Surgery, Renmin Hospital of Wuhan University, Wuhan 430060, China
机械通气是急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)的主要治疗手段,机械通气改善机体氧合时,其反复牵张肺泡可导致呼吸机相关性肺损伤(ventilator-induced lung injury, VILI),增加ARDS患者的病死率[1]。而采取减小潮气量和适当提高呼气末正压(positive end-expiratory pressure, PEEP)水平的肺保护通气策略可提高ARDS患者的生存率,但这些措施易致动脉血二氧化碳分压(PaCO2)升高,导致的高碳酸血症(hypercapnia, HPC)以往被认为对机体不利而当作肺保护通气策略的副作用。但近年来研究发现机体对HPC有一定的耐受和容许性,其本身可对多个器官产生保护效应[2],但缺乏研究证实其病理生理机制。
血管生成素-2(angiopoietin-2,Ang-2)与肺血管渗漏性水肿及ARDS的严重程度相关,ARDS死亡患者血中Ang-2水平明显升高[3]。本研究拟通过应变加载系统对肺泡上皮细胞进行诱导培养,研究在高二氧化碳环境下机械牵张对肺泡上皮细胞炎性因子及Ang-2表达的影响,探讨允许性高碳酸血症在VILI中的作用机制。
1 材料与方法 1.1 实验材料肺泡Ⅱ型上皮细胞株(A549细胞)购自华中科技大学同济医学院细胞免疫实验室,DMEM-12培养液(Hyclone,美国),胎牛血清(Sciencell,美国),细胞柔性基底加载装置Flexercell-4000TTM(Flexcell,美国),二氧化碳孵箱,MTT试剂盒(Sigma,美国),TNF-α,IL-8 ELISA试剂盒(KOMA,韩国),Ang-2抗体(Zymed,美国)。CytoTox 96®非放射性细胞毒性检测试剂盒(Sigma,美国)。
1.2 细胞培养A549细胞培养于含10%胎牛血清DMEM-12培养液,培养液中含100 U/ml青霉素和100 U/ml链霉素,于恒温恒湿CO2孵育箱培养,温度37 ℃,CO2含量5%。将A549细胞以0.5×106/孔接种于包被胶原基底膜collagenⅠ的BioFlex 6孔培养板,孵育过夜。细胞贴壁并融合50%后,用无血清DMEM-12培养基洗3遍,并换成无血清DMEM-12培养基2 ml。
1.3 细胞牵张模型建立及实验分组将培养的A549细胞的BioFlex6孔板置于FX- 5000T应变加载系统上,选择25 mm牵张平台,频率调整为0.5 Hz,牵张与放松时间之比为1:1,给予应变力20%的机械牵张。采用随机数字法,将培养细胞分为4组(n=24):静止对照组(A组):常规培养,不行机械牵张;机械牵张组(B组):给予20%应力牵张24 h;机械牵张+正常二氧化碳孵育组(C组):5% CO2环境下给予20%应力牵张24 h;机械牵张+高二氧化碳孵育组(D组):15% CO2环境下给予20%应力牵张24 h。
1.4 细胞因子TNF-α及IL-8检测分别于机械牵张开始,6,12,24 h,每组取6孔,留取上清液,3 000 r/min离心5 min,-20 ℃冰箱保存待测。用酶联免疫吸附法(ELISA)测定培养基上清液中TNF-α,IL-8含量,严格按试剂盒说明书进行操作。
1.5 Western Blot检测Ang-2蛋白表达蛋白裂解液提取蛋白,取50 μg蛋白质行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转印到硝酸纤维膜上。将膜放入含50 g/L脱脂奶粉的PBST中封闭,4 ℃过夜后,用PBST洗膜3次,每次10 min;然后加入一抗[Ang-2(1:500);β-actin(1:1 000)]37 ℃孵育2 h;除去一抗,用PBST洗膜3次,每次10 min,然后加入与一抗相应的二抗(1:2 000),37 ℃孵育2 h,用PBST洗膜3次, 采用ECL显色液显色并照相。
1.6 细胞活力检测将细胞以0.3×105个/孔接种于96孔培养板中,每组取6孔,细胞培养结束后每孔加入甲基噻唑蓝20 μl(5 mg/m1),37 ℃孵育4 h,弃上清,加入150 μl二甲基亚砜,置于摇床上10 min,应用酶标仪在570 nm波长处测定吸光度值,以此反映细胞活力。
1.7 细胞损伤检测通过非放射性细胞毒性检测试剂盒检测乳酸脱氢酶(LDH)释放率,细胞接种后,收集上清液,加入细胞裂解液,震荡,按照试剂盒说明书测定上清液和细胞裂解液中LDH活性。LDH释放率=上清液LDH活性/(上清液LDH活性+细胞裂解液LDH活性)×100%。
1.8 统计学处理采用SPSS 13.0统计学软件进行处理,计量资料以均数±标准差表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果 2.1 高碳酸环境下机械牵张对肺泡上皮细胞炎性因子TNF-α及IL-8的影响与静止对照组(A组)相比,给予20%机械应力牵张的A549细胞时间依赖性的增加了炎性因子TNF-α和IL-8的释放(P<0.05)。同C组相比,D组可降低炎性因子的表达水平,且差异具有统计学意义,见表 1。
| 表 1 ELISA法检测TNF-α和IL-6的水平 |
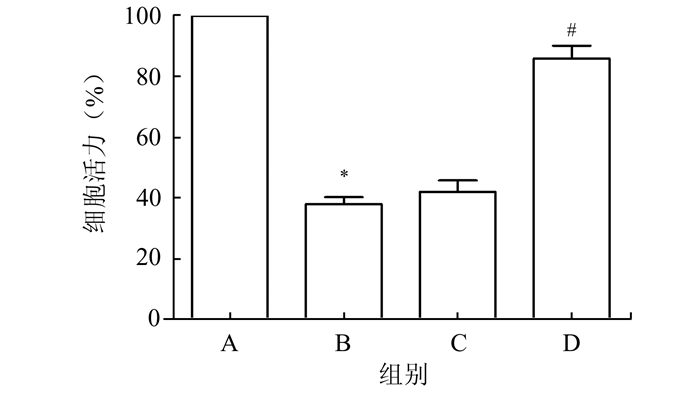
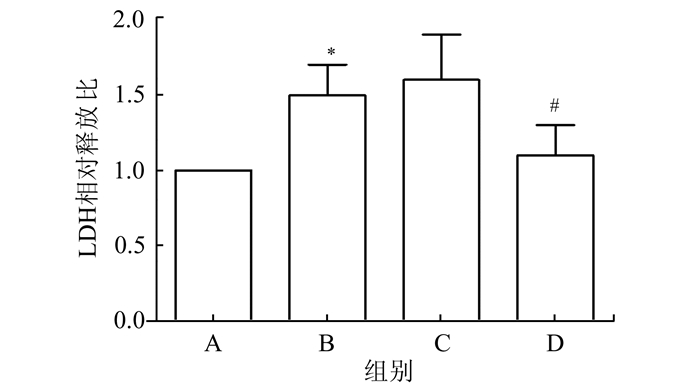
图 1结果显示,与A组相比,给予20%机械应力牵张24 h的A549细胞存活率由(96.3±2.3)%下降至(38.1±3.6)%(P<0.05),而在高二氧化碳环境下(D组),细胞存活率则升至(86.6±4.2)%(P<0.05)。图 2结果显示,同静止对照组比较,机械牵张对肺泡上皮细胞具有明显损伤作用,LDH释放显著增多(P<0.05),而在高二氧化碳环境下可使LDH的释放作用明显减弱,与机械牵张组相比,差异具有统计学意义(P<0.05)。
|
图 1 高碳酸环境对机械牵张肺泡上皮细胞细胞存活力的影响 *P<0.05,与A组比较;#P<0.05,与B组比较,n=24 |
|
图 2 高碳酸环境对机械牵张肺泡上皮细胞LDH释放的影响 *P<0.05,与A组比较;#P<0.05,与B组比较,n=24 |
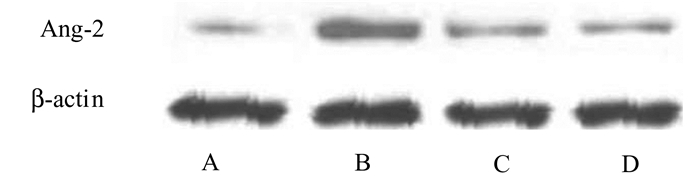
与A组相比,给予20%机械应力牵张的A549细胞显著增加了Ang蛋白的表达(P<0.05)。同C组相比,D组可降低Ang蛋白的表达水平,见图 3。
|
图 3 Western Blot检测Ang-2在各组之间的表达情况 A:静止对照组; B:机械牵张组; C:正常二氧化碳+机械牵张组; D:高二氧化碳+机械牵张组 |
越来越多的研究表明,高碳酸血症(HPC)在急性肺损伤(ALI)/ARDS的损伤修复过程中发挥重要作用,ARDSnet的大样本随机对照研究表明,同高潮气量通气相比,允许性高碳酸血症患者生存率更高。HPC本身可通过减轻肺部炎症等作用来减少肺损伤。Kavanagh[4]的研究不仅支持允许性HPC的应用,而且提倡通过增加CO2的吸入量提高PaCO2来达到治疗性高碳酸血症目的。其给内毒素肺损伤小鼠吸入5%的CO2形成HPC,结果证实HPC能减少肺氧的消耗,提高肺顺应性,减少肺中性粒细胞的渗出,并减少肺损害的组织学指标,明显改善ALI大鼠的各项指标, 包括氧合状况、肺顺应性、气道峰压、肺毛细血管通透性及生存率。本研究采用体外实验证实,高碳酸环境下,机械牵张导致的肺泡上皮细胞损伤减轻,炎性因子释放下降,说明HPC可对VILI发挥保护作用。
多项研究表明,机械通气时,过度牵拉肺组织会使异常的机械力作用于细胞,激活NF-κB信号传导通络,导致一系列炎性介质如:TNF-α,IL-8,MCP-1等升高,导致严重的炎性反应[5],其中TNF-α和IL-8具有重要作用,IL-8的主要作用是调节中性粒细胞趋化性,促进中性粒细胞移出内皮细胞,促进细胞脱颗粒及其吞噬功能。TNF-α可刺激IL-8的释放。肺泡型上皮细胞、支气管上皮细胞、肺内巨噬细胞均可产生IL-8。在兔肺复张模型试验中发现IL-8的浓度及IL-8 mRNA水平均增高,促进肺复张性肺水肿发生及加重。对ALI患者测定肺泡灌洗液中IL-8水平表明,IL-8水平升高与中性粒细胞水平升高相一致,因此IL-8被认为是严重肺损伤的早期标志[6]。
LDH是细胞能量代谢中的重要酶,可催化乳酸生成丙酮酸,同时产生ATP,细胞受损或者死亡后,细胞膜破裂[7],LDH从胞质中释放,因此LDH可反映细胞损伤情况,本研究发现,机械牵张肺泡上皮细胞可引起细胞释放LDH增加,而经高二氧化碳孵育的牵张细胞则LDH释放降低,说明在高二氧化碳环境下,牵张细胞损伤更小。
Ang-2是一种血管内皮生长因子,可与内皮细胞特异性受体Tie-2相结合,进而与Ang-1竞争性结合Tie-2,从而导致Ang-1与Tie-2结合发挥作用减弱,导致血管通透性增高,引起血管渗漏[8]。研究发现急性肺损伤患者血清中Ang-2的含量明显升高,并在体外实验中应用患者血清可破坏内皮细胞屏障,且内皮细胞屏障作用的破坏程度与Ang2水平呈现明显相关性[9];另有研究在体外单独使用Ang2也可破坏内皮细胞屏障功能,并引起了明显的肺血管渗漏和肺水肿,目前是靶向干预和治疗ALI/ARDS的新措施[10],本研究证实,Ang-2参与了VILI的致病过程,HPC减轻VILI可能系通过Ang-2参与所致。
综上所述,本实验研究结果显示,机械牵张肺泡上皮细胞可促进TNF-α和IL-8的表达增加,降低细胞的活力,而高碳酸环境则可以减轻机械牵张所致人肺泡Ⅱ型上皮细胞损伤,上述研究结果有助于丰富和完善HPC干预VILI的机制理论,为探索进一步的治疗提供思路。
| [1] | Bigatello LM, Pesenti A. Ventilator-induced lung injury: less ventilation, less injury[J]. Anesthesiology, 2009, 111(4): 699-700. DOI: 10.1097/ALN.0b013e3181b76545. |
| [2] | Peltekova V, Engelberts D, Otulakowski G, et al. Hypercapnic acidosis in ventilator-induced lung injury[J]. Intensive Care Med, 2010, 36(5): 869-878. DOI: 10.1007/s00134-010-1787-7. |
| [3] | Imai Y, Kuba K, Rao S, et al. Angiotensin-converting enzyme 2 protects from severe acute lung failure[J]. Nature, 2005, 436(7 047): 112-116. |
| [4] | Kavanagh BP, Laffey JG. Hypercapnia: permissive and therapeutic[J]. Minerva Anestesiol, 2006, 72(6): 567-576. |
| [5] | Ko YA, Yang MC, Huang HT, et al. NF-κB activation in myeloid cells mediates ventilator-induced lung injury[J]. Respir Res, 2013, 14: 69. DOI: 10.1186/1465-9921-14-69. |
| [6] | Halbertsma FJ, Vaneker M, Scheffer GJ, et al. Cytokines and biotrauma in ventilator-induced lung injury: a critical review of the literature[J]. Neth J Med, 2005, 63(10): 382-392. |
| [7] | Gavrieli Y, Sherman Y, Ben-Sasson SA. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation[J]. J Cell Biol, 1992, 119(3): 493-501. DOI: 10.1083/jcb.119.3.493. |
| [8] | Wada T, Jesmin S, Gando S, et al. The role of angiogenic factors and their soluble receptors in acute lung injury (ALI)/ acute respiratory distress syndrome (ARDS) associated with critical illness[J]. J Inflamm (Lond), 2013, 10: 6. DOI: 10.1186/1476-9255-10-6. |
| [9] | Yang KY, Liu KT, Chen YC, et al. Plasma soluble vascular endothelial growth factor receptor-1 levels predict outcomes of pneumonia-related septic shock patients: a prospective observational study[J]. Crit Care, 2011, 15(1): R11. DOI: 10.1186/cc9412. |
| [10] | van der Heijden M, van Nieuw Amerongen GP, Koolwijk P, et al. Angiopoietin-2, permeability oedema, occurrence and severity of ALI/ARDS in septic and non-septic critically ill patients[J]. Thorax, 2008, 63(10): 903-909. DOI: 10.1136/thx.2007.087387. |
 2018, Vol. 39
2018, Vol. 39

