2. 湖北省鄂州市中心医院妇产科 湖北 鄂州 436000
2. Dept. of Gynaecology and Obstetrics, Ezhou Central Hospital, Ezhou 436000, Hubei, China
胰腺癌是排名第10位的人类常见恶性肿瘤,在发达国家的男女人群中是导致与癌症相关死亡的第4位最常见原因[1]。外科手术仍然是治愈的最好方法。由于大多数病人发现时已处于中晚期,失去手术治疗机会,其5年生存率只有3%[2]。治疗进展期胰腺癌的化疗药物有限,且不能明显提高患者的生存率,因此,亟需研发一种新型药物来预防和治疗胰腺癌。维生素D3又名骨化三醇,在钙磷代谢中发挥着重要作用。Williams等[3]发现血清维生素D的缺乏可促进乳腺癌的转移。近年来有研究报道维生素D3可通过阻断Hedgehog信号通路在多种肿瘤中发挥抗瘤作用。Hedgehog信号通路成员主要包括Hedgehog配体、PTCH受体、Smoothened(Smo)受体、Gli转录因子家族及下游的其他信号分子[4]。Cortes等[5]发现维生素D3通过与细胞膜上的Smo受体的固醇结合区相互作用来拮抗Hedgehog信号通路,从而调节造血干细胞的产生。本研究应用不同浓度维生素D3干预胰腺癌PANC-1细胞,检测Hedgehog信号通路中Smo蛋白表达的变化及对细胞迁移能力的影响,探讨维生素D3抗胰腺癌的作用机制。
1 材料与方法 1.1 材料 1.1.1 细胞株人胰腺癌PANC-1细胞购自中国科学院上海细胞库。
1.1.2 主要试剂和药物RPMI 1640细胞培养基、胎牛血清、胰蛋白酶购自Gibco公司;孔径8 μm的Transwell小室为BD Biosciences公司生产。Smo多克隆抗体购自abcam公司;β-actin、HRP标记羊抗兔二抗及抗小鼠IgG购自武汉博士德生物工程有限公司;常规生物化学试剂购自国药集团化学试剂有限公司。维生素D3(纯度99.9%)购自Sigma公司。
1.2 方法 1.2.1 药品配制维生素D3用无水乙醇稀释成100 mmol/L,0.22 μm微孔滤膜过滤,分装,4 ℃保存。
1.2.2 细胞培养人胰腺癌PANC-1细胞在RPMI 1640培养液(含10%FBS及100 U/L的青-链霉素双抗), 37 ℃,5%CO2饱和湿度培养箱中培养,每2 d更换培养液, 0.25%胰蛋白酶消化传代。取对数生长期细胞进行实验。每个浓度设5个复孔,实验重复3次。
1.2.3 Western Blot检测Smo蛋白的表达分别收集阴性对照组、25、50、75、100 μmol/L的维生素D3干预PANC-1细胞48 h后的细胞,提取蛋白,Bradford法测定蛋白含量,制备Western上样样品,进行SDS-PAGE胶电泳;将电泳分离的蛋白电转膜至PVDF膜;用含5%脱脂奶粉的TBST(封闭液)封闭PVDF膜2 h;加兔抗人Smo一抗(1:400,3% BSA TBST稀释)4 ℃孵育过夜,TBST充分洗涤PVDF膜5-6次,5 min/次;加HRP标记羊抗兔二抗(1:50 000,3% BSA TBST稀释)孵育2 h,TBST洗涤PVDF膜5-6次,5 min/次;内参使用β-actin(鼠抗人,稀释度1:1 000)。ECL化学发光,X线胶片曝光,凝胶成像系统扫描,以目的条带与β-actin条带灰度值的比值代表蛋白的表达水平。
1.2.4 Transwell迁移实验体外细胞迁移实验采用孔径8.0 μm的24孔transwell小室。实验分为阴性对照组及25, 50, 75, 100 μmol/L不同浓度维生素D3处理组。取对数生长期的用无血清处理12-24 h的PANC-1细胞,经消化离心后,用无血清DMEM/F12培养基重悬细胞,调整细胞密度为1×105个/ml,取200 μl含或不含药物处理的细胞悬液加入到24孔Transwell小室的上室,24孔板下室加入加入800 μl含10% FBS的RPMI 1640培养基,下层培养液和小室间避免有气泡产生,37 ℃,5% CO2培养箱培养18 h。取出小室,PBS清洗2次,10%甲醇溶液固定30 min,5%结晶紫染液室温下染色20 min,PBS清洗2遍,200倍显微镜下拍照,随机选择5个视野计数,取平均值。每组细胞设5个复孔,实验重复3次。迁移抑制率%=(1-实验组迁移细胞数/对照组迁移细胞数)×100%。
1.3 统计学处理应用SPSS 17.0统计软件进行统计学处理。实验数据用x±s表示,用单因素方差分析或t检验进行分析。P<0.05为差异有统计学意义。
2 结果 2.1 Western Blot检测维生素D3对PANC-1细胞Smo蛋白表达的影响图 1显示,不同浓度维生素D3处理胰腺癌PANC-1细胞48 h后,阴性对照组及25, 50, 75, 100 μmol/L组细胞Smo/β-actin灰度值分别为:0.579±0.120, 0.409±0.090, 0.289±0.075, 0.182±0.034, 0.068±0.019,随浓度的增加而下调,差异有统计学意义(F=19.781,P<0.05), 其中50, 75, 100 μmol/L组与阴性对照组,100 μmol/L组与25, 50, 75 μmol/L组之间的差异均有统计学意义(P<0.05),以100 μmol/L组的作用最强。
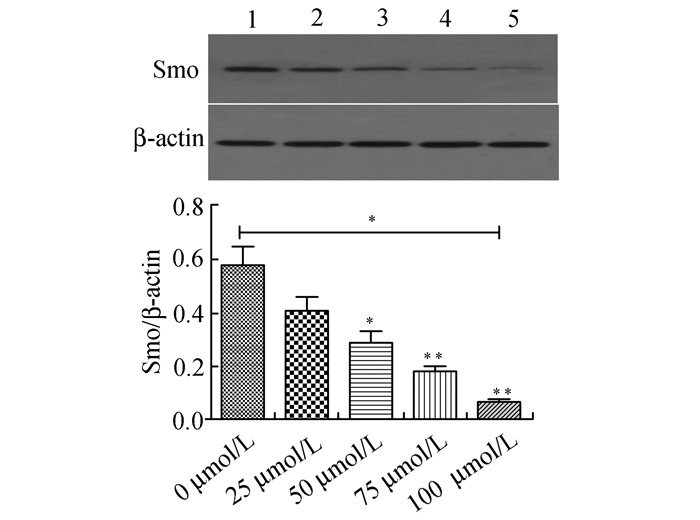
|
图 1 不同浓度(0,25,50,75,100 μmol/L)维生素D3干预PANC-1细胞48 h对Smo蛋白表达的影响 1:阴性对照组;2: 25 μmol/L组;3: 50 μmol/L组;4: 75 μmol/L组;5: 100 μmol/L组;与对照组比较,*P<0.05, 与前一浓度组比较,**P<0.01 |
Transwell小室检测维生素D3对胰腺癌PANC-1细胞迁移能力的影响。如图 2所示,分别用25, 50, 75, 100 μmol/L的维生素D3处理细胞24 h后,穿到Transwell小室下面的细胞数与对照组相比均明显减少(P<0.01), 且各个浓度组间比较差异均有统计学意义(P<0.01)。25, 50, 75, 100 μmol/L维生素D3对细胞的迁移抑制率分别为(15.45±1.35)%、(37.26±2.11)%、(69.96±2.71)%、(84.55±2.83)%。
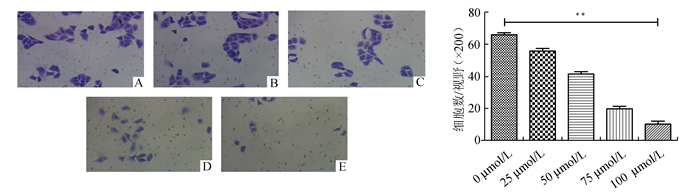
|
图 2 不同浓度(0, 25, 50, 75, 100 μmol/L)维生素D3干预PANC-1细胞24 h对细胞迁移的影响(×200) A:阴性对照组;B: 25 μmol/L组;C: 50 μmol/L组;D: 75 μmol/L组;E:100 μmol/L组, **P<0.01 |
胰腺癌早期难以发现,恶性程度高,传统治疗方法(手术、放疗、化疗、靶向治疗以及生物治疗)其治疗效果不尽如人意,预后差,发病率和死亡率逐年上升[6],已成为严重威胁人类健康的恶性肿瘤之一。通过对胰腺癌发病的分子生物学机制的了解,可以更好地明确胰腺癌的发生发展机制,有利于对胰腺癌的预防和早期发现、早期诊断和早期治疗。胰腺癌的发病主要涉及原癌基因的激活、抑癌基因的失活以及基因组维护基因的功能异常,它们通过一条或多条信号通路引起细胞增殖、凋亡、分化等基本生命过程的调控异常,导致细胞不断恶化,最终导致肿瘤的形成。与胰腺癌的发生、发展相关的信号通路包括Notch、Hedgehog、Wnt和TGF-β信号通路,其中Hedgehog信号通路成为近些年来研究的热点。Bai等[7]报道通过阻滞Hedgehog信号通路可有效抑制胰腺癌细胞的增殖、促进其凋亡,延缓其恶性进展,从而发挥抗胰腺癌的作用。
维生素D3是一种新发现的Hedgehog信号通路阻滞剂。Kennel等[8]报道血清维生素D3的水平异常与多种肿瘤的发生有关。Uhmann等[9]研究表明维生素D3通过Hedgehog信号通路能够拮抗基底细胞癌、人类肾细胞癌、胚胎横纹肌肉瘤、胃癌和胆管细胞癌、异种移植胰腺癌模型的生物学行为。Bijlsma等[10]发现维生素D3以类似于环巴胺(已知的Smo受体拮抗剂)敏感的方式与Smo受体在体外高亲和力结合,而用维生素D3处理的斑马鱼胚胎模拟了Smo受体阴性的表型,从而在体内外实验中证实了其对Hedgehog信号通路的抑制作用与Smo受体直接结合相关。在生理情况下,由于缺乏Hedgehog配体,Smo的分子伴侣受体Ptch可以抑制Smo的活性,同时一种混合抑制因子(Sufu)与Gli转录因子家族特异性结合阻止了Hedgehog信号通路下游靶基因的激活,从而在Hedgehog信号通路中充当一种负性调节因子。一旦Hedgehog配体与Ptch结合之后,解除了Ptch对Smo的抑制作用,Smo蛋白从细胞质定位至细胞膜,促进了Sufu与Gli转录因子家族的解离,从而导致Hedgehog信号通路的激活[11]。Mason等[12]进一步提出假说认为Ptch受体表面的固醇感受区(SSD)在Smo蛋白活性的抑制中起着重要作用。目前普遍认为Ptch通过清除Smo受体周围的氧化型胆固醇来调节Smo的活性,当Ptch受体的SSD发生突变或者与Hedgehog配体结合时,Ptch受体的氧化型胆固醇泵被关闭,导致这些氧化型胆固醇在Smo受体周围的积聚,从而恢复了Smo对Gli转录因子家族的激活作用和在细胞膜上的定位[13]。Albert等[14]研究发现在Ptch受体发生突变的异种移植小鼠皮肤肿瘤模型和基底细胞癌细胞中,维生素D3通过靶向抑制Hedgehog信号通路从而在体内外发挥其抗肿瘤效应,提示了维生素D3是在Smo蛋白的水平上发挥Hedgehog信号通路阻滞作用的。
然而,Teichert等[15]在野生型小鼠皮肤肿瘤模型中发现维生素D3的干预抑制了Hedgehog信号通路相关分子的表达,在维生素D受体基因敲除(VDR-KO)小鼠中却未发现这种现象,提示维生素D3可能通过维生素D受体(VDR)途径来调控Hedgehog信号通路。Uhmann等[16]研究发现维生素D3在基底细胞癌中的抗肿瘤作用与Hedgehog信号通路的抑制和VDR信号通路的激活相关,且2条信号通路相互独立。维生素D3是通过某条单独的信号通路,还是通过2条通路的协同作用来调控肿瘤的发生及发挥抗瘤作用,尚需进一步研究。
本研究结果显示,不同浓度的维生素D3干预胰腺癌PANC-1细胞后,Smo蛋白的表达随浓度的增加而下调,以较大剂量更为明显(50, 75, 100 μmol/L),表明了维生素D3对Hedgehog信号通路的抑制作用。本研究结果还显示,维生素D3可以有效抑制PANC-1细胞的迁移,在较大浓度组(75, 100 μmol/L)的迁移抑制率增加更为明显。维生素D3处理后,Smo蛋白呈浓度依赖性的表达下调,表明了维生素D3可通过抑制Hedgehog信号通路中Smo蛋白的表达进一步抑制胰腺癌PANC-1细胞的迁移,从而发挥抗胰腺癌作用。
| [1] | Barreto SG, Neale RE. Vitamin D and pancreatic cancer[J]. Cancer Lett, 2015, 368(1): 1-6. DOI: 10.1016/j.canlet.2015.06.030. |
| [2] | Singh D, Upadhyay G, Srivastava RK, et al. Recent advances in pancreatic cancer: biology, treatment, and prevention[J]. Biochim Biophys Acta, 2015, 1856(1): 13-27. |
| [3] | Williams JD, Aggarwal A, Swami S, et al. tumor autonomous effects of vitamin D deficiency promote breast cancer metastasis[J]. Endocrinology, 2016, 157(4): 1341-1347. DOI: 10.1210/en.2015-2036. |
| [4] | Rimkus TK, Carpenter RL, Qasem S, et al. Targeting the sonic Hedgehog signaling pathway: review of smoothened and GLI inhibitors[J]. Cancers (Basel), 2016, 8(2): 1-23. |
| [5] | Cortes M, Liu SY, Kwan W, et al. Accumulation of the vitamin D precursor cholecalciferol antagonizes hedgehog signaling to impair hemogenic endothelium formation[J]. Stem Cell Reports, 2015, 5(4): 471-479. DOI: 10.1016/j.stemcr.2015.08.010. |
| [6] | Zhang Q, Zeng L, Chen Y, et al. Pancreatic cancer epidemiology, detection, and management[J]. Gastroenterol Res Pract, 2016, 2016: 1-10. |
| [7] | Bai Y, Chen B, Hong W, et al. Sedum sarmentosum Bunge extract induces apoptosis and inhibits proliferation in pancreatic cancer cells via the hedgehog signaling pathway[J]. Oncol Rep, 2016, 35(5): 2775-2784. DOI: 10.3892/or.2016.4679. |
| [8] | Kennel KA, Drake MT. Vitamin D in the cancer patient[J]. Curr Opin Support Palliat Care, 2013, 7(3): 272-277. |
| [9] | Uhmann A, Niemann H, Lammering B, et al. Calcitriol inhibits hedgehog signaling and induces vitamin D receptor signaling and differentiation in the patched mouse model of embryonal rhabdomyosarcoma[J]. Sarcoma, 2012, 2012: 1-7. |
| [10] | Bijlsma MF, Spek CA, Zivkovic D, et al. Repression of smoothened by patched-dependent (pro-)vitamin D3secretion[J]. PLoS Biol, 2006, 4(8): 1397-1410. |
| [11] | Tang JY, So PL, Epstein EH Jr. Novel Hedgehog pathway targets against basal cell carcinoma[J]. Toxicol Appl Pharmacol, 2007, 224(3): 257-264. |
| [12] | Mason RS, Reichrath J. Sunlight vitamin D and skin cancer[J]. Anticancer Agents Med Chem, 2013, 13(1): 83-97. DOI: 10.2174/187152013804487272. |
| [13] | Reichrath J, Reichrath S. The relevance of the vitamin D endocrine system (VDES) for tumorigenesis, prevention, and treatment of non-melanoma skin cancer (NMSC): Present concepts and future perspectives[J]. Dermatoendocrinol, 2013, 5(1): 38-50. DOI: 10.4161/derm.24156. |
| [14] | Albert B, Hahn H. Interaction of hedgehog and vitamin D signaling pathways in basal cell carcinomas[J]. Adv Exp Med Biol, 2014, 810: 329-341. |
| [15] | Teichert AE, Elalieh H, Elias PM, et al. Overexpression of hedgehog signaling is associated with epidermal tumor formation in vitamin D receptor-null mice[J]. J Invest Dermatol, 2011, 131(11): 2289-2297. DOI: 10.1038/jid.2011.196. |
| [16] | Uhmann A, Niemann H, Lammering B, et al. Antitumoral effects of calcitriol in basal cell carcinomas involve inhibition of hedgehog signaling and induction of vitamin D receptor signaling and differentiation[J]. Mol Cancer Ther, 2011, 10(11): 2179-2188. DOI: 10.1158/1535-7163.MCT-11-0422. |
 2018, Vol. 39
2018, Vol. 39


