宫颈癌位于世界女性恶性肿瘤死亡率第2位,也是目前已知的可由病毒感染引发的肿瘤之一[1],在我国已成为威胁女性健康的一个重大问题。目前,宫颈癌的发病具有年轻化、临床分期早和非鳞癌比例逐步升高的趋势。目前,临床上对于宫颈癌的主要治疗手段包括手术、化疗和放疗等,虽然有一定的效果,但是并未解决实质的问题[2],困惑人们较大的问题是宫颈癌的复发和转移。
研究发现,免疫细胞和它们所释放的细胞因子不仅能够清除肿瘤细胞,同时能够为肿瘤发展提供一个适宜的微环境,从而促进肿瘤进展[3]。白细胞介素(interleukin, IL)-17A是一种促炎细胞因子,它参与了许多炎性疾病。目前,IL-17A在许多癌症中均有发现,如卵巢癌、乳腺癌、胃癌和肝细胞癌[4]。IL-17A在肿瘤发生和进展中扮演了重要的角色。据文献报道[5],IL-17A可能通过促进肿瘤细胞增殖、侵袭迁移以及血管生成等来促进肿瘤的进展,表明IL-17A可能与肿瘤原发病灶的肿瘤生长微环境相关。目前大多数研究以肿瘤微血管密度(microvessel density,MVD)作为肿瘤微血管生成的标志,而CD31是很好的血管内皮标记物,主要用于证明内皮细胞组织的存在,用于评估肿瘤血管生成。为了明确IL-17A表达与宫颈癌肿瘤血管生的相关性,本研究根据免疫组化检测宫颈癌组织IL-17A和CD31表达水平,对IL-17A在宫颈癌中表达与宫颈癌肿瘤血管生成的相互关系作了初步探讨。
1 材料与方法 1.1 标本来源收集武汉大学中南医院2015年1月-2017年10月收治的80例宫颈癌患者行手术切除的宫颈癌组织。术前未经过化疗、放疗及免疫治疗,病理诊断均为宫颈癌。另取每例癌旁宫颈组织(超过癌组织5 cm以上)作对照组,经病理检查确诊为正常宫颈组织。
1.2 主要试剂IL-17A兔抗人多克隆抗体购自Santa Cruz公司,CD31兔抗人单克隆抗体购自Abcam公司,免疫组化试剂盒购自福建迈新生物公司,DAB显色剂、枸橼酸缓冲液、树胶购自武汉谷歌生物公司。
1.3 实验方法 1.3.1 免疫组化中标本及切片的处理在30%盐酸乙醇清洁液体中浸泡载玻片24 h, 流水冲洗后, 用蒸馏水清洗3遍, 载玻片于95%乙醇中浸泡6-8 h后晾干,使用稀释(按1:9的比例稀释)的多聚赖氨酸溶液涂片, 60 ℃烤箱内烘干,装盒备用。
1.3.2 免疫组化SP法① 烤片:65 ℃,1 h;②脱蜡及复水:二甲苯10 min,100%乙醇5 min,95%乙醇5 min,90%乙醇5 min,85%乙醇5 min,80%乙醇5 min,75%乙醇5 min,60%乙醇5 min,50%乙醇5 min,30%乙醇5 min,自来水1 min;③阻断灭活内源性过氧化物酶:3%H2O2 37 ℃孵育10 min,PBS冲洗3次,每次5 min;④抗原修复:将切片置入0.01 mol/L枸橼酸缓冲液(pH 6.0)中用微波炉最大火力煮沸(95 ℃,15-20 min),冷却(约5-10 min),反复2次,然后把切片放在室温中自然冷却,再用PBS冲洗3次,每次5 min;⑤封闭:用TBST配制5%的山羊血清,室温封闭30 min,然后甩去多余液体,勿洗;⑥加一抗:用步骤⑤所配的封闭液配制所需浓度的一抗(IL-17A:1:200,HPSE:1:100,CD31:1:100),滴加在载玻片上,同时用PBS作阴性对照,并用盖玻片覆盖住组织部位,放入4 ℃冰箱过夜,再用PBS冲洗3次,每次5 min;⑦加二抗:37 ℃孵育30 min,再用PBS冲洗3次,每次5 min;⑧滴加辣根过氧化物酶标记的链霉素卵白素工作液,37 ℃孵育30 min;⑨DAB显色:滴加新鲜配置的DAB显色溶液(150 μl), 控制染色1-5 min,自来水冲洗干净后过蒸馏水; ⑩苏木素复染2 min;⑪脱水:30%乙醇3 min,50%乙醇3 min,70%乙醇3 min,80%乙醇3 min,90%乙醇3 min,95%乙醇3 min,100%乙醇3 min,二甲苯20 min;⑫树胶封片镜检。
1.4 结果判定 1.4.1 表达定位IL-17A表达定位在细胞质,镜下显示为胞质中出现的大小不一的棕黄色染色颗粒,CD31表达定位在血管内皮细胞及其连接处,镜下显示为围绕血管的棕黄色染色颗粒。
1.4.2 判定标准① 根据染色程度和染色阳性细胞百分比进行评分。Olympus光学显微镜高倍镜下(40×)随机挑选5个视野, 每个视野记数100个肿瘤细胞, 阳性判定标准为记数的肿瘤细胞细胞核或细胞质中出现棕黄色染色颗粒, 最终根据肿瘤细胞染色程度和染色阳性细胞百分比进行评分。细胞染色强度×阳性细胞百分比对应的值作为IHC评分结果。0-1为阴性,2-4为+,5-8为,9-12为。②CD31阳性标准及MVD计数:以胞质出现棕黄色颗粒为血管内皮细胞阳性。先在低倍镜(×40)下全面观察切片,选择微血管最密集区,在200倍视野(20倍物镜×10倍目镜,0.738 6 mm2)计数微血管数,每张切片计数5个视野,取其平均数作为该肿瘤的MVD值(个/mm2)。在肿瘤区内单个或成丛的内皮细胞,不管成腔与否均视为单个血管。分支血管只要不相连,也视为一个微血管。凡管径≥8个红细胞或带有肌层的血管不予计数。
1.5 统计学方法用SPSS 22.0统计软件处理数据。计量资料采用非配对t检验,计数资料采用卡方检验,以P<0.05为差异具有统计学意义。
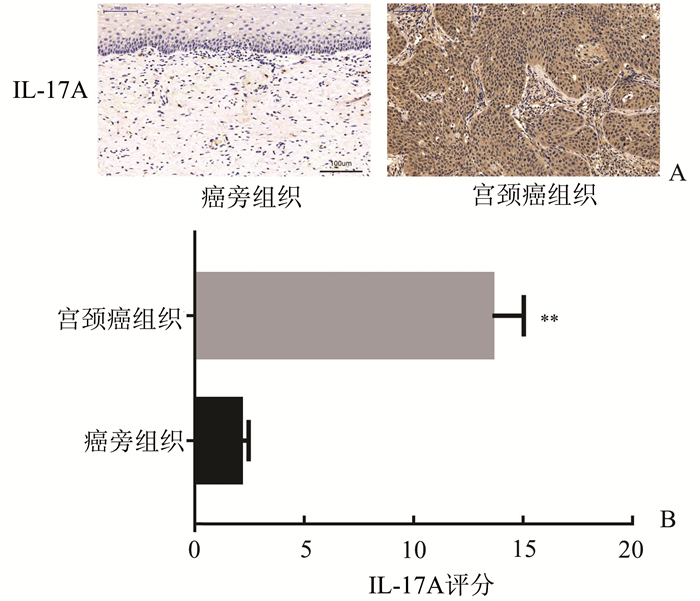
2 结果 2.1 IL-17A的表达与宫颈癌临床病理特点的分析根据实验结果可知,IL-17A在宫颈癌组织表达量显著高于癌旁组织(P<0.01),其染色部位主要分布于胞质内(见图 1)。在年龄方面,50岁以上患者IL-17A阳性表达率为73%,小于或等于50岁的患者IL-17A阳性表达率为67%,两者之间并无统计学差异(P>0.05);在病理组织分级中,高分化病人IL-17A阳性表达率为83%,中分化病人IL-17A蛋白阳性表达率为71%,低分化病人IL-17A蛋白阳性表达率为57%,三者之间并无统计学差异(P>0.05);在临床分期中,Ⅰ-Ⅱ期患者IL-17A蛋白阳性表达率为71%,Ⅲ-Ⅳ期患者IL-17A蛋白阳性表达率为67%,两者之间并无统计学差异(P>0.05);淋巴结转移阳性的患者中IL-17A蛋白阳性表达率为62%,转移阴性的患者中IL-17A蛋白阳性表达率为86%,两者之间并无统计学差异(P>0.05)。由此可见,IL-17A的表达与宫颈癌的年龄、组织病理分级、临床分期、淋巴结转移之间并无相关性(见表 1)。
|
图 1 免疫组化SP法检测IL-17A在宫颈癌中的表达(×200) A:免疫组化显示IL-17A在宫颈癌及癌旁组织的表达;B:IL-17A在宫颈癌及癌旁组织表达的免疫组化评分,**P<0.01 |
| 表 1 IL-17A的表达与宫颈癌临床病理特点的分析 |
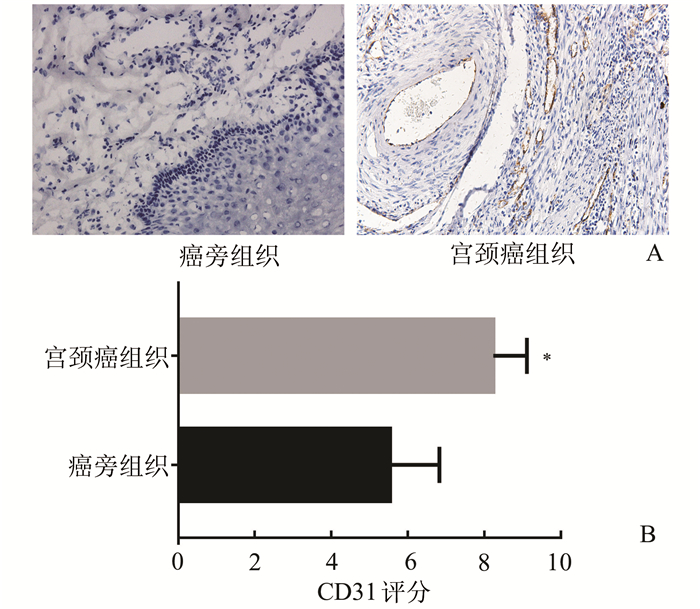
如图 2所示,CD31在宫颈癌组织表达量显著高于癌旁组织(P<0.05)。在宫颈癌患者中,56例IL-17A阳性表达的病例,MVD为(52.35±15.57)个/mm2,24例IL-17A蛋白阴性表达的病例,MVD为(35.21±11.23)个/mm2。经t检验分析,两组数据有显著差异,IL-17A阳性组MVD明显高于阴性组(P=0.000)。
|
图 2 免疫组化SP法检测CD31在宫颈癌中的表达(×200) A:免疫组化显示CD31在宫颈癌及癌旁组织的表达;B:CD31在宫颈癌及癌旁组织表达的免疫组化评分,*P<0.05 |
宫颈癌形成与高危型人乳头状瘤病毒(HR-HPV)持续感染相关。宫颈癌的发展是从低级别宫颈上皮内瘤变(cervical intraepithelial neoplasial, CIN1)到高级别宫颈上皮内瘤变(CIN2和CIN3)最终导致癌症的逐步发展的过程[6]。宫颈黏膜组织活检发现,与未感染的女性相比,HR-HPV感染的女性宫颈上皮淋巴细胞和中性粒细胞浸润增加,炎症程度加重。就感染HR-HPV而言,炎症往往只涉及宫颈上皮表层,而未涉及基底层或扩散至宫颈上皮全层。这表明炎症随HPV类型、是否持续性感染而变化,并成为疾病进展的高危因素。Hammes等[7]检测健康女性、低度鳞状上皮内病变(low-grade squamous intraepithelial lesion, LSIL)、高度鳞状上皮内病变(high-grade squamous intraepithelial lesion, HSIL)和浸润性宫颈癌(invasive cervical cancer, ICC)的宫颈上皮中巨噬细胞的数量,发现细胞数量与宫颈病变严重程度正相关,巨噬细胞的迁移增加会造成宫颈上皮损伤加重。这一发现明确了宫颈上皮中巨噬细胞数量与癌前病变到癌症的进展直接相关,同时也从某个侧面反映了炎症反应强度也与宫颈病变程度密切相关。
近年来,IL-17在肿瘤中的发生作用已经被证实。人们在研究胰腺炎转变为癌症的机制中发现,炎性因子能够使细胞中“沉睡”状态的致癌基因Kras发生突变,从而促进细胞的癌变[8]。最近一项研究中指出[9],宫颈肿瘤细胞可能通过诱导肿瘤间质细胞表达高水平CCL20,然后再募集CD4/IL-17/CCR6阳性细胞到肿瘤组织中。由此我们推测从HPV感染到发展为恶性肿瘤与包括Th17细胞在内的炎症微环境作用相关。另外,已有研究报道IL-17A能够促进肿瘤血管生成:Bao [10]等研究发现,在肺腺癌细胞中,IL-17A能够通过增加VEGF的表达来促进肿瘤血管的生成。Fujie等[11]通过体内实验发现,IL-17A能够上调CXCL1、CXCL5、CXCL6和CXCL8的表达,能够诱导肿瘤相关血管生成,增加肿瘤微血管的数量和密度。此外,还有研究[12]发现IL-17可能参与了T细胞介导的血管发生,从而促进宫颈癌进展。IL-17能够诱导多种促血管生成因子的表达如VEGF、IL-6、PGE2和TGF-β。IL-17还能诱导IL-8的产生,IL-8信号通路能促进肿瘤原发部位炎性细胞浸润、肿瘤转移和内皮细胞的血管生成[13, 14]。提示IL-17A与肿瘤血管生成关系密切。
为了进一步证实IL-17A与宫颈癌之间的相关性,我们共收集了80例来自本单位手术切除的宫颈癌组织,使用常规免疫组化方法检测IL-17A和CD31的表达情况,观察IL-17A在宫颈癌细胞中的定位以及它们的表达的相关性。结果发现IL-17A主要在癌细胞中表达,并且IL-17A在宫颈癌中的阳性表达率均为70%。IL-17A的表达与宫颈癌的年龄、组织病理分级、临床分期、淋巴结转移之间并无相关性,而与MVD相关。分析实验结果可知,IL-17A在宫颈癌组织中过表达,同时,前期研究报道IL-17A与肿瘤血管生成相关,IL-17A介导的信号通路可以促进肿瘤血管生成,我们的实验结果与这一观点相符。由此,我们认为IL-17A可以作为宫颈癌肿瘤标志物,对肿瘤的预后起到一定的提示作用。同时,IL-17A表达阳性的宫颈癌中MVD明显升高,说明IL-17A可能与宫颈癌肿瘤血管生成相关。这些结论为宫颈癌前期诊断以及预后提供了一定的理论基础,但是由于样本量偏小,还存在一定的局限性。
| [1] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65: 87-108. DOI: 10.3322/caac.21262. |
| [2] |
赵恩锋, 鲍嫘, 李超, 等. 近50年宫颈癌的发病趋势和临床特点分析[J].
第一军医大学学报, 2005, 25(6): 605-609.
Zhao EF, Bao L, Li C, et al. The incidence and clinical characteristics of cervical cancer in recent 50 years[J]. Journal of First Military Medical University, 2005, 25(6): 605-609. DOI: 10.3321/j.issn:1673-4254.2005.06.018. |
| [3] | Hui L, Chen Y. Tumor microenvironment: Sanctuary of the devil[J]. Cancer Lett, 2015, 368(1): 7-13. DOI: 10.1016/j.canlet.2015.07.039. |
| [4] | Zhang X, Zheng L, Sun Y, et al. Analysis of the association of interleukin-17 gene polymorphisms with gastric cancer risk and interaction with Helicobacter pylori infection in a Chinese population[J]. Tumor Biol, 2014, 35(2): 1 575-1 580. DOI: 10.1007/s13277-013-1217-x. |
| [5] | Feng M, Wang Y, Chen K, et al. IL-17A promotes the migration and invasiveness of cervical cancer cells by coordinately activating MMPs expression via the p38/NF-kB signal pathway[J]. PLoS One, 2014, 9(9): e108 502. DOI: 10.1371/journal.pone.0108502. |
| [6] | Wu NL, Huang DY, Tsou HN, et al. Syk mediates IL-17-induced CCL20 expression by targeting Act1-dependent K63-linked ubiquitination of TRAF6[J]. J Invest Dermatol, 2015, 135(2): 490-498. DOI: 10.1038/jid.2014.383. |
| [7] | Hammes LS, Tekmal RR, Naud P, et al. Macrophages, inflammation and risk of cervical intraepithelial neoplasia (CIN) progression-clinicopathological correlation[J]. Gynecol Oncol, 2007, 105(1): 157-165. DOI: 10.1016/j.ygyno.2006.11.023. |
| [8] | Loncle C, Bonjoch L, Folch-Puy E, et al. IL-17 functions through the novel REG3β-JAK2-STAT3 inflammatory pathway to promote the transition from chronic pancreatitis to pancreatic cancer[J]. Cancer Res, 2015, 75(22): 4 852-4 862. DOI: 10.1158/0008-5472.CAN-15-0896. |
| [9] | Walch-Rückheim B, Mavrova R, Henning M, et al. Stromal fibroblasts induce CCL20 through IL6/C/EBPb to support the recruitment of Th17 cells during cervical cancer progression[J]. Cancer Res, 2015, 75(24): 5 248-5 259. DOI: 10.1158/0008-5472.CAN-15-0732. |
| [10] | Bao Z, Lu G, Cui D, et al. IL-17A-producing T cells are associated with the progression of lung adenocarcinoma[J]. Oncol Rep, 2016, 36(2): 641-650. DOI: 10.3892/or.2016.4837. |
| [11] | Fujie H, Niu K, Ohba M, et al. A distinct regulatory role of Th17 cytokines IL-17A and IL-17F in chemokine secretion from lung microvascular endothelial cells[J]. Inflammation, 2012, 35(3): 1 119-1 131. DOI: 10.1007/s10753-011-9419-0. |
| [12] | Zhang Y, Hou F, Liu X. Tc17 cells in patients with uterine cervical cancer[J]. PLoS One, 2014, 9(2): e86 812. DOI: 10.1371/journal.pone.0086812. |
| [13] | Lukaszewicz-Zajac M, Kulczyńska-Przybik A, Muszyński P, et al. Serum concentrations of receptor for interleukin 8 in patients with esophageal cancer[J]. Pol Arch Med Wewn, 2016, 126(11): 854-861. |
| [14] | Okamura A, Takeuchi H, Matsuda S, et al. Factors affecting cytokine change after esophagectomy for esophageal cancer[J]. Ann Surg Oncol, 2015, 22(9): 3 130-3 135. DOI: 10.1245/s10434-014-4348-4. |
 2018, Vol. 39
2018, Vol. 39

