2. 武汉市第一医院皮肤科 湖北 武汉 430022
2. Dept.of Dermatology, Wuhan No.1 Hospital, Wuhan 430022, China
皮肤衰老是人体衰老的一部分,研究表明,皮肤衰老与紫外线照射导致的正常人皮肤成纤维细胞(normal human skin fibroblasts, NHSFs)氧化应激损失密切相关。β-联蛋白(β-catenin)是转录因子共激活剂,它在调控细胞增殖、分化、凋亡和衰老方面有着非常重要的作用,有研究显示高表达的β-catenin对氧化应激所致的NHSFs衰老相关表型具有调控作用[1],但其具体作用机制还不甚清楚。本研究通过在NHSFs中转染pcDNA3.1-β-catenin,并用中波紫外线(UVB)进行氧化应激处理,研究高表达的β-catenin对NHSFs的作用,并通过检测细胞衰老相关因子FOXO3a的表达来探讨其作用机制。
1 材料与方法 1.1 材料与仪器高糖DMED培养基、胎牛血清、0.25%胰蛋白酶-0.02%EDTA(Gibco)、Clinibio 128C型酶标仪(奥地利ASYS Hitech公司);PCR仪(美国Perkin Elmer公司);Universal Hood Ⅱ型紫外凝胶成像系统(意大利Bio-Rad公司);台式紫外线辐射仪(上海希格玛公司);中波紫外线(UVB)探测仪(比利时Bioblock Scientific公司);CH倒置光学显微镜、荧光显微镜(日本Olympus公司);Luciferase reporter system kit (美国Promega公司);衰老相关β-半乳糖苷酶(SA-β-gal)染色试剂盒(美国CDK公司);新生牛血清(美国Gibco公司);质粒pcDNA3.1-β-catenin载体(美国Clontech公司);流式细胞仪(德国Miltenyi Biotec GmbH公司);大肠杆菌DH5α由华中科技大学同济医学院实验室惠赠,用于质粒扩增。
1.2 方法 1.2.1 人皮肤成纤维细胞的分离和培养[2]经患者监护人知情同意并经我院伦理委员会批准后,收集我院泌尿外科儿童包皮环切术切除的多余包皮组织。去除皮下脂肪及血管, 采用组织块法分离获得包皮成纤维细胞。高糖DMED培养基加10%胎牛血清培养,细胞长至90%融合后以0.25%胰蛋白酶-0.02%EDTA消化后传代培养, 取第3代细胞进行实验。
1.2.2 UVB诱导皮肤成纤维细胞衰老参考文献并结合我们前期实验,采用亚毒性剂量的UVB (10 mJ/cm2)连续5次照射第3代NHSFs诱导人皮肤细胞衰老模型[3],通过以上NHSFs衰老模型来模拟人皮肤衰老。
1.2.3 SA-β-gal活性测定[1]UVB处理培养基孵育2 h后弃去,PBS洗3遍,换新鲜培养基继续培养72 h。按试剂盒说明书操作进行SA-β-gal活性测定,吸除细胞培养基,用PBS洗涤1次,加入适量SA-β-gal染色固定液,室温固定15 min,吸除细胞固定液,加入PBS洗涤3次,每次3 min。吸除PBS,加入适量细胞染色工作液,37 ℃孵育12 h,中性树胶封片,光学显微镜观察。阳性细胞(衰老细胞)镜下呈淡蓝至深蓝色。标本阳性率以阳性标本占总标本数的百分率表示。
1.2.4 细胞转染大肠杆菌DH5α扩增质粒pcDNA3.l-β-catenin,PCR和DNA测序来鉴定。通过脂质体LipofectamineTM 2000将pcDNA3.l-β-catenin和绿色荧光蛋白(green fluorescent protein,GFP)共同转染到NHSFs中,转染后细胞继续孵育48 h,然后用Luciferase reporter system kit检测荧光素酶的活性,鉴定细胞转染率。
1.2.5 流式细胞仪检测NHSFs凋亡率将pcDNA3.l-β-catenin和GFP共同转染到NHSFs中,然后UVB处理组作为实验组,命名为NHSFs+β-catenin+UVB组;空载体pcDNA3.1转染到NHSFs中,命名为NHSFs+vector组;空载体pcDNA3.1转染到NHSFs中,然后UVB处理命名NHSFs+vector+UVB组,后两组为对照组,分别检测各组细胞凋亡率。
1.2.6 Western印迹测定NHSFs中β-catenin和FOXO3a蛋白的表达分别检测NHSFs+β-catenin+UVB组、NHSFs+vector组、NHSFs+vector+UVB组中β-catenin和FOXO3a蛋白的表达,具体实验方法参考文献[4]。
1.2.7 统计学分析所有数据均用SPSS 13.0软件进行统计分析。所有计量资料数据以均数±标准差(x±s)表示,计量资料用t检验,计数资料用χ2检验,P < 0.05为差异有统计学意义。
2 结果 2.1 人皮肤成纤维细胞的分离与培养采用组织块法培养第4天开始有细胞从组织块边缘爬出, 第10-14天细胞长至融合,长梭形细胞中间可见铺路石样细胞表皮细胞,将融合细胞按1:3进行传代,传代后细胞生长加速第2天可融合,从第2代开始细胞呈典型的长梭形,铺路石样表皮细胞消失。
2.2 UVB诱导成纤维细胞衰老及SA-β-gal染色UVB 10 mJ/cm2能量照射后可见细胞生长停滞呈典型衰老形态,细胞形态上变得宽大扁平,胞质透明,胞核内颗粒增多,见图 1。SA-β-gal半乳糖苷酶细胞衰老染色可见典型衰老细胞核周染成蓝色, 对照组细胞阳性率为(34.25±1.63)%。
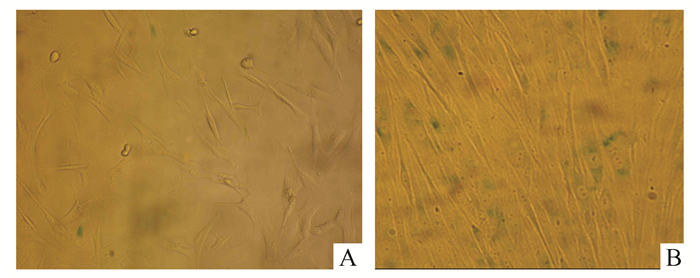
|
图 1 UVB诱导成纤维细胞SA-β-gal染色 A: UVB处理前; B: UVB处理后 |
用荧光素酶检测荧光转染率大概30%左右,pcDNA3.1-p-catenin载体成功转染入NHSFs细胞中,见图 2。
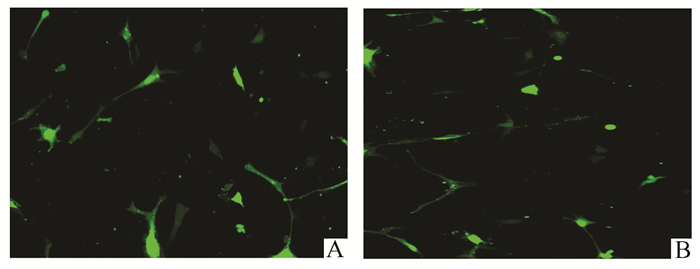
|
图 2 荧光素酶检测β-catenin转染率 A:NHSFs+β-vector组荧光转染率;B:NHSFs+β-catenin组荧光转染率 |
转染pcDNA3.l-β-catenin进入NHSFs中后,为了评估各实验组细胞凋亡情况,我们检测了各个实验组细胞凋亡情况,见图 3。在NHSFs+vector, NHSFs+vector+UVB,NHSFs+β-catenin+UVB组中细胞凋亡水平分别是:(2.98±0.19)%、(25.14±3.24)%、(16.43±2.46)%。我们发现,在NHSFs+vector+UVB组中细胞凋亡率较高,而在NHSFs+β-catenin+UVB组中细胞凋亡率降低(P < 0.05)。
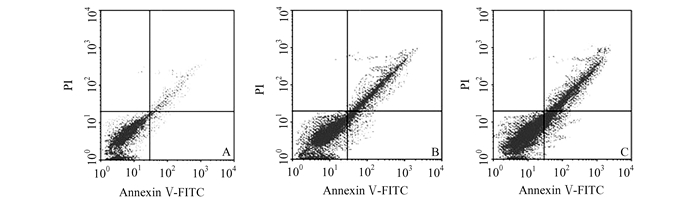
|
图 3 各组细胞凋亡率情况 A:NHSFs+vector组;B:NHSFs+vector+UVB组;C:NHSFs+β-catenin+UVB组 |
见图 4。β-catenin/GAPDH蛋白的比值在NHSFs+vector, NHSFs+vector+UVB, NHSFs+β-catenin+UVB组分别是0.63±0.03、0.21±0.18、0.47±0.09。FOXO3a/GAPDH蛋白的比值在NHSFs+vector, NHSFs+vector+UVB, NHSFs+β-catenin+UVB组分别是0.89±0.59、0.24±0.02、0.48±0.76。上述数据表明:FOXO3a蛋白的水平在NHSFs+vector+UVB组明显低于NHSFs+vector组(P < 0.05),并且,FOXO3a的表达水平在NHSFs+β-catenin+UVB组较NHSFs+vector+UVB组高(P < 0.05)。
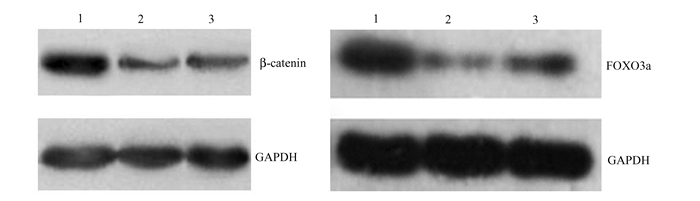
|
图 4 Western印迹测定NHSFs中β-catenin和FOXO3a蛋白的表达情况 1:NHSFs+vector组;2:NHSFs+vector+UVB组;3:NHSFs+β-catenin+UVB组 |
皮肤衰老与紫外线特别是中波紫外线(UVB)密切相关,紫外线诱导皮肤衰老已有多年的研究,技术成熟[5], β-catenin是细胞质中一种重要的多功能蛋白,可以通过Wnt信号通路发挥抗细胞凋亡作用[7],近期研究发现β-catenin及其信号通路在调控细胞衰老中起着重要作用[6],但其抗细胞衰老的机制不甚清楚。
在细胞衰老的相关研究中发现,FOXO3a是叉头(Forkhead)蛋白家族成员之一,FOXO3a蛋白可通过与相应的DNA结合调控下游因子,在细胞增殖凋亡、细胞周期阻滞、血管新生、DNA修复及应激反应中发挥重要作用[8-10]。FOXO3a通过相关信号通路可以抑制氧化应激从而达到延缓衰老[11],活性氧(ROS)与衰老过程密切相关,而FOXO3a可以通过激活superoxide dismutase 2 (SOD2)和catalase (CAT)减少ROS的含量[12],通过激活FOXO3a和Nrf2通路,可以增加下游的抗氧化剂,包括SOD2, CAT, GR, GSH, GCL, HO-1等基因的表达与功能,有助于对D-半乳糖衰老的保护[13]。
进一步研究发现,β-catenin和FOXO3a之间可以通过相互作用增强细胞对氧化应激的适应能力,通过Wnt/β-catenin信号通路,FOXO3a的同源基因DAF-16和β-catenin同源基因BAR-1相互作用对氧化应激诱导起到非常重要的作用[14]。除了Wnt/β-catenin信号通路,FOXO3a还可以通过AKT、JNK等信号通路抑制氧化应激,延缓细胞衰老[15],这种抗氧化应激的机制包括:提供FOXO3a转录因子核定位的信号抑制FOXO磷酸化和FOXO3a结合MhSOD启动因子减少ROS的活性等方面[16]。
我们通过培养第三代成纤维细胞,转染pcDNA3.l-β-catenin进入NHSFs中,并用中波紫外线诱导皮肤衰老模型,检测转染pcDNA3.1-β-catenin后对NHSFs中β-catenin和FOXO3a表达的影响,我们的数据表明了,高表达的β-catenin激活了FOXO3a,从而上调了FOXO3a的表达。而FOXO3a的表达上调可以抑制细胞衰老,这可能是β-catenin抗细胞衰老的作用机制之一,具体作用机制还需要我们进一步研究。
| [1] |
田黎明, 谢红付, 李吉, 等. β联蛋白对体外过氧化氢所致人皮肤成纤维细胞衰老表型的影响[J].
中华皮肤科杂志, 2013, 46(7): 485-488.
Tian LM, Xie HF, Li J, et al. Effect of B-catenin on senescent phenotypes of human skin fibroblasts induced by hydrogen peroxide in vitro[J]. Chin J Dermatol, 2013, 46(7): 485-488. |
| [2] | Chainiaux F, Magalhaes JP, Eliaers F, et al. UVB-induced premature senescence of human diploid skin fibroblasts[J]. Int J Biochem Cell Biol, 2002, 34(11): 1331-1339. DOI: 10.1016/S1357-2725(02)00022-5. |
| [3] | Li Y, Bi Z, Yan B, et al. UVB radiation induces expression of HIF-1alpha and VEGF through the EGFR/PI3K/DEC1 pathway[J]. Int J Mol Med, 2006, 18(4): 713-719. |
| [4] |
田黎明, 谢红付, 李吉, 等. 氧化应激所致的人皮肤成纤维细胞衰老中β-连环蛋白的表达研究[J].
中华皮肤科杂志, 2011, 44(4): 259-262.
Tian LM, Xie HF, Li J, et al. Expression of B-catenin in oxidative stress-induced premature senescence of hmuan skin flbroblasts[J]. Chin J Dermatol, 2011, 44(4): 259-262. |
| [5] | Yaar M, Gilchrest BA. Photoageing: mechanism, prevention and therapy[J]. Br J Dermatol, 2007, 157(5): 874-887. DOI: 10.1111/bjd.2007.157.issue-5. |
| [6] | Yamaguchi M. The transcriptional regulation of regucalcin gene expression[J]. Mol Cell Biochem, 2011, 346(12): 147-171. |
| [7] |
周玉涛, 周中银, 操寄望, 等. 小干扰RNA沉默β-catenin基因对人结肠癌SW480细胞增殖及凋亡的影响[J].
武汉大学学报:医学版, 2015, 36(2): 231-234.
Zhou YT, Zhou ZY, Cao JW, et al. Effects of siRNAsilencing beta-catenin expression on proliferation and apoptosis of human colon cancer cell line SW480[J]. Medical Journal of Wuhan University, 2015, 36(2): 231-234. |
| [8] | Wilk A, Urbanska K, Grabacka M, et al. Fenofibrate induced nuclear translocation of FOXO3a triggers Bim-mediated apoptosis in glioblastoma cells in vitro[J]. Cell Cycle, 2012, 11(14): 2660-2671. DOI: 10.4161/cc.21015. |
| [9] | Karadedou CT, Gomes AR, Chen J, et al. FOXO3a represses VEGF expression through FOXM1-dependent and independent mechanisms in breast cancer[J]. Oncogene, 2011, 31(14): 1845-1858. |
| [10] | Lu Q, Zhai Y, Cheng Q, et al. The Akt-FoxO3a-manganese superoxide dismutase pathway is involved in the regulation of oxidative stress in diabetic nephropathy[J]. Exp Physiol, 2012, 98(4): 934-945. |
| [11] | Clavel S, Siffroi-Fernandez S, Coldefy AS, et al. Regulation of the intracellular localization of Foxo3a by stress-activated protein kinase signaling pathways in skeletal muscle cells[J]. Mol Cell Biol, 2010, 30(2): 470-480. DOI: 10.1128/MCB.00666-09. |
| [12] | Tan WQ, Wang K, Lv DY, et al. Foxo3a inhibits cardiomyocyte hypertrophy through transactivating catalase[J]. Journal of Biological Chemistry, 2008, 283(44): 29730-29739. DOI: 10.1074/jbc.M805514200. |
| [13] | Li YN, Guo Y, Xi MM, et al. Saponins from Aralia taibaiensis attenuate D-galactose-induced aging in rats by activating FOXO3a and Nrf2 pathways[J]. Oxid Med Cell Longev, 2014, 2014(2): 290-298. |
| [14] | Essers MA, de Vries-Smits LM, Barker N, et al. Functional interaction between and FOXO in oxidative stress signaling[J]. Science, 2005, 308(5725): 1811-1184. |
| [15] | Clavel S, Siffroi-Fernandez S, Coldefy AS, et al. Regulation of the intracellular localization of Foxo3a by stress-activated protein kinase signaling pathways in skeletal muscle cells[J]. Mol Cell Biol, 2010, 30(2): 470-480. DOI: 10.1128/MCB.00666-09. |
| [16] | Yamaoto M, Clark JD, Pastor JV, et al. Regulation of oxidatlve stress by the anti-aging hormone Klotho[J]. J Biol Chem, 2005, 280(45): 38029-38034. DOI: 10.1074/jbc.M509039200. |
 2018, Vol. 39
2018, Vol. 39


