子痫前期是一种严重危害母儿健康的妊娠并发症,属于妊娠期高血压疾病的一种特殊类型,全球发生率约为5%-8%[1]。关于子痫前期发病机制的研究一直是产科研究的重点和难点,至今尚未得到完全阐明,但妊娠早期滋养细胞侵袭不足、子宫螺旋动脉重塑障碍被一致认为是子痫前期发病机制的关键环节[2]。在胎盘形成初始阶段,氧张力的动态变化对调节滋养细胞功能具有重要作用,氧张力的失调可以通过影响滋养细胞功能,诱发子痫前期的发生。在动物模型试验中,暴露在9.5% O2浓度下的小鼠血压升高并表现出类似子痫前期的症状[3]。在体外细胞实验中,1%-3%O2的缺氧条件显著抑制滋养细胞的增殖[4]、侵袭[5]及血管形成[6]并促进滋养细胞凋亡[7]。缺氧(低于5%氧浓度)诱导细胞生成缺氧诱导因子(hypoxia-inducible factor 2α,HIF-2α),随后绑定到靶基因缺氧反应元件上发挥生物学效应,HIF-2α被证实参与肿瘤细胞增殖、迁移、侵袭、血管形成等功能[8]。有研究证实子痫前期胎盘中HIF-2α的表达显著升高[9],提示HIF-2α有可能涉及子痫前期的发生,而关于HIF-2α对滋养细胞功能影响的研究甚少,本研究拟以绒膜外滋养细胞系HTR8/SVneo为研究对象, 探索HIF-2α对滋养细胞侵袭及血管形成的影响,并探讨其可能参与的信号通路。
1 材料与方法 1.1 主要材料和试剂HTR8/SVneo细胞购于武汉大学中国典型培养物保藏中心;10%胎牛血清(Hyclone, USA);RPMI 1640培养基(Hyclone, USA);37 ℃恒温CO2培养箱(Thermo, USA);37 ℃恒温三气培养箱(BINDER, Germany);HIF-2α抑制剂(Merck, USA); 兔抗人HIF-2α抗体(Abcam,USA);兔抗人ARRDC3抗体、兔抗人GAPDH抗体、兔抗人PPARγ抗体均来自美国proteintech公司;Matrigel基质胶(BD, USA); Transwell小室(Costar, USA)。
1.2 细胞培养及造模HTR8/SVneo细胞接种在含有10%胎牛血清的RPMI 1640培养基的培养瓶,在37 ℃恒温CO2培养箱培养。每3 d更换一次培养液。细胞生长至对数生长期时采用0.25%胰酶消化传代。37 ℃恒温三气培养箱氧气浓度设置为1%,将HTR8/SVneo细胞按1×106/孔的密度接种于6孔板待细胞贴壁后放在三气培养箱中缺氧培养12、24 h。
1.3 Western BlotHIF-2α、过氧化物酶体增殖激活受体(peroxisome proliferator activated receptor gamma,PPARγ)及ARRDC3(arrestin domain containing 3)蛋白表达用Western Blot方法[10]检测。
1.4 Transwell法检测细胞侵袭滋养细胞HTR8/SVneo侵袭能力用Transwell法[11]检测。
1.5 Tube formation法检测细胞管形成滋养细胞管形成能力用Tube formation法[12]检测。
1.6 统计学处理使用SPSS 20.0统计软件包进行统计分析,计量资料以均值±标准差表示,每个实验独立重复3次。用t检验或单因素方差分析进行分析,以P<0.05表示差异具有统计学意义,P<0.01表示差异具有显著统计学意义。
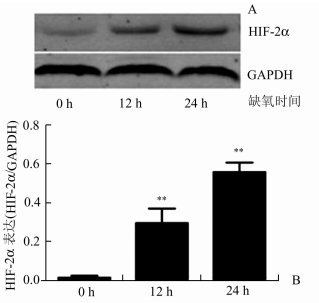
2 结果 2.1 缺氧(1%O2)诱导HTR8/SVneo细胞HIF-2α的表达在滋养细胞缺氧的子痫前期细胞模型(HTR8/SVneo细胞暴露于1%O2条件下培养24 h)中,Western Blot检测显示HTR8/SVneo细胞HIF-2α蛋白的表达随缺氧时间的延长而增多。缺氧12和24 h,HIF-2α及蛋白的表达分别平均增高了14倍(P<0.01)和27倍(P<0.01)(图 1)。
|
图 1 不同缺氧时间(0、12、24 h)HTR8/SVneo细胞HIF-2α的表达 A: Western blot检测HTR8/SVneo细胞HIF-2α蛋白的表达; B: Western Blot相对定量,与0 h相比,**P<0.01 |
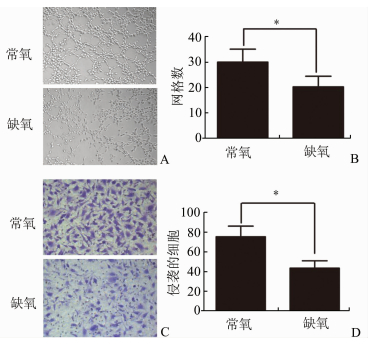
Tube formation法检测缺氧对HTR8/SVneo细胞血管形成能力的影响。如图 2A、2B所示,缺氧组基质胶上网格数与常氧组相比明显减少(P<0.05),分别为(20.25±2.09)、(30.00±2.58);Transwell小室法检测缺氧对HTR8/SVneo细胞侵袭能力的影响。如图 2C、2D所示缺氧组侵袭到Transwell小室下表面的细胞数与常氧组相比明显减少(P<0.05), 分别为(43.50±3.75)、(76.50±5.42)。
|
图 2 缺氧(1%O2)抑制滋养细胞HTR8/SVneo的侵袭及小管形成能力 A: Tube formation法检测缺氧组与常氧组HTR8/SVneo细胞网格形成数(×200);B: HTR8/SVneo细胞网格形成数的定量(×200);C: Transwell小室检测缺氧组与常氧组HTR8/SVneo细胞的侵袭能力;D: HTR8/SVneo细胞侵袭数的定量, *P<0.05 |
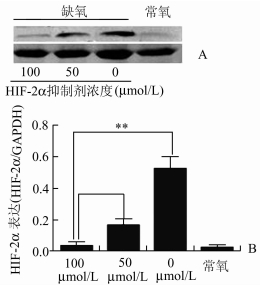
缺氧条件下(1%O2,24 h)不同浓度HIF-2α抑制剂抑制处理HTR8/SVneo细胞,Western Blot检测显示用浓度为50 μmol/L和100 μmol/L的HIF-2α抑制剂抑制处理,HTR8/SVneo细胞HIF-2α蛋白的表达分别平均下调了60%(P<0.01)和90%(P<0.01)(图 3)。
|
图 3 HIF-2α抑制剂抑制HTR8/SVneo细胞在缺氧条件下HIF-2α的表达 A: Western Blot检测HTR8/SVneo细胞HIF-2α蛋白的表达; B: Western Blot相对定量,**P<0.01 |
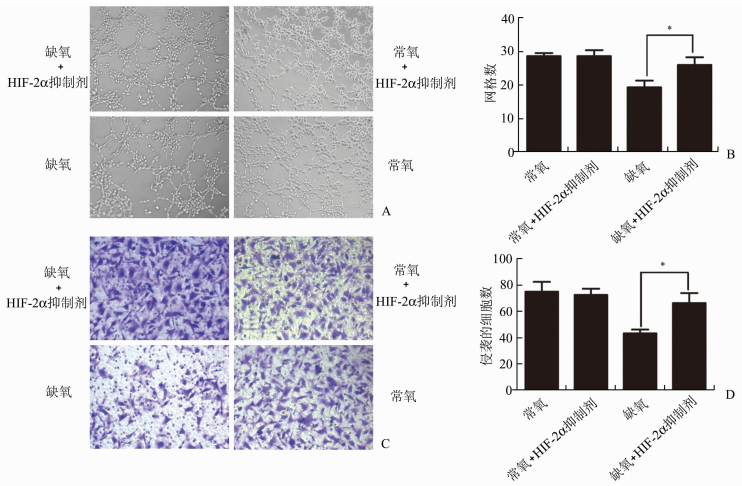
常氧及缺氧条件下(1%O2,24 h)使用100 μmol/L的HIF-2α抑制剂检测HIF-2α被抑制前后HTR8/SVneo细胞侵袭及血管形成能力的变化。如图 4A、4B所示,缺氧+HIF-2α抑制剂组基质胶上网格形成数与单纯缺氧组相比明显增高(P<0.05),分别为(25.00±1.08)、(19.25±1.49);常氧条件下HIF-2α抑制剂对基质胶上网格形成数无显著影响(P>0.05),分别为(27.92±0.53)、(29.43±1.09)。如图 4C、4D所示缺氧+HIF-2α抑制剂组侵袭到Transwell小室下表面的细胞数与单纯缺氧组相比明显增高(P<0.05), 分别为(70.50±6.71)、(42.00±3.24);常氧条件下HIF-2α抑制剂对滋养细胞侵袭数无显著影响(P>0.05),分别为(76.36±7.21)、(75.67±4.32)。
|
图 4 缺氧条件下HIF-2α抑制剂增强HTR8/SVneo细胞侵袭及成管能力 A: Tube formation法检测HTR8/SVneo细胞网格形成数(×200);B: HTR8/SVneo细胞网格形成数的定量;C: Transwell小室检测滋养细胞HTR8/SVneo的侵袭能力(×200);D: HTR8/SVneo细胞侵袭数的定量, *P<0.05 |
为了探索缺氧条件下HIF-2α调节滋养细胞功能的信号通路,我们检测两个与HIF-2α相关的细胞因子ARRDC3及PPARγ。图 5所示,Western Blot显示常氧条件下,HIF-2α抑制剂抑制使用前后ARRDC3的表达分别为(2.50±0.29)%、(2.67±0.73)%, 差异无统计学意义(P>0.05);PPARγ的表达分别为(10.02±1.29)%、(9.27±1.59)%,差异无统计学意义(P>0.05)。缺氧(1%O2)条件下,HIF-2α抑制剂抑制使用前后ARRDC3的表达分别为(22.07±3.22)%、(7.21±1.72)%, 差异有显著统计学意义(P<0.01);PPARγ的表达分别为(33.23±1.20)%、(12.53±1.43)%,差异有显著统计学意义(P<0.01)。
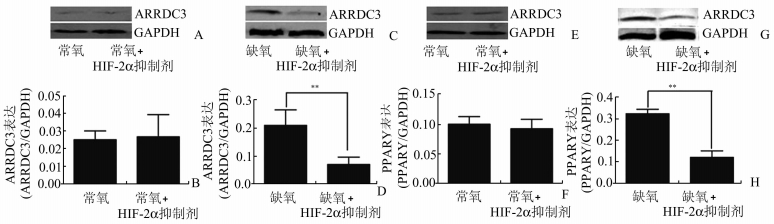
|
图 5 缺氧条件下HIF-2α抑制剂抑制HTR8/SVneo细胞ARRDC3和PPARγ的表达 A-B:常氧条件下Western Blot检测ARRDC3的表达及Western Blot相对定量,P>0.05;C-D:缺氧条件下Western Blot检测ARRDC3的表达及Western Blot相对定量,**P<0.01;E-F:常氧条件下Western Blot检测PPARγ的表达及Western Blot相对定量,P>0.05;G-H:缺氧条件下Western Blot检测PPARγ的表达及Western Blot相对定量。**P<0.01 |
缺氧是指导滋养细胞侵袭及血管重铸的关键信号,上皮表型滋养细胞向侵袭性表型绒毛外滋养细胞及血管内皮黏附性表型绒毛外滋养细胞转换受氧张力的调控,持续异常的低氧环境很可能抑制滋养细胞侵袭并造成螺旋动脉的重铸失败,引发子痫前期的发生。有研究表明[13]虽然绒毛外滋养细胞的增殖依赖于妊娠早期的低氧环境,但在较高的氧气张力下绒毛外滋养细胞才能分化成侵袭性表型。在体外细胞实验中缺氧抑制滋养细胞侵袭能力[14]。缺氧复氧模拟子痫前期体外细胞模型实验表明滋养细胞血管形成能力下降[15],然而,缺氧造成滋养细胞侵袭及血管形成能力下降的机制尚不明确。
有研究表明,与正常孕妇相比,子痫前期孕妇胎盘中HIF-2α蛋白表达显著升高[9, 16],Jadoon等人发现缺氧诱导BeWo细胞高表达的HIF-2α通过上调脂肪酸转运体的表达参与子痫前期的发病[17],这些发现提示了HIF-2α在缺氧与子痫前期发病之间的潜在作用。然而HIF-2α对滋养细胞功能的影响尚不清楚,我们通过构建滋养细胞缺氧模型,发现缺氧诱导HTR8/SVneo细胞HIF-2α的表达并抑制HTR8/SVneo细胞侵袭及血管形成,在缺氧条件下抑制HIF-2α的表达能显著改善缺氧对滋养细胞侵袭及血管形成的抑制。尽管有很多研究证实了HIF-2α在肿瘤细胞侵袭及血管形成调控中的重要作用[8, 18],但我们的研究首次证实了在缺氧条件下HIF-2α参与了滋养细胞侵袭及血管形成的调控。
为了初步探索HIF-2α参与滋养细胞侵袭及血管形成调控的信号通路,我们验证了与HIF-2α相关的两个信号分子ARRDC3及PPARγ的表达。ARRDC3及PPARγ被鉴定为HIF-2α调节微血管内皮细胞血管形成的靶基因[19], 在血管内皮细胞血管形成过程中具有调控作用。ARRDC3被证实参与肿瘤细胞侵袭的调控[20],过去数十年的研究表明滋养细胞和肿瘤细胞在增殖、迁移及侵袭等细胞功能上有惊人的相似性,在本研究中,缺氧条件下HIF-2α抑制剂显著抑制滋养细胞ARRDC3的表达,我们有理由推断ARRDC3可能参与到缺氧条件下HIF-2α介导的滋养细胞侵袭和血管调控的信号通路。利用PROMO数据库我们发现了ARRDC3启动子区域有PPARγ的结合位点,OKa等人的研究证实PPARγ诱导ARRDC3的表达[21]。PPARγ参与子痫前期及胎儿宫内生长发育受限的发病[4]。McCarthy等人的研究表明用PPAR-γ拮抗剂处理的大鼠表现出血管形成因子和血管形成拮抗因子的表达失调[22]。在我们的研究中,滋养细胞PPARγ的表达被HIF-2α抑制剂抑制,这表明PPAR-γ也可能参与到缺氧条件下HIF-2α介导的滋养细胞侵袭和血管调控的信号通路。由于实验条件的限制,HIF-2α、ARRDC3及PPARγ之间具体调控机制的研究没有进一步进行,有待于后续实验深入研究。
我们的研究首次发现缺氧通过诱导HIF-2α的表达抑制滋养细胞侵袭及血管形成能力,并证实了该过程涉及HIF-2α-PPARγ-ARRDC3的表达调控。研究结果为子痫前期发病机制的研究提供了新线索。
| [1] | Jim B, Karumanchi SA. Preeclampsia: pathogenesis, prevention, and long-term complications[J]. Semin Nephrol, 2017, 37(4): 386-397. DOI: 10.1016/j.semnephrol.2017.05.011. |
| [2] | Ngene NC, Moodley J. Role of angiogenic factors in the pathogenesis and management of pre-eclampsia[J]. Int J Gynaecol Obstet, 2018, 141(1): 5-13. DOI: 10.1002/ijgo.2018.141.issue-1. |
| [3] | Lai Z, Kalkunte S, Sharma S. A critical role of interleukin-10 in modulating hypoxia-induced preeclampsia-like disease in mice[J]. Hypertension, 2011, 57(3): 505-514. DOI: 10.1161/HYPERTENSIONAHA.110.163329. |
| [4] | Tache V, Ciric A, Moretto-Zita M, et al. Hypoxia and trophoblast differentiation: a key role for PPAR gamma[J]. Stem Cells Dev, 2013, 22(21): 2. |
| [5] | Fang M, Du H, Han B, et al. Hypoxia-inducible microRNA-218 inhibits trophoblast invasion by targeting LASP1: Implications for preeclampsia development[J]. Int J Biochem Cell Biol, 2017, 87: 95-103. DOI: 10.1016/j.biocel.2017.04.005. |
| [6] | Ahmed A, Dunk C, Ahmad S, et al. Regulation of placental vascular endothelial growth factor (VEGF) and placenta growth factor (PIGF) and soluble Flt-1 by oxygen-a review[J]. Placenta, 2000, 21(Suppl A): S16-S24. |
| [7] | Aban C, Martinez N, Carou C, et al. Endocannabinoids participate in placental apoptosis induced by hypoxia inducible factor-1[J]. Apoptosis, 2016, 21(10): 1 094-1 105. DOI: 10.1007/s10495-016-1274-x. |
| [8] | Zhang Q, Lou Y, Zhang J, et al. Hypoxia-inducible factor-2alpha promotes tumor progression and has crosstalk with Wnt/beta-catenin signaling in pancreatic cancer[J]. Mol Cancer, 2017, 16(1): 119. DOI: 10.1186/s12943-017-0689-5. |
| [9] | Rajakumar A, Whitelock KA, Weissfeld LA, et al. Selective overexpression of the hypoxia-inducible transcription factor, HIF-2alpha, in placentas from women with preeclampsia[J]. Biol Reprod, 2001, 64(2): 499-506. DOI: 10.1093/biolreprod/64.2.499. |
| [10] | Hnasko TS, Hnasko RM. The Western Blot[J]. Methods Mol Biol, 2015, 1 318: 87-86. |
| [11] | Gu Y, Shi Y, Yang Q, et al. miR-3074-5p Promotes the apoptosis but inhibits the invasiveness of human extravillous trophoblast-derived HTR8/SVneo cells in vitro[J]. Reprod Sci, 2018, 25(5): 690-699. DOI: 10.1177/1933719117725823. |
| [12] | Basak S, Sarkar A, Mathapati S, et al. Cellular growth and tube formation of HTR8/SVneo trophoblast: effects of exogenously added fatty acid-binding protein-4 and its inhibitor[J]. Mol Cell Biochem, 2018, 437(1-2): 55-64. DOI: 10.1007/s11010-017-3095-9. |
| [13] | Zhou Y, Fisher SJ, Janatpour M, et al. Human cytotrophoblasts adopt a vascular phenotype as they dif- ferentiate. A strategy for successful endovascular invasion[J]. ? J Clin Invest, 1997, 99(9): 2139-2151. DOI: 10.1172/JCI119387. |
| [14] | Zheng Y, Zhao Y, Luo Q, et al. Edaravone protects against cobalt chloride-induced dysfunctions in apoptosis and invasion in trophoblast cells[J]. Mol Reprod Dev, 2016, 83(7): 576-587. DOI: 10.1002/mrd.22652. |
| [15] | Shan N, Zhang X, Xiao X, et al. Laminin alpha4 (LAMA4) expression promotes trophoblast cell invasion, migration, and angiogenesis, and is lowered in preeclamptic placentas[J]. Placenta, 2015, 36(8): 809-820. DOI: 10.1016/j.placenta.2015.04.008. |
| [16] | Liu W, Wang SJ, Lin QD. Study on the expressions of PHD and HIF in placentas from normal pregnant women and patients with preeclampsia[J]. Int J Biol Sci, 2014, 10(3): 278-284. DOI: 10.7150/ijbs.6375. |
| [17] | Jadoon A, Cunningham P, Mcdermott LC. Regulation of fatty acid binding proteins by hypoxia inducible factors 1alpha and 2alpha in the placenta: relevance to pre-eclampsia[J]. Prostaglandins Leukot Essent Fatty Acids, 2015, 93: 25-29. DOI: 10.1016/j.plefa.2014.09.004. |
| [18] | Li NA, Wang H, Zhang J, et al. Knockdown of hypoxia inducible factor-2alpha inhibits cell invasion via the downregulation of MMP-2 expression in breast cancer cells[J]. Oncol Lett, 2016, 11(6): 3 743-3 748. DOI: 10.3892/ol.2016.4471. |
| [19] | Nauta TD, van den Broek M, Gibbs S, et al. Identification of HIF-2alpha-regulated genes that play a role in human microvascular endothelial sprouting during prolonged hypoxia in vitro[J]. Angiogenesis, 2017, 20(1): 39-54. DOI: 10.1007/s10456-016-9527-4. |
| [20] | Arakaki AKS, Pan WA, Lin H, et al. The a-arrestin ARRDC3 suppresses breast carcinoma invasion by re- gulating G protein-coupled receptor lysosomal sorting and signaling[J]. J Biol Chem, 2018, 293(9): 3 350-3 362. DOI: 10.1074/jbc.RA117.001516. |
| [21] | Oka S, Masutani H, Liu W, et al. Thioredoxin-bin- ding protein-2-like inducible membrane protein is a novel vitamin D3 and peroxisome proliferator-activated receptor (PPAR)gamma ligand target protein that regulates PPARgamma signaling[J]. Endocrinology, 2006, 147(2): 733-743. DOI: 10.1210/en.2005-0679. |
| [22] | McCarthy FP, Drewlo S, English FA, et al. Evidence implicating peroxisome proliferator-activated receptor-gamma in the pathogenesis of preeclampsia[J]. Hypertension, 2011, 58(5): 882-887. DOI: 10.1161/HYPERTENSIONAHA.111.179440. |
 2018, Vol. 39
2018, Vol. 39


