慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以气流受限为特征的疾病, 气流受限不完全可逆,呈进行性发展, 与肺部对有害气体或颗粒产生的异常炎症反应有关。在全世界, COPD是一种严重危害人类身体健康的呼吸系统慢性常见病、多发病,目前居死亡原因的第4位[1]。根据WTO发表的研究, 至2020年COPD将成为世界疾病经济负担的第5位[2]。其发病机制至今尚不明确,吸烟是COPD的最主要危险因素[3],但近年来越来越多的研究显示CD4+T细胞介导的自身免疫应答可能是COPD的发病的重要机制[4],CD4+T细胞通过活化能分化为不同的效应性T细胞亚群,其中辅助性T细胞17(Th17)通过分泌白细胞介素(IL)-17、IL-22等促炎症因子从而介导自身免疫应答,与实验性自身免疫性脑炎(EAE)、系统性红斑狼疮(SLE)、类风湿性关节炎(RA)等自身免疫性疾病的发病密切相关[5]。调节性T细胞(Treg)通过分泌IL-10等抑炎因子抑制效应T细胞的活化增殖达到免疫耐受的作用,Th17/Treg细胞之间平衡作用维持免疫稳态和抑制自身免疫应答的发生上发挥着关键的作用。本研究通过检测COPD患者和健康对照组外周血中Th17和Treg细胞及其相关细胞因子的表达,探究Th17/Treg平衡在COPD发病过程中的作用。
1 材料与方法 1.1 临床资料收集2015年6-12月在武汉大学人民医院呼吸内科住院就诊的COPD患者及体检中心体检人群,慢性阻塞性肺疾病急性加重期患者(AECOPD组)25例,纳入标准:①符合中华医学会呼吸病学分会2013年修订版《慢性阻塞性肺疾病诊治指南(修订版)》[6];②年龄50-80岁; ③有急性加重表现:气促加重、痰量增加、痰变脓性。慢性阻塞性肺疾病稳定期患者(SCOPD组)21例,纳入标准:符合上述标准①②,近3月年无急性加重病史,排除标准:①合并其他肺部疾病(肺结核、支气管扩张、肺间质纤维化等); ②有其他系统疾病或恶性肿瘤; ③有风湿系统疾病或自身免疫功能缺陷。健康吸烟者(HS)17例、健康非吸烟者(NHS组)16例作为对照,均来源于我院健康医护人员或健康体检者,所有对象均签署受试者知情同意书,本研究通过医院伦理委员会批准。
1.2 主要仪器和试剂CytoFLEX流式细胞仪(美国Beckman Coulter公司),Bio-Plex悬浮芯片系统(美国Bio-Rad公司),抗人CD3-FITC单克隆抗体、抗人CD4-PE/Cy7单克隆抗体、抗人IL-17A-PE单克隆抗体、抗人CD25-PE单克隆抗体、抗人FOXP3-AF647、Cell Activation Cocktail、莫能菌素、胞内标记所需破膜固定试剂盒、莫能菌素均购自美国Biolegend公司,人淋巴细胞分离液(北京达科为公司),Bio-Plex试剂盒(美国Bio-Rad公司)。
1.3 研究方法 1.3.1 外周血标本收集和PBMC的分离受试者抽取清晨空腹静脉血5 ml置EDTA抗凝管中,300 g离心3 min,收集上清液1 ml置于-80 ℃冻存待Bio-plex检测,在离心后的全血中加入PBS等比稀释,无菌离心管中加入4 ml淋巴细胞分离液,并将稀释的血液平铺在液面上,800 g离心15 min,收集白膜层的细胞,加10 ml PBS稀释,500 g离心5 min,收集离心细胞,重悬于3 ml RPMI 1640制成外周血单个核细胞(PBMC)悬液,调整细胞浓度为2×106个/ml,用于流式细胞术检测。
1.3.2 Th17细胞和Treg细胞的检测取PBMC悬液1 ml加入6孔细胞培养板,每孔加入1 ml RPMI 1640培养液,2 μl Cell Activation Cocktail和1 μl Monensin(2 μg/ml),混匀后放入37 ℃,5%CO2培养箱中刺激培养5 h,加入PBS洗涤,离心弃上清,重悬细胞取100 μl置于流式上样管中,加入5 μl抗人CD3-FITC抗体和抗人CD4-PE/Cy7抗体,避光孵育30 min,洗涤离心弃上清后加1 ml固定剂,混匀后室温避光孵育30 min, 加入破膜剂2 ml, 加入抗人IL-17A-PE抗体,避光孵育30 min,用PBS洗涤弃上清,上机检测,应用流式细胞仪配套的Flowjo软件获取并分析10 000个细胞,Th17细胞以CD3+CD4+IL-17A+T细胞占CD4+T细胞的百分比表示Th17细胞比值。PBMC中加入5 μl抗人CD4-PE/Cy7抗体和抗人CD25-PE抗体,破膜固定后加入alexa fluor 647标记的FOXP3抗体,上机检测,应用流式细胞仪配套的Flowjo软件获取并分析10 000个细胞,Treg细胞以CD4+CD25+FOXP3+ T细胞占CD4+T细胞的百分比表示Treg细胞比值。
1.3.3 细胞因子的检测采用Bio-Plex悬液芯片技术检测各组血清中的细胞因子IL-1β, IL-6, IL-10, IL-17A的水平,实验步骤严格按照试剂盒说明书操作。
1.4 统计学处理采用SPSS 22.0软件进行数据分析,计量资料用平均值±标准差表示,组间比较采用方差分析,两两比较采用非参数秩和检验,相关性分析采用Pearson分析,P<0.05表示差异具有统计学意义。
2 结果 2.1 各组的一般资料和肺功能比较NHS组、HS组、SCOPD组和AECOPD组年龄、性别构及吸烟指数差异无统计学差异(P>0.05),AECOPD组与SCOPD组之间第1秒用力呼气容积(FEV1)/预计值、FEV1/FVC差异有统计学意义(P<0.01),HS组较NHS组FEV1/预计值、FEV1/FVC有所下降,但仍处于正常范围,且两者之间差异无统计学意义(P>0.05)。
| 表 1 研究对象的一般资料和肺功能比较(x±s) |
AECOPD组、SCOPD组外周血CD4+细胞中Th17细胞比例明显高于NHS组和HS组,同时AECOPD组外周血Th17细胞比例高于SCOPD组,差异有统计学意义(P<0.01,图 1和表 2), 与NHS组相比,AECOPD组、SCOPD组外周血CD4+细胞中Treg细胞比例有明显下降,且AECOPD组Treg细胞比例明显低于SCOPD组,差异有统计学意义(P<0.01,图 2和表 2),AECOPD组、SCOPD组Th17/Treg比值明显高于NHS组以及HS组,差异有统计学意义(P<0.01,表 2),HS组Treg细胞比例和Th17/Treg比值较NHS组略有上升,差异无统计学意义(P>0.05,表 2)。

|
图 1 各组中外周血Th17细胞表达流式图 |
| 表 2 各组间Th17细胞与Treg细胞表达率的比较(x±s) |
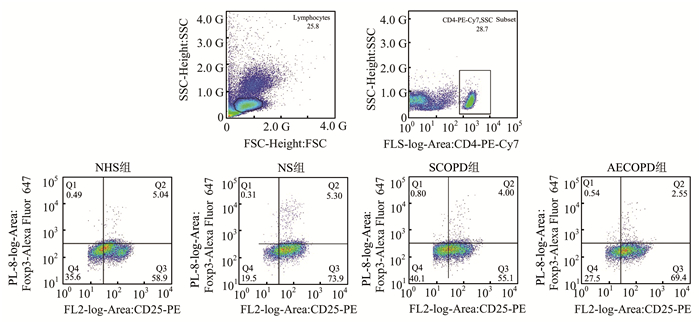
|
图 2 各组外周血中Treg细胞表达流式图 |
AECOPD组、SCOPD组患者血清中IL-1β、IL-6、IL-17A表达水平均明显高于NHS组和HS组(P均 < 0.01), 且AECOPD组均比SCOPD组明显增高(P均 < 0.05),然而与NHS组和HS组相比,SCOPD组和AECOPD组患者血清中IL-10表达水平明显降低(P均 < 0.01),且AECOPD组较SCOPD组有所下降(P<0.05),见表 3。
| 表 3 各组间IL-1β、IL-6、IL-10、IL-17A、TNF-α水平的比较(pg/ml, x±s) |
SCOPD组、AECOPD组中Th17比例与Treg细胞比例呈负相关(r分别为-0.770、-0.788,均P<0.01),在NHS组、HS组中未见明显相关性,SCOPD组Th17/Treg比值与FEV1/预计值、FEV1/FVC呈负相关(r分别为-0.815、-0.763,均P<0.05)。
3 讨论长期以来COPD的发病机制研究局限在慢性气道炎症方面,近年来研究[7]发现,自身免疫所介导的炎症反应可能在COPD的起病和疾病进展中起着重要作用,香烟烟雾刺激可引起气道上皮细胞的损伤,损伤的上皮细胞被巨噬细胞等吞噬,当这种吞噬作用不足时有可能出现抗原改变成为自身抗原,从而引起一系列的自身免疫反应,导致气道的炎症损伤。中性粒细胞、CD4+T细胞、CD8+T细胞、巨噬细胞等参与了这一过程,其中Th17细胞是近年来新发现的一种CD4+淋巴细胞亚群,主要产生IL-17、IL-22等细胞因子,诱导中性粒细胞聚集从而发挥抗炎作用。有研究[8]发现COPD稳定期患者外周血和中Th17细胞比例高于吸烟者和正常对照者, 并与FEV1/预计值(%)和FEV1/FVC(%)负相关, 并随着气流受限的进一步加重, Th17细胞的数量也有所增加, 与本研究结果基本一致。Wang[9]等在动物试验中发现,慢性烟熏刺激下的小鼠体内IL-17含量明显升高, 肺组织上皮细胞大量分泌IL-6、IL-8、G-CSF、MCP-1等炎性介质,引起类似于COPD的慢性炎症反应,而在IL-17RA基因敲除的小鼠体内,后者CD4+淋巴细胞、巨噬细胞、中性粒细胞的浸润、肺气肿的程度明显轻于前者。这提示Th17细胞在吸烟所致的肺气肿的免疫应答中有着重要作用。
Tregs是一群具有免疫抑制性的T细胞亚群, 能抑制效应性T细胞的过度增殖、激活以及自身免疫应答,从而维持机体的免疫平衡。目前关于Treg细胞表达与COPD关系存在争议,Barcelo[10]等研究表明发现COPD轻、中度患者外周血Treg细胞比例较健康人群显著降低; 较早研究发现COPD稳定期COPD患者支气管肺泡灌洗液中Treg细胞数量增加,各项研究的结论不相一致,可能一方面与所选研究对象的病情轻重及分期不同有关,另一方面也与流式检测Treg细胞的染色方法有关。由于CD25分子在活化的CD4+T细胞中的表达上调,仅以CD4+CD25+细胞代表Treg细胞存在一定局限性,特别是在机体炎症反应加剧、大量T细胞增殖与活化的情况下,CD4+CD25+细胞中有nTreg、Tr1、Th等亚型,其中nTreg亚型主要产生免疫抑制效应。为克服这一局限,本研究同时胞外染色CD4、CD25及胞内染色nTreg细胞特异性转录因子Foxp3,并将CD4+CD25+Foxp3+细胞定义为Treg细胞, 本研究结果发现,COPD急性加重期患者外周血Treg细胞水平明显低于稳定期COPD患者,这提示Treg细胞在AECOPD患者体内受到抑制,肺部炎症反应无法得到有效控制,导致病情进一步加重,而且稳定期COPD患者Treg细胞水平较正常人偏低,与Barcelo等研究结果相一致,说明尽管病情处于缓解期,但患者体内Treg细胞已经出现失衡,比正常人更容易发生肺部炎症反应。
研究报道在类风湿关节炎、狼疮性肾炎[11]等自身免疫病中存在Th17/Treg失衡,但在COPD中是否也存在这种失衡尚不明确,本研究结果显示Th17比例与Treg细胞比例在COPD患者中呈负相关,在对照组中无这种相关性,COPD缓解期组Th17/Treg比值与FEV1/预计值、FEV1/FVC亦呈负相关,提示COPD患者体内存在Th17/Treg细胞免疫失衡,且这种失衡与COPD患者的肺功能下降情况有所相关,本研究中COPD患者外周血中炎症因子IL-1β、IL-6水平明显增高,抗炎性细胞因子IL-10的水平有所降低,CD4+T细胞在IL-1β、IL-6作用下分化发育为Th17细胞,进一步分泌IL-17、IL-22等细胞因子介导炎症反应,导致患者呼吸道的慢性炎症长期持续存在,进一步导致气道重塑[12],引起持续气流受限,最终导致肺功能的进行性损害。
综上所述,COPD患者外周血中Th17细胞、IL-17A水平明显上升,Treg细胞、IL-10水平有所下降,Th17、Treg之间的平衡失调,可能参与了COPD的发病和急性加重过程,本研究为COPD发病机制和其免疫改变提供了理论依据,也对COPD新的治疗方案和疗效评价的制定有一定的指导意义。
| [1] | Ford ES, Croft JB, Mannino DM, et al. COPD surveillance-United States, 1999-2011[J]. Chest, 2013, 144(1): 284-305. DOI: 10.1378/chest.13-0809. |
| [2] | Vestbo J, Hurd SS, Agustí AG, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease GOLD executive summary[J]. Am J Respir Crit Care Med, 2013, 187(4): 347-365. DOI: 10.1164/rccm.201204-0596PP. |
| [3] | Agusti A, Edwards LD, Celli B, et al. Characteristics, stability and outcomes of the 2011 GOLD COPD groups in the ECLIPSE cohort[J]. Eur Respir J, 2013, 42(3): 636-646. DOI: 10.1183/09031936.00195212. |
| [4] | Yang JF, Sundrud MS, Skepner J, et al. Targeting Th17 cells in autoimmune diseases[J]. Trends Pharmacol Sci, 2014, 35(10): 493-500. DOI: 10.1016/j.tips.2014.07.006. |
| [5] | Korn T, Bettelli E, Oukka M, et al. IL-17 and Th17 cells[J]. Annu Rev Immunol, 2009, 27: 485-517. DOI: 10.1146/annurev.immunol.021908.132710. |
| [6] |
中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺病诊治指南(2013年修订版)[J].
中华结核呼吸杂志, 2013, 36(4): 255-264.
Chronic obstructive pulmonary disease group of the Chinese Medical Association for respira tory diseases. Guidelines for the diagnosis and treatment of chronic obstructive pulmonary disease (Revised Edition 2013)[J]. Chinese Journal of Tuberculosis and Respiration, 2013, 36(4): 255-264. |
| [7] | Weaver CT, Elson CO, Fouser LA, et al. The Th17 pathway and inflammatory diseases of the intestines, lungs, and skin[J]. Annu Rev Pathol, 2013, 8: 477-512. DOI: 10.1146/annurev-pathol-011110-130318. |
| [8] | Profita M, Albano GD, Riccobono L, et al. Increased levels of Th17 cells are associated with non-neuronal acetylcholine in COPD patients[J]. Immunobiology, 2014, 219(5): 392-401. DOI: 10.1016/j.imbio.2014.01.004. |
| [9] | Wang HY, Peng WD, Weng YS, et al. Imbalance of Th17/Treg cells in mice with chronic cigarette smoke exposure[J]. Int Immunopharmacol, 2012, 14(4): 504-512. DOI: 10.1016/j.intimp.2012.09.011. |
| [10] | Barcelo B, Pons J, Ferrer JM, et al. Phenotypic characterisation of T-lymphocytes in COPD: abnormal CD4+CD25+ regulatory T-lymphocyte response to tobacco smoking[J]. Eur Respir J, 2008, 31(3): 555-562. DOI: 10.1183/09031936.00010407. |
| [11] | Chang Y, Nadigel J, Boulais N, et al. CD8 positive T cells express IL-17 in patients with chronic obstructive pulmonary disease[J]. Respiratory Research, 2011, 12: 43. DOI: 10.1186/1465-9921-12-43. |
| [12] | Eustace A, Smyth LJC, Mitchell L, et al. Identification of cells expressing IL-17A and IL-17F in the lungs of patients with COPD[J]. Chest, 2011, 139(5): 1 089-1 100. DOI: 10.1378/chest.10-0779. |
 2018, Vol. 39
2018, Vol. 39


