糖尿病是一种内分泌系统的代谢性疾病,是一种难以治愈的慢性疾病,引起的急慢性并发症对于患者的预后及生活质量均有着较大的影响,其发病机制和胰岛素抵抗、胰岛β细胞的损伤和凋亡等有关[1, 2]。过氧化物酶体增殖物激活受体α(PPARα)是一种依赖配体活化的转录因子,也是调节脂肪代谢的关键转录因子,并且能够参与调节炎症反应过程,在糖脂代谢和细胞凋亡的过程中起着重要作用。内质网作为蛋白质合成和能量代谢的场所,可以通过调节自身容量来适应环境中的能量代谢过程,因而其稳态与应激和糖脂代谢紊乱的发生有密切关联。蛇床子素是一种具有生物活性的香豆素化合物,广泛存在于伞形科植物蛇床子和独活等当中,研究证实蛇床子素具有降血脂、抗氧化、抗炎、清除自由基以及抗肿瘤的作用[3-5],且已有动物实验证明蛇床子素能够降低小鼠的血糖[6],但尚未发现有关蛇床子素对于胰岛β细胞作用的研究。本实验通过棕榈酸(palmitic acid, PA)诱导胰岛β细胞凋亡,研究蛇床子素是否能发挥其保护作用,探讨其可能的保护机制,为将来的临床研究提供依据。
1 材料与方法 1.1 实验材料小鼠胰岛β细胞株NIT-1,由本实验室保存。棕榈酸试剂(PA,Sigma公司),AnnexinV-FITC细胞凋亡试剂盒(碧云天公司),蛇床子素(购自成都德思特生物公司)、RT-PCR试剂盒(日本Tara公司)。PA溶于无水乙醇中,并加入小牛血清白蛋白(BSA),其中无水乙醇与BSA比例为1:9,配制成50 mmol/L储存液,4 ℃保存;蛇床子素溶于DMSO及无水乙醇按照1:1配成的溶液中,配成40.93 mmol/L的母液,-20 ℃保存。
1.2 实验方法 1.2.1 小鼠胰岛β细胞NIT-1细胞培养复苏NIT-l细胞,加入到含10%胎牛血清的DMEM高糖培养基中,置于37 ℃、5%CO2温箱中培养,隔日换液,每日观察细胞,待其生长至70%-80%单层融合,用0.25%胰酶-0.02%EDTA消化传代。
1.2.2 MTT法筛选蛇床子素浓度NIT-1细胞按每孔5 000个细胞接种于96孔板中,37 ℃,5%CO2条件下培养24 h后分别加入0.5, 1.25, 2.5, 5, 10, 20, 40 μmol/L浓度的蛇床子素,分别培养24, 48, 72 h后,换成每孔加入180 μl无血清的培养基和20 μl的MTT试剂培养2 h,后吸除培养基加入150 μl的DMSO试剂,置于摇床上摇晃10 min,然后置于酶标仪内,测定490 nm处的吸光度(OD)值。实验重复3遍,每次设定5个复孔。
1.2.3 细胞分组及处理将细胞分为正常处理组(高糖DMEM培养基,正常细胞空白对照)、PA处理凋亡细胞组(高糖DMEM培养基,加50 mmol/L的PA)、PA处理+蛇床子素组(高糖DMEM培养基,加50 mmol/L的PA,加5 μmol/L的蛇床子素)。
1.2.4 流式细胞仪检测细胞凋亡率按AnnexinV-FITC细胞凋亡试剂盒说明书的步骤,收集各组的细胞悬液,用预冷的PBS洗涤并重悬细胞后,再依次加入AnnexinV-FITC和碘化丙啶(PI),充分混匀,避光孵育15-20 min,上机检测各组细胞凋亡率。
1.2.5 RT-PCR检测各组细胞中PPARα、UCP-2、CHOP、GRP78 mRNA的表达采用Redzol总RNA抽提试剂盒提取RNA,逆转录成cDNA后进行RT-PCR。引物序列:CHOP为F 5′-CCAACAGAGGTCACACGCACATC-3′,R 5′-TCGTTCTCCTGCTCCTTCTCCTTC-3′;GRP78为F 5′-AG CGACAAGCAACCAAAGAT-3′,R 5′-CCCAGGTCAAACACAAGGAT-3′;UCP-2为F 5′-GGCTGGAGGTGGTCGGAGATAC-3′,R 5′-CAGCACAGTTGACAATGGCATTACG-3′;PPAR-α为F 5′-CTTCACGATGCTGTCCTCCTTGATG-3′;R 5′-GATGTCACAGAACGGCTTCCTCAG-3′。β-actin为F 5′-TCTACAATGAGCTGCGTGTG-3′,R 5′-GGTGAGGATCTTCATGAGGT-3′。依据试剂盒说明使用两步法扩增,反应条件为,95 ℃预变性30 s,95 ℃变性5 s,退火温度分别为55 ℃(PPARα及β-actin),56 ℃(CHOP),57 ℃(UCP-2及GRP78)退火30 s,循环40次。数据处理采用相对定量(2-△△CT)法,分别计算各组目的基因的相对含量,其中△△CT=(CT目的基因-CT内参基因)实验组-(CT目的基因-CT内参基因)对照组。
1.2.6 Western Blot检测各组细胞中Caspase3、Bax、Bcl-2、eIF2α、p-eIF2α蛋白的表达抽提总蛋白,每孔上样约40 μg,常规SDS-PAGE电泳转膜后,5%脱脂奶粉封闭1 h,分别加入一抗4 ℃摇床过夜,浓度为Caspase3(1:1 000)、Bax(1:2 000)、Bcl-2(1:500)、eIF2a(1:1 000)、p-eIF2a(1:500)。缓冲溶液TBST漂洗3次后加入HRP标记的山羊抗兔二抗(1:10 000)室温下孵育30 min,TBST洗4遍,每次5 min,ECL显影曝光,用A1phaEase FC软件分析蛋白的相对表达量。
1.3 统计学方法采用SPSS 22.0软件进行统计学分析,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验,以P < 0.05为差异有统计学意义。
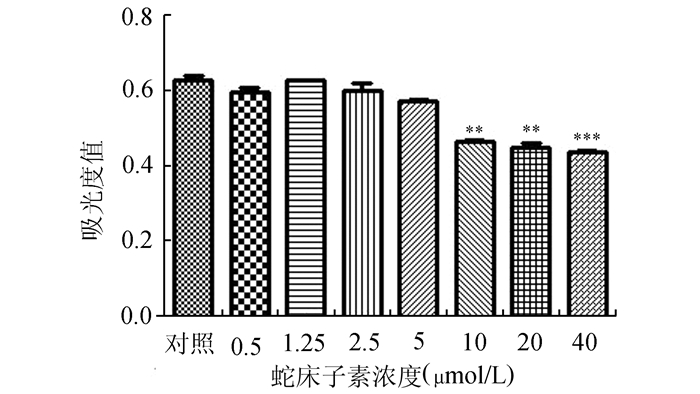
2 结果 2.1 蛇床子浓度筛查使用不同浓度的蛇床子素处理NIT-1细胞3 d,通过MTT法来检测每个孔细胞的吸光度值。结果:用不同浓度的蛇床子素处理NIT-1细胞,在0-5 μmol/L范围内蛇床子素对于细胞增殖无明显影响,而>5 μmol/L时蛇床子素可明显抑制细胞的增殖(P < 0.05)。故本实验选择使用5 μmol/L的蛇床子素来作为后续的实验浓度来处理细胞(图 1)。
|
图 1 蛇床子素对于NIT-1细胞增殖的影响 与对照组比较,**P < 0.01, ***为P < 0.001 |
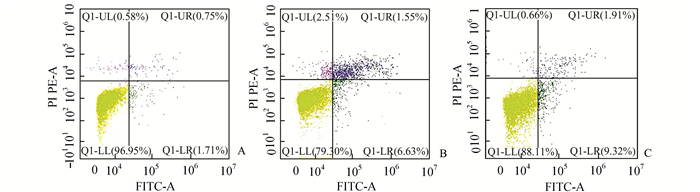
0.5 mmol/L的PA能够引起NIT-1细胞损伤,增加NIT-1细胞的凋亡率,结果以早凋和晚凋细胞之和表示,可以看出,PA组细胞的凋亡率明显高于空白组,分别为(2.5±0.4)%(P < 0.01)和(18.2±1.0)%(P < 0.01);而PA+蛇床子素组的凋亡率明显低于PA组,分别为(11.2±0.8)%(P < 0.01)和(18.2±1.0)%(P < 0.01) (图 2)。
|
图 2 流式细胞仪检测细胞凋亡结果 A:正常细胞组; B: PA处理组; C: PA+蛇床子素组 |
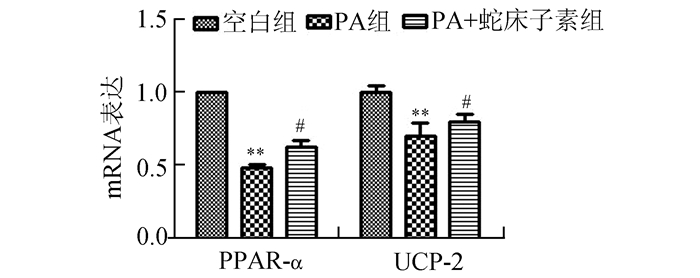
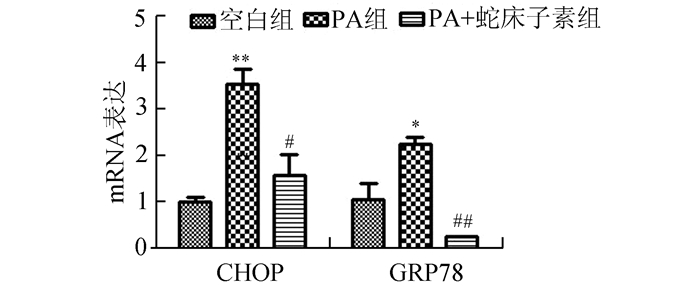
在NIT-1的细胞中,PA可以引起PPARα、UCP-2 mRNA表达量的下调,而在加入蛇床子素的由PA诱导凋亡的细胞中,PPARα、UCP-2的表达量较PA组明显增加(图 3)。内质网应激相关基因的表达方面,PA诱导凋亡组细胞的CHOP、GRP78 mRNA表达明显较空白组增加,而蛇床子素+PA组CHOP、GRP78 mRNA的表达则明显较PA组减少(图 4)。
|
图 3 PPARα和UCP2 mRNA的表达情况 与空白组比较,**P < 0.01;与PA组比较,#P < 0.05 |
|
图 4 CHOP和GRP78 mRNA表达情况 与空白组比较,*P < 0.05,**P < 0.01;与PA组比较,#P < 0.05,##P < 0.01 |
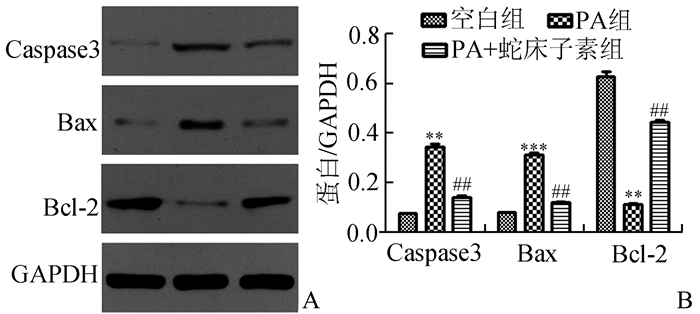
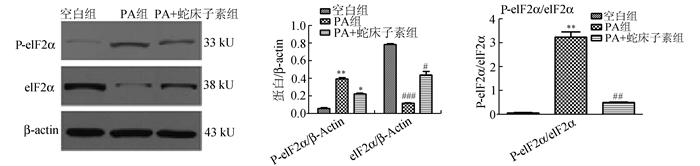
与空白组相比,PA组NIT-1细胞Caspase3、Bax蛋白表达高于正常组(P < 0.05),而PA+蛇床子素组这些蛋白的表达则较PA组明显下降(P < 0.05);PA组Bcl-2蛋白表达低于正常组(P < 0.05),而PA+蛇床子素组表达则高于PA组(P < 0.05)(图 5)。另外,对于eIF-2α蛋白,PA诱导可以增加其磷酸化水平(P < 0.05),而与之相比,再加入蛇床子素则可以明显降低其磷酸化水平(P < 0.05)(图 6)。
|
图 5 蛇床子素对Caspase3、Bax、Bcl-2蛋白表达的影响 A: Western Blot结果;B:相对表达量比较:与空白组比较,**P < 0.01,***P < 0.001;与PA组比较,##P < 0.01 |
|
图 6 蛇床子素对内质网应激相关蛋白表达的影响 A: Western Blot结果;B、C:相对表达量比较:与空白组比较,**P < 0.01,*P < 0.05;与PA组比较,#P < 0.05, ##P < 0.01, ###P < 0.001 |
胰岛β细胞的损伤及凋亡是糖尿病的重要发病机制之一[7],也是糖尿病治疗研究的方向之一。除先天性胰岛β细胞功能的缺陷外,还有多种因素如氧化应激、糖毒性、脂毒性、内质网应激等都引起细胞内环境紊乱以致β细胞的损伤,甚至诱发β细胞的凋亡。NIT-1细胞与正常胰岛β细胞的生理状态较为接近,可以很好地模拟β细胞的病理生理[8]。
本实验加入0.5 mmol/L的PA诱导NIT-1细胞凋亡,流式细胞术及Western Blot结果均证实其能引起NIT-1细胞明显凋亡,因而可以使用PA诱导NIT-1细胞凋亡进行后续实验。
蛇床子素化学名为7-甲氧基-8-异戊烯基香豆素,是一种具有生物活性的香豆素化合物,广泛存在于伞形科植物蛇床的成熟果实蛇床子和独活等当中,已证实其具有降血脂、抗氧化、抗炎、清除自由基、降糖、抗肿瘤的作用。本实验中,流式细胞术结果表明蛇床子素可以降低因棕榈酸损伤细胞引起的细胞凋亡,并且蛇床子素+PA组的抗凋亡蛋白Bcl-2的表达高于PA组,凋亡相关蛋白Bax、Caspase3的表达则较PA组降低,说明蛇床子素对于PA诱导凋亡的NIT-1细胞的损伤具有保护作用。
PPARα是一种经典的转录调节因子,主要通过结合PPAR反应元件来调节基因的表达,在糖脂质代谢方面起着重要的作用。有研究表明PPARα可以通过加速胰岛β细胞脂质的β氧化,以减少脂质沉积,以改善胰岛素抵抗[9],促进外周组织对血糖的分解利用或者糖原的生成,以降低血糖。也有研究发现,PPARα可以通过上调解偶联蛋白2(UCP-2)的表达,减少线粒体活性氧的产生来起到抗凋亡氧化的作用[10]。本实验中PA组诱导凋亡的细胞的PPARα和UCP-2 mRNA的表达比空白对照组的细胞低,而蛇床子素预处理则使得二者的表达明显地升高,而且经过多次多组细胞的实验数据的对比,我们发现PPARα和UCP-2的mRNA表达的增减趋势存在一定的同步性,说明蛇床子素对NIT-1细胞起到的保护作用和PPARα mRNA的表达上调有关,推测PPARα一方面减少胞内脂质沉积来改善脂毒性对细胞的影响,另一方面通过上调UCP-2的表达,以减少线粒体活性氧的产生来减少β细胞的凋亡。
内质网应激是指内质网在蛋白合成过程中,大量的错误折叠蛋白或未折叠蛋白在内质网腔内积聚,引起急性应激反应以及钙离子代谢平衡紊乱。内质网应激可以激活CHOP介导的凋亡通路,也可以通过减少eIF2α磷酸化以及上调分子伴侣GRP78的表达来修复错误或者未折叠的蛋白质产生保护作用。本实验中PA诱导的细胞凋亡可以使得CHOP和GRP78 mRNA的表达增加,增加eIF2α磷酸化水平,说明PA处理可以诱发内质网应激的发生,而在蛇床子素预处理组,CHOP mRNA和GRP78 mRNA表达以及eIF2α蛋白的磷酸化水平均降低,解释为蛇床子素可以保护细胞,抑制内质网应激的发生,说明蛇床子素的抗凋亡作用与其抑制内质网应激导致的细胞凋亡反应的发生有关。
综上所述,蛇床子素能减少棕榈酸诱导的NIT-1细胞的凋亡率,能降低凋亡蛋白Bax、Caspase3的表达,提高抗凋亡蛋白Bcl-2的表达,抑制细胞的凋亡,这个过程的作用机制可能与PPARα和内质网应激通路有关。
| [1] | Thomsen SK, Gloyn AL. The pancreatic β cell: recent insights from human genetics[J]. Trends Endocrinol and Metab, 2014, 25(8): 425-434. DOI: 10.1016/j.tem.2014.05.001. |
| [2] | Pirot P, Cardozo AK, Eizirik DL. Mediators and mechanisms of panceatic β-cell death in the type l diabetes[J]. Arq Bras Endocrinol Metabol, 2008, 52: 156-165. DOI: 10.1590/S0004-27302008000200003. |
| [3] | Sun F, Xie ML, Zhu LJ, et al. Inhibitory effect of osthole on alcohol induced fatty liver in mice[J]. Dig Liver Dis, 2009, 41(2): 127-133. DOI: 10.1016/j.dld.2008.01.011. |
| [4] |
刘建新, 张文平, 周俐, 等. 蛇床子素对大鼠的抗炎作用和机制[J].
中药材, 2005, 28(11): 1002-1006.
Liu JX, Zhang WP, Zhou L, et al. Anti-inflammatory effect and mechanism of osthole in rats[J]. Journal of Chinese Medicinal Materials, 2005, 28(11): 1002-1006. DOI: 10.3321/j.issn:1001-4454.2005.11.016. |
| [5] | Zimecki M, Artym J, Cisowski W, et al. Immunomodulatory and anti-inflammatory activity of selected osthole derivatives[J]. Z Naturforsch C, 2009, 64(5-6): 361-368. DOI: 10.1515/znc-2009-5-610. |
| [6] | Liang HJ, Suk FM, Wang CK, et al. Osthole, a potential antidiabetic agent, alleviates hyperglycemia in db/db mice[J]. Chemico-Biological Interactions, 2009, 181(3): 309-315. DOI: 10.1016/j.cbi.2009.08.003. |
| [7] | Piero M, Silvia DG, Lorella M, et al. Pancreatic islets from type2 diabetic patients have functional defects and increased apoptosis that are ameliorated by metformin[J]. J Clin Endocrinol Metab, 2004, 89(11): 5535-5541. DOI: 10.1210/jc.2004-0150. |
| [8] |
刘文军, 陆付耳, 董慧, 等. 小檗碱对高糖高脂诱导的NIT-1胰岛β细胞凋亡的影响[J].
中国病理生理杂志, 2008, 24(4): 788-791.
Liu WJ, Lu FE, Dong H, et al. Effects of berberine on the apoptosis of NIT-1 cells induced by high glucose and saturated fatty acids[J]. Chinese Journal of Pathophysiology, 2008, 24(4): 788-791. DOI: 10.3321/j.issn:1000-4718.2008.04.035. |
| [9] | Ravnskjaer K, Boergesen M, Rubi B, et al. Pemxisome prolifemtors activated receptor α (PPARα) potentiates, whereas PPARγ attenuates glucose stimulated insulin secretion in paIlcreatic β cells[J]. Endocrinology, 2005, 146: 3266-3276. DOI: 10.1210/en.2004-1430. |
| [10] | Patizrson AD, Shah YM, Matsubara T, et al. PPARα-dependent induction of uncoupling protein 2 protects against acetaminophen-induced liver toxicity[J]. Hepatology (Baltimore, Md), 2012, 56(1): 281-290. DOI: 10.1002/hep.25645. |
 2018, Vol. 39
2018, Vol. 39


