2. 中南大学湘雅三医院/卫生部移植医学工程技术研究中心 湖南 长沙 410013
2. The 3rd Xiangya Hospital of Central South University, & Research Center of National Health Ministry on Transplantation Medicine Engineering and Technology, Changsha 410013, China
噬血细胞综合征(haemophagocytic syndrome,HPS)又称为噬血细胞性淋巴组织细胞增多症(haemophagocytic lymphohistiocytosis,HLH),是一种免疫介导的危及生命的罕见疾病,由自然杀伤细胞和细胞毒性T细胞功能失调引起,1939年首次被描述,在欧美国家每年每百万人口仅1-10人发病。HPS可以发生在任何年龄,但大多数临床指南、前瞻性研究和临床试验都集中在儿科患者,近年来报道成人HPS的发生率约为40%[1]。HPS根据病因分为原发性和继发性,继发性原因中主要分为病毒感染相关、自身免疫相关或瘤形成相关,潜在的遗传缺陷在儿童HPS的发生发展中起主要作用,而感染和药物是成人HPS发生的主要外在因素[2]。肝移植术后并发HPS多半因病毒、细菌、真菌等感染所致。且大多数肝移植患者由于终末期肝病影响,机体一般情况较差,术后在重症监护室恢复期长,又大量使用免疫抑制剂,加上各种侵入性操作等因素,发生各种感染的风险明显增加。临床上,该综合征主要表现为发热、肝脾肿大、血细胞减少以及造血器官中巨噬细胞活化等,常常不易鉴别,以致临床管理较为复杂,常需要重症监护、免疫抑制治疗、生物治疗,以及造血干细胞移植治疗,对这些综合征的了解不足可能导致患者预后不良,早期诊断对于及时启动适当的治疗和改善患者的生存率及生活质量至关重要[3]。
1 病例介绍 1.1 病例特点51岁男性患者;因“乏力、黄疸1月余”入院;既往有银屑病史27年余,在服中药治疗(具体不详),有乙肝小三阳病史18年余,未行抗乙肝治疗,18年前曾因车祸出现左侧锁骨骨折行锁骨固定术,无高血压、糖尿病、肺气肿等病史,无肺结核等传染病史,无药物及食物过敏史;入院体检:体温36.3 ℃,脉搏76次/min,呼吸20次/min,血压120/66 mmHg,神清,精神可,全身皮肤及巩膜黄染,全身皮肤有皮疹及脱皮,以腹部及四肢居多,未见明显出血点及瘀斑,未见肝掌、蜘蛛痣。浅表淋巴结无肿大。双肺呼吸音清,未闻及明显干湿啰音,听诊心音正常,心率76次/min,律齐,各瓣膜区未闻及明显病理性杂音。腹软,无压痛及反跳痛,肝肋下未及,脾脏肋下5 cm,Murphy征阴性,移动性浊音阴性。肠鸣音正常,双下肢无水肿。门诊及院外辅助检查结果:① 2015年4月21日于上海长海医院行CT提示:考虑脂肪肝、肝硬化、脾肿大伴腹水;双下肺炎伴右侧胸腔少量积液。② 2015年4月25日于上海长海医院检查提示:戊型肝炎病毒抗体IgM阳性;戊型肝炎病毒性抗体IgG阳性;甲胎蛋白27.61 ng/ml;肝胆彩超提示:慢性肝炎,胆囊炎。③ 2015年5月5日于上海长海医院行肝脏MR平扫+增强提示:肝硬化,少量腹水;肝内多发小囊肿;胆囊炎改变;凝血功能提示:凝血酶原时间35.7 s;凝血酶原时间国际比值3.7;活化部分凝血活酶时间74.5 s;肝功能提示:总胆红素692.5 μmol/L,直接胆红素471.1 μmol/L,间接胆红素221.4 μmol/L。
1.2 入院诊断慢加急性重症肝炎;肝硬化;肝功能衰竭;乙型病毒性肝炎;戊型肝炎;脾大;腹水;银屑病。
1.3 治疗经过入院后完善肝移植术前相关检查,无明确手术禁忌证,给予人纤维蛋白原改善凝血功能及一般状况,入院后第9天在全麻下行同种异体肝移植术,手术方式为原位肝移植,无肝期80 min。抗排斥治疗方案仅包括甲泼尼龙冲击治疗,术中500 mg,术后第1天60 mg/6 h,术后第2天50 mg/6 h,术后第3天40 mg/6 h,术后第4天30 mg/6 h,术后第5天开始20 mg/d, 维持10 d。患者术后持续高热,血压低,胸片提示双肺感染,血压低,需用升压药维持,血培养示革兰阳性球菌感染,应用万古霉素+伏立康唑+复方磺胺甲恶唑三联抗感染治疗,患者病情无明显好转,且有骨髓抑制表现,全血细胞减少,白细胞1.55×109/L,红细胞2.51×1012/L,血小板44×109/L,经全院会诊讨论,将抗感染治疗方案调整为替加环素+头孢哌酮钠舒巴坦钠,加强静脉营养支持,并行骨髓穿刺,骨穿结果提示患者粒细胞缺乏,巨核细胞受抑制,且髓象呈噬血现象(图 1)。且患者查血示甘油三酯增高至1.99 mmol/L,铁蛋白显著升高,至1 919.32 ng/ml,而NK细胞的百分比处于正常低值,为9.17%。根据2004年国际组织细胞协会[4]制定的HLH指南以及2009年美国血液病学会[5]修改的新诊断标准,患者可以诊断为HLH。于是在积极抗感染治疗的同时,予以大剂量静脉注射人免疫球蛋白、胸腺肽α1,并行升白细胞治疗,加强静脉营养支持,并使用低剂量甲泼尼龙(40 mg,2次/d)连续冲击治疗,他克莫司2 mg/d抗排斥治疗,后患者痰培养又提示鲍曼不动杆菌及铜绿假单胞菌,根据药敏结果调整抗生素使用。最终患者血培养和痰培养均转阴,在长达4个月的住院期后,患者感染治愈,一般情况均好转后出院。
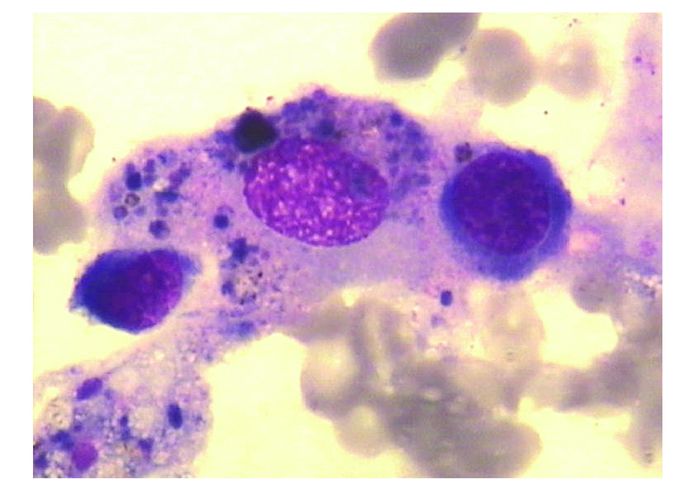
|
图 1 骨髓涂片(Wright-Giemsa×1 000) 显示活化的巨噬细胞吞噬红细胞,Wright-Giemsa为瑞氏-吉姆萨复合染色 |
患者现肝移植术后2年余,健康存活,无后遗症。
2 讨论首例继发性HPS是Risdall等报道的,他们描述了患有活动性病毒感染的患者的病例,其骨髓显示出伴有嗜血性细胞增多的组织细胞增生,并提出HLH是“病毒相关的血噬细胞综合征[6]。然而,继发性HPS不仅与病毒有关,它与细菌、结核杆菌、真菌和寄生虫等感染均可能相关。与感染相关的HPS称为感染相关性HPS(infection-associated HPS,IAHS)。尽管HPS最常见的病因是病毒,但是我们的病例中的病原体被认为是细菌,尽管乙型肝炎病毒和丙型肝炎病毒也可能有影响,即使在病肝去除后,也不能排除远期肝炎病毒HCC触发HPS的可能性。
HPS被定义为骨髓、脾脏或淋巴结中吞噬巨噬细胞的增殖,临床表现主要为≥7 d的发热,峰值≥38.5 ℃,血细胞减少(三系中至少两系)和脾肿大等。因此,HPS的诊断是基于临床和病理学的。在病理生理学方面,急性期通常会有淋巴组织细胞浸润,最常见于脾脏、淋巴结和骨髓,此外,体循环中的T细胞细胞因子和单核因子水平升高,自然杀伤细胞和细胞毒性T细胞无法有效地终止免疫应答,导致淋巴细胞和巨噬细胞的持续活化,结果是广泛的噬血现象和细胞因子如干扰素-γ,肿瘤坏死因子α,白细胞介素-1和白介素-6的过度产生[7]。
在更好地了解到T淋巴细胞和巨噬细胞在HPS中的可能作用后,使用环孢菌素、类固醇和依托泊苷联合治疗成为了非移植术后HPS的确定治疗方法。Henzan等人的研究表明,抗细胞因子疗法联合英夫利昔单抗治疗对传统治疗无反应的HPS患者可能是一个新的选择[8]。尽管有报道针对难治性病例进行了化疗及骨髓或干细胞移植,这些疗法从未用于肝移植后HPS,治疗继发性HPS的根本措施是解决其原发病及高细胞因子状态,只有当病原体的感染受到控制时,才能实现IAHS的临床缓解。
有报道表明粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)可用于治疗HPS,因为它不仅影响粒细胞系,而且还影响其他系,同样静注人免疫球蛋白(immunoglobulin therapy,IVIg)也可以改善HPS的预后。基于前人的成功经验,Karasu等建议采用G-CSF和IVIg联合治疗肝移植患者术后HPS[9]。
目前对于肝移植术后并发HPS的病例报告较少,介绍了数种治疗方法,但是报告内患者总体存活率非常低,因此,迫切需要在非移植术后HPS患者已有治疗方案的基础上作调整,为肝移植术后并发HPS的患者建立特定的治疗策略。肝移植术后的患者常因各种原因引起血小板减少,如病毒感染、药物和其他因素,尽管全血细胞减少的原因往往是模糊的,但是如果肝移植术后患者发热并发现有血小板减少,则应尽快进行骨髓穿刺,以排除HPS,以改善患者的预后及总体存活率。
| [1] | Ramos-Casals M, Brito-Zerón P, López-Guillermo A, et al. Adult haemophagocytic syndrome[J]. The Lancet, 2014, 383: 1503-1516. DOI: 10.1016/S0140-6736(13)61048-X. |
| [2] | Weitzman S. Approach to hemophagocytic syndromes[J]. Hematology Am Soc Hematol Educ Program, 2011, 2011: 178-183. |
| [3] | Bode SF, Ammann S, Al-Herz W, et al. The syndrome of hemophagocytic lymphohistiocytosis in primary immunodeficiencies: implications for differential diagnosis and pathogenesis[J]. Haematologica, 2015, 100: 978-988. |
| [4] | Henter JI, Horne A, Arico M, et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis[J]. Pediatr Blood Cancer, 2007, 48: 124-131. DOI: 10.1002/(ISSN)1545-5017. |
| [5] | Filipovich AH. Hemophagocytic lymphohistiocytosis (HLH) and related disorders[J]. Hematology Am Soc Hematol Educ Program, 2009, 2009: 127-131. |
| [6] | Risdall RJ, McKenna RW, Nesbit ME, et al. Virus-associated hemophagocytic syndrome: a benign histiocytic proliferation distinct from malignant histiocytosis[J]. Cancer, 1979, 44: 993-1002. DOI: 10.1002/(ISSN)1097-0142. |
| [7] | Soyama A, Eguchi S, Takatsuki M, et al. Hemophagocytic syndrome after liver transplantation: report of two cases[J]. Surg Today, 2011, 41: 1524-1530. DOI: 10.1007/s00595-010-4512-9. |
| [8] | Henzan T, Nagafuji K, Tsukamoto H, et al. Success with infliximab in treating refractory hemophagocytic lymphohistiocytosis[J]. Am J Hematol, 2006, 81: 59-61. DOI: 10.1002/(ISSN)1096-8652. |
| [9] | Karasu Z, Kilic M, Cagirgan S, et al. Hemophagocytic syndrome after living-related liver transplantation[J]. Transplant Proc, 2003, 35: 1482-1484. DOI: 10.1016/S0041-1345(03)00511-6. |
 2017, Vol. 38
2017, Vol. 38


