阿尔茨海默病(Alzheimer’s disease,AD)是一种多因素导致的起病隐匿、进行性发展的中枢神经系统退行性疾病,以认知功能衰退、行为异常和日常生活能力下降为主要病理表现。β淀粉样蛋白(Aβ)斑块沉积[1]和tau蛋白高度磷酸化形成的配对螺旋样纤维[2]是导致AD发病的主要原因。据统计,目前全球痴呆患者大约有5 000万人,而AD占其总数的60%~70%,是痴呆中最常见的一种类型[3]。随着年龄的增长,AD的发病率也逐步上升,65岁以后,AD发病率增加1倍,预计到2050年全球AD患者将达到1亿人左右[4],这将给家庭和社会带来沉重的负担。有关AD防治策略的研究一直被医学界视为需重点攻克的世界性难题。然而,现有临床药物对其治疗效果并不明显,且具有较强的副作用。
运动作为一种可干预AD的非药物手段,已受到越来越多人的关注。大量临床试验[5-7]表明,运动可明显改善AD患者的认知功能。Sampaio等[8]通过对30例AD患者进行12周的运动训练,发现相对于不运动的对照组,运动组的认知功能明显提高。Holthoff等[9]对30例AD患者实施3个月的运动干预,结果显示运动可有效改善AD患者的学习和记忆能力。Hernandez等[10]的一项研究也表明,身体活动对改善AD患者的认知功能具有积极作用。但也有一些研究并未观察到运动干预对AD患者认知功能的积极作用。Cott等[11]通过对AD患者进行16周的有氧运动训练,发现运动并未明显改善AD患者的认知功能。Hoffmann等[12]让190名AD患者做中、高强度有氧运动后,并未观察到运动组的认知功能较对照组有明显提高。Miu等[13]对52名AD患者进行12周的运动训练,发现运动对认知功能的改善无积极作用。因此,关于运动对AD患者认知功能的干预效果急需更具说服力的分析和评价。
先前虽有人已开展相关的meta分析,如:Rao等[14]研究发现,有氧运动和力量训练可有效缓解AD患者病情发展,提高其认知能力;Panza等[15]的研究表明,运动可延缓AD患者和AD风险人群认知功能的下降,且有氧运动可能是最有效的运动防治方法;Du等[16]的研究结果显示,运动干预可缓解AD患者的认知功能下降。但这些meta分析的研究对象均包含了各种类型的痴呆,并非单纯的AD患者,且对认知功能的检测手段也不一致,其结果的准确性受到影响。鉴于目前关于运动对AD患者认知功能的防治效果和方案仍不够明确、具体,且简易智力状态检查量表(mini⁃mental state examination,MMSE)测评是结果可靠且采用最广泛的认知功能检测手段之一[15],本文通过对接受运动干预的AD患者认知功能的MMSE得分进行meta分析,评价运动对AD患者认知功能的总体影响,并在此基础上,通过分析不同类型和频率运动对AD患者认知功能的影响,探讨运动干预AD的最佳防治方案,从而为运动防治AD的理论和实践提供参考。
1 资料与方法 1.1 文献检索策略中文检索数据库包括中国知网、万方数据和重庆维普数据库,检索关键词包括“运动”“训练”“阿尔茨海默病患者”和“认知”等。外文检索数据库包括SCI、PubMed、MEDLINE,检索关键词为“exercise”“training”“physical activity”“walk”“Alzheimer”和“cognition”等,检索年限均为建库至2018年12月。
1.2 文献纳入与剔除标准纳入标准:①文献研究类型为随机对照试验;②研究对象为确诊的AD患者;③运动干预类型为有氧运动或有氧与无氧结合运动;④对AD患者认知功能的检测方式为MMSE测评。
剔除标准:①综述类文章;②研究对象为痴呆类型不确定、血管性痴呆、多发梗塞性痴呆、混合性痴呆、中度认知障碍患者,老年人及其他非AD的痴呆患者;③干预方式包括认知、音乐等非单纯运动的训练方式;④对AD患者认知功能检测方式为阿尔茨海默病评估量表(Alzheimer’s disease assessment scale⁃cognition,ADAS⁃cog)、认知功能快速评分量表(rapid evaluations of cognitive functions,ERFC)、蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)测评,画钟测验(clock drawing test,CDT),霍普金斯词语学习测验(Hopkins verbal learning test,HVLT),符号-数字模式测验(symbol⁃digit modalities test,SDMT),剑桥自动化成套神经心理测验(Cambridge neuropsychological test automatic battery,CANTAB),连线测验(trail making test,TMT)及样本匹配(matching sample)等非MMSE检测手段;⑥数据未给出具体数值;⑦动物试验。
1.3 资料与数据提取资料提取和输入由评价者独立完成,排除明显不符合标准的研究,对可能符合纳入标准的文献进行全文阅读,以确定是否符合纳入标准。文献资料采用自制表格收集,资料信息包括作者、发表年份、研究对象的总数、干预组和对照组样本量、痴呆类型、男性百分比、基线MMSE、年龄、运动干预类型、运动频率、干预时间、测量方法、干预组和对照组认知功能得分、结论等。
1.4 试验组和对照组的运动干预方式及认知功能的评定方法运动干预方式分为有氧运动、有氧和无氧结合运动。根据世界卫生组织的规定,将每周体育活动时间150 min作为区分高、低频率体育活动的标准。每周体育活动时间高于150 min为高频率,低于150 min为低频率。若文献中缺少研究所需的数据,则通过计算获得,认知功能的测量统一采用MMSE。
1.5 统计分析运用RevMan 5.3软件对纳入的文献结局指标进行meta分析,计量资料以合并值均数差(mean difference,MD)及其95%置信区间(confidence interval,CI)表示,干预效果以平均值±标准差(mean±SD)表示。用I2统计量进行各研究间异质性检验,当I2≤50%时,表明各同类研究间无异质性,选取固定效应模型(fixed effect model)进行合并统计分析。当I2˃50%时,表明研究间存在异质性,需对异质性来源进行分析,通过亚组或敏感性分析对异质性来源进行分析处理以减少异质性,使合并的资料达到同质后再用固定效应模型分析。若经上述处理发现异质性仍比较大,可采用随机效应模型(random effect model)进行分析。运用Stata软件进行Egger检验,以及发表偏倚的影响分析。运用RevMan 5.3软件绘制漏斗图,如无发表偏倚,整个图形应是一个对称倒置的漏斗形,如存在发表偏倚,散点图的分布可能是不对称或歪斜的。
2 结果 2.1 文献检索结果初步检索获取文献4 523篇,其中英文文献3 392篇(1 166篇为SCI收录期刊论文,1 467篇为MEDLINE收录论文,759篇为PubMed收录论文),中文文献1 131篇(来自中国知网325篇、万方数据489篇、重庆维普317篇)。剔除重复发表文献2 250篇,在阅读文题和摘要以及区分文献类型基础上剔除2 242篇,在阅读全文基础上再排除16篇,最终纳入文献15篇(图 1)。纳入文献发表年份为2010—2017年,获得样本774例(干预组388例,对照组386例)。这15篇文献的AD患者平均年龄为70.55~84.05岁,基线MMSE为15.3~23.95分,纳入文献的研究对象样本量为16~190例,运动类型为单纯有氧运动(11篇文献)或有氧与无氧结合运动(4篇文献)。干预时间为12~24周,低频率运动为90~120 min/周,高频率运动为180~270 min/周。认知功能检测手段均为MMSE。文献的基本特征如表 1所示。
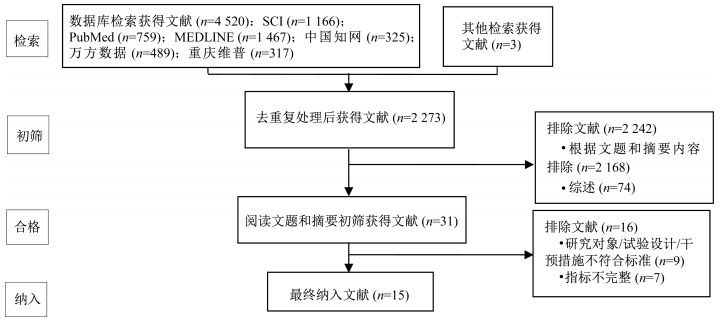
|
| 图 1 文献筛选流程 Figure 1 Flow diagram of literature search |
| 表 1 纳入文献基本特征 Table 1 Basic features of included literature |
采用Jadad等制定的量表对纳入文献进行评价,根据随机、盲法、失访与退出情况打分(0~5分)。1~2分为得分较低的文献,3~5分为得分较高的文献。在本文纳入的文献中,Jadad评分较高的文献有9篇,得分较低者有6篇。
2.3 发表偏倚分析将运动对AD患者认知功能的干预效果绘制成漏斗图(图 2),其图形较为对称;然后进行Egger检验(表 2),P=0.066>0.05,结果提示无明显发表偏倚。
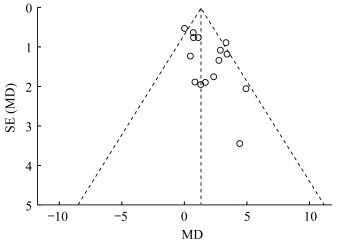
|
| 图 2 发表偏倚漏斗图 Figure 2 Funnel plot of publication bias |
| 表 2 Egger检验结果 Table 2 Egger inspection result |
15篇文献共选取774例受试者,比较运动对AD患者认知功能干预的总体效果。异质性检验结果显示,I2=41%,P=0.05,提示不存在异质性,故采用固定效应模型进行meta分析。合并效应量[MD=1.27,95%CI(0.77,1.78),P˂0.000 01]。森林图(图 3)显示,运动对AD患者认知功能影响MD的95%CI横线落在无效线右侧。结果显示,运动对AD患者认知功能的总体效果试验组优于对照组。
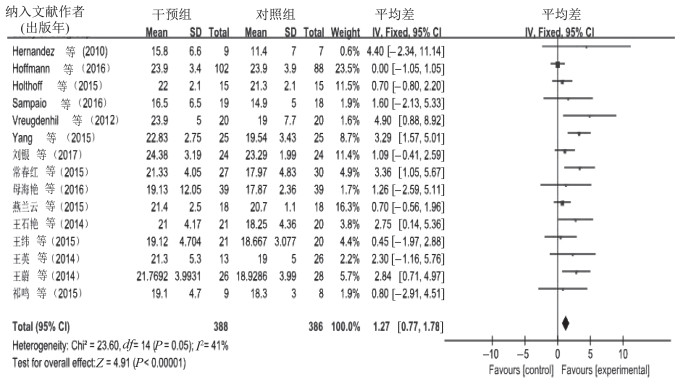
|
| 图 3 运动对AD患者认知功能总体影响的meta分析 Figure 3 Meta analysis of the overall effect of exercise on cognitive function in AD |
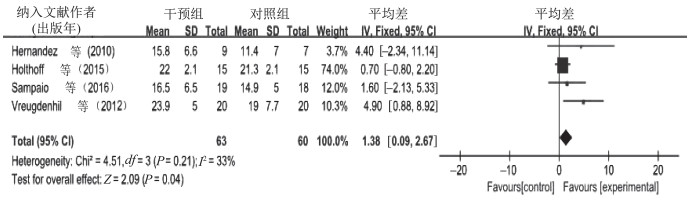
11篇文献共选取了651例受试者,比较有氧运动对AD患者认知功能的影响,I2=48%,P=0.04,提示不存在异质性,故采用固定效应模型进行meta分析。合并效应量[MD=1.26,95%CI(0.70,1.81),P˂0.000 01]。森林图(图 4)显示,运动对AD患者认知功能影响MD的95%CI横线落在无效线右侧。结果显示,有氧运动对AD患者认知功能的影响试验组优于对照组。4篇文献共选取123例受试者,比较有氧与无氧结合运动对AD患者认知功能的影响,I2=33%,P=0.21,提示不存在异质性,故采用固定效应模型进行meta分析。合并效应量[MD=1.38,95%CI(0.09,2.67),P=0.04]。森林图(图 5)显示,有氧与无氧结合运动对AD患者认知功能影响MD的95%CI横线落在无效线右侧。结果显示,有氧与无氧结合运动对AD患者认知功能的影响试验组优于对照组。经比较,有氧与无氧结合运动对AD患者认知功能的干预效果优于单纯的有氧运动。
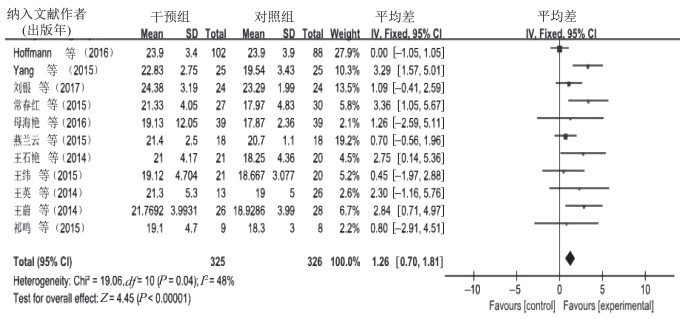
|
| 图 4 有氧运动对AD患者认知功能影响的meta分析 Figure 4 Meta analysis of the effect of aerobic exercise on cognitive function in AD |
|
| 图 5 有氧与无氧结合运动对AD患者认知功能影响的meta分析 Figure 5 Meta analysis of the effect of combined exercise on cognitive function in AD |
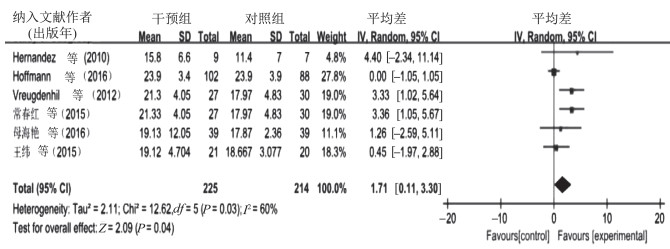
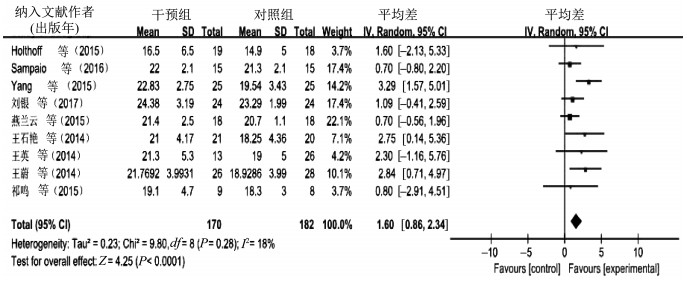
6篇文献共选取了439例受试者,比较高频率运动对AD患者认知功能的影响,I2=60%,P=0.03,提示存在异质性,故采用随机效应模型进行meta分析,合并效应量[MD=1.71,95%CI(0.11,3.30),P=0.04]。森林图(图 6)显示,运动对AD患者认知功能影响MD的95%CI横线落在无效线右侧。结果显示,高频率运动对AD患者认知功能的影响试验组优于对照组。9篇文献共选取了352例受试者,比较低频率运动对AD患者认知功能的影响,I2=18%,P=0.28,提示不存在异质性,但为便于比较此处也采用随机效应模型进行meta分析,合并效应量[MD=1.60,95%CI(0.86,2.34),P<0.000 1]。森林图(图 7)显示,低频率运动对AD患者认知功能影响MD的95%CI横线落在无效线右侧。结果显示,低频率运动对AD患者认知功能的影响试验组优于对照组。经比较,高频率运动对AD患者认知功能的干预效果优于低频率运动。
|
| 图 6 高频率运动对AD患者认知功能影响的meta分析 Figure 6 Meta analysis of the effect of high-frequency exercise on cognitive function in AD |
|
| 图 7 低频率运动对AD患者认知功能影响的meta分析 Figure 7 Meta analysis of the effect of low-frequency exercise on cognitive function in AD |
本文对AD患者认知功能运动干预效果进行meta分析,结果显示,运动对AD患者认知功能影响总体是有益的,且这种有益效果与运动类型、频率有一定关系。有氧与无氧结合运动对AD患者认知功能影响优于单纯的有氧运动,高频率运动对AD患者认知功能影响优于低频率运动。
运动作为一种防治AD的非药物手段,其改善AD患者认知功能的生物学机制已得到大量临床和动物试验证明。运动可促进脑血循环和脑血流量重新分配,通过提高酶和促炎细胞因子活性增强抗氧化作用[28];运动可通过增加血管内皮生长因子、脑源性神经营养因子、神经生长因子表达和降低Aβ斑块的聚集,促进神经再生和突触发生,进而改善涉及认知的大脑结构和神经回路[29-31]等;运动还可通过降低tau蛋白聚集、增加大脑海马前额、颞叶皮质区灰质和白质体积[32],提高学习记忆和认知功能。
有氧运动对AD患者认知功能改善具有明显作用,它可提高最大摄氧量,促进血液循环,增加大脑抗氧化酶活性,减少自由基产生,从而降低氧化应激水平,并促进Aβ降解、神经发生和血管生成[30, 33]等。然而,本文结果显示,有氧与无氧结合运动对AD患者认知功能干预效果优于单纯的有氧运动,这与先前2项meta分析[34-35]结果相一致,其机制可能是无氧运动在前者干预方式中发挥了独特作用。有研究表明,人体内血脂组分含量改变和同型半胱氨酸浓度升高可能是导致AD患者认知功能下降的重要原因[36-37],而适宜的无氧运动可有效降低人体内血脂异常的风险和同型半胱氨酸的浓度[38-39],从而缓解AD病理进程。也有研究表明,AD发病率与AD患者肌肉力量成反比[40],肌肉力量越强的受试者其AD发病率越低,认知功能水平越高[41],而无氧运动有利于避免因久坐的生活方式而导致的身体机能衰退,并改善心血管健康状况,增加肌肉力量和体积,从而提高AD患者认知功能。
本文结果显示,高频率运动对AD患者认知功能干预作用优于低频率运动,而高频率运动对AD患者认知功能改善作用更佳,可能与其运动频率较高带来的运动量增加有关。有研究结果显示,在一定范围内,运动量越大,对痴呆患者认知功能改善作用越明显。有研究[42]表明,脑组织的供血不足致使神经元代谢下降是导致痴呆的一个重要原因,且脑血流量降低度与痴呆的严重程度成正比。运动可增大微动脉管径,加快微动静脉血流速度,增加组织器官的血流量,从而改善痴呆患者认知功能,且这种有益效果在一定范围内与运动量呈正相关[43]。另一项研究[44]也表明,运动可有效改善大脑海马CA3区神经细胞病理特征,增加其正常细胞数量,且相对于低、中运动量,高运动量对脑组织海马CA3区神经细胞病理改变作用更明显,相同面积内正常细胞数目更多。Yaffe等[45]通过对5 295名65岁以上老年人进行超过8 a的跟踪调查,发现运动频率越高的人其认知功能下降的可能性越小。
本文结果有与先前研究结果不一致的地方。一项关于运动对AD患者认知功能影响的meta分析结果[15]表明,单纯的有氧运动对AD患者认知功能影响优于有氧与无氧结合运动;而另一项关于运动对痴呆患者认知功能影响的meta分析[35]结果显示,与低频率运动相比,高频率运动对痴呆患者认知功能影响无明显区别。造成结果不一致可能有如下2个原因。
(1)研究对象不一致。先前关于运动对AD患者认知功能影响meta分析的研究对象均包含了各种类型的痴呆。这与本文研究对象均为单纯确诊的AD患者有本质区别。痴呆作为一种常见的疾病,按其发病机制的不同可分为血管性痴呆、多发梗塞性痴呆、混合性痴呆、中度认知障碍以及阿尔茨海默病等。不同种类的痴呆发病机制不同,运动对其干预的生物学机制也有本质区别,而将不同痴呆类型一起分析很可能是导致先前研究与本文结论不一致的一个潜在因素。
(2)认知功能测量方法不一致。先前关于运动对AD患者认知功能影响的meta分析不仅与本文的研究对象不一致,其对研究对象认知功能的检测手段也与本文明显不同。如在同一篇meta分析文献中采用MMSE、ADAS⁃cog和CDT等多种认知功能检测手段,这些不一致的检测方式很可能是造成其分析结果与本文结果不同的另一个因素。本文统一纳入AD患者认知功能检测方式均为MMSE的文献,因为MMSE作为认知障碍检查方法,可用于对AD患者进行时间定向力、地点定向力、即刻记忆、注意力及计算力、延迟记忆、语言及视空间等方面的检查,能全面而准确地反映受试者智力状态及认知功能缺损程度,是目前最具影响且使用最普遍的标准化智力状态检查工具之一。其他认知功能检测方式,包括TMT、SDMT、MoCA、ADAS⁃cog、样本匹配、伦敦老年人心理评定量表和ERFC等使用率则相对较低[15]。因此,本文选择将MMSE作为对AD患者认知功能检测方式的文献,可在保证文献质量的同时纳入大量同质性随机对照试验进行meta分析。
本文的创新点在于:①分析对象均为确诊的AD患者,而对于非确诊的AD患者的随机对照试验数据不予采用;②对AD患者认知功能的检测方式均为MMSE,而对于非MMSE检测手段的文献不予采用;③根据运动的不同类型和频率做二级分析,进一步探讨不用类型和频率的运动对AD患者认知能力的干预作用。
本文尚存在一些局限性:①研究对象存在如年龄、性别、疾病严重程度等不一致性,这可能会对结果精确性造成一定影响;②干预频率从90 min/周到270 min/周不等,干预时间从12周到24周不等,而有关高频率运动对AD患者认知功能干预效果的研究有限,因而,本文未能分析运动干预AD患者认知功能有效运动频率的上下限。
4 结论运动对AD患者认知功能的改善具有积极作用。有氧和无氧结合运动对AD患者认知功能的干预效果优于单纯的有氧运动。高频率运动对AD患者认知功能的干预效果优于低频率运动。AD是一种病因极其多样和复杂的疾病,未来的研究需对其发病机制进行更深入、透彻和全面的了解,还需进一步探讨运动频率干预AD患者认知功能的上下限,以及无氧或不同强度运动对AD患者认识功能的干预效果,通过定性和定量研究分析不同类型、强度和频率运动对AD的干预作用,从而制订更有效的防治AD的运动方案。
作者贡献声明:
刘军:搜集数据,统计分析数据,撰写论文;
刘仁仪:提出论文选题,设计论文框架,审核、指导修改论文;
叶星:调研文献,核实数据。
| [1] |
BECKER J A, HEDDEN T, CARMASIN J, et al. Amyloid-beta associated cortical thinning in clinically normal elderly[J].
Annals of Neurology, 2011, 69(6): 1032-1042 DOI:10.1002/ana.22333 (  0) 0)
|
| [2] |
REDDY P H. Abnormal tau, mitochondrial dysfunction, impaired axonal transport of mitochondria, and synaptic deprivation in Alzheimer's disease[J].
Brain Research, 2011, 1415: 136-148 DOI:10.1016/j.brainres.2011.07.052 (  0) 0)
|
| [3] |
BRUNNSTROM H, GUSTAFSON L, PASSANT U, et al. Prevalence of dementia subtypes:A 30-year retrospective survey of neuropathological reports[J].
Archives of Gerontology and Geriatrics, 2009, 49(1): 146-149 DOI:10.1016/j.archger.2008.06.005 (  0) 0)
|
| [4] |
BARNES D E, YAFFE K. The projected effect of risk factor reduction on Alzheimer's disease prevalence[J].
Lancet Neurology, 2011, 10(9): 819-828 DOI:10.1016/S1474-4422(11)70072-2 (  0) 0)
|
| [5] |
ADLARD P A, PERREAU Y M, PO P V, et al. Voluntary exercise decreases amyloid load in a transgenic model of Alzheimer's disease[J].
Neuroscience, 2005, 25(17): 4217-4221 DOI:10.1523/JNEUROSCI.0496-05.2005 (  0) 0)
|
| [6] |
KIM D Y, JUNG S Y, KIM T W, et al. Treadmill exercise decreases incidence of Alzheimer's disease by suppressing glycogen synthase kinase-3beta expression in streptozotocin-induced diabetic rats[J].
Journal of Exercise Rehabilitation, 2015, 11(2): 87-94 (  0) 0)
|
| [7] |
DAO A T, ZAGAAR M A, AlKADHI K A. Moderate treadmill exercise protects synaptic plasticity of the dentate gyrus and related signaling cascade in a rat model of Alzheimer's disease[J].
Molecular Neurobiology, 2015, 52(3): 1067-1076 DOI:10.1007/s12035-014-8916-1 (  0) 0)
|
| [8] |
SAMPAIO A, MARQUES E A, MOTA J, et al. Effects of a multicomponent exercise program in institutionalized elders with Alzheimer's disease[J].
Dementia(London), 2016, 18(2): 417-431 (  0) 0)
|
| [9] |
HOLTHOFF V A, MARSCHNER K, SCHARF M, et al. Effects of physical activity training in patients with Alzheimer's dementia:Results of a pilot RCT study[J].
PLoS One, 2015, 10(4): e0121478 DOI:10.1371/journal.pone.0121478 (  0) 0)
|
| [10] |
HERNANDEZ S S, COEIHO F G, GOBBI S, et al. Effects of physical activity on cognitive functions, balance and risk of falls in elderly patients with Alzheimer's dementia[J].
Rev Bras Fisiote, 2010, 14(1): 68-74 DOI:10.1590/S1413-35552010000100011 (  0) 0)
|
| [11] |
COTT C A, DAWSON P, SIDANI S, et al. The effects of a walking/talking program on communication, ambulation, and functional status in residents with Alzheimer disease[J].
Alzheimer Disease and Associated Disorders, 2002, 16(2): 81-87 DOI:10.1097/00002093-200204000-00005 (  0) 0)
|
| [12] |
HOFFMANN K, SOBOL N A, FREDERIKSEN K S, et al. Moderate-to-high intensity physical exercise in patients with Alzheimer's disease:A randomized controlled trial[J].
Journal of Alzheimer's Disease, 2016, 50(2): 443-453 (  0) 0)
|
| [13] |
MIU D, SZETO S L, MAK Y F, et al. A randomised controlled trail on the effect of exercise on physical:Cognitive and affective function in dementia subjects[J].
Asian Journal of Gerontology and Geriatrics, 2008(3): 8-16 (  0) 0)
|
| [14] |
RAO A K, CHOU A, BURSLEY B, et al. Systematic review of the effects of exercise on activities of daily living in people with Alzheimer's disease[J].
American Journal of Occupational Therapy, 2014, 68(1): 5650-5615 (  0) 0)
|
| [15] |
PANZA G A, TAYlOR B A, MACDONALD H V, et al. Can exercise improve cognitive symptoms of Alzheimer's disease?[J].
Journal of the American Geriatrics Society, 2018, 66(3): 487-495 DOI:10.1111/jgs.15241 (  0) 0)
|
| [16] |
DU Z, LI Y, LI J, et al. Physical activity can improve cognition in patients with Alzheimer's disease:A systematic review and meta-analysis of randomized controlled trials[J].
Clinical Interventions in Aging, 2018, 13: 1593-1603 DOI:10.2147/CIA.S169565 (  0) 0)
|
| [17] |
VREUGDENHIL A, CANNELL J, DAVIES A, et al. A community-based exercise programme to improve functional ability in people with Alzheimer's disease:A randomized controlled trial[J].
Scandinavian Journal of Caring Sciences, 2012, 26(1): 12-19 DOI:10.1111/j.1471-6712.2011.00895.x (  0) 0)
|
| [18] |
YANG S Y, SHAN C L, QING H, et al. The effects of aerobic exercise on cognitive function of Alzheimer's disease patients[J].
CNS & Neurological Disorders Drug Targets, 2015, 14(10): 1292-1297 (  0) 0)
|
| [19] |
刘银, 王童, 朱奕, 等. 中等强度有氧运动改善阿尔茨海默病患者认知功能的研究[J].
中国康复, 2017, 32(5): 386-389 (  0) 0)
|
| [20] |
常春红, 王蔚, 朱奕, 等. 有氧训练对阿尔茨海默病的干预作用研究[J].
中国康复医学杂志, 2015, 30(11): 1131-1134 (  0) 0)
|
| [21] |
母海艳, 吕继辉, 郝智, 等. 有氧运动对轻中度阿尔茨海默病患者生活能力、认知功能和精神症状的影响[J].
中华老年多器官疾病杂志, 2016, 15(6): 451-454 (  0) 0)
|
| [22] |
燕兰云, 王蔚, 沈飞飞, 等. 不同训练时间的有氧运动干预轻中度阿尔茨海默病的临床研究[J].
中国康复医学杂志, 2015, 30(8): 771-776 (  0) 0)
|
| [23] |
王石艳, 朱奕, 张勤, 等. 中等强度有氧运动对阿尔茨海默病患者认知和运动功能的影响[J].
中华物理医学与康复杂志, 2014, 36(10): 765-768 (  0) 0)
|
| [24] |
王纬, 王蔚, 杨思雨, 等. 静息态脑功能低频振幅对有氧训练后AD患者功能改善评估的研究[J].
江苏医药, 2015, 41(10): 1156-1159 (  0) 0)
|
| [25] |
王英, 沈飞飞, 朱奕, 等. 中高强度有氧运动干预阿尔茨海默病的临床研究[J].
中国临床神经科学, 2014, 22(5): 504-509 (  0) 0)
|
| [26] |
王蔚, 朱奕, 杨思雨, 等. 有氧训练对阿尔茨海默病患者认知功能和日常生活活动能力的影响[J].
中国康复医学杂志, 2014, 29(12): 1151-1155 (  0) 0)
|
| [27] |
祁鸣, 张玲. 基于静息态fMRI的有氧训练在阿尔茨海默病患者中的有效性研究[J].
中国临床医学影像杂志, 2015, 26(11): 761-763 (  0) 0)
|
| [28] |
LANGE-ASSCHENFEIDT C, KOJDA G. Alzheimer's disease, cerebrovascular dysfunction and the benefits of exercise:From vessels to neurons[J].
Experimental Gerontology, 2008, 43(6): 499-504 DOI:10.1016/j.exger.2008.04.002 (  0) 0)
|
| [29] |
PEREIRA A C, HUDDIESTON D E, BRICKMAN A M, et al. An in vivo correlate of exercise-induced neurogenesis in the adult dentate gyrus[J].
Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(13): 5638-5643 DOI:10.1073/pnas.0611721104 (  0) 0)
|
| [30] |
GOMEZ-PINILLA F, ZHUANG Y, FENG J, et al. Exercise impacts brain-derived neurotrophic factor plasticity by engaging mechanisms of epigenetic regulation[J].
The European Journal of Neuroscience, 2011, 33(3): 383-390 DOI:10.1111/j.1460-9568.2010.07508.x (  0) 0)
|
| [31] |
LIU H L, ZHAO G, CAI K, et al. Treadmill exercise prevents decline in spatial learning and memory in APP/PS1 transgenic mice through improvement of hippocampal long-term potentiation[J].
Behavioural Brain Research, 2011, 218(2): 308-314 DOI:10.1016/j.bbr.2010.12.030 (  0) 0)
|
| [32] |
COLCOMBE S J, ERICKSON K I, SCALF P E, et al. Aerobic exercise training increases brain volume in aging humans[J].
The Journals of Gerontology Series A, Biological Sciences and Medical Sciences, 2006, 61(11): 1166-1170 DOI:10.1093/gerona/61.11.1166 (  0) 0)
|
| [33] |
COSTA D A, CRACCHIOLO J R, BACHSTETTER A D, et al. Enrichment improves cognition in AD mice by amyloid-related and unrelated mechanisms[J].
Neurobiology of Aging, 2007, 28(6): 831-844 DOI:10.1016/j.neurobiolaging.2006.04.009 (  0) 0)
|
| [34] |
CAI H, LI G, HUA S, et al. Effect of exercise on cognitive function in chronic disease patients:A meta-analysis and systematic review of randomized controlled trials[J].
Clinical Interventions in Aging, 2017, 12: 773-783 DOI:10.2147/CIA.S135700 (  0) 0)
|
| [35] |
GROOT C, HOOGHIEMSTR A M, RAIJMAKERS P G, et al. The effect of physical activity on cognitive function in patients with dementia:A meta-analysis of randomized control trials[J].
Aging Research Reviews, 2016, 25: 13-23 DOI:10.1016/j.arr.2015.11.005 (  0) 0)
|
| [36] |
HERRMANN M, SCHORR H, OBEID R, et al. Homocysteine increases during endurance exercise[J].
Clinical Chemistry and Laboratory Medicine, 2003, 41(11): 1518-1524 (  0) 0)
|
| [37] |
BONAREK M, BARBERGER-GATEAU P, LETENNEUR L, et al. Relationships between cholesterol, apolipoprotein E polymorphism and dementia:A cross-sectional analysis from the PAQUID study[J].
Neuroepidemiology, 2000, 19(3): 141-148 DOI:10.1159/000026249 (  0) 0)
|
| [38] |
HURLEY B F, HANSON E D, SHEAFF A K. Strength training as a countermeasure to aging muscle and chronic disease[J].
Sports Medicine, 2011, 41(4): 289-306 DOI:10.2165/11585920-000000000-00000 (  0) 0)
|
| [39] |
LIU-AMBROSE T, DONALDSON M G. Exercise and cognition in older adults:Is there a role for resistance training programmes?[J].
British Journal of Sports and Medicine, 2009, 43(1): 25-27 (  0) 0)
|
| [40] |
BUCHMAN A S, WILSON R S, BIENIAS J L, et al. Change in body mass index and risk of incident Alzheimer disease[J].
Neurology, 2005, 65(6): 892-897 DOI:10.1212/01.wnl.0000176061.33817.90 (  0) 0)
|
| [41] |
BOYLE P A, BUCHMAN A S, WILSON R S, et al. Association of muscle strength with the risk of Alzheimer disease and the rate of cognitive decline in community-dwelling older persons[J].
Archives of Neurology, 2009, 66(11): 1339-1344 (  0) 0)
|
| [42] |
贾健民, 贾健平, 贾丽, 等. 老年鼠海马自由基与学习记忆关系的研究[J].
中华医学杂志, 2003, 83(9): 96-98 (  0) 0)
|
| [43] |
刘新霞, 赵燕燕, 陈春生, 等. 不同运动量对小鼠微循环及耐缺氧能力的影响[J].
中国康复医学杂志, 2008, 23(9): 786-788 (  0) 0)
|
| [44] |
高凤国.不同运动量对血管性痴呆防治作用的研究[D].保定: 河北大学, 2010: 9-15
http://cdmd.cnki.com.cn/Article/CDMD-10075-1011269523.htm (  0) 0)
|
| [45] |
YAFFE K, BARNES D, NEVITT M, et al. A prospective study of physical activity and cognitive decline in elderly women:Women who walk[J].
Archives of Internal Medicine, 2001, 161(14): 1703-1708 DOI:10.1001/archinte.161.14.1703 (  0) 0)
|
 2020, Vol. 44
2020, Vol. 44


