线粒体是真核生物细胞内极为关键的细胞器,是真核生物细胞进行生物氧化和能量转化的场所,可通过氧化磷酸化为机体生命活动提供大部分能量,故有“能量工厂”之称。然而,线粒体在生成ATP提供能量的同时,又会产生活性氧自由基(ROS),ROS的异常累积可攻击线粒体DNA(mt DNA)等损伤线粒体功能。因此,及时清除细胞内受损伤的线粒体对于维持细胞稳态具有重要作用,而真核细胞主要通过自噬清除损伤线粒体。2005年,Lemasters[1]首次提出线粒体自噬的概念,主要指在氧化应激、衰老及能量限制等刺激下,细胞内的线粒体发生去极化损伤,受损的线粒体被特异性包裹进自噬体中,并与溶酶体融合,从而完成受损线粒体的降解,维持细胞内环境的稳态。线粒体自噬异常可导致受损线粒体的清除减少,积累增加,进而引发线粒体功能紊乱。
2 线粒体自噬的调控机制 2.1 PINK1/Parkin介导的线粒体自噬PINK1[2]/Parkin(PTEN-induced putative kinase protein1/Parkin)[3]是2个与帕金森病有关的基因,目前研究普遍认为,PINK1/ Parkin是参与线粒体自噬的极为关键的信号途径。其中Parkin是一个E3泛素连接酶,高表达于脑、骨骼肌、心肌以及肝脏等组织[4],游离于细胞质内[5]。正常生理状态下,成熟的PINK1与线粒体外膜转运酶(TOM)结合形成一个700kDa的复合物并进入线粒体膜间隙[6],随后与线粒体内膜转运酶(TIM)作用,并被内膜菱状蛋白(PARL)迅速降解[7],以确保健康线粒体中PINK1的含量较低,线粒体自噬的活性也保持在正常生理水平。当线粒体受损伤、线粒体膜电位下降时,PINK1不再向内膜转运以及与TOM结合,而是定位于线粒体外膜并从细胞质中募集Parkin至线粒体。进而引发下游的线粒体蛋白,如线粒体装配调节因子(MARF)、线粒体融合蛋白1(Mfn1)、线粒体融合蛋白2(Mfn2)和电压依赖性阳离子通道蛋白1(VDAC1)的级联泛素化,抑制损伤线粒体的流动性及其与正常线粒体的融合,促进自噬体对受损线粒体的特异性识别并包裹,最终受损线粒体得以清除[4, 8]。已有研究证实,抑制PINK1或Parkin基因表达均能导致受损线粒体的清除障碍,积累增加[9]。以上研究结果显示,PINK1/Parkin是调控线粒体自噬的关键途径,然而其作用机制尚未完全阐明。最新的研究结果显示,PRDX6是PINK1/ Parkin通路的上游调控因子,当线粒体受损时ROS生成增加,过量的ROS可导致PRDX6堆积增加,进而激活下游的PINK1/ Parkin途径清除受损伤的线粒体[10]。
2.2 Bnip3/Nix介导的线粒体自噬线粒体自噬途径亦存在于机体发育过程中,其中很多哺乳动物的成熟红细胞没有线粒体,这是因为在网织红细胞向血红细胞的发育过程中线粒体逐步退化消失。诸多研究表明,Bnip3(BCL2 and adenovirus E1B 19kDa protein-interacting protein 3)/ Nix(NIP3-like protein X,NIX,又称BNIP3L)通路参与调控哺乳动物红细胞中线粒体的清除降解过程[4, 11]。Bnip3是由Boyd等[12]于1994年首次以腺病毒E1B19 kDa蛋白为诱饵通过酵母双杂交鉴定出来的特异性蛋白,其含有一个BH3结构域和一个羧基末端跨膜域,可促进线粒体自噬与细胞凋亡的发生。Nix定位于线粒体外膜,敲除Nix基因可显著降低机体清除受损线粒体的能力[13],这说明Nix同样可通过激活细胞凋亡及细胞自噬进程进而降解清除受损线粒体等细胞组件。此外,进一步的深入研究发现,Nix主要通过以下两方面开启细胞自噬:① 通过其BH3结构域与Bcl-2竞争性结合解离Bcl-2-Beclin1 复合物,进而启动自噬[14],而且Nix还可通过诱导ROS生成激活自噬,但其具体机制尚不完全清楚[15];② Nix参与调控线粒体自噬,不仅在去极化线粒体的Parkin募集中不可或缺,还可与LC3蛋白直接结合并招募LC3至受损线粒体上进而引发线粒体自噬[13]。
2.3 FUNDC1介导的线粒体自噬2012年,Liu等[16]首次证实线粒体外膜蛋白FUNDC1参与调控缺氧条件下哺乳动物细胞的线粒体自噬。FUNDC1是一个由155个氨基酸组成的3次跨膜蛋白,锚定于线粒体外膜,在大多数哺乳动物中具有高度保守性。高表达的FUNDC1可激活线粒体自噬,并且是Atg5依赖性的。LC3是自噬发生的关键蛋白,而FUNDC1的N末端有与LC3直接结合的作用域(LIR),LIR的缺失或突变能抑制FUNDC1与LC3的相互作用,进而下调线粒体自噬。在正常生理状态下,蛋白激酶Src通过磷酸化LIR的Thy18位点抑制FUNDC1与LC3的作用,进而下调线粒体自噬活性。相反,在低氧环境下,蛋白激酶Scr的活性被抑制,其磷酸化FUNDC1的能力亦随之降低,去磷酸化的FUNDC1与LC3结合增强,进而激活下游的线粒体自噬。此外,该课题组最近研究还发现,FUNDC1的不同磷酸化位点其功能截然不同,前文已述及在低氧条件下蛋白激酶Src通过磷酸化FUNDC1的LIR Thy18位点抑制FUNDC1与LC3的作用,进而下调线粒体自噬活性,但同时低氧刺激亦能募集ULK1(UNC51-like kinase)至受损线粒体,后者通过磷酸化FUNDC1的Ser17位点进而促进线粒体自噬[17]。
以上研究表明,FUNDC1的磷酸化位点至关重要,决定着线粒体自噬的不同去路。并且低氧诱导的线粒体自噬通路效应不是单一的,而是多条途径共同拮抗的结果。这说明FUNDC1调控线粒体自噬的分子机制有待进一步探索和证实。
3 线粒体自噬、功能受损与胰岛素抵抗胰岛素抵抗是指正常剂量的胰岛素产生低于其正常生物学效应的一种状态,其实质为胰岛素介导的糖代谢能力下降,主要表现为胰岛素作用的靶组织(骨骼肌、肝脏和脂肪)和靶器官对胰岛素敏感性及反应性降低。目前越来越多的研究提示,氧化损伤导致的线粒体功能紊乱是胰岛素抵抗的重要原因[18],其中,以胰岛素抵抗为主要病理特征的代谢类疾病,如肥胖和糖尿病模型中均观察到线粒体数目降低、体积减小及ATP产生下降[19],提示胰岛素抵抗状态下存在线粒体失衡。推测是因为营养失衡导致能量代谢平衡的破坏,使得线粒体产生过多ROS,而ROS反过来又能直接攻击线粒体造成其功能受损。线粒体功能紊乱进一步抑制下游胰岛素相关的生理生化过程,如骨骼肌葡萄糖利用率降低,胰腺分泌胰岛素下降及肝脏糖异生增加,最终引发糖尿病[20-21]。
关于线粒体自噬与胰岛素抵抗关系的研究表明,Parkin基因特异性敲除的肌管中葡萄糖的摄取量增加,但施加胰岛素刺激后葡萄糖的摄取量不增反减,同时胰岛素信号传导也明显被抑制。该研究迄今为止首次在细胞水平验证了线粒体自噬关键基因的缺失可引发肌管的胰岛素抵抗[5]。遗憾的是,其对于线粒体自噬调控胰岛素抵抗的分子学机制并未进行深入探索。已有的研究证实,ROS诱导的线粒体去极化损伤是激活线粒体自噬通路PINK1/Parkin的上游信号分子[22-23],故推测当线粒体发生功能紊乱时,线粒体自噬活性上调,进而使得受损线粒体的清除增加,线粒体功能得到增强,最终改善下游的胰岛素通路而改善胰岛素抵抗症状。相反,线粒体自噬异常时细胞清除受损线粒体的能力降低,导致受损线粒体积累,线粒体更新障碍使得细胞堆积大量的ROS等代谢产物,从而影响细胞内胰岛素信号通路,诱发胰岛素抵抗[24]。此外,本文前期研究结果显示,长期高脂膳食诱导的营养性肥胖小鼠骨骼肌中线粒体功能及数量普遍下降,线粒体自噬相关信号PINK1/Prakin、Bnip3/Nix在转录及翻译水平上均存在不同程度的异常[25],提示胰岛素抵抗时线粒体功能亦受损,同时伴随线粒体自噬活性的下调。这说明线粒体自噬与胰岛素抵抗的关系较为复杂,可互为因果,故未来开展关于线粒体自噬与胰岛素抵抗的研究具有重要意义。
以上研究结果显示,氧化损伤导致的线粒体功能紊乱在胰岛素抵抗的发生发展中具有重要作用,而线粒体自噬能清除受损线粒体,减轻氧化应激,进而缓解胰岛素抵抗。因此,推测通过增强线粒体自噬的活性改善线粒体功能是防治胰岛素抵抗的合理途径。
4 线粒体自噬在运动改善胰岛素抵抗中的作用 4.1 运动促进线粒体自噬长期适度运动作为一种健康的生活方式,不仅可以强化肌肉、控制体重,而且在防治糖尿病、肿瘤、阿尔茨海默症等方面发挥重要作用;然而,运动促进健康的具体机制并未完全明了。已知运动可以引起机体多个系统产生有益的适应性变化,线粒体亦参与其中。1967年,Holloszy[26]首次报道证实运动促进骨骼肌的线粒体生物发生,即野生型动物肌肉比家养型动物肌肉含有更高的线粒体数目,同时长期跑台运动显著增强大鼠骨骼肌的线粒体蛋白表达及酶活性,这一开创性的研究奠定了线粒体运动适应的基础。随后大量的实验数据证实,急性运动与长期运动通过激活细胞自噬与线粒体自噬进而改善骨骼肌线粒体质量[27-29]。
人体运动与静息最大的生理区别在于机体耗氧的变化,而线粒体是负责细胞呼吸、提供能量的关键细胞器。因此,在运动过程中线粒体的结构、功能等的变化具有重要意义。在长期进化过程中,线粒体形成了一套完整的机制即以线粒体质量控制来维持线粒体数目及质量的相对平衡,其包括线粒体生物发生、动态变化(融合与分裂)及自噬。近年随着研究的不断深入,对于线粒体的运动适应有了更加全面的认识。以往关于线粒体运动性适应的研究主要集中于线粒体生物发生等正向适应领域,对于线粒体自噬这一“逆向适应”领域的报道较少。研究证实,运动不仅促进线粒体生物发生(正向适应),也能激活细胞自噬(包含线粒体自噬),未来以“自噬”为标志的“逆向适应”研究将更全面地揭示线粒体质量调控的机理,这将进一步丰富线粒体相关疾病的病理机制[30]。然而目前关于运动与线粒体自噬的报道较少,且多聚焦于线粒体自噬相关基因的表达方面。
Lira等[28] 研究发现,在饥饿、胰高血糖素、运动等条件下,ATP供不应求,AMP/ATP比值升高,活化AMPK,进而经下游的一系列效应激活线粒体生物发生、线粒体自噬等途径。其研究还证实,耐力运动能促进骨骼肌中细胞自噬蛋白及线粒体自噬蛋白Bnip3的表达,这意味着骨骼肌的运动适应离不开线粒体自噬的参与。进一步的实验数据显示,急性运动与耐力运动均促进骨骼肌中Bnip3的基因表达[28, 31]。这说明Bnip3与Nix是对运动极为敏感的分子,因此运动可能通过激活Bnip3/Nix途径清除受损线粒体。除此之外,Scheele等[32] 的研究显示,耐力运动能上调PINK1mRNA的表达。与Scheele等的研究相似,Santos-Alves等比较了不同方式运动对肝脏线粒体自噬相关蛋白的表达影响,发现12周跑台运动可增加肝脏Parkin蛋白表达,但PINK1蛋白表达降低,而12周自主跑轮运动可降低Parkin蛋白表达,PINK1蛋白表达无显著变化。以上研究提示,Bnip3/Nix、PINK1/Parkin通路均参与机体运动适应过程,但不同类型的运动激活的线粒体自噬途径以及不同组织中的线粒体自噬途径可能不同。此外,Jamart等的一项研究指出,24 h的耐力跑并未引起极限长跑运动员骨骼肌中Parkin、PINK1的显著变化,推测这可能是因为极限长跑运动员由于长期的运动其骨骼肌已产生运动性适应所致。
以上研究表明,骨骼肌的运动适应离不开线粒体自噬的参与。运动不仅促进线粒体的生物发生、融合分裂,也可通过激活线粒体自噬途径清除受损或衰老的线粒体,从而保障线粒体数目与质量的平衡,维持骨骼肌代谢稳态。
4.2 运动、线粒体自噬与胰岛素抵抗线粒体自噬异常抑制胰岛素信号,而运动不仅能改善胰岛素抵抗状态,也可激活线粒体自噬,那么线粒体自噬在运动改善胰岛素抵抗中的作用如何?He等[29]的研究表明,运动能上调野生小鼠骨骼肌、肝脏等组织的自噬活性,同时长期高脂膳食所导致的高血糖、高血脂及瘦素抵抗症状得到明显缓解,但自噬缺陷小鼠体内中未检测到这些变化,这说明自噬的激活对于运动改善机体能量代谢不可或缺,而且运动能通过激活自噬进而提高胰岛素敏感性。遗憾的是,目前尚未有研究数据验证线粒体自噬在运动改善胰岛素抵抗中所具有的作用以及线粒体自噬对于运动改善机体能量代谢是否必需。人体实验结果表明,运动过程中的能量摄入量直接影响骨骼肌的氧化能力,其中禁食状态下运动不仅能激活线粒体自噬[31],更能增强骨骼肌的氧化能力,提示线粒体自噬与能量代谢可能密切相关,运动可通过激活线粒体自噬进而改善机体能量代谢,缓解胰岛素抵抗。本团队前期研究发现,在运动干预营养性肥胖小鼠过程中,PINK1、Parkin、PARL以及Nix、Bnip3 mRNA均适应性增加,且PINK1蛋白表达增加较为显著,这说明运动改善营养性肥胖状况时线粒体自噬关键途径PINK1/Parkin、Bnip3/Nix均参与其中,且PINK1/Parkin信号通路发挥主要作用,但其具体分子机制仍须进一步探讨[25]。以上研究结果提示线粒体自噬在运动改善机体能量代谢中发挥着一定的作用。
线粒体自噬是细胞调节功能,适应内外环境变化的重要生理过程。目前对线粒体自噬在运动改善胰岛素抵抗中的作用及分子机制研究较少。如前所述,ROS诱导的线粒体去极化损伤是激活线粒体自噬通路PINK1/Parkin的上游信号分子[22-23]。运动过程中ROS的增多主要源于线粒体呼吸链,且运动过程中的线粒体比静息状态下的线粒体产生更多的ROS,另外,耐力运动能提高线粒体的功能,推测运动过程中生成的ROS能作为第二信使激活线粒体自噬,进而使得受损线粒体的清除增加,线粒体的功能得到增强。此外,血糖高低主要由骨骼肌、肝脏和胰腺组织协同调控,线粒体功能损伤能同时影响骨骼肌、肝脏及胰腺中胰岛素相关的生理生化过程,如葡萄糖激活胰腺β细胞释放胰岛素、肌肉对葡萄糖的利用以及肝脏的糖异生可能因细胞线粒体功能紊乱而受阻,从而导致胰岛素抵抗;而运动引发的线粒体功能增强可缓解上述症状,最终改善胰岛素抵抗(图 1)。
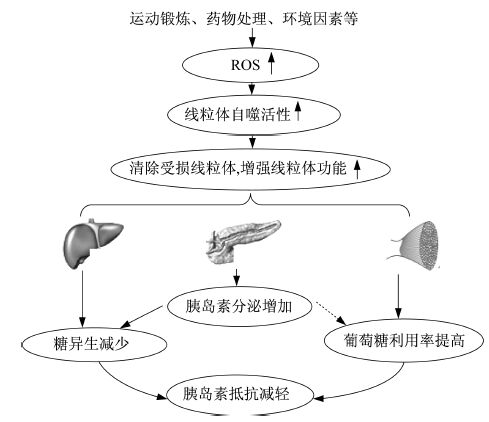
|
图 1 运动通过激活线粒体自噬而缓解胰岛素抵抗的可能作用 Figure 1 The possible mechanism for mitophagy in exercise-induced insulin resistance |
综上所述,运动可以通过提高人及动物的线粒体生物发生而改善胰岛素抵抗,关于运动是否同样能通过激活线粒体自噬而缓解胰岛素抵抗仍须进一步的探索与验证。可以预见的是,通过运动、线粒体激活剂等增强肥胖、糖尿病等代谢类疾病个体的线粒体自噬活性,减少受损线粒体的堆积,降低氧化损伤是防治胰岛素抵抗的合理途径。
5 结论与展望线粒体自噬与胰岛素抵抗息息相关,线粒体自噬异常可导致受损线粒体堆积,加重氧化损伤,抑制胰岛素相关过程,最终引发胰岛素抵抗。运动可促进线粒体自噬,使得受损或衰老线粒体被及时、有效清除,进而降低氧化损伤,改善线粒体功能,缓解胰岛素抵抗。因此,保持适度的线粒体自噬水平可完善线粒体质量控制,维持骨骼肌稳态,进而防治肥胖、糖尿病等代谢类疾病的发生与发展。
目前关于运动与骨骼肌线粒体自噬的研究刚刚起步,尤其是线粒体自噬在运动改善胰岛素抵抗中的作用及分子信号机制方面还存在一些亟待探讨的关键问题:① 与线粒体生物发生及融合分裂相比,目前对于线粒体自噬的研究尚不成熟,尤其是对线粒体自噬的进程、具体分子机制及其与线粒体生物发生、融合分裂的关系等仍未明了。② 线粒体自噬与胰岛素抵抗的关系较为复杂,可相互影响、互为因果。因此,未来研究聚焦于线粒体自噬在机体能量代谢中的作用及其具体分子机制具有重要意义。③ 运动能激活骨骼肌线粒体自噬,然而线粒体自噬的激活是否运动改善机体能量代谢作用的必要条件,即线粒体自噬在运动改善机体能量代谢中的作用仍值得商榷。虽然目前关于线粒体自噬与胰岛素抵抗、运动的研究较少,但毋庸置疑的是,这些问题的解决将有助于理解线粒体自噬在线粒体质量控制、骨骼肌运动适应中的重要作用,并为代谢类疾病的防治提供新的靶向。
| [1] |
Lemasters J J. Selective mitochondrial autophagy,or mitophagy,as a targeted defense against oxidative stress,mitochondrial dysfunction,and aging[J].
Rejuvenation Res, 2005, 8(1) : 3-5 DOI:10.1089/rej.2005.8.3 ( 0) 0)
|
| [2] |
Valente E M, Abou-Sleiman P M, Caputo V, et al. Hereditary early-onset Parkinson's disease caused by mutations in PINK1[J].
Science, 2004, 304(5674) : 1158-1160 ( 0) 0)
|
| [3] |
Kitada T, Asakawa S, Hattori N, et al. Mutations in the parkin gene cause autosomal recessive juvenile parkinsonism[J].
Nature, 1998, 392(6676) : 605-608 DOI:10.1038/33416 ( 0) 0)
|
| [4] |
Youle R J, Narendra D P. Mechanisms of mitophagy[J].
Nat Rev Mol Cell Biol, 2011, 12(1) : 9-14 ( 0) 0)
|
| [5] |
Drew B G, Ribas V, Le J A, et al. HSP72 is a mitochondrial stress sensor critical for Parkin action,oxidative metabolism,and insulin sensitivity in skeletal muscle[J].
Diabetes, 2014, 63(5) : 1488-1505 DOI:10.2337/db13-0665 ( 0) 0)
|
| [6] |
Lazarou M, Jin S M, Kane L A, et al. Role of PINK1 binding to the TOM complex and alternate intracellular membranes in recruitment and activation of the E3 ligase Parkin[J].
Dev Cell, 2012, 22(2) : 320-333 ( 0) 0)
|
| [7] |
Jin S M, Lazarou M, Wang C, et al. Mitochondrial membrane potential regulates PINK1 import and proteolytic destabilization by PARL[J].
J Cell Biol, 2010, 191(5) : 933-942 DOI:10.1083/jcb.201008084 ( 0) 0)
|
| [8] |
Ding W X, Yin X M. Mitophagy:Mechanisms,pathophysiological roles,and analysis[J].
Biol Chem, 2012, 393(7) : 547-564 ( 0) 0)
|
| [9] |
Bueler H. Mitochondrial dynamics,cell death and the pathogenesis of Parkinson's disease[J].
Apoptosis, 2010, 15(11) : 1336-1353 DOI:10.1007/s10495-010-0465-0 ( 0) 0)
|
| [10] |
Ma S, Zhang X, Zheng L, et al. Peroxiredoxin 6 is a crucial factor in the initial step of mitochondrial clearance and is upstream of the PINK1-Parkin pathway[J].
Antioxid Redox Signal, 2016, 24(9) : 486-501 DOI:10.1089/ars.2015.6336 ( 0) 0)
|
| [11] |
Zhang J, Ney P A. Role of BNIP3 and NIX in cell death,autophagy,and mitophagy[J].
Cell Death Differ, 2009, 16(7) : 939-946 ( 0) 0)
|
| [12] |
Boyd J M,Malstrom S,Subramanian T,et al.Adenovirus E1B 19 kDa and Bcl-2 proteins interact with a common set of cellular proteins[Z].1994:79,341-351
( 0) 0)
|
| [13] |
Novak I, Kirkin V, Mcewan D G, et al. Nix is a selective autophagy receptor for mitochondrial clearance[J].
EMBO Rep, 2010, 11(1) : 45-51 DOI:10.1038/embor.2009.256 ( 0) 0)
|
| [14] |
Bellot G, Garcia-Medina R, Gounon P, et al. Hypoxia-induced autophagy is mediated through hypoxia-inducible factor induction of BNIP3 and BNIP3L via their BH3 domains[J].
Mol Cell Biol, 2009, 29(10) : 2570-2581 DOI:10.1128/MCB.00166-09 ( 0) 0)
|
| [15] |
Ding W X, Ni H M, Li M, et al. Nix is critical to two distinct phases of mitophagy,reactive oxygen species-mediated autophagy induction and Parkin-ubiquitin-p62-mediated mitochondrial priming[J].
J Biol Chem, 2010, 285(36) : 27879-27890 DOI:10.1074/jbc.M110.119537 ( 0) 0)
|
| [16] |
Liu L, Feng D, Chen G, et al. Mitochondrial outer-membrane protein FUNDC1 mediates hypoxia-induced mitophagy in mammalian cells[J].
Nat Cell Biol, 2012, 14(2) : 177-185 DOI:10.1038/ncb2422 ( 0) 0)
|
| [17] |
Wu W, Tian W, Hu Z, et al. ULK1 translocates to mitochondria and phosphorylates FUNDC1 to regulate mitophagy[J].
Embo Rep, 2014, 15(5) : 566-575 DOI:10.1002/embr.201438501 ( 0) 0)
|
| [18] |
Bonnard C, Durand A, Peyrol S, et al. Mitochondrial dysfunction results from oxidative stress in the skeletal muscle of diet-induced insulin-resistant mice[J].
J Clin Invest, 2008, 118(2) : 789-800 ( 0) 0)
|
| [19] |
Morino K, Petersen K F, Dufour S, et al. Reduced mitochondrial density and increased IRS-1 serine phosphorylation in muscle of insulin-resistant offspring of type 2 diabetic parents[J].
J Clin Invest, 2005, 115(12) : 3587-3593 DOI:10.1172/JCI25151 ( 0) 0)
|
| [20] |
王学敏, 刘健康.
线粒体医学与健康[M]. 北京: 科学出版社, 2012: 16-18.
( 0) 0)
|
| [21] |
Liu J, Shen W, Zhao B, et al. Targeting mitochondrial biogenesis for preventing and treating insulin resistance in diabetes and obesity:Hope from natural mitochondrial nutrients[J].
Adv Drug Deliv Rev, 2009, 61(14) : 1343-1352 DOI:10.1016/j.addr.2009.06.007 ( 0) 0)
|
| [22] |
Wang Y, Nartiss Y, Steipe B, et al. ROS-induced mitochondrial depolarization initiates PARK2/PARKIN-dependent mitochondrial degradation by autophagy[J].
Autophagy, 2012, 8(10) : 1462-1476 DOI:10.4161/auto.21211 ( 0) 0)
|
| [23] |
Wei X, Qi Y, Zhang X, et al. Cadmium induces mitophagy through ROS-mediated PINK1/Parkin pathway[J].
Toxicol Mech Methods, 2014, 24(7) : 504-511 DOI:10.3109/15376516.2014.943444 ( 0) 0)
|
| [24] |
Gonzalez C D, Lee M S, Marchetti P, et al. The emerging role of autophagy in the pathophysiology of diabetes mellitus[J].
Autophagy, 2011, 7(1) : 2-11 DOI:10.4161/auto.7.1.13044 ( 0) 0)
|
| [25] |
崔迪, 邱守涛, 王海燕, 等. 耐力运动对营养性肥胖小鼠骨骼肌细胞自噬及线粒体自噬的影响[J].
体育科学, 2014(12) : 63-71 ( 0) 0)
|
| [26] |
Holloszy J O. Biochemical adaptations in muscle:Effects of exercise on mitochondrial oxygen uptake and respiratory enzyme activity in skeletal muscle[J].
J Biol Chem, 1967, 242(9) : 2278-2282 ( 0) 0)
|
| [27] |
Pagano A F, Py G, Bernardi H, et al. Autophagy and protein turnover signaling in slow-twitch muscle during exercise[J].
Med Sci Sports Exerc, 2014, 46(7) : 1314-1325 DOI:10.1249/MSS.0000000000000237 ( 0) 0)
|
| [28] |
Lira V A, Okutsu M, Zhang M, et al. Autophagy is required for exercise training-induced skeletal muscle adaptation and improvement of physical performance[J].
Faseb J, 2013, 27(10) : 4184-4193 DOI:10.1096/fj.13-228486 ( 0) 0)
|
| [29] |
He C, Bassik M C, Moresi V, et al. Exercise-induced BCL2-regulated autophagy is required for muscle glucose homeostasis[J].
Nature, 2012, 481(7382) : 511-515 DOI:10.1038/nature10758 ( 0) 0)
|
| [30] |
漆正堂, 丁树哲. 运动适应的细胞信号调控:线粒体的角色转换及其研究展望[J].
体育科学, 2013(7) : 65-69 ( 0) 0)
|
| [31] |
Jamart C, Naslain D, Gilson H, et al. Higher activation of autophagy in skeletal muscle of mice during endurance exercise in the fasted state[J].
Am J Physiol Endocrinol Metab, 2013, 305(8) : E964-E974 DOI:10.1152/ajpendo.00270.2013 ( 0) 0)
|
| [32] |
Scheele C, Petrovic N, Faghihi M A, et al. The human PINK1 locus is regulated in vivo by a non-coding natural antisense RNA during modulation of mitochondrial function[J].
BMC Genomics, 2007(8) : 74 ( 0) 0)
|
 2017, Vol. 41
2017, Vol. 41


