| 咪唑醋酸离子液体催化CO2交联壳聚糖的微观机理研究 |
壳聚糖(chitosan,CS)是一类天然有机高分子多糖,由β-(1, 4)-2-氨基-2-脱氧-β-D-葡萄糖重复单元组成[1](图 1),是甲壳素(chitin)的脱乙酰产物。甲壳素是自然界中含量仅此于纤维素的第二大天然高分子聚合物[2],广泛存在于虾、蟹等的贝壳中。壳聚糖具有优良的生物亲和性、生物相容性和生物可降解性[3]。壳聚糖结构中含有亲水性的氨基和羟基,因此,壳聚糖容易与其他有机分子发生一系列的衍生化反应,得到相应的衍生化产物。但是,壳聚糖与纤维素、半纤维素等生物质类似,不易溶解于普通的有机溶剂中,因此,壳聚糖的衍生化反应往往较难发生。2002年,Rogers课题组[4]发现在温和的实验条件下,纤维素能够高效溶解于咪唑类离子液体中,这一发现开辟了离子液体在生物质能源领域的应用研究。近年来的研究表明,咪唑类离子液体不仅可以作为溶解纤维素的溶剂,并且可用作催化剂促进壳聚糖的衍生化反应,得到高产率的衍生化产物[5-6]。
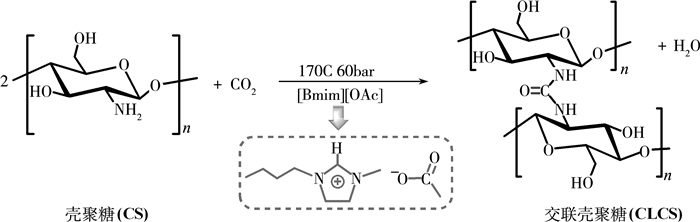 |
| 图 1 以CO2为交联剂,[Bmim][OAc]离子液体催化的交联壳聚糖的形成 |
2017年,Guazzelli课题组[7]发现,在温和的实验条件下,CO2和1-丁基-3-甲基咪唑醋酸([Bmim][OAc])离子液体,能够使壳聚糖发生分子间交联反应,生成含脲基的交联壳聚糖产物(图 1)。Guazzelli等[7]认为,反应中CO2是交联剂,而[Bmim][OAc]离子液体一方面作为反应溶剂,另一方面作为催化剂催化壳聚糖的交联(图 2)。他们认为,壳聚糖中的氨基首先与CO2交联形成羧酸盐,进而经历脱水反应通过四面体中间体或异腈酸中间体生成交联产物。
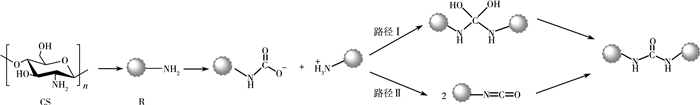 |
| 图 2 Guazzelli等[7]提出的壳聚糖交联机理 |
为了从分子水平上理解壳聚糖的交联机理,我们进行了密度泛函理论计算,探讨了[Bmim][OAc]的催化机制,分析了阴、阳离子的角色,阐明了CO2交联壳聚糖的反应过程、反应机理和能量变化。
1 计算细节本文计算采用团簇模型,以壳聚糖单体(R,图 2)为壳聚糖模型化合物,催化反应体系包括2个壳聚糖单体、1个[Bmim][OAc]离子对和1个CO2分子。计算全部采用M06-2X泛函和6-31G基组,并对参与反应的所有氢原子使用p型极化函数,用Gaussian 09程序包[8]完成。研究表明,M06-2X泛函可以较为精确地描述体系中的弱相互作用[9-10]。对全部稳定点进行了振动频率分析,以确保得到的稳定点是势能面上真正的局域最小点(没有虚频)和一阶鞍点(一个虚频)。对优化的过渡态构型进行了內禀反应坐标计算,以证实每一个过渡态连接相应的局域最小点[11]。
2 结果与讨论如图 1所示,壳聚糖糖环上有三个不同的反应位点,即氨基、羟基和亚甲基羟基。在我们以前的报道中[6],已经对比过三个活性位点的相对活性,发现壳聚糖糖环上的氨基比糖环上的羟基和亚甲基上的羟基具有更高的反应活性。因此,本文的计算中,我们只探讨壳聚糖糖环上的氨基作为活性位点的交联反应。
2.1 非催化的壳聚糖交联非催化的壳聚糖交联反应的计算结果示于图 3。R与CO2的反应涉及亲电加成、脱水和亲核加成三个基元步骤,对应的三个过渡态分别为TS1-2、TS2-3和TS4-5,涉及的总的反应势垒高达56.1 kcal/mol,在温和的实验条件下难以逾越。因此,无催化剂存在时,用CO2作为交联剂难以使壳聚糖发生交联反应。
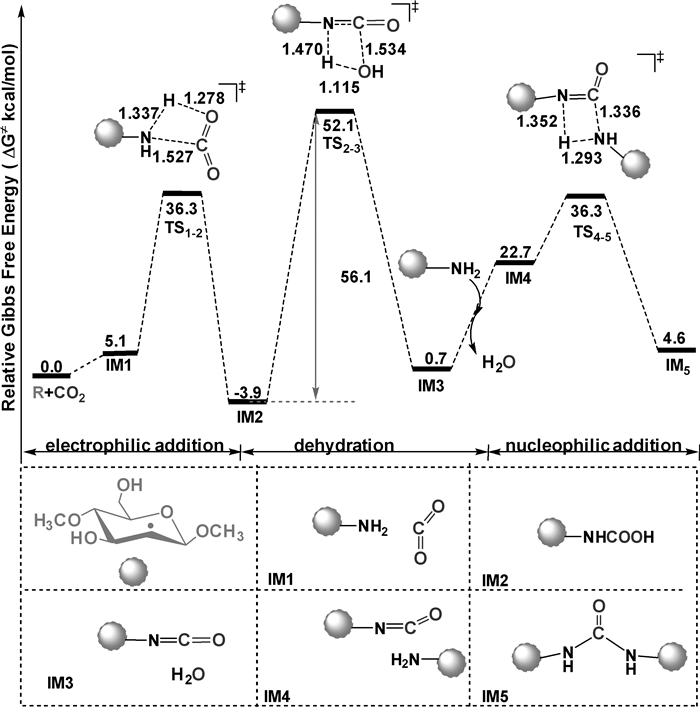 |
| 图 3 非催化的壳聚糖交联反应的势能剖面图 |
2.2 水催化的壳聚糖交联
图 4给出了水分子催化的壳聚糖交联反应的势能剖面图。水分子在反应过程中扮演质子传递梭的角色,涉及的过渡态构型由四元环扩至六元环,使反应的总势垒降低至33.6 kcal/mol,不过该势垒依然较高。表明用CO2作为交联剂,水作为反应介质,壳聚糖难以在温和条件下实现交联。
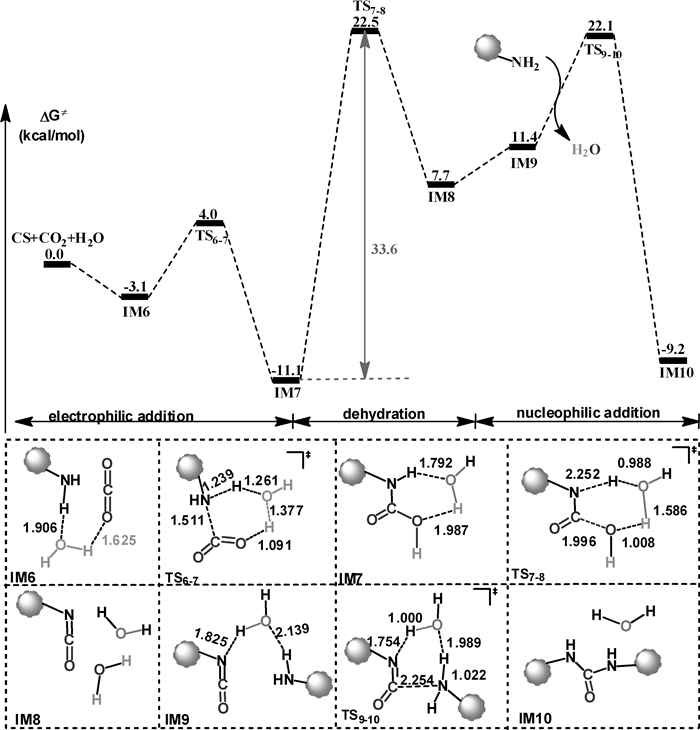 |
| 图 4 水分子催化的壳聚糖交联反应 |
2.3 [Bmim][OAc]离子液体催化的壳聚糖交联
根据Guazzelli等人[7]的建议,在[Bmim][OAc]离子液体中,使用CO2作交联剂,壳聚糖交联反应可能通过图 2所示的两种路径实现,分别涉及四面体中间体(路径Ⅰ)和异腈酸中间体(路径Ⅱ)。我们首先探讨这两种路径的可行性,计算的势能剖面分别示于图 5和图 6。
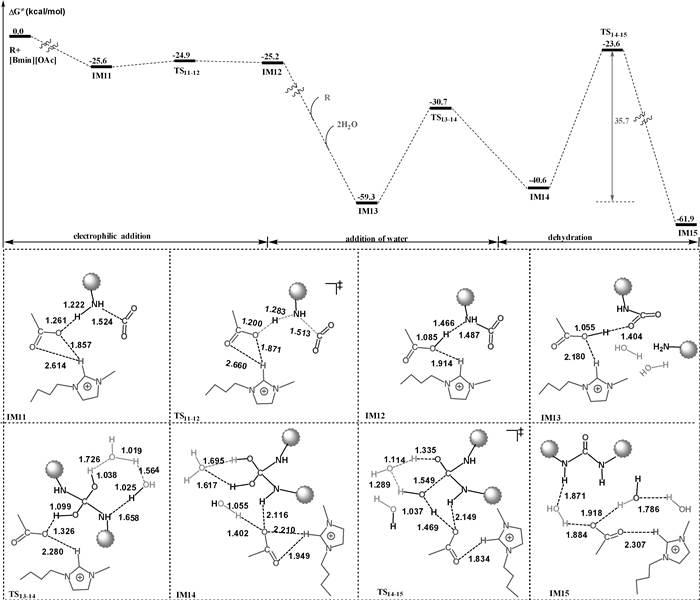 |
| 图 5 [Bmin][OAc]催化的壳聚糖交联反应:路径Ⅰ |
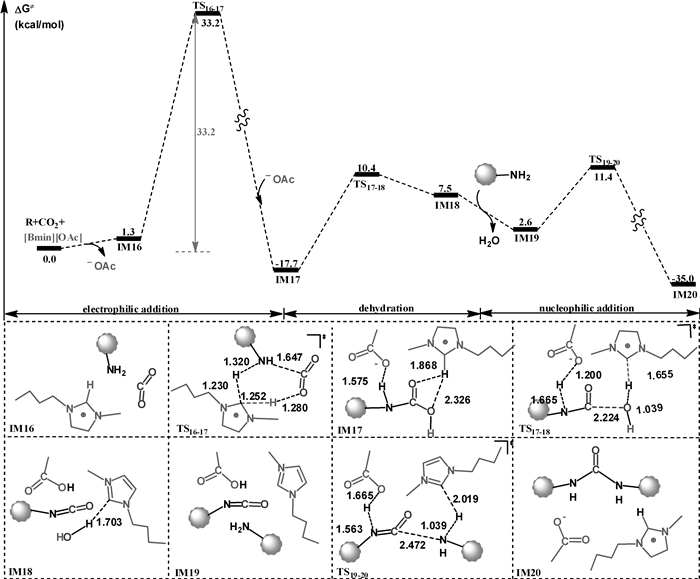 |
| 图 6 [Bmim][OAc]离子液体催化壳聚糖交联反应:路径Ⅱ |
如图 5所示,IM11表示壳聚糖单体-[Bmim][OAc]-CO2三组分氢键络合物,其相对能量为-25.6 kcal/mol。反应的第一步是IM11经过渡态TS11-12形成中间体IM12。在TS11-12中,醋酸根阴离子作为布朗斯特酸夺取底物氨基上的H,协助CO2亲电进攻底物的氨基氮原子。计算结果表明该过程是一个无势垒的过程。第二个壳聚糖单体和2个水分子进入反应的活性中心,形成中间体IM13。反应的第二步是四面体中间体IM14的形成过程,该过程涉及的过渡态是TS13-14。最后,IM14经历过渡态TS14-15脱水形成交联产物。计算的总势垒是35.7 kcal/mol,反应放热61.9 kcal/mol。该路径中离子液体和水分子均参与了反应。
图 6给出了路径Ⅱ的计算结果。在第一步亲电加成过程中,咪唑阳离子作为质子传递梭协助CO2亲电加成到底物氨基上,导致C-N键的形成,得到中间体IM17。第二步是IM17经历过渡态TS17-18形成异腈酸中间体IM18,随后IM18脱出水分子并与另一分子壳聚糖形成络合物IM19。从IM19到产物的阶段是一个协同过程,即底物氨基亲核进攻异腈基的碳原子,同时伴随2个H的转移,如TS19-20所示。如图 6所示,路径Ⅱ中,亲电加成过程具有最高的吉布斯自由能势垒,为33.2 kcal/mol,是整个过程的速控步骤。
图 5和6中的结果表明,路径Ⅰ和路径Ⅱ涉及的总势垒分别为35.7和33.2 kcal/mol,这些能垒在温和的反应条件下均难以克服,表明两条路径不能合理解释实验观察到的壳聚糖在温和条件下的交联反应。
比较TS16-17和TS6-7的结构及相对能量,可以发现:当CO2与壳聚糖的氨基发生亲电加成反应时,由于水分子的质子传递能力强于咪唑阳离子的质子传递能力,致使TS16-17的相对能量远远高于TS6-7的相对能量(33.2 vs 7.1 kcal/mol)。因此,壳聚糖交联反应可能按图 7所示的路径进行,该路径是图 4与图 6的组合。水分子首先作为质子传递桥催化CO2和壳聚糖发生亲电加成反应,生成羧酸中间体IM7。然后,[Bmim][OAc]离子液体的阴、阳离子协同催化中间体IM7发生脱水反应,生成异腈酸中间体IM18。其中,[Bmim+]阳离子作为布朗斯特酸,将其咪唑环上酸性最强的H提供给羟基,从而协助C-O键断裂;与此同时,[OAc-]阴离子作为布朗斯特碱,夺取亚氨基的氢质子,生成醋酸和异腈酸中间体IM18。最后,咪唑分子和醋酸分子分别作为布朗斯特酸和布朗斯特碱协助第二分子壳聚糖与IM18发生亲核加成反应,生成交联壳聚糖。如图 7所示,该路径的势垒为29.1 kcal/mol,放热35.0 kcal/mol。
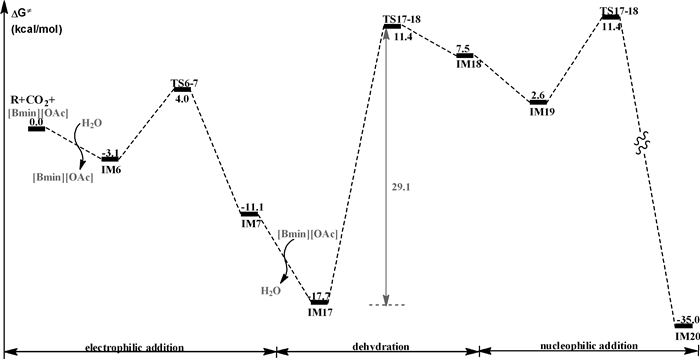 |
| 图 7 水分子和[Bmim][OAc]离子液体协同催化的壳聚糖交联反应 |
3 结论
通过密度泛函理论计算,探讨了CO2交联壳聚糖的分子机理。计算结果表明,水分子和[Bmim][OAc]离子液体协同催化交联反应的发生,CO2首先与氨基亲电加成形成异腈酸中间体,进而通过脱水反应形成交联壳聚糖。水分子在初始的亲电加成过程中作为质子梭传递质子,离子液体的阴、阳离子分别作为布朗斯特碱、酸协助异腈酸酯中间体的形成。在水和[Bmim][OAc]离子液体的协同催化下,壳聚糖和CO2发生交联反应的势垒降低至29.1 kcal/mol。计算结果明确了CO2交联壳聚糖的分子机理,合理解释了温和条件下容易实现壳聚糖交联反应的实验事实。
| [1] |
WANG Z, ZHENG L, LI C, et al. A novel and simple procedure to synthesize chitosan-graft-polycaprolactone in an ionic liquid[J]. Carbohydrate Polymers, 2013, 94(1): 505-10. DOI:10.1016/j.carbpol.2013.01.090 |
| [2] |
CHEN X, CHEW S L, KERTON F M, YAN N. Direct conversion of chitin into a N-containing furan derivative[J]. Green Chemistry, 2014, 16(4): 2204-2212. DOI:10.1039/C3GC42436G |
| [3] |
KUMAR M N R. A review of chitin and chitosan applications[J]. Reactive and Functional Polymers, 2000, 46(1): 1-27. DOI:10.1016/S1381-5148(00)00038-9 |
| [4] |
SWATLOSKI R P, SPEAR S K, HOLBREY J D, ROGERS R D. Dissolution of cellose with ionic liquids[J]. Journal of the American Chemical Society, 2002, 124(18): 4974-4975. DOI:10.1021/ja025790m |
| [5] |
AJLOO D, SANGIAN M, GHADAMGAHI M, et al. Effect of two imidazolium derivatives of ionic liquids on the structure and activity of adenosine deaminase[J]. International Journal of Biological Macromolecules, 2013, 55: 47-61. DOI:10.1016/j.ijbiomac.2012.12.042 |
| [6] |
MU X L, YANG X D, ZHANG D J, LIU C B. Theoretical study of the reaction of chitosan monomer with 2, 3-epoxypropyl-trimethyl quaternary ammonium chloride catalyzed by an imidazolium-based ionic liquid[J]. Carbohydrate Polymers, 2016, 146: 46-51. DOI:10.1016/j.carbpol.2016.03.032 |
| [7] |
MEZZETTA A, GUAZZELLI L, CHIAPPE C. Access to cross-linked chitosans by exploiting CO2 and the double solvent-catalytic effect of ionic liquids[J]. Green Chemistry, 2017, 19(5): 1235-1239. DOI:10.1039/C6GC02935C |
| [8] |
FRISCH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 09, Revision B. 01;Gaussian, Inc. : Wallingford, CT, 2010.
|
| [9] |
HOHENSTEIN E G, CHILL S T, SHERRILL C D. Assessment of the performance of the M05-2X and M06-2X exchange-correlation functionals for noncovalent interactions in biomolecules[J]. Journal of Chemical Theory and Computation, 2008, 4(12): 1996-2000. DOI:10.1021/ct800308k |
| [10] |
WALKER M, HARVEY A J, SEN A, DESSENT C E. Performance of M06, M06-2X, and M06-HF density functionals for conformationally flexible anionic clusters:M06 functionals perform better than B3LYP for a model system with dispersion and ionic hydrogen-bonding interactions[J]. The Journal of Physical Chemistry A, 2013, 117(47): 12590-12600. DOI:10.1021/jp408166m |
| [11] |
FUKUI K. Formulation of the reaction coordinate[J]. The Journal of Physical Chemistry, 1970, 74(23): 4161-4163. DOI:10.1021/j100717a029 |
 2018, Vol. 32
2018, Vol. 32


